Нарушение переваривания и всасывания липидов реферат
Обновлено: 05.07.2024
Расщепление триглицеридов в желудке взрослого человека невелико, но оно в определенной степени облегчает последующее переваривание их в кишечнике. Даже незначительное по объему расщепление триглицеридов в желудке приводит к появлению свободных жирных кислот, которые, не подвергаясь всасыванию в желудке, поступают в кишечник и способствуют там эмульгированию жиров, облегчая таким образом воздействие на них липазы панкреатического сока.
После того как химус попадает в двенадцатиперстную кишку, прежде всего происходит нейтрализация попавшей в кишечник с пищей соляной кислоты желудочного сока бикарбонатами, содержащимися в панкреатическом и кишечном соках. Выделяющиеся при разложении бикарбонатов пузырьки углекислого газа способствуют хорошему перемешиванию пищевой кашицы с пищеварительными соками. Одновременно начинается эмульгирование жира. Наиболее мощное эмульгирующее действие на жиры оказывают соли желчных кислот, попадающие в двенадцатиперстную кишку с желчью в виде натриевых солей. Большая часть желчных кислот конъюгирована с глицином или таурином. По химической природе желчные кислоты являются производными холановой кислоты:
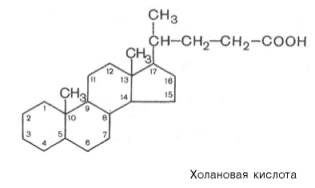
Желчные кислоты представляют собой основной конечный продукт метаболизма холестерина.
В желчи человека в основном содержатся холевая (3,7,12-триоксихола-новая), дезоксихолевая (3,12-диоксихолановая) и хенодезоксихолевая (3,7-диоксихолановая) кислоты (все гидроксильные группы имеют α-конфи-гурацию и поэтому обозначены пунктирной линией):
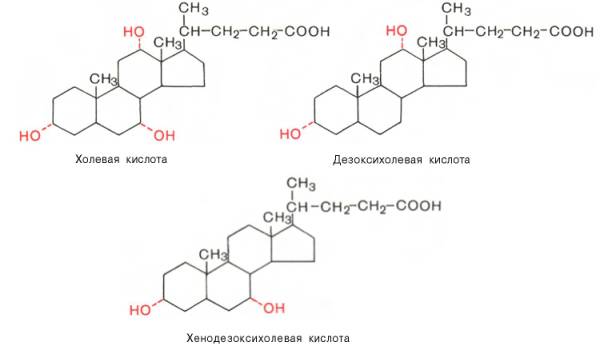
Кроме того, в желчи человека в малых количествах содержатся лито-холевая (3α-оксихолановая) кислота, а также аллохолевая и уреодезокси-холевая кислоты – стереоизомеры холевой и хенодезоксихолевой кислот.
Как отмечалось, желчные кислоты присутствуют в желчи в конъюги-рованной форме, т.е. в виде гликохолевой, гликодезоксихолевой, гли-кохенодезоксихолевой (около 2 /3 – 4 /5 всех желчных кислот) или таурохо-левой, тауродезоксихолевой и таурохенодезоксихолевой (около 1 /5 – 1 /3 всех желчных кислот) кислот. Эти соединения иногда называют парными желчными кислотами, так как они состоят из двух компонентов – желчной кислоты и глицина или таурина. Соотношения между конъюгатами обоих видов могут меняться в зависимости от характера пищи: в случае преобладания в ней углеводов увеличивается относительное содержание глициновых конъюгатов, а при высокобелковой диете – тауриновых конъюгатов. Строение парных желчных кислот может быть представлено в следующем виде:

Считают, что только комбинация соль желчной кислоты + ненасыщенная жирная кислота + моноглицерид придает необходимую степень эмульгирования жира. Соли желчных кислот резко уменьшают поверхностное натяжение на поверхности раздела жир/вода, благодаря чему они не только облегчают эмульгирование, но и стабилизируют уже образовавшуюся эмульсию.
Известно, что основная масса пищевых глицеридов подвергается расщеплению в верхних отделах тонкой кишки при действии липазы панкреатического сока. Этот фермент был впервые обнаружен известным французским физиологом С. Bernard в середине прошлого века.
Панкреатическая липаза (КФ 3.1.1.3) является гликопротеидом, имеющим мол. массу 48000 (у человека) и оптимум рН 8–9. Данный фермент расщепляет триглицериды, находящиеся в эмульгированном состоянии (действие фермента на растворенные субстраты значительно слабее). Как и другие пищеварительные ферменты (пепсин, трипсин, химотрипсин), панкреатическая липаза поступает в верхний отдел тонкой кишки в виде неактивной пролипазы.
Превращение пролипазы в активную липазу происходит при участии желчных кислот и еще одного белка панкреатического сока – колипазы (мол. масса 10000). Последняя присоединяется к пролипазе в молекулярном соотношении 2:1. Это приводит к тому, что липаза становится активной и устойчивой к действию трипсина.
Установлено, что основными продуктами расщепления триглицеридов при действии панкреатической липазы являются β(2)-моноглицерид и жирные кислоты. Фермент катализирует гидролиз эфирных связей в α(1), α'(3)-положениях, в результате чего и образуются β(2)-моноглицерид и две частицы (молекулы) жирной кислоты. На скорость катализируемого липазой гидролиза триглицеридов не оказывает существенного влияния ни степень ненасыщенности жирных кислот, ни длина ее цепи (от С12 до С18).
Гидролиз триглицеридов при участии панкреатической липазы можно изобразить в виде следующей схемы:
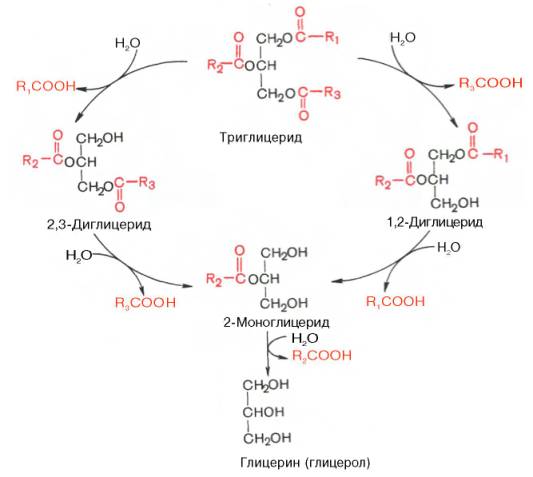
В панкреатическом соке наряду с липазой содержится моноглицеридная изомераза – фермент, катализирующий внутримолекулярный перенос ацила из β(2)-положения моноглицерида в α(1)-положение. В процессе переваривания пищевых жиров при участии этого фермента примерно треть β-моноглицерида превращается в α-моноглицерид. Поскольку эфирная связь в α-положении чувствительна к действию панкреатической липазы, последняя расщепляет большую часть α-моноглицеридов до конечных продуктов – глицерина и жирной кислоты. Меньшая часть α-моноглице-ридов успевает всосаться в стенку тонкой кишки, минуя воздействие липазы.
Всасывание триглицеридов и продуктов их расщепления. Всасывание происходит в проксимальной части тонкой кишки. Тонкоэмульгированные жиры (величина жировых капель эмульсии не должна превышать 0,5 мкм) частично могут всасываться через стенки кишечника без предварительного гидролиза. Основная часть жира всасывается лишь после расщепления его панкреатической липазой на жирные кислоты, моноглицериды и глицерин. Жирные кислоты с короткой углеродной цепью (менее 10 атомов углерода) и глицерин, будучи хорошо растворимыми в воде, свободно всасываются в кишечнике и поступают в кровь воротной вены, оттуда в печень, минуя какие-либо превращения в кишечной стенке.
Более сложно происходит всасывание жирных кислот с длинной углеродной цепью и моноглицеридов. Этот процесс осуществляется при участии желчи и главным образом желчных кислот, входящих в ее состав. В желчи соли желчных кислот, фосфолипиды и холестерин содержатся в соотношении 12,5:2,5:1,0. Жирные кислоты с длинной цепью и моноглицериды в просвете кишечника образуют с этими соединениями устойчивые в водной среде мицеллы. Структура мицелл такова, что их гидрофобное ядро (жирные кислоты, моноглицериды и др.) оказывается окруженным снаружи гидрофильной оболочкой из желчных кислот и фосфолипидов. Мицеллы примерно в 100 раз меньше самых мелких эмульгированных жировых капель. В составе мицелл высшие жирные кислоты и моноглицериды переносятся от места гидролиза жиров к всасывающей поверхности кишечного эпителия. Относительно механизма всасывания жировых мицелл единого мнения нет. Одни исследователи считают, что в результате так называемой мицеллярной диффузии, а возможно, и пиноцитоза мицеллы целиком проникают в эпителиальные клетки ворсинок, где происходит распад жировых мицелл. При этом желчные кислоты сразу поступают в ток крови и через систему воротной вены попадают сначала в печень, а оттуда вновь в желчь. Другие исследователи допускают возможность перехода в клетки ворсинок только липидного компонента жировых мицелл. Соли желчных кислот, выполнив свою физиологическую роль, остаются в просвете кишечника; позже основная масса их всасывается в кровь (в подвздошной кишке), попадает в печень и затем выделяется с желчью. Таким образом, все исследователи признают, что происходит постоянная циркуляция желчных кислот между печенью и кишечником. Этот процесс получил название печеночно-кишечной (гепатоэнтеральной) циркуляции.
С помощью метода меченых атомов было показано, что в желчи содержится лишь небольшая часть желчных кислот (10–15% от общего количества), вновь синтезированных печенью. Таким образом, основная масса желчных кислот (85–90%) – это желчные кислоты, реабсорбирован-ные в кишечнике и повторно секретируемые в составе желчи. Установлено, что у человека общий пул желчных кислот составляет примерно 2,8–3,5 г, при этом они совершают 6–8 оборотов в сутки.
Расщепление и всасывание фосфолипидов и холестерина. Подавляющая часть фосфолипидов содержимого тонкой кишки приходится на фосфати-дилхолин (лецитин), основная масса которого поступает в кишечник с желчью (11–12 г/сут) и меньшая часть (1–2 г/сут) – с пищей.
Существует две точки зрения относительно судьбы поступивших в тонкую кишку экзогенных и эндогенных фосфолипидов. Согласно одной из них, и те, и другие фосфолипиды подвергаются в кишечнике атаке со стороны фосфолипазы А2, катализирующей гидролиз сложноэфирной связи в β-положении. В результате катализируемой фосфолипазой А2 реакции глицерофосфолипиды расщепляются с образованием лизофосфолипида и жирной кислоты. Лизофосфолипид может подвергаться расщеплению при действии другого фермента панкреатического сока – лизофосфолипазы. В результате из лизолецитина освобождается последняя частица жирной кислоты и образуется глицерофосфохолин, который хорошо растворяется в водной среде и всасывается из кишечника в кровь.
В зависимости от пищи организм взрослого человека получает ежедневно 300–500 мг холестерина, содержащегося в пищевых продуктах частично в свободном (неэстерицифицированном) виде, частично в виде эфиров с жирными кислотами. Эфиры холестерина расщепляются на холестерин и жирные кислоты особым ферментом панкреатического и кишечного соков – гидролазой эфиров холестерина, или холестеролэстеразой (КФ 3.1.1.13). В тонкой кишке происходит всасывание холестерина, источником которого являются:
– холестерин пищи (0,3–0,5 г/сут; у вегетарианцев значительно меньше); – холестерин желчи (ежедневно с желчью выделяется 1–2 г эндогенного неэстерифицированного холестерина);
– холестерин, содержащийся в слущенном эпителии пищеварительного тракта и в кишечных соках (до 0,5 г/сут).
В общей сложности в кишечник поступает 1,8–2,5 г эндогенного и экзогенного холестерина. Из этого количества около 0,5 г холестерина выделяется с фекалиями в виде восстановленного продукта – копростерина и очень небольшая часть в виде окисленных продуктов – холестенона и др. И восстановление, и окисление холестерина происходят в толстой кишке под воздействием ферментов микробной флоры. Основная часть холестерина в неэстерифицированной форме подвергается всасыванию в тонкой кишке в составе смешанных жировых мицелл, состоящих из желчных кислот, жирных кислот, моноглицеридов, фосфолипидов и лизофосфо-липидов.
Ресинтез липидов в кишечной стенке. Триглицериды. По современным представлениям, ресинтез триглицеридов происходит в эпителиальных
клетках (энтероцитах слизистой оболочки ворсинок тонкой кишки) двумя путями. Первый путь – β-моноглицеридный. Долгое время этот путь считался единственным. Суть его состоит в том, что β-моноглицериды и жирные кислоты, проникающие в процессе всасывания в эпителиальные клетки кишечной стенки, задерживаются в гладком эндоплазматическом рети-кулуме клеток. Здесь из жирных кислот образуется их активная форма – ацил-КоА и затем происходит ацилирование β-моноглицеридов с образованием сначала диглицеридов, а затем триглицеридов:
β-Моноглицерид + R—СО—S-KoA –> Диглицерид + HS-KoA ;
Диглицерид + R1—СО—S-KoA –> Триглицерид + HS-KoA.
Все реакции катализируются ферментным комплексом – триглицерид-синтетазой, включающим в себя ацил-КоА-синтетазу, моноглицеридацил-трансферазу и диглицеридацилтрансферазу.
Второй путь ресинтеза триглицеридов протекает в шероховатом эндо-плазматическом ретикулуме эпителиальных клеток и включает следующие реакции:
1) образование активной формы жирной кислоты – ацил-КоА при участии ацил-КоА-синтетазы;
2) образование α-глицерофосфата при участии глицеролкиназы;
3) превращение α-глицерофосфата в фосфатидную кислоту при участии глицерофосфат-ацилтрансферазы;
4) превращение фосфатидной кислоты в диглицерид при участии фос-фатидат-фосфогидролазы;
5) ацилирование диглицерида с образованием триглицерида при участии диглицеридацилтрансферазы.
Как видно, первая и последняя реакции повторяют аналогичные реакции β-моноглицеридного пути. Установлено, что α-глицерофосфатный путь ресинтеза жиров (триглицеридов) приобретает значение, если в эпителиальные клетки слизистой оболочки тонкой кишки поступили преимущественно жирные кислоты. В случае, если в стенку кишки поступили жирные кислоты вместе с β-моноглицеридами, запускается β-моногли-церидный путь. Как правило, наличие в эпителиальных клетках избытка β-моноглицеридов тормозит протекание α-глицерофосфатного пути.
Ресинтез фосфолипидов в кишечной стенке. В энтероцитах наряду с ре-синтезом триглицеридов происходит также и ресинтез фосфолипидов. В образовании фосфатидилхолинов и фосфатидилэтаноламинов участвует ресинтезированный диглицерид, а в образовании фосфатидилинозитолов – ресинтезированная фосфатидная кислота. Участие этих субстратов в образовании фосфолипидов в стенке кишечника происходит по тем же закономерностям, что и в других тканях (см. с. 396, 397).
Необходимо подчеркнуть, что в стенке кишечника синтезируются жиры, в значительной степени специфичные для данного вида животного и отличающиеся по своему строению от пищевого жира. В известной мере это обеспечивается тем, что в синтезе триглицеридов (а также фосфолипидов) в кишечной стенке принимают участие наряду с экзогенными и эндогенные жирные кислоты. Однако способность к осуществлению в стенке кишечника синтеза жира, специфичного для данного вида животного, все же ограничена. Показано, что при скармливании животному (например, собаке), особенно предварительно голодавшему, больших количеств чужеродного жира (например, льняного масла или верблюжьего жира) часть его обнаруживается в жировых тканях животного в неизмененном виде. Жировая ткань скорее всего является единственной тканью, где могут откладываться чужеродные жиры. Липиды, входящие в состав протоплазмы клеток других органов и тканей, отличаются высокой специфичностью, их состав и свойства мало зависят от пищевых жиров.
Образование хиломикронов и транспорт липидов. Ресинтезированные в эпителиальных клетках кишечника триглицериды и фосфолипиды, а также поступивший в эти клетки из полости кишечника холестерин (здесь он может частично эстерифицироваться) соединяются с небольшим количеством белка и образуют относительно стабильные комплексные частицы – хиломикроны (ХМ). Последние содержат около 2% белка, 7% фосфолипидов, 8% холестерина и его эфиров и более 80% триглицеридов. Диаметр ХМ колеблется от 0,1 до 5 мкм. Благодаря большим размерам частиц ХМ не способны проникать из эндотелиальных клеток кишечника в кровеносные капилляры и диффундируют в лимфатическую систему кишечника, а из нее – в грудной лимфатический проток. Затем из грудного лимфатического протока ХМ попадают в кровяное русло, т.е. с их помощью осуществляется транспорт экзогенных триглицеридов, холестерина и частично фосфолипидов из кишечника через лимфатическую систему в кровь. Уже через 1–2 ч после приема пищи, содержащей жиры, наблюдается алиментарная гиперлипемия. Это физиологическое явление, характеризующееся в первую очередь повышением концентрации триглицеридов в крови и появлением в ней ХМ. Пик алиментарной гиперлипемии наблюдается через 4–6 ч после приема жирной пищи. Обычно через 10–12 ч после приема пищи содержание триглицеридов возвращается к нормальным величинам, а ХМ полностью исчезают из кровяного русла.
Известно, что печень и жировая ткань играют наиболее существенную роль в дальнейшей судьбе ХМ. Последние свободно диффундируют из плазмы крови в межклеточные пространства печени (синусоиды). Допускается, что гидролиз триглицеридов ХМ происходит как внутри печеночных клеток, так и на поверхности. ХМ не способны (из-за своих размеров) проникать в клетки жировой ткани. В связи с этим триглицериды ХМ подвергаются гидролизу на поверхности эндотелия капилляров жировой ткани при участии фермента липопротеидлипазы.
Гродно, 2017
Содержание
1. Введение…………………………………………………………………….3
2. Нарушение переваривания и всасываниялипидов……………………. 4
3. Причины нарушения и всасывания липидов…………………………….6
4. Заключение…………………………………………………………………8
5. Список использованной литературы…………………………………….9
Липиды - это разнообразная по строению группа органических веществ, которые объединены общим свойством - растворимостью в неполярных растворителях.
В организме липиды выполняютразнообразные функции:
1) Структурная. Сложные липиды и холестерин амфифильны, они образуют все клеточные мембраны;
2) Энергетическая. В организме до 33% всей энергии АТФ образуется за счет окисления липидов;
3) Антиоксидантная;
4) Запасающая.
5) Защитная. ТГ, в составе жировой ткани, обеспечивают теплоизоляционную и механическую защиту тканей. Воска образуют защитную смазку на коже человека;
6) Регуляторная.
7)Пищеварительная. Из холестерина синтезируются желчные кислоты. Желчные кислоты, фосфолипиды, холестерин обеспечивают эмульгирование и всасывание липидов;
8) Информационная. Ганглиозиды обеспечивают межклеточные контакты.
Источником липидов в организме являются синтетические процессы и пища. Некоторые липиды в организме не синтезируются (полиненасыщенные жирные кислоты - витамин F, витамины А, Д, Е, К),они являются незаменимыми и поступают в организм только с пищей.
В сутки человеку требуется потреблять 80-100г липидов, из них 25-30г растительного масла, 30-50г сливочного масла и 20-30г жира животного происхождения.
Нарушение переваривания и всасывания липидов
Для нормального переваривания и всасывания липидов в кишечнике определяющее значение имеет взаимодействие таких факторов,как:
1) выработка поджелудочной железой липолитического фермента липазы;
2) поступление с желчью желчных кислот, эмульгирующих жиры и продукты их распада, активирующих панкреатическую липазу и участвующих во всасывании жирных кислот (всасывается комплекс жирных и желчных кислот);
3) захват продуктов переваривания липидов клетками слизистой оболочки тонкого кишечника;
4) превращение в стенкекишечника всосавшихся продуктов гидролиза липидов в частицы (хиломикроны) для дальнейшего транспорта их в лимфатические сосуды и далее в кровоток.
Нарушение переваривания липидов может быть при:
1) нарушение оттока жёлчи из жёлчного пузыря (желчекаменная болезнь, опухоль). Уменьшение секреции жёлчи вызывает нарушение эмульгирования липидов, что ведет к снижению гидролиза липидов пищеварительными ферментами;2) нарушение секреции сока поджелудочной железы приводит к дефициту панкреатической липазы и снижает гидролиз липидов.
Нарушение переваривания липидов тормозит их всасывание, что приводит к увеличению количества липидов в фекалиях — возникает стеаторея (жирный стул). В норме в фекалиях липидов не более 5%. При стеаторее нарушается всасывание жирорастворимых витаминов (A, D, Е, К) и незаменимыхжирных кислот (витамин F), поэтому развиваются гиповитаминозы жирорастворимых витаминов. Избыток липидов связывает вещества нелипидной природы (белки, углеводы, водорастворимые витамины), и препятствует их перевариванию и всасыванию. Возникают гиповитаминозы по водорастворимым витаминам, белковое и углеводное голодание. Непереваренные белки подвергаются гниению в толстой кишке.
Стеатореяпоявляется:
1. Из-за отсутствия желчи в кишечнике (синдром ахолии);
2. Из-за нарушения поступления в кишечник панкреатического сока. Отметим, что ухудшению эмульгирования и переваривания жиров способствует и низкая кислотность желудочного сока;
3. Из-за первичной мальабсорбции (целиакия, тропическая спру, болезнь Уиппла, другие хронические энтериты, гиповитаминоз по фолиевой.
Липиды - это химические соединения, нерастворимые в воде, но растворимые в хлороформе или спирте. К липидам относятся ненасыщенные и насыщенные жирные кислоты, моно-, ди-, триацилглицериды, холестерин, фос-фолипиды, гликолипиды, стерины и воски.
Триацилглицериды - это эфиры трехатомного спирта глицерина, в норме обеспечивающие до 40% потребляемых организмом калорий.
Жирные кислоты - самые простые по строению липиды, в природе их существует свыше 200 разновидностей, более 20 из которых представлено в тканях человека (табл. 41). Они являются предшественниками простагландинов, поддерживают жидкое состояние, присущее липидам клеточных мембран в норме, предотвращают отложение холестерина в стенках кровеносных сосудов и выполняют многие другие функции. Полиненасыщенные жирные кислоты (ли-нолевая, линоленовая, арахидоновая) относятся
к незаменимым и условно объединены в группу под названием витамин F.
Холестерин относится к стероидным спиртам. Он является источником образования желчных кислот, стероидных гормонов, витамина D, входит в состав клеточных мембран, является важным компонентом липопротеидов плазмы крови.
Фосфолипиды - это сложные эфиры многоатомных спиртов с высшими жирными кислотами и фосфорной кислотой, в их состав входят азотсодержащие соединения: холин, этанол амин, серии. Они содержатся в мембранах клеток и клеточных органелл, регулируют их проницаемость и активность Na + /K + - АТФазы, К + -АТФазы, Са 2+ - АТФазы, аденилатциклазы и др.
Патология обмена липидов связана с нарушением их расщепления, всасывания, транспорта, утилизации, депонирования и метаболизма.
11.5.1. Нарушение переваривания и всасывания липидов
Для нормального переваривания и всасывания их в кишечнике определяющее значение имеет взаимодействие таких факторов, как:

1) выработка поджелудочной железой липо-литического фермента липазы;
2) поступление с желчью желчных кислот, эмульгирующих жиры и продукты их распада, активирующих панкреатическую липазу и участвующих во всасывании жирных кислот (всасывается комплекс жирных и желчных кислот);
3) захват продуктов переваривания липидов клетками слизистой оболочки тонкого кишечника;
4) превращение в стенке кишечника всосавшихся продуктов гидролиза липидов в частицы (хиломикроны) для дальнейшего транспорта их в лимфатические сосуды и далее в кровоток.
При нарушении любого из этих процессов развивается стеаторея - избыточное содержание жира в испражнениях.
Причинами нарушения переваривания и всасывания липидов являются:
1. Дефицит или низкая активность панкреатической липазы (поражение поджелудочной железы), что приводит к нарушению расщепления жиров.
2. Недостаточное поступление желчных кислот в кишечник (при гепатитах, циррозах, холециститах, обтурационной желтухе и др.) вызывает нарушение эмульгирования и расщепления жира, а также переноса продуктов его гидролиза к всасывающей поверхности эпителия кишечника.
3. Дефицит гормонов желудочно-кишечного тракта (холецистокинин, гастрин и др.), регулирующих сокращение стенок желчного пузыря, процессы эмульгирования и расщепления жиров, их транспорт через кишечную стенку.
4. Поражение эпителия тонкого кишечника различными ядами (флоридзин, монойодуксус-ная кислота) и инфекционными агентами, инак-тивирующими ферментные системы ресинтеза триацилглицеридов эпителия тонкого кишечника, а также процессы фосфорилирования и де-фосфорилирования в стенке кишечника.
5. Авитаминозы А, В, С.
6. Избыточное потребление с пищей ионов Са г+ и Mg 2+ , что приводит к образованию нерастворимых в воде солей жирных кислот (мыла).
7. Дефицит холина в пище или недостаточное его образование из метионина при малобелковом питании тормозит реабсорбцию липидов.
8. Изменение деятельности нервной и эндокринной систем: перерезка блуждающего нерва
ослабляет всасывание жиров из кишечника, аналогично действует наркоз; АКТГ и тироксин усиливают всасывание жира. При недостатке гормонов коры надпочечников или избытке адреналина всасывание жира замедляется.
9. Усиленная перистальтика кишечника и диарея препятствуют реабсорбции большей части жира.
10. Нарушение метаболизма липидов в энте-роцитах с образованием аномальных белково-липидных комплексов ухудшает всасывание жира и вызывает образование жировых скоплений в стенке тонкого кишечника и в мелких лимфатических протоках, что блокирует отток лимфы.
Дефицит липидов в организме может быть связан не только с нарушением их всасывания в кишечнике, но и с усилением их выведения. Организм может терять липиды с мочой (липи-дурия), что наблюдается при липоидном нефрозе. Возможны потеря липидов сальными железами (экзема, угревая сыпь) и выход липидов из депо при травматизации больших участков жировой ткани и костного мозга.
Недостаток липидов в организме может привести:
1) к развитию гиповитаминозов (снижение содержания жирорастворимых витаминов A, D, Е, К);
2) к возникновению дефицита незаменимых полиненасыщенных жирных кислот с последующим нарушением синтеза биологически активных веществ (лейкотриены, простагландины и др.). Это, как правило, сопровождается выпадением волос, воспалительным поражением кожи, возникновением некротических очагов и экзематозных явлений, поражением почек, потерей способности к размножению;
3) к развитию истощения.
Гиперлипемия является одним из показателей нарушения жирового обмена и характеризуется увеличением содержания липидов в крови.
Липиды поступают в лимфу, а затем в кровь из кишечника в виде самых крупных липопро-теидов - хиломикронов, из печени в кровь выходят липопротеиды очень низкой плотности. При липолизе из подкожной жировой клетчат-ки, легких, костного мозга освобождаются не-этерифицированные жирные кислоты (НЭЖК).
Уровень липидов в плазме крови в норме не превышает 1-2 г/л.
Гиперлипемия может быть алиментарной, транспортной и ретенционной.
Алиментарная гиперлипемия - временное увеличение уровня хиломикронов в крови, вызванное приемом жирной пищи или проведением пробы с липидной нагрузкой. Она легко устраняется с помощью возросшей функциональной активности гепатоцитов, утилизирующих хило-микроны. Возможно также усиление депонирования липидов в жировой ткани (рис. 89).
Транспортная гиперлипемия обусловлена либо усиленной мобилизацией из депо в виде неэтерифицированных жирных кислот при голодании, стрессе, сахарном диабете, либо нару-
шением метаболизма циркулирующих в крови липопротеидов при различных формах семейной гиперлипемии. Усилению мобилизации липидов из жировой ткани, костного мозга способствуют соматотропный и кортикотропный гормоны гипофиза, а также глюкагон, тироксин и адреналин, которые активируют тканевую липазу через аденилатциклазную систему.
Из печени липопротеиды (комплекс липидов с белками) поступают в кровь. Сами липиды гид-рофобны и поэтому не образуют суспензии в плазме крови. Гидрофильность им обеспечивают белки.
Мобилизация жира из легких, приводящая к гиперлипемии, возникает также при длительной гипервентиляции легких, например у пловцов и профессиональных певцов.
Ретенционная гиперлипемия (от лат. retentio
- задерживать) развивается в результате задержки перехода нейтральных жиров из крови в ткани. Возникает при атеросклерозе, ишемичес-кой болезни сердца, нефрозе, сахарном диабете, при механической желтухе, поступлении большого количества NaCl (ингибирует липопротеи-новую липазу). В патогенезе этого вида гиперлипемии большое значение имеют следующие факторы:
1. Снижение уровня гепарина, активирующего фактор просветления (липопротеиновая липаза),
- при нефрозе, механической желтухе, атеросклерозе.
2. Уменьшение содержания альбуминов в крови (осуществляют транспорт НЭЖК в клетки различных органов) - при нефротическом синдроме, заболеваниях печени и др.
3. Присутствие в сыворотке ингибитора ли-попротеиновой липазы - при нефротическом синдроме.
4. Снижение активности липокаина, активирующего поступление в кровь липопротеиновой липазы - при сахарном диабете.
11.5.3. Нарушение обмена липопротеидов (гиперлипопротеидемии и диспипопротеидемии)
Всосавшиеся в кровь неполярные липидные молекулы циркулируют в крови и лимфе в комплексе с полярными соединениями (белками). Существует большой спектр частиц, несколько

отличающихся по размерам, плотности и составу. Среди них выделены 4 основные группы липопротеидов (ЛП).
1. Липопротеиды высокой плотности (ЛПВП, или сс-ЛП). В состав ЛПВП входят 40-55% белка (процент от общей массы частицы), 27-30% фосфолипидов, 3-8% триглицеридов, 2-3% свободного холестерина, 14-20% эфиров холестерина. Они синтезируются паренхимой печени, в стенке тонкого кишечника и всегда присутствуют в плазме крови здоровых людей. Выполняют транспортную функцию, переводя избыток холестерина с поверхности сосудов в печень и выводя его излишек из клеток эндотелия (рис. 90).
мой эндогенных триглицеридов. В плазме крови происходит трансформация ЛПОНП в (3-ЛП (при участии ферментов липопротеидлипазы и лецитин-холестеринацилтрансферазы - ЛХАТ крови). В ходе их катаболизма размеры частиц уменьшаются, меняется их состав (теряются триглицериды и возрастает относительный процент холестерина).
3. Липопротеиды низкой плотности (ЛПНП, или р-ЛП) имеют следующий состав: 24-31% -свободный холестерин, 16-28% - этерифициро-ванный холестерин, 7-11% - триглицериды, около 30% - фосфолипиды, 20-25% - белок. Они образуются в плазме из ЛПОНП и являются самой атерогенной фракцией липопротеидов у человека.
4. Хиломикроны (ХМ) - самые крупные ли-попротеидные частицы, поступающие в кровь из лимфы и представляющие собой транспортную форму пищевых жиров (экзогенных триглицеридов). В их составе находятся: 3-8% фосфолипидов, 2-4% эфиров холестерина, около 2% свободного холестерина, 1-2% белка и 86-94% триглицеридов. Хиломикроны образуются в стенке кишечника в процессе всасывания экзогенных триглицеридов и холестерина, проникают в лимфу, а оттуда в кровеносные сосуды. В плазме крови они расщепляются под действием липопротеидлипазы и теряют значительное количество триглицеридов (образуются СЖК и глицерин). Для ткани легких катаболизм ХМ особенно важен, поскольку играет ключевую роль в обеспечении высокой активности альвеолярных макрофагов и необходим для синтеза фосфолипидов сурфактанта (рис.91). В связи с этим при заболеваниях легких положительный эффект дает жировая диета. Следует отметить, что плазма крови здоровых людей натощак (через 12-14 ч после приема пищи) не содержит ХМ.
При ряде заболеваний липопротеидный спектр


сыворотки меняется и возникают гипер- или гипо-(а)липопротеидемии. При этом наблюдаются увеличение или, наоборот, снижение содержания, вплоть до полного отсутствия одного или нескольких классов липопротеидов в крови, а также появление их определенных форм (дис-л ипопротеидемии).
Различают 5 типов гиперлипопротеидемий (ГЛП):
I. Гиперхиломикронемия - характеризуется высоким содержанием хиломикронов в плазме натощак. Проявляется ксантоматозом - это отложение холестерина и его эфиров в купферовс-ких клетках печени, гистиоцитах подкожной клетчатки и сухожилиях с последующим разрастанием соединительной ткани в виде бляшек и узлов желтоватого цвета (рис. 92).
У больных развивается гепатоспленомегалия, наблюдаются тромбоз и микронекрозы поджелудочной железы с последующим формированием хронического панкреатита, абдоминальные колики после принятия жирной пищи. На коже видны ксантомы в виде желтоватых папул. Заболевание может быть вызвано наследственным аутосомно-рецессивным дефектом липопротеино-вой липазы либо аутоиммунными заболеваниями соединительной ткани (при системной красной волчанке образуются антитела против гли-козаминогликанов, что нарушает процесс гепариновой активации липопротеидлипазы).
Читайте также:

