Молекулярные механизмы регуляции клеточного цикла реферат
Обновлено: 06.07.2024
После завершения проектов секвенирования генома были предприняты попытки приблизиться к пониманию характера изменений в генах и в функционировании их продуктов на протяжении клеточного цикла. Метод микроаррей-анализа позволил исследователям идентифицировать все изменения транскрипции, происходящие в клеточном геноме на протяжении цикла или после обработки клеток веществами, которые блокируют их продвижение по циклу.
Наиболее исчерпывающий анализ изменений профиля экспрессии генов выполнен на дрожжах S. cerevisiae и S. pombe. При этом были идентифицированы гены, транскрипция которых на протяжении клеточного цикла меняется. Аналогичным образом использовали микроаррей-анализ для идентификации генов, транскрипция которых при активации точки контроля увеличивается или снижается. Эту же стратегию также применяли к другим организмам для поиска общих принципов регуляции клеточного цикла и активации точек контроля, а также для оценки различий между здоровыми и трансформированными клетками животных.
Стратегия микроаррей-анализа сейчас используется для получения геномного профиля злокачественных клеток и выработки терапевтических подходов к лечению больных.
Еще один метод, который используется для идентификации регуляторных белков клеточного цикла, представляет собой глобальный анализ локализации белка. Например, была установлена локализация почти каждого белка, закодированного в геноме клеток S. cerevisiae и S. pombe. При этом использовался метод слияния каждой открытой рамки считывания с последовательностью, кодирующей зеленый флуоресцентный белок Также в перспективе намечается проведение крупномасштабных анализов с использованием методов протеомики, которые позволят определить белковые компоненты всех мультимерных комплексов, обеспечивающих жизнедеятельность клетки. Такой анализ мог бы способствовать нашему пониманию функционирования различных белков и их комплексов.
Принимая во внимание всю важность точек контроля в координации событий клеточного цикла, особенно необходимым представляется понимание молекулярных механизмов их функционирования. Точки контроля за повреждениями в ДНК, за ее репликацией в S-фазе, а также контролирующие сборку веретена, требуют участия ряда протеинкиназ. Однако пока идентифицировано лишь ограниченное число субстратов этих киназ, и представляется весьма важным продолжать поиск с тем, чтобы возможно более полно выяснить роль различных реакций фосфорилирования в процессах контроля. Выяснение всех перечисленных вопросов явилось бы крупным шагом вперед в понимании роли точек контроля в обеспечении точности передачи хромосом дочерним клеткам.
Аналогичным образом, несмотря на большое количество доступной информации относительно регуляции киназ митоза, предстоит еще многое выяснить о мишенях этих киназ. Совместное использование генетических методов на дрожжевых объектах и методов биохимического анализа при работе с экстрактами яйцеклеток лягушки и морского ежа обеспечило получение важных данных о функциях Cdk1 киназы митоза. Однако картина еще далека от завершения.
Как Cdk1 регулирует несколько таких митотических процессов, как конденсация хромосом, сборка веретена и разделение сестринских хроматид? Дальнейшая идентификация субстратов Cdk1 помогла бы полнее понять их молекулярные основы. Не менее важным представлется выяснить, каким образом выход клетки из митоза связан со снижением активности Cdk1. Как снижение активности фермента сопряжено с распадом веретена и цитокинезом? Вызваны ли эти процессы дефосфорилированием белков? Если да, то каким образом они регулируются путем дефосфорилирования белков?
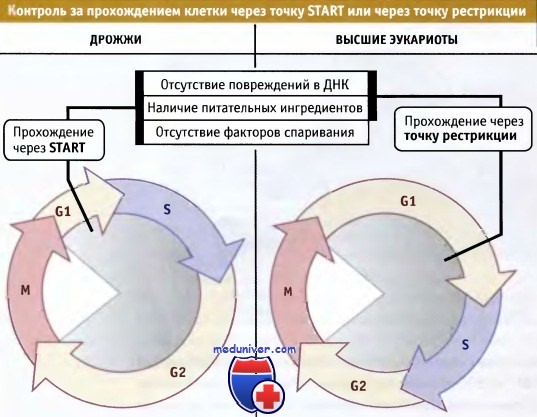
Прохождение клетки через точку START (у дрожжей) или точку рестрикции (у высших эукариот) служит сигналом о готовности клетки войти в цикл и регулируется внешними факторами,
такими как наличие необходимых для роста питательных ингредиентов или отсутствие гормонов спаривания (у дрожжей).
Процесс также регулируется внутренними факторами, например степенью интактности ДНК.
Постоянное усовершенствование масс-спектрометрических методов уже обеспечило простоту исследования таких модификаций белков, как фосфорилирование. Методы биохимической генетики оказались мощным инструментом в идентификации субстратов протеинкиназ. В этих методах используются ингибиторы модифицированных киназ для установления роли последних в специфических реакциях фосфорилирования. Такие аналог-чувствитель-ные аллели (аллели, содержащие мутантную форму киназы, которая не зависит от АТФ, но является аналогом дикой формы) оказались ценным инструментом для избирательного ингибирования этой специфической киназы и идентификации ее субстратов in vivo. Очевидно, что подобные методические подходы помогут исследователям ответить на следующие вопросы: Какие белки фосфорилируются на определенных стадиях клеточного цикла?
Насколько меняется степень фосфорилирования определенного белка после снижения активность определенной киназы? Ответы на все эти вопросы помогут составить полную картину того, как протеинкиназы регулируют критические процессы клеточного цикла.
В то время как протеинкиназы служат регуляторами критических событий клеточного цикла, направленный протеолиз обеспечивает необратимое продвижение клетки по циклу. SCF и АРС представляют собой две убиквитин-лигазы, специфические для клеточного цикла и необходимые для нормального протекания его процессов. Дефекты убиквитин-зависимого протеолиза также связаны с развитием опухолей. Поэтому идентификация белков, которые подвергаются убиквитин-зависимому протеолизу на протяжении цикла деления, играет критическую роль для понимания процессов клеточного цикла и развития опухолей.
Уже предприняты попытки обнаружить такие белки. Например, используя систему in vitro, в экстрактах яйцеклеток лягушки был идентифицирован набор белков, которые подвергаются специфическому протеолизу в митозе. Продолжение поиска таких белков и тщательный поиск субстатов SCF и АРС должны способствовать выяснению роли убиквитин-зависимого протеолиза в процессах цикла. Более того, выяснение деталей протеолиза может способствовать выявлению дополнительных мишеней для действия лекарственных средств.
Клеточный цикл представлет собой упорядоченную цепь событий, которые приводят к дупликации клеточного содержимого и к делению клетки на две. События клеточного цикла регулируются во времени и в пространстве. Определенный порядок и точность протекания процессов клеточного цикла обеспечиваются специальными механизмами мониторинга, известными под названием точек контроля. В случае возникновения дефектов процесса дупликации точки контроля задерживают прохождение клетки по циклу, обеспечивая возможность исправления ошибок.
Репликация генетической информации происходит в S-фазе, а сегрегация информации — в фазе митоза. Обе фазы разделены фазами-промежутками, G1 и G2. Такой порядок событий устанавливается точками контроля и реализуется с помощью основных регуляторных киназ клеточного цикла, CDKs. Некоторые процессы цикла наступают, только когда понижается активность Cdk1 (например, сборка пререпликативного комплекса), а другие — только при повышении ее активности (вступление в митоз). Походящие для репликации внешние условия устанавливаются, только когда активность Cdkl низкая, а митотический процесс начинается, когда активность киназы высока. Вхождение в фазу митоза завершается после полной активации Cdk1, а также некоторых других протеинкиназ. Эти киназы регулируют функцию машины сегрегации хромосом, а именно веретена.
После биполярного прикрепления сестринских хроматид к митотическому веретену при наступлении анафазы они расходятся и в дальнейшем мигрируют к противоположным полюсам веретена за счет его элонгации. Разделение сестринских хроматид в анафазе требует участия убиквитин-лигазы, АРС. Активность Cdk1 в анафазе начинает снижаться, что позволяет клетке входить в S-фазу следующего цикла.
Внешние сигналы определяют, должна ли здоровая клетка вступить в цикл деления или перейти в неделящееся, покоящееся состояние. Такие сигналы зависят от наличия питательных веществ, межклеточных взаимодействий, а также от присутствия ростовых факторов. Биохимические процессы, которые генерируются в ответ на поступление внешних сигналов, могут обладать стимулирующими или ингибиторными свойствами. В большинстве случаев, они влияют на точку перехода из G1- в S-период, которая для большинства клеток представляет собой основную точку контроля в цикле. Коммитирование клетки к вступлению в S-фазу, переход от G2 к митозу и наступление анафазы находятся под контролем соответствующих точек, которые задерживают прохождение клетки по циклу в случае, если не выполнены все требования, обеспечивающие точность прохождения событий цикла.
Дефекты механизма функционирования точек контроля приводят к сохранению ошибок дупликации в следующем поколении клеток и могут привести к нерегулируемой пролиферации и к развитию рака. Образованию опухолей способствуют два типа мутаций: инактивирующие мутации в генах-супрессорах опухоли и активирующие мутации в протоонкогенах. Одна мутация редко служит причиной возникновения опухоли, и риск развития рака возрастает, когда в клетке присутствуют несколько мутаций, нарушающих ее генетическую стабильность.
Видео стадии и фазы клеточного цикла клетки
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Казахский национальный университет им. Аль-фараби

Молекулярные механизмы регуляции клеточного цикла
Кафедра: молекулярной биологии и генетики
Дисциплина: цитогенетика человека и животных
Введение
Клеточный цикл и продолжительность его стадий у разных организмов.
1.2. Клеточный цикл высших дрожжей
1.3. Клеточный цикл растений
G1 фаза. В течении этой фазы, также называемой фазой первого разрыва, клетка физически становится больше, копирует органеллы и создает молекулярные строительные блоки, которые потребуются на более поздних.
S-фаза. В S-фазе клетка синтезирует полную копию ДНК в своем ядре. Он также дублирует структуру, организующую микротрубочки, называемую центросомой. Центросомы помогают разделить ДНК во время фазы M.
Во время второй фазы перерыва, или фазы G2, клетка больше растет, производит белки и органеллы и начинает реорганизовывать свое содержимое, готовясь к митозу. Эта фаза заканчивается, когда начинается митоз.
Фазы G1, S и G2 вместе известны как межфазные. Префикс является промежуточным между, отражая, что интерфаза имеет место между одной митотической (M) фазой и следующей.
Во время митотической (M) фазы клетка делит скопированную ДНК и цитоплазму, образуя две новые клетки. M-фаза включает два различных процесса, связанных с делением: митоз и цитокинез.

В митозе ядерная ДНК клетки конденсируется в видимые хромосомы и разделяется митотическим веретеном, специализированной структурой, состоящей из микротрубочек. Митоз проходит в четыре стадии: профаза (иногда делится на раннюю профазу и прометафазу), метафаза, анафаза и телофаза. Подробнее об этих этапах вы можете узнать из видео о митозе. При цитокинезе цитоплазма клетки делится на две части, образуя две новые клетки. Цитокинез обычно начинается сразу после окончания митоза с небольшим перекрытием. Важно отметить, что цитокинез в клетках животных и растений протекает по-разному.
У животных деление клеток происходит, когда полоса цитоскелетных волокон, называемая сократительным кольцом, сжимается внутрь и сжимает клетку надвое, этот процесс называется сократительным цитокинезом. Вмятина, образовавшаяся при сжатии кольца внутрь, называется бороздой спайности. Клетки животных можно защемить пополам, потому что они относительно мягкие и мягкие. Клетки растений намного жестче, чем клетки животных; они окружены жесткой клеточной стенкой и имеют высокое внутреннее давление. Из-за этого растительные клетки делятся на две части, создавая новую структуру посередине клетки. Эта структура, известная как клеточная пластинка, состоит из компонентов плазматической мембраны и клеточной стенки, доставленных в везикулах, и разделяет клетку на две части.
Разным клеткам требуется разное время для завершения клеточного цикла. Типичной человеческой клетке может потребоваться около 24 часов для деления, но быстро меняющиеся клетки млекопитающих, такие как те, что выстилают кишечник, могут завершать цикл каждые 9-10 часов, когда они выращиваются в культуре. Различные типы клеток также по-разному распределяют свое время между фазами клеточного цикла. Например, у ранних эмбрионов лягушки клетки почти не проводят времени в G1 и G2, а вместо этого быстро переключаются между фазами S и M, что приводит к делению одной большой клетки, зиготы, на множество более мелких клеток.


Контрольные точки клеточного цикла - это механизмы наблюдения, которые контролируют порядок, целостность и точность основных событий клеточного цикла. К ним относятся рост клеток до подходящего размера, репликация и целостность хромосом, а также их точное разделение при митозе. Многие из этих механизмов имеют древнее происхождение и очень консервативны, и, следовательно, в значительной степени основаны на исследованиях на простых организмах, таких как дрожжи. Другие эволюционировали в высших организмах и контролируют альтернативные судьбы клеток, оказывая значительное влияние на подавление опухолей. Здесь мы рассматриваем эти различные пути контрольных точек и последствия их дисфункции на судьбу клеток. Был достигнут огромный прогресс в молекулярном изучении различных путей контрольных точек клеточного цикла.

Контроль размера ячейки

Функция контрольной точки веретена предотвращает активацию APC Cdc20 в условиях, когда кинетохоры не заняты микротрубочками веретена или прикреплены, но не находятся под напряжением (например, когда они прикреплены к тому же полюсу, известному как merotelic прикрепление). В этих условиях белок контрольной точки веретена Mad2 (Mitotic Arrest Deficient) ингибирует активность Cdc20 как в контексте Cdc20 на неприсоединенных кинетохорах, где он образует комплекс контрольной точки митоза, так и на APC-связанных молекулах. Cdc20 также регулируется киназой митотической контрольной точки Bub1 у дрожжей (почкование не ингибируется беномилом) и ее двоюродным братом Bub1R у млекопитающих. Как Cdc2 неактивен, так и APC, и, следовательно, клетки не могут войти в анафазу.
Контрольная точка веретена включает ряд других белков, список которых растет с эволюционной сложностью. Кроме того, формирование веретена, а также обнаружение и коррекция дефектов веретена находятся под контролем киназ Polo, Aurora и NIMA-related (Nek). В этом отношении контрольная точка веретена разделяет ту же основную предпосылку, что и те, которые контролируют целостность ДНК, рассмотренную выше - предотвращают переход клеточного цикла, в то время как другие эффекторы исправляют дефект, изменяющий геном. Однако митотическая контрольная точка уникальна тем, что она функционирует для поддержания активности CDK, тогда как те, которые функционируют в интерфазе, стремятся поддерживать неактивность CDK.
4. Роль белка р53 в клеточном цикле.
Р53 представляет собой фактор транскрипции, который в высокой степени индуцируется многими стрессовыми сигналами, такими как повреждение ДНК, активация онкогенов и недостаток питательных веществ. Остановка клеточного цикла и апоптоз - наиболее важные результаты активации p53. Многие исследования показали, что функции клеточного цикла p53 и апоптоза важны для предотвращения развития опухоли. p53 также регулирует многие клеточные процессы, включая метаболизм, антиоксидантный ответ и восстановление ДНК. Новые данные свидетельствуют о том, что эта неканоническая активность p53 может также иметь сильные противоопухолевые эффекты в определенном контексте. Этот обзор фокусируется на функциях p53 остановки клеточного цикла и апоптоза, их роли в супрессии опухолей и регуляции решения клеточной судьбы после активации p53.
Остановка клеточного цикла и апоптоз - наиболее заметные биологические результаты активации p53 в культуре клеток и в экспериментах на животных. Основополагающее открытие p53 как ингибитора опосредованной онкогеном трансформации в формировании очагов, вероятно, является результатом его остановки клеточного цикла или активности апоптоза. ДНК-связывающий домен p53 млекопитающих обладает предельной термостабильностью, что облегчает идентификацию чувствительных к температуре мутантов и обеспечивает мощный инструмент для контроля функции p53.
Учитывая способность p53 вызывать как остановку клеточного цикла, так и гибель клеток, регуляция решения клеточного цикла является предметом многочисленных исследований. Это тема, имеющая большое клиническое значение, поскольку р53-опосредованный апоптоз в нормальных тканях участвует в токсичности химиотерапии, ишемии и нейродегенеративных заболеваниях, таких как болезнь Альцгеймера и Паркинсона. Индукция р53-опосредованного апоптоза в опухолевых клетках считается желательным результатом лечения рака, тогда как индукция остановки клеточного цикла может мешать лекарствам, нацеленным на митоз, и снижать эффективность лекарств, повреждающих ДНК.
Функции и роль белка р53
Остановка клеточного цикла с помощью p53 в основном опосредуется активацией транскрипции p21 / WAF1. p53 связывается с двумя сайтами на 2,4 т.п.н. и 1,4 т.п.н. выше промотора p21. 5'-сайт на промоторе p21 является одним из самых сильных проанализированных сайтов связывания p53 с константой диссоциации
Клеточный цикл - важнейший процесс роста организма. Клеточный цикл - это фундаментальный процесс, посредством которого клетка созревает, синтезирует ДНК и делится с образованием дочерних клеток. Все многоклеточные организмы используют деление клеток для роста, поддержания и восстановления клеток и тканей. Одноклеточные организмы используют этот процесс для размножения.
Клеточный цикл - это репликация и воспроизведение клеток у эукариот или прокариот. Для прокариот клеточный цикл, называемый бинарным делением, позволяет им жить, делясь на две новые дочерние клетки. Что касается эукариот, рассмотрите такое животное, как кошка: если кошка получит серьезную травму, ей потребуется клеточный цикл для репликации клеток, чтобы заменить те, которые были повреждены в результате травмы, и, следовательно, нуждается в клеточном цикле для самовосстановления. Зиготы также зависят от клеточного цикла, чтобы сформировать множество клеток, чтобы в конце своего процесса произвести детский организм. Растениям необходим клеточный цикл, чтобы расти и обеспечивать жизнь всем организмам на Земле. и поэтому клеточный цикл очень важен для организмов, поскольку если бы его не было, или если бы он внезапно остановился, жизнь полностью прекратилась бы.
Клеточный цикл влияет на нашу повседневную жизнь. Большинство видов рака являются результатом неправильного клеточного деления, возникающего из-за отклонений в регуляции нормального клеточного цикла. Биология стволовых клеток и регуляция роста органов также включают обширное изучение клеточного цикла. Поэтому на сегодняшний день, огромное значение в изучении рака и других различных заболеваниях, которые мы рассматривали выше, это изучение клеточного цикла и его составляющих.
Функция "чтения" служит для ознакомления с работой. Разметка, таблицы и картинки документа могут отображаться неверно или не в полном объёме!
Молекулярные механизмы регуляции клеточного цикла Клеточный цикл – это период жизни клетки от одного деления до другого или от деления до смерти. Клеточный цикл состоит из интерфазы (период вне деления) и самого клеточного деления.
В конце G1 периода принято различать специальный момент, называемый R точкой (точка рестрикции, R пункт), после которого клетка обязательно в течение нескольких часов (обычно 1–2) вступает в S период. Период времени между R точкой и началом S периода можно рассматривать в качестве подготовительного для перехода в S период.
Самый главный процесс, который идет в S периоде, – это удвоение или редупликация ДНК. Все остальные реакции, происходящие в это время в клетке, направлены на обеспечение синтеза ДНК. К таким вспомогательным процессам можно отнести синтез гистоновых белков, синтез ферментов, регулирующих и обеспечивающих синтез нуклеотидов и образование новых нитей ДНК.
Прохождение клетки по всем периодам клеточного цикла строго контролируется. При движении клеток по клеточному циклу в них появляются и исчезают, активируются и ингибируются специальные регуляторные молекулы, которые обеспечивают: 1) прохождение клетки по определенному периоду клеточного цикла и 2 переход из одного периода в другой. Причем прохождение по каждому периоду, а также переход из одного периода в другой контролируется различными веществами. Сейчас мы попробуем выяснить, что же это за вещества и что они делают.
Общая ситуация выгладит так. В клетке постоянно присутствуют специальные белки-ферменты, которые путем фосфорилирования других белков (по остаткам серина, тирозина или треонина в полипептидной цепи), регулируют активность генов, ответственных за прохождение клетки по тому или иному периоду клеточного цикла. Эти белки-ферменты называются циклин-зависимыми протеинкиназами (cdc). Имеется несколько их разновидностей, но они все обладают сходными свойствами. Хотя количество этих циклин-зависимых протеинкиназ может варьировать в различных периодах клеточного цикла, они присутствуют в клетке постоянно, независимо от периода клеточного цикла, то есть они имеются в избытке. Другими словами, их синтез или количество не лимитирует или не регулирует прохождение клеток по клеточному циклу. Однако при патологии, если синтез их нарушен, снижено их количество или имеются мутантные формы с измененными свойствами, то это, конечно же, может повлиять на течение клеточного цикла.
Почему же такие циклин-зависимые протеинкиназы сами не могут регулировать прохождение клеток по периодам клеточного цикла. Оказывается, что они находятся в клетках в неактивном состоянии, а для того чтобы они активировались и начали работать, необходимы специальные активаторы. Ими являются циклины. Их также много разных типов, но они присутствуют в клетках не постоянно: то появляются, то исчезают. В разные фазы клеточного цикла образуются разные циклины, которые связываясь с Cdk образуют различные Cdk циклиновые комплексы. Эти комплексы регулируют разные фазы клеточного цикла и поэтому называются G1-, G1/S-, S- и М-Cdk (рис. из моих рис. циклины). Так, например, прохождение клетки по G1 периоду клеточного цикла обеспечивает комплекс циклин-зависимой протеинкиназы 2 (cdk2) и циклина D1, циклин-зависимой протеинкиназы 5 (cdk5) и циклина D3.
Клетка является элементарной единицей всего живого. Вне клетки жизни нет. Размножение клеток происходит только путем деления исходной клетки, которому предшествует воспроизведение ее генетического материала. Активация деления клетки происходит вследствие воздействия на нее внешних или внутренних факторов. Процесс деления клетки с момента ее активации называется пролиферацией. Иными словами, пролиферация - это размножение клеток, т.е. увеличение числа клеток (в культуре или ткани), происходящее путем митотических делений. Время существования клетки как таковой, от деления до деления, обычно называют клеточным циклом
Во взрослом организме человека, клетки различных тканей и органов имеют неодинаковую способность к делению. Кроме того, при старении интенсивность пролиферации клеток снижается (т.е. увеличивается интервал между митозами). Встречаются популяции клеток, полностью потерявшие свойство делиться. Это, как правило, клетки, находящиеся на терминальной стадии дифференцировки, например, зрелые нейроны, зернистые лейкоциты крови, кардиомиоциты. В этом отношении исключение составляют иммунные В- и Т- клетки памяти, которые, находясь в конечной стадии дифференцировки, при появлении в организме определенного стимула в виде ранее встречавшегося антигена способны начать пролиферировать. В организме есть постоянно обновляющиеся ткани - различные типы эпителия, кроветворные ткани. В таких тканях существуют клетки, которые постоянно делятся, заменяя отработавшие или погибающие типы клеток (например, клетки крипт кишечника, клетки базального слоя покровного эпителия, кроветворные клетки костного мозга). Также в организме существуют клетки, которые не размножаются в обычных условиях, но вновь приобретают это свойство при определенных условиях, в частности при необходимости регенерации тканей и органов. Процесс пролиферации клеток жестко регулируется как самой клеткой (регуляция клеточного цикла, прекращение или замедление синтеза аутокринных ростовых факторов и их рецепторов), так и ее микроокружением (отсутствие стимулирующих контактов с соседними клетками и матриксом, прекращение секреции и/или синтеза паракринных ростовых факторов). Нарушение регуляции пролиферации приводит к неограниченному делению клетки, что в свою очередь инициирует развитие онкологического процесса в организме.
Активация пролиферации
Основную функцию, связанную с инициацией пролиферации, берет на себя плазматическая мембрана клетки. Именно на ее поверхности происходят события, которые связаны с переходом покоящихся клеток в активированное состояние, предшествующее делению. Плазматическая мембрана клеток за счет располагающихся в ней молекул-рецепторов воспринимает различные внеклеточные митогенные сигналы и обеспечивает транспорт в клетку необходимых веществ, принимающих участие в инициации пролиферативного ответа. Митогенными сигналами могут служить контакты между клетками, между клеткой и матриксом, а также взаимодействие клеток с различными соединениями, стимулирующими их вступление в клеточный цикл, которые получили название факторов роста. Клетка, получившая митогенный сигнал на пролиферацию, запускает процесс деления.
КЛЕТОЧНЫЙ ЦИКЛ
Весь клеточный цикл состоит из 4 этапов: пресинтетического (G1), синтетического (S), постсинтетического (G2) и собственно митоза (М). Кроме того, существует так называемый G0-период, характеризующий состояние покоя клетки. В G1-периоде клетки имеют диплоидное содержание ДНК на одно ядро. В этот период начинается рост клеток, главным образом, за счет накопления клеточных белков, что обусловлено увеличением количества РНК на клетку. Кроме того, начинается подготовка к синтезу ДНК. В следующем S-периоде происходит удвоение количества ДНК и соответственно удваивается число хромосом. Постсинтетическая G2 фаза называется также премитотической. В этой фазе происходит активный синтез мРНК (матричная РНК). Вслед за этой стадией следует собственно деление клетки надвое или митоз.
Деление всех эукариотических клеток связано с конденсацией удвоенных (реплицированных) хромосом. В результате деления эти хромосомы переносятся в дочерние клетки. Такой тип деления эукариотических клеток - митоз (от греч. mitos - нити) - является единственным полноценным способом увеличения числа клеток. Процесс митотического деления подразделяют на несколько этапов: профаза, прометафаза, метафаза, анафаза, телофаза.
РЕГУЛЯЦИЯ КЛЕТОЧНОГО ЦИКЛА
Назначение регуляторных механизмов клеточного цикла состоит не в регуляции прохождения клеточного цикла как такового, а в том, чтобы обеспечить, в конечном счете, безошибочность распределения наследственного материала в процессе репродукции клеток. В основе регуляции размножения клеток лежит смена состояний активной пролиферации и пролиферативного органа. Регуляторные факторы, контролирующие размножение клеток можно условно разделить на две группы: внеклеточные (или экзогенные) или внутриклеточные (или эндогенные). Экзогенные факторы находятся в микроокружении клетки и взаимодействуют с поверхностью клетки. Факторы, которые синтезируются самой клеткой и действуют внутри нее, относятся к эндогенным факторам. Такое подразделение весьма условно, поскольку некоторые факторы, будучи эндогенными по отношению к продуцирующей их клетке, могут выходить из нее и действовать как экзогенные регуляторы на другие клетки. Если регуляторные факторы взаимодействуют с теми же клетками, которые их продуцируют, то такой тип контроля называется аутокринным. При паракринном контроле синтез регуляторов осуществляется другими клетками.
ЭКЗОГЕННЫЕ РЕГУЛЯТОРЫ ПРОЛИФЕРАЦИИ
У многоклеточных организмов регуляция пролиферации различных типов клеток происходит вследствие действия не одного какого-либо ростового фактора, а их совокупности. Кроме того, некоторые ростовые факторы, будучи стимуляторами для одних типов клеток, ведут себя как ингибиторы по отношению к другим. Классические ростовые факторы представляют собой полипептиды с молекулярной массой 7-70 кДа. К настоящему моменту известно более сотни таких ростовых факторов. Однако здесь будут рассмотрены только некоторые из них.
Пожалуй, самое большое количество литературы посвящено фактору роста из тромбоцитов (PDGF). Освобождаясь при разрушении сосудистой стенки, PDGF участвует в процессах тромбообразования и заживления ран. PDGF является мощным ростовым фактором для покоящихся фибробластов. Наряду с PDGF, не менее обстоятельно изучен эпидермальный фактор роста (EGF), который также способен стимулировать пролиферацию фибробластов. Но, кроме этого также стимулирующе влияет и на другие типы клеток, в частности на хондроциты.
Большую группу ростовых факторов составляют цитокины (интерлейкины, факторы некроза опухоли, колоние-стимулирующие факторы и т.д.). Все цитокины полифункциональны. Они могут, как усиливать, так и угнетать пролиферативные ответы. Так, например, разные субпопуляции CD4+ Т-лимфоцитов, Th1 и Th2, продуцирующие разный спектр цитокинов, по отношению друг к другу являются антагонистами. То есть, Th1 цтокины стимулируют пролиферацию клеток, которые их продуцируют, но в то же время подавляют деление Th2 клеток, и наоборот. Таким образом, в норме в организме сохраняется постоянный баланс этих двух типов Т-лимфоцитов. Взаимодействие факторов роста с их рецепторами на поверхности клетки приводит к запуску целого каскада событий внутри клетки. В результате чего происходит активация факторов транскрипции и экспрессия генов пролиферативного ответа, что в конечном итоге инициирует репликацию ДНК и вступление клетки в митоз.
ЭНДОГЕННЫЕ РЕГУЛЯТОРЫ КЛЕТОЧНОГО ЦИКЛА
В нормальных эукариотических клетках прохождение клеточного цикла жестко регулируется. Причиной онкологических заболеваний является трансформация клеток, как правило, связанная с нарушениями регуляторных механизмов клеточного цикла. Одним из основных результатов дефективности клеточного цикла является генетическая нестабильность, поскольку клетки с ущербным контролем клеточного цикла теряют способность корректно удваивать и распределять между дочерними клетками свой геном. Генетическая нестабильность приводит к приобретению новых особенностей, которые отвечают за прогрессирование опухоли. Циклин-зависимые киназы (CDK)и их регуляторные субъединицы (циклины) являются основными регуляторами клеточного цикла. Прохождение клеточного цикла достигается путем последовательной активации и дезактивации разных комплексов циклин-CDK. Действие комплексов циклин-CDK заключается в фосфорилировании ряда белков-мишеней в соответствии с фазой клеточного цикла, в которой активен тот или иной комплекс циклин-CDK . Так, например, циклин Е-CDK2 активен в поздней G1 фазе и фосфорилирует белки, необходимые для прохождения через позднюю G1 фазу и вход в S фазу. Циклин А-CDK2 активен в S и G2 фазах, он обеспечивает прохождение S фазы и вход в митоз. Циклин А и циклин Е являются центральными регуляторами репликации ДНК. Поэтому неправильная регуляция экспрессии какого-либо из этих циклинов приводит к генетической нестабильности. Было показано, что накопление ядерного циклина А происходит исключительно в тот момент, когда клетка входит в S фазу, т.е. в момент G1/S перехода. С другой стороны, было показано, что уровень циклина Е повышался после прохождения так называемой точки ограничения (R-точки) в поздней G1 фазе, а затем существенно понижался, когда клетка входила в S фазу.
ПУТИ РЕГУЛЯЦИИ CDK
Активность циклин-зависимых киназ (CDK) жестко регулируется, по крайней мере, по четырем механизмам:
1) Основной способ регуляции CDK - это связывание с циклином, т.е. в свободном виде киназа не активна, и только комплекс с соответствующим циклином обладает необходимыми активностями.
2) Активность комплекса циклин-CDK также регулируется за счет обратимого фосфорилирования. Для того чтобы приобрести активность, необходимо фосфорилирование CDK, которое осуществляется при участии CDK активирующего комплекса (САК), состоящего из циклина Н, CDK7 и Mat1.
3) С другой стороны, в молекуле CDK, в регионе, ответственном за связывание субстрата, имеются сайты, фосфорилирование которых приводит к ингибированию активности комплекса циклин-CDK. Эти сайты фосфорилируются группой киназ, включая Wee1 киназу, и дефосфорилируются фосфатазами Cdc25. Активность этих ферментов (Wee1 и Cdc25) существенно варьирует в ответ на разные внутриклеточные события, такие как повреждения ДНК.
4) В конце концов, некоторые комплексы циклин-CDK могут быть заингибированы вследствие связывания с ингибиторами CDK (CKI). Ингибиторы CDK состоят из двух групп белков INK4 и CIP/KIP. Ингибиторы INK4 (p15, p16, p18, p19) связываются с CDK4 и CDK6 и инактивируют их, предотвращая взаимодействие с циклином D. CIP/KIP ингибиторы (p21, p27, p57) могут связываться с комплексами циклин-CDK, содержащими CDK1, CDK2, CDK4 и CDK6. Примечательно, что при определенных условиях CIP/KIP ингибиторы могут усиливать киназную активность комплексов циклин D-CDК4/6
РЕГУЛЯЦИЯ G1 ФАЗЫ
В G1 фазе, в так называемой точке рестрикции (ограничения, R-точка), клетка принимает решение, делится ей или нет. Точка рестрикции - это та точка клеточного цикла, после которой клетка становится невосприимчивой к внешним сигналам вплоть до завершения всего клеточного цикла. Точка рестрикции делит G1 фазу на два функционально различных этапа: G1pm (постмитотический этап) и G1ps (пресинтетический этап). В течение G1pm клетка оценивает присутствующие в ее окружении ростовые факторы. Если необходимые ростовые факторы присутствуют в достаточном количестве, то клетка переходит в G1ps. Клетки, перешедшие в G1ps период, продолжают нормальное прохождение всего клеточного цикла даже при отсутствии ростовых факторов. Если отсутствуют необходимые ростовые факторы в G1pm периоде, то клетка переходит в состояние пролиферативного покоя (G0 фаза).
Основным результатом каскада сигнальных событий, происходящих вследствие связывания ростового фактора с рецептором на поверхности клетки, является активация комплекса циклин D-CDK4/6. Активность этого комплекса существенно возрастает уже в раннем G1 периоде. Этот комплекс фосфорилирует мишени, необходимые для прохождения в S фазу. Основным субстратом комплекса циклин D-CDK4/6 является продукт гена ретинобластомы (pRb). Нефосфорилированный pRb связывается и, тем самым, инактивирует транскрипционные факторы группы E2F. Фосфорилирование pRb комплексами циклин D-CDK4/6 приводит к высвобождению E2F, который проникает в ядро и инициирует трансляцию генов белков, необходимых для репликации ДНК, в частности генов циклина Е и циклина А. В конце G1 фазы происходит кратковременное увеличение количества циклина Е, которое предвещает накопление циклина А и переход в S фазу.
Остановку клеточного цикла в G1 фазе могут вызвать следующие факторы: повышение уровня ингибиторов CDK, депривация ростовых факторов, повреждения ДНК, внешние воздействия, онкогенная активация
РЕГУЛЯЦИЯ S ФАЗЫ
S фаза - это этап клеточного цикла, когда происходит синтез ДНК. Каждая из двух дочерних клеток, которые образуются в конце клеточного цикла, должна получить точную копию ДНК материнской клетки. Каждое основание молекул ДНК, составляющих 46 хромосом человеческой клетки, должно быть скопировано только один раз. Именно поэтому синтез ДНК регулируется крайне жестко.
Было показано, что только ДНК клеток, находящихся в G1 или S фазе, может реплицироваться. Это наводит на мысль, что ДНК должна быть для репликации и что тот кусочек ДНК, который был удвоен, теряет эту . Репликация ДНК начинается в месте связывания белков, называемых ORC (Origin of replicating complex). Несколько компонентов, необходимых для синтеза ДНК, связываются с ORC в поздней М или ранней G1 фазе, формируя пререплекативный комплекс, что собственно и дает ДНК для репликации. На стадии перехода G1/S к пререплекативному комплексу добавляются еще белки, необходимые для репликации ДНК, таким образом, образуется комплекс инициации. Когда начинается процесс репликации и образуется репликативная вилка, многие компоненты отделяются от инициирующего комплекса, а в месте инициации репликации остаются только компоненты пострепликативного комплекса.
Во многих работах было показано, что для нормального функционирования инициирующего комплекса необходима активность циклин А-CDK2. Кроме того, для успешного окончания S фазы также необходима активность комплекса циклин А-CDK2, что, собственно, и является основным регуляторным механизмом, обеспечивающим успешное завершение синтеза ДНК. Остановку в S фазе может индуцировать повреждение ДНК.
РЕГУЛЯЦИЯ G2 ФАЗЫ
G2 фаза - это этап клеточного цикла, который начинается после завершения синтеза ДНК, но до начала конденсации. Основным регулятором прохождения G2 фазы служит комплекс циклин В-CDK2. Арест клеточного цикла в G2 фазе происходит вследствие инактивации комплекса циклин В-CDK2. Регулятором перехода G2/М является комплекс циклин В-CDK1, его фосфорилирование/дефосфорилирование регулирует вход в М фазу. Повреждения ДНК или наличие нереплицированных участков предотвращает переход в М фазу.
Читайте также:

