Микробиология поддесневой зубной бляшки реферат
Обновлено: 08.07.2024
1. Зубная бляшка как первичный этиологический фактор в развитии воспалительных заболеваний пародонта
Этиология и патогенез воспалительных заболеваний
пародонта окончательно не установлены. С начала XX
века до 60-х годов в центре внимания стояли вопросы
общих заболеваний организма, окклюзии. В 60-70-е годы
на первое место была поставлена проблема зубной
бляшки и ее роли в развитии воспалительных изменений
в пародонте.
2. без бляшки нет пародонтита
• Впервые о ведущей роли
микроорганизмов зубного налета в
этиологии гингивита сообщил
Зоненверт (1958), выделив ферменты
агрессивности. В 1963 году Розбери
подтвердил эту точку зрения. В
настоящее время клинически и
экспериментально установлено:
без бляшки нет пародонтита
3. Гипотезы
• Длительное время (с начала 60-х до
середины 80-х годов XX столетия)
воспалительные заболевания пародонта
рассматривались как следствие
неспецифического инфицирования
микроорганизмами зубной бляшки (гипотеза о
неспецифическом инфицировании налетом).
• В эксперименте выяснилось, что не у всех
подопытных собак, несмотря на увеличение
биомассы зубной бляшки, определялся
пародонтит.
Гипотезы
• В 1975-1983 годах на первое место
вышла гипотеза специфичной
микрофлоры зубной бляшки (т.н.
специфическая гипотеза налета).
Благодаря исследованиям Slots F.
(1979), Loesche W. (1992) и др. в
полости рта были обнаружены новые
микроорганизмы и признано
существование пародонтопатогенных
бактерий.
5. Гипотезы
• Тот факт, что специфические бактерии имеются в
полости рта, позволил ввести в 1985 году теорию
оппортунистической инфекции.
• Сегодня считают, что при определенных формах
пародонтита специфичность бактерий стимулируется
тем, что находящиеся в зубном налете
микроорганизмы развиваются под экзогенным или
эндогенным влиянием и вытесняют другие бактерии.
Поэтому воспалительные заболевания пародонта
теперь рассматривают как оппортунистическую
инфекцию, зависящую не только от присутствия
патогенных бактерий, но и от среды способствующей
их размножению (локальные изменения РН,
анаэробная ниша, изменения резистентности
организма и др.)
Микробиология наддесневой
зубной бляшки
• При здоровых деснах на зубах определяется
небольшое количество бляшки, состоящее из
грамположительных бактерий: Str. mitis, Str.
sanguis, актиномицет (A. naeslundii и A.
viscosus), коринебактерий, а также
незначительного числа грамотрицательных
кокков (Neisseria, Veillonella).
• Результаты микробиологических
исследований при гингивите показывают рост
количества актиномицетов (особенно A.
viscosus), трепонем, а также
грамотрицательных палочек (Fusobacterium
nucleatum) и кокков (Veillonella parvula).
• Увеличение же количества и вирулентности
бактерий поддесневой зубной бляшки
способно вызывать пародонтит.
• Собственно его можно рассматривать как
следствие атаки микроорганизмами
поддесневой зубной бляшки при
благоприятных для них условиях тканей
пародонта. По данным Flemmig F. и Karch H.
(1998), лишь несколько из более 500
установленных видов бактерий, находящихся
в поддесневой бляшке, связаны с этиологией
маргинального пародонтита.
9. Микробиология поддесневой зубной бляшки
• За возникновение и развитие
воспалительных изменений в тканях
пародонта наиболее ответственны
следующие микроорганизмы: Actinobacillus
actinomycetemcomitans, Porphyromonas
gingivalis, Bacteroides forsythus, Prevotella
intermedia, Prevotella melanogenica,
Peptostreptococcus, Fusobacterium nucleatum,
Actimomycetus viscosus, odontolyticus, israeli,
naeslundii, Veillonella parvula.
• Actinobacillus actinomycetemcomitans
входит в состав нормальной
микрофлоры полости рта.
• Факторы патогенности - капсула,
компоненты которой ингибируют
синтез ДНК и коллагена (что
вызывает повреждение околозубных
тканей при воспалительных
поражениях пародонта);
лейкотоксин, вызывающий гибель
нейтрофилов,
и бактериоцин, губящий
конкурентные микроорганизмы.
• Porphyromas gingivalis образует индол,
связывает и разрушает фибриноген,
секретирует коллагеназу, агглютинирует
эритроциты.
• Bacteroides forsythus, как и другие
бактероиды, обладают способностью к
адгезии к поверхности эпителия и
выделяет продукты, повреждающие его.
Установлено, что без присутствия
бактероидов невозможно воссоздать
экспериментальную модель
пародонтита и гингивита.
• Prevotella intermedia, Prevotella melanogenica
продуцируют фосфолипазу А, нарушающую
целостность мембран эпителиальных клеток,
что вызывает их гибель.
• Пептострептококки обладают высокими
адгезивными свойствами по отношению к
эпителию и эмали зуба, агрегируют с другими
бактериями полости рта, и образуют с ними
ассоциации.
• Fusobacterium nucleatum образуют индол,
секретирует фосфолипазу А, лейкоцитин,
который оказывает цитотоксическое действие
на различные клетки.
• Основные виды актиномицетов
(Actinomycetus viscosus, A. odontolyticus,
A. naeslundii, A. israeli) при
ферментации углеводов образуют
кислые продукты, проявляющие
агрессивность по отношению к твердым
тканям зубов. Увеличение числа
актиномицетов (особенно A. viscosus) в
наддесневой зубной бляшке приводит к
развитию острого гингивита. A. viscosus
выделяют из зубных камней и
пришеечных кариозных поражений.
• Veillonella parvula самостоятельно
обычно не вызывает развитие
патологических процессов, но может
входить в состав смешанных групп
патогенов либо вызывать вторичные
инфекции. Содержит ферменты,
нейтрализующие кислые продукты
метаболизма других бактерий, является
антагонистом кариесогенных
стрептококков.
• Антигены, токсины зубной бляшки повышают
проницаемость эпителия десневой борозды.
Это увеличивает выделение сулькулярной
жидкости. Под влиянием последней, бактерии
совместно с лейкотоксинами (полипептид,
выделенный из экссудата, способный
активизировать комплекс антиген-антитело)
повышают проницаемость капилляров,
способствуя выходу в соединительную ткань
десны и десневую жидкость полиморфноядерных лейкоцитов. В результате их
альтерации выделяются лизосомальные
ферменты - стартовые площадки воспаления
по Струкову.
• Начальное поражение
пародонта
развивается из клинически здоровой десны
в течение 2-4 дней после аккумуляции
бляшки. Это состояние полностью
обратимо. Клинически оно не
определяется.
• Раннее поражение пародонта
развивается в течение 14 дней при
отсутствии лечения начального
поражения. Клинически соответствует
острому гингивиту.
• Открытое поражение
пародонта
у взрослых развивается в течение
нескольких недель после раннего
поражения. Клинически проявляется
хроническим гингивитом или переходом
последнего в пародонтит. Может быть
полностью обратимым при надлежащей
гигиене полости рта.
• Прогрессирующее поражение
представляет собой деструктивный
процесс в тканях пародонта. Одними
гигиеническими мероприятиями уже
невозможно достичь восстановления
разрушенных тканей.
А - клинически здоровая десна. Наддесневой налет, в краевом
эпителии появляются единичные полиморфные ядерные
нейтрофильные гранулоциты;
Б - начальный этап. Налет в десневой борозде (sulcus),
возрастающее проникание гранулоцитов, первые признаки
ослабления эпителия, увеличенная проницаемость сосудов,
появление лимфоцитов, начало разрушения коллагена
соединительной ткани;
В - ранний этап воспаления. Трещины в эпителии, увеличение
количества сосудов, появление воспалительных отеков
(лимфоциты), отчетливое разрушение коллагена, увеличение
проницаемости сосудов.
Г - хроническое воспаление. Отчетливое образование
десневого кармана (патологический карман), дальнейшее
разрушение соединительной ткани, значительное выделение
нейтрофильных абсорбирующих гранулоцитов, последующие
изменения сосудов.
24. Последними исследованиями не подтверждается связь между курением и отложением поддесневой бляшки
• У курящих сигареты обнаружено большее
отложение зубного камня, а у курящих трубку
- более интенсивное образование зубной
бляшки.
• Доказано (Corberandy., 1980) токсическое
влияние продуктов сгорания табака на
нейтрофильные лейкоциты, мигрирующие в
полость рта и выполняющие фагоцитарную
функцию. У курильщиков уменьшено
количество секреторного IgA (который
отвечает за местную защитную реакцию
против антигенов, контактирующих со
слизистыми оболочками) и снижена
активность IgG в отношении P. intermedia и F.
nucleatum. Вдобавок, у курильщиков снижен
уровень Т-хелперов.
Зубная бляшка. Структура зубной бляшки. Состав зубной бляшки.
Зубная бляшка — наиболее сложный и многокомпонентный биотоп полости рта, в состав которого входят практически все представители микрофлоры полости рта. Количество бляшек и их соотношение значительно варьирует у разных людей и в разные периоды их жизни.
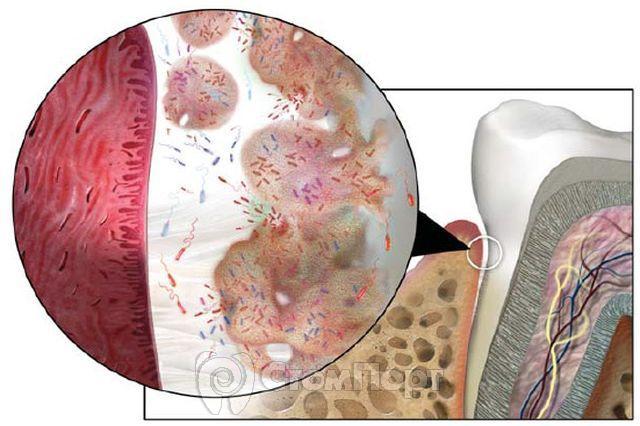
Зубные бляшки — скопления бактерий в конгломерате протеинов и полисахаридов. Матрицу бляшки составляют вещества, попадающие на поверхность зубов со слюной, а также частично образующиеся как метаболиты микроорганизмов. Выделяют над- и поддесневые бляшки, а также бляшки, образующиеся на поверхности зубов и в межзубных щелях. Количественные и качественные изменения микробиоценоза играют решающую роль в возникновении кариеса зубов и пародонтита.
Зубная бляшка начинает формироваться уже через 1-2 ч после чистки зубов. Бляшкообра-зование начинается с взаимодействия кислых групп гликопротеинов слюны с ионами Са2+ зубной эмали, одновременно основные группы гликопротеинов реагируют с фосфатами гидрокси-апатитов. В результате на поверхности зуба образуется тонкая плёнка — пелликула, а присутствие микробов, особенно кислотообразующих, стимулирует её образование. Плёнка облегчает микробную колонизацию поверхности зуба и десневых карманов. Первыми там появляются стрептококки — S. sanguis и S. sativarius, а затем прочие представители аэробной и факультативно-анаэробной флоры. Жизнедеятельность микроорганизмов снижает окислительно-восстановительный потенциал, что создаёт условия для колонизации региона анаэробами— вейло-неллами, актиномицетами и фузобактериями.
При различных значениях рН микробный пейзаж зубных бляшек может значительно варьировать, в частности на верхних зубах преобладают аэробы и факультативные анаэробы (стрептококки и лактобаниллы), на нижних — анаэробы (вейлонеллы и фузобактерии). При образовании бляшек в межзубных щелях микробная колонизация протекает гораздо интенсивнее, но замены аэробных микроорганизмов анаэробами не происходит.
Значительное влияние на развитие зубных бляшек оказывает диета. При высоком содержании в ней углеводов происходит образование большого количества молочной кислоты в результате их ферментации стрептококками и лактобациллами. Молочную кислоту разлагают вейло-неллы, нейссерии и фузобактерии до уксусной, муравьиной, пропионовой и других органических кислот, что обусловливает резкий сдвиг рН среды в кислую сторону. Из углеводов микроорганизмы также могут образовывать различные полисахариды. Внутриклеточные полисахариды аккумулируются в виде запасных гранул. Их разложение также приводит к образованию различных органических кислот. Внеклеточные полисахариды частично утилизируются бактериями, например стрептококками, облегчают их адгезию к субстратам.
В процессе бляшкообразования происходит существенное изменение состава микрофлоры. В первой фазе длительностью 2-4 ч образуется так называемая «ранняя* зубная бляшка, в которой преобладают аэробные и факультативно-анаэробные бактерии — стрептококки, стафилококки, нейссерии и лактобактерии. Общее содержание бактерий не превышает 100-1000 в 1 г. Во второй фазе (4-5-е сутки) их сменяют анаэробные лептотрихии и фузобактерии. Общее содержание бактерий увеличивается до 1-10 млн в 1 г. В третьей фазе (6-7-е сутки и далее) микробиоценоз приобретает качественный окончательный состав, но в нём постоянно происходят количественные сдвиги. Резко снижается содержание аэробов и факультативных анаэробов (нейссерии, стрептококки) с преобладанием облигатных анаэробов (бактероиды, фузобактерии, вейлонеллы, актиномицеты, пептостреп-тококки). Последние выделяют комплекс токсических субстанций и ферментов (коллагеназа, проте-аза, гиалуронидаза и др.), повреждающие прилежащие ткани. Протеазы способны разрушать AT (IgA и IgG), что облегчает дальнейшую микробную колонизацию. Общее содержание бактерий достигает десятков и сотен миллиардов в 1 г. Зубные бляшки могут образовываться и на поверхности пломб; микробный состав бляшек зависит от характера и качества пломбировочного материала.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Зубные бляшки представляют собой обширные наросты патогенных микроорганизмов на поверхности одного или нескольких зубов. Образуемая при этом кислая среда является агрессивной для эмали, приводя к ее разрушению – вплоть до глубокого кариеса.
Зубные бляшки: состав и типичные локализации
В составе зубных бляшек практически отсутствуют пищевые остатки. Они представляют собой склизкую субстанцию, состоящую из следующих групп микроорганизмов:
- cтрептококки – до 50%;
- дифтероиды – до 30%;
- бактероиды, вейлонеллы, фузобактерии, нейссерии и вибрионы – остальной объем.

Причины скопления патогенной микрофлоры
Выделим главные из них:
- общий сбой в работе иммунной системы;
- чрезмерное употребление сахара и сладких продуктов;
- пренебрежение чисткой зубов и другими гигиеническими процедурами полости рта;
- специфический состав слюны.


Симптоматика и этапы образования зубных бляшек
Основным способом выявить зубные бляшки является визуальный осмотр. При этом хорошо заметны отложения на поверхностях зубов. Они могут быть как белыми – практически в цвет эмали, так и в бежевых тонах – из-за курения и/или употребления кофе. Консистенция бляшек -мягкая пластинчатая либо твердая.
По наблюдениям врачей-стоматологов, светлые отложения чаще всего мягкие. Потемнение происходит в процессе твердения. Более темный налет разрастается медленнее светлого.
Скорость, с которой появляются зубные бляшки, а также место, зависят от индивидуальных особенностей организма каждого человека. При этом друг за другом сменяются 3 этапа:
- созревание первичной пелликулы, покрывающей зуб частично или полностью;
- обсеменение колониями микроорганизмов;
- закрепление патогенных микробов на зубной эмали.

Диагностика
Для качественного лечения важно своевременное и точное определение происхождения патогенной микрофлоры.
Лечение зубных бляшек
В зависимости от запущенности, зубные бляшки лечат как в кабинете у стоматолога, так и в домашних условиях.
Врач выполняет тщательную чистку поверхностей зубов и пародонтальных карманов. Затем проводится обработка антисептиками, подобранными индивидуально с учетом бактериологического анализа.Потребуется несколько визитов в клинику.
В случае лечения дома пациенту назначают полоскания специальными растворами. Длительность использования и концентрацию раствора определяет врач.о

Возможные осложнения
Бляшки на зубах не только портят их внешний вид, но и являются причиной кариеса, который развивается стремительно и приводит к быстрой утрате здоровых зубов.
Несвоевременное обращение к врачу по поводу зубных бляшек приводит и к воспалительным заболеваниям десен.

Меры профилактики
Избежать появления зубных бляшек поможет тщательная гигиена ротовой полости. Она включает чистку зубов дважды в день минимум 3 минуты. При этом следует использовать зубную щетку со щетиной средней жесткости и зубную пасту с фтором.
Раз в полгода-год рекомендована ультразвуковая чистка у стоматолога. Также, в зависимости от ситуации, специалист может предложить следующие меры профилактики:
В течение последних 120 лет исследователи-стоматологи пытались понять микробную природу болезней ротовой полости. Их взгляды на зубную бляшку и составляющие ее микроорганизмы менялись от гипотез о специфичности бляшки к предположениям об ее неспецифичности и снова возвращались к теории о наличии специфических пародонтальных патогенов в бляшке. Изменения во взглядах на бляшку и образующие ее микроорганизмы влияют на стратегию профилактики заболеваний пародонта и контроля за ними. В последние годы некоторые исследователи-стоматологи стали рассматривать бляшку как биопленку. Такое изменение взгляда на бляшку является важной основой будущих усилий по профилактике и лечению. Данная статья освещает различные, менявшиеся с годами представления специалистов-стоматологов о бляшке, выдвигая на первый план современный взгляд на бляшку как на биопленку, и описывает разновидности терапии болезней пародонта.
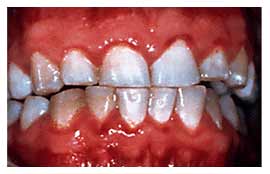
Несмотря на усилия специалистов-стоматологов, инфекции ротовой полости по-прежнему широко распространены. Среднестатистический взрослый американец имеет от 10 до 17 разрушенных, удаленных или запломбированных постоянных зубов. Большинство жителей США болели гингивитом, меньшая часть страдает умеренно выраженными или тяжелыми формами заболеваний пародонта (рис. 1).
Общепризнанно, что микрофлора ротовой полости является многообразной и наличие специфических бактерий во внутриротовой бляшке рассматривается как необходимая, но недостаточная причина возникновения заболевания. До конца не ясно, как именно микроорганизмы бляшки (рис. 2) вызывают заболевания ротовой полости.

Компоненты зубной бляшки и входящие в нее микроорганизмы изучаются с помощью аналитического оборудования, и полученные результаты влияют на стратегию контроля и профилактику заболеваний зубов. За последние два десятилетия современные научные методы изменили взгляд на зубную бляшку, и сейчас многие ученые-стоматологи рассматривают ее как биопленку.
Биопленка
Биопленка — это хорошо организованное, взаимодействующее сообщество микроорганизмов. Классическим примером биопленки может служить тонкое наслоение на скалах, находящихся посреди течения. Подобные бляшки образуются и в ротовой полости. В природе биопленки распространены повсеместно. Они формируются в условиях текучести. Установлено, что свыше 95% существующих в природе бактерий находятся в биопленках. Иногда биопленки могут быть полезными, например, их применяют для обеззараживания отработанных и сточных вод.
Тонкое наслоение, формирующееся на зубах,— пример, знакомый большинству специалистов-стоматологов. Биопленки выстилают нефтепроводы, аквариумы, постоянные катетеры, внутренние имплантаты, контактные линзы и протезы (рис. 3).

Биопленки могут оказаться смертоносными. Болезнь легионеров, унесшая жизни 29 человек в Филадельфии в 1976 г., в конечном счете оказалась связанной с бактериями биопленки в системе кондиционирования воздуха. Миллионы долларов ежегодно расходуются на работы по контролю за этими биопленками.
Изменение взглядов на бляшку
Национальный институт стоматологических и черепнолицевых исследований недавно проводил международную конференцию по микробной экологии. Эта встреча сосредоточила внимание на новом взгляде на бляшку как на биопленку. Конференция подчеркнула важность изменения мнения о зубной бляшке и ее роли в развитии заболеваний ротовой полости. Такая смена взглядов стоматологов на бляшки происходит не впервые, за последние 120 лет эти воззрения претерпели различные изменения.
Период с 1880 по 1930 получил название золотого века микробиологии. За это время были дифференцированы возбудители многих важнейших системных инфекций. Исследователи также искали единственную специфическую причину заболеваний ротовой полости. Предполагая, что бляшка содержит специфический микроорганизм, вызывающий заболевания пародонта, ученые-стоматологи исследовали бляшки в поисках этого возбудителя. Используя доступные в то время методики (микроскопию влажных и окрашенных мазков), ученые идентифицировали различные группы потенциальных возбудителей заболеваний пародонта.
У пациентов с заболеваниями пародонта были выделены амебы, спирохеты, веретенообразные бактерии и стрептококки, считавшиеся, таким образом, потенциальными возбудителями. Лечение болезней пародонта в то время различалось в зависимости от предполагаемых причин заболевания и включало красители, систематическое применение мышьяксодержащих антимикробных препаратов, внутримышечные инъекции препаратов ртути, а также вакцины.
1930-е годы возвестили о новом взгляде на роль бляшки и ее микроорганизмов в этиологии заболеваний пародонта. Ученые-стоматологи предположили, что заболевания пародонта связаны с неким конституциональным дефектом индивидуума. Считалось, что механические раздражители, такие как камни и нависающие края реставраций, также играют важную роль в патогенезе заболеваний пародонта.
На смену уверенности в наличии единственного микробного возбудителя заболеваний пародонта пришли теории неспецифичности бляшек. Гипотеза о неспецифичности бляшки предполагала, что в деструкции пародонта играет роль скорее вся бактериальная флора бляшки, чем специфические бактерии одного вида. Вся бляшка рассматривалась как патогенная. Кроме того, наличие бляшки означает отягощенное течение заболевания. Контроль за бляшками считался необходимым для ограничения производства веществ, раздражающих десны и приводящих к воспалению и разрушению пародонта. Идентификация специфических микроорганизмов была не важна, важен был строгий контроль за бляшками, и это стало центральным моментом в терапии болезней пародонта.
1960-е отмечены возвращением к гипотезе о специфичности бляшки. Исследователи успешно показали возможность передачи заболеваний пародонта между хомяками. Электронная микроскопия подтвердила наличие спирохет в соединительной и эпителиальной тканях пациентов с острым язвенно-некротическим гингивитом в противоположность здоровым лицам контрольной группы. Допустив, что вызванные разными видами микробов бляшки отличаются друг от друга, ученые снова вернулись к поиску специфического микробного пародонтального возбудителя и лечения, нацеленного на причинный фактор.
Новейшие методы микробиологических исследований, такие как микроскопия в затемненном поле, трансмиссионная электронная микроскопия, сканирующая электронная микроскопия, исследования ДНК и иммунологический анализ помогли в исследованиях.
С тех пор ученые продолжают поиски специфического этиологического агента с переменным успехом. Haffajee и Socransky подробно описали причины, затрудняющие точное указание специфических патологических агентов. Некоторые из этих трудностей относятся к процессу отбора микробиологических проб и их культивированию. Эти проблемы включают: получение образца из пародонтального кармана, трудности культивирования некоторых микроорганизмов и большое количество пародонтальных патогенных микроорганизмов, которые могут быть обнаружены в пародонтальном кармане и затем выращены. Забор проб еще более усложняется тем фактом, что в пародонтальном кармане содержатся не только патогенные, но и сапрофитные виды микрофлоры.
Несмотря на эти трудности, нынешние исследователи по-прежнему согласны с тем, что заболевания пародонта являются инфекциями, вызванными специфическими патогенными микроорганизмами. Недавно было обращено внимание на Bacteroides forsythus, а также на P. gingivalis и A. actinomycetemcomitans как на первичных важнейших возбудителей большинства инфекций пародонта, явно связанных с другой подгруппой микроорганизмов (C. rectus, E. nodatum, F. nucleatum, P. intermedia/nigrescens, P. micros, S. intermedium и T. denticola) как с возможными болезнетворными микробами. Исследователи заняты разработкой и совершенствованием диагностических тестов для обнаружения возбудителя пародонтита и его лечения.
Бляшка как биопленка
Раньше изучались бактерии, выращенные в колониях на чашках Петри в лабораториях. Более усложненная микроскопия, такая как однофокусный сканирующий лазер, позволила исследовать биопленки в их естественных состояниях. Микроорганизмы в биопленке ведут себя не так, как бактерии в культурной среде.
Основные свойства биопленки:
- Взаимодействующая общность разных типов микроорганизмов
- Микроорганизмы собраны в микроколонии
- Микроколонии окружены защитным матриксом
- Внутри микроколоний — различная среда
- Микроорганизмы имеют примитивную систему связи
- Микроорганизмы в биопленке устойчивы к антибиотикам, антимикробным средствам и реакции организма хозяина
Наблюдаемые в микроскоп бактерии в биопленке распределены неравномерно. Они сгруппированы в микроколонии, окруженные обволакивающим межмикробным матриксом (рис. 5).
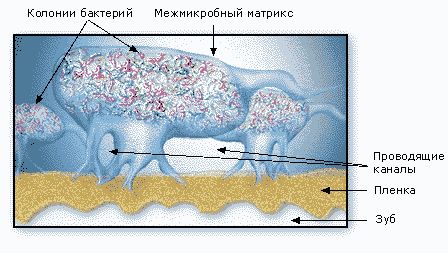
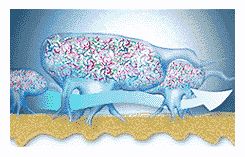
Матрикс пронизан каналами, по которым циркулируют питательные вещества, продукты жизнедеятельности, ферменты, метаболиты и кислород. Эти микроколонии имеют свои микросреды, отличающиеся уровнями рН, усваиваемостью питательных веществ, концентрациями кислорода (рис. 6).
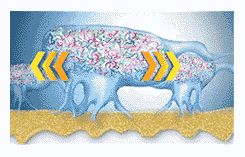
Бактерии в биопленке общаются между собой посредством химических раздражений (сигналов) (рис. 7). Эти химические раздражители вызывают выработку бактериями потенциально вредных белков и ферментов.
Наши предшествующие попытки предвидеть и контролировать заболевания пародонта были основаны на свойствах бактерий, выращенных в лабораторных условиях. С пониманием сути биопленки было показано, что существуют большие различия в поведении бактерий в лабораторной культуре и в их естественных экосистемах. К примеру, бактерия в биопленке вырабатывает такие вещества, которые она не продуцирует, будучи в культуре. Кроме того, матрикс, окружающий микроколонии, служит защитным барьером. Это помогает понять, почему антимикробные средства как общего действия, так и применяемые местно, не всегда дают успешные результаты, даже тогда, когда они нацелены на конкретный вид микроорганизмов. Это также помогает объяснить, почему механическое удаление бляшек и личная гигиена ротовой полости продолжают оставаться неотъемлемой составной частью лечения заболеваний пародонта. Биопленки могут быть удалены механическими средствами, однако они немедленно начинают восстанавливаться, поэтому поиск путей борьбы с биопленками продолжается.
Новые рубежи
Промышленные исследователи внедряют новые технологии борьбы с биопленками. Один из подходов предполагает вмешательство в обмен сигналами между бактериями таким образом, чтобы они не могли общаться между собой. Другой путь — подражание природной защите, выработанной обитателям океана, например, китами и дельфинами, не накапливающими бактериальные биопленки. Исследователи-стоматологи также продолжают следовать по пути новых стратегий для препятствия развития биопленок в ротовой полости.
Возможные стратегические направления для предотвращения развития биопленок в ротовой полости
- примесь питательных веществ, образующих основания (аргинин)
- уменьшение циркуляции в зубодесневом желобке благодаря противовоспалительным средствам
- ингибирование ключевых микробных ферментов
Регулирование рН биопленки
- сахарозаменители
- антимикробные средства
- фтористые соединения
- стимуляция выработки оснований
Регулирование окислительно-восстановительного потенциала
- вещества-восстановители
- вещества-окислители
Изменение концентрации кислорода, рН, усваиваемости питательных веществ в бляшке показало возможность моделирования микрофлоры биопленки и может оказаться полезным. Например, пародонтальным патогенным микроорганизмам для роста необходим низкий окислительно-восстановительный потенциал. Показано, что добавление окислителя, такого как метиленовый синий, в пародонтальные карманы подавляет рост P. gingivalis.
Поскольку увеличение циркуляции в зубодесневом желобке улучшает обеспечение питанием поддесневой биопленки, регулирование этой циркуляции может в будущем использоваться для контроля за поддесневой биопленкой. Использование противовоспалительных средств может не только помочь подавить разрушительные тенденции в организме хозяина, но и уменьшить поступление питательных веществ в биопленку в процессе циркуляции в зубодесневом желобке.
Зубные бляшки — это скопления бактерий в матриксе органических веществ, главным образом протеинов и полисахаридов, приносимых туда слюной и продуцируемых самими микроорганизмами (рис. 25.1) . Различают над- и поддесневые бляшки.

При формировании зубных бляшек в этот период особая роль принадлежит оральным стрептококкам. Так, в течение первых 8 ч количество клеток S. sanguis в бляшках составляет 15 — 35 % общего количества микроорганизмов, а ко 2-му дню — 70%. S. salivatius в бляшках обнаруживается лишь в течение первых 15 мин. Затем к ним присоединяются вейллонеллы, коринебактерии и актиномицеты. На 9 — 11-й день появляются фузиформные бактерии, количество которых быстро возрастает. Таким образом, при образовании бляшек вначале превалирует аэробная и факультативная анаэробная микрофлора, которая резко понижает окислительно-восстановительный потенциал в данной области, создавая тем самим условия для развития строгих анаэробов.
Микрофлора бляшек на зубах верхней и нижней челюстей различается по составу: на бляшках зубов верхней челюсти чаще обитают стрептококки и лактобактерии, на бляшках зубов нижней челюсти — вейллонеллы и нитевидные бактерии. Актиномицеты выделяются из бляшек обеих челюстей в одинаковом количестве. Такое распределение микрофлоры объясняется различными значениями рН среды.
Бляшкообразование на поверхности фиссур и межзубных промежутков, где превалируют грамположительные кокки и палочки при отсутствии анаэробов, происходит иначе. Первичная колонизация идет очень быстро и уже в 1-й день достигает максимума. В дальнейшем количество бактериальных клеток в течение длительного времени остается постоянным. Таким образом, здесь не происходит замены аэробной микрофлоры анаэробной, которая наблюдается в бляшках гладкой поверхности зубов.
На развитие зубных бляшек во многом влияют количество и состав потребляемой пищи, в частности углеводов. В результате ферментативной деятельности оральных стрептококков и лактобактерий происходит расщепление сахарозы с образованием большого количества молочной кислоты, что резко снижает среды. Дальнейший распад образовавшейся молочной кислоты вейллонеллами, нейссериями и другими микроорганизмами приводит к накоплению уксусной, пропионовой, муравьиной и других органических кислот, которые также участвуют в бляшкообразовании. При избыточном потреблении сахарозы и других углеводов происходит образование внутри- и внеклеточных полисахаридов. Первые близки к гликогену и могут использоваться бактериальной клеткой как запасные питательные вещества. При их разложении происходит образование молочной и других органических кислот, которые снижают значение рН среды и участвуют в бляшкообразовании. Однако при рН ниже 5,5 синтез внутриклеточных полисахаридов подавляется. Многие микроорганизмы полости рта, особенно S. mutаns, способны образовывать внеклеточные полисахариды — растворимый и нерастворимый глюкан (декодерам) и леван (фруктан). Растворимый глюкан и леван легко расщепляются как S. mutans, так и другими микроорганизмами. Нерастворимый глюкан активно участвует в процессе адгезии оральных микроорганизмов.
Наряду с кислыми продуктами в результате метаболизма образуются щелочные продукты, например мочевина, аммиак и др., присутствие которых приводит к повышению значения рН в бляшках, что препятствует дальнейшему их развитию.
Читайте также:

