Методы световой микроскопии реферат
Обновлено: 17.05.2024
Зародившись в XVI веке оптические приборы произвели настоящую революцию, как в научной, так и в прикладной сферах биологических наук. Эти инструменты впервые позволили человеку заглянуть в мир микроскопических существ и отдельных клеток, дали возможность изучать биологические объекты чрезвычайно малых размеров и их отдельные элементы. С тех пор методы микроскопии прошли длинную эволюцию, постоянно совершенствуясь и достигая всё большей разрешающей способности. Благодаря этому, методы микроскопии нисколько не потеряли своей актуальности и по сей день, находя самое широкое применение в биологических и медицинских науках, лабораторных и клинических исследованиях, позволяя изучать морфологию и физиологию клеток – строительных блоков всех живых существ. Так же они применяются в исследованиях наноматериалов, при выполнении работ, требующих особой тонкости, таких как микрохирургия. С годами были разработаны различные конструкции микроскопа (прямые, инвертированные, стереоскопические микроскопы), а также большое количество модификаций метода микроскопии, таких как светлопольная, фазово-контрастная, темнопольная, люминесцентная, лазерная конфокальная и мультифотонная микроскопия. Микроскопия является неотъемлемой частью многих исследовательских работ, при этом регулярно появляются новые методы и перспективы для их применения.

2. Spasov A.A., Bugaeva L.I., Bukatin M.V., Kuzubova E.A., Rebrova D.N. The influence of a new antioxidatic preparation on the reproductive function of male-rats // European Journal of Natural History. – 2007. – № 1. – С. 115–116.
3. Stevens A., Yang H., Kovarik L., Yuan X. Compressive Sensing in Microscopy: a Tutorial // Microscopy and Microanalysis, 2016. Т. 22. № . S3. Р. 2084–2085. DOI: 10.1017/S1431927616011260.
4. Снегирева Л.В. Оптические методы исследования в биологии и медицине // Международный журнал экспериментального образования. – 2017. – № 2. – С. 51–52.
5. Феофанов А.В. Cпектральная лазерная сканирующая конфокальная микроскопия в биологических исследованиях // Успехи биологической химии. – 2007. – № 47. – С. 371–410.
Микроскопия – это изучение объектов и элементов чрезвычайно малых размеров. Человеческий глаз имеет предел разрешения и детализации таких объектов, диктуемый его природными свойствами. Для преодоления этого биологического ограничения используются различные приборы-микроскопы. На сегодняшний день, одним из ведущих методов исследования микрообъектов в биологических науках является оптическая (она же световая) микроскопия. Световые микроскопы являются важнейшими инструментами как при проведение некоторых рутинных медицинских анализов, так и в биологических и медико-биологических научных исследованиях. Они незаменимы при изучении морфологических свойств микробиологических объектов, к которым относятся насекомые и их части, многие паразиты, клетки растений и животных, простейшие и бактерии. Возможность изучения топографии, морфологии, ультраструктуры позволило человеку значительно расширить свои знания о микроорганизмах. В медицине, микроскопы позволяют проводить подсчёт клеток крови, анализ биопсий на структуру, морфологию и наличие определённых включений. С применением молекулярно-биологических техник, появилась возможность выявить локализацию отдельных химических веществ.
Сущность оптических методов
Современная световая микроскопия обеспечивает увеличение до 2–3 тысяч раз, что является достаточным для изучения различных форм жизни на клеточном уровне и других биологических объектов [1, 2]. Основными характеристиками любого микроскопа являются разрешающая способность и контраст. Разрешающая способность – минимальное расстояние, на котором находятся две точки, различаемые как раздельные объекты. Контраст –возможность различать объекты и отдельные детали от их фона. Если различие в яркости объекта и фона составляет менее 3 – 4 %, то его невозможно различить, даже если оптика микроскопа теоретически способна разрешить его детали. На контраст влияют как свойства объекта, которые изменяют световой поток по сравнению с фоном, так и способности оптики прибора уловить возникающие различия в свойствах луча. Главным ограничением для возможностей светового микроскопа является волновая природа света, которое не позволяет увидеть объекты, размеры которых сопоставимы с волновой длиной электромагнитного излучения светового диапазона, т.е. меньше 1 микрометра.
Для различных нужд создаются оптические системы различной конструкции [3, 4]:
Прямой микроскоп является наиболее часто встречаемой конструкцией. Такая схема используется чаще всего при изучение прозрачных и полупрозрачных микрообъектов размеров, сопоставимых с клетками. Лабораторные микроскопы особенно широко применяются в различных областях биологии (ботанике, микробиологии, цитологии) и медицины (обычно это микробиологический и гистологический анализ материала).
Инвертированная схема микроскопа отличается от прямой тем, что в ней объективы находятся не над, а под исследуемым предметом. Это позволяет оптимизировать конструкцию инструмента для работы с достаточно большими по своему объему объектами, вроде флаконов для культивирования клеток. В зависимости от назначения и особенностей конструкции, инвертированные микроскопы могут быть биологическими, люминесцентными, металлографическими и др. Подобные приборы широко используются при различных научных и лабораторных исследованиях в микробиологии и медицине.
Стереоскопические или стереомикроскопы имеют в своей конструкции два расположенных под углом объектива, и благодаря этому позволяют получать стереоскопическое изображение исследуемого объекта. Стереомикроскопы обладают существенно большей глубиной резкости, чем обычные, что позволяет использовать их для изучения относительно крупных и выпуклых микрообъектов – таких как части растений, грибов, колонии микроорганизмов. Выделяют два типа конструкции световых микроскопов: схема Грену и оптическая система с общим главным объективом.
Светлопольная микроскопия позволяет исследовать объекты в проходящем свете в светлом поле [2,5]. Данный вид микроскопии предназначен для исследования морфологии, размеров клеток, их взаимного расположения, структурной организации клеток и других особенностей. У светового микроскопа максимальная разрешающая способность составляет 0,2 мкм, что обеспечивает высокоточное увеличение микроскопа до 1500х.
Фазово-контрастная микроскопия (рис. 1) используется для получения высококонтрастных изображений прозрачных образцов, таких как живые клетки, микроорганизмы, тонкие кусочки ткани, литографические узоры, волокна, латексные дисперсии, осколки стекла и субклеточные частицы, включая ядра и другие органеллы. Метод контраста участка использует оптический механизм для того, чтобы перевести мельчайшие изменения в участке в соответствующие изменения в амплитуде, которые можно визуализировать как разницы в контрасте изображения. Одно из главных преимуществ микроскопии контраста участка в том, что живущие клетки можно рассмотреть в их естественном положении, без предварительного убийства. В результате динамика протекающих биологических процессов может наблюдаться и регистрироваться в высоком контрасте, с высокой четкостью мельчайших деталей образца.


Лазерная конфокальная микроскопия

Мультифотонная микроскопия схожа с конфокальной и обеспечивает четкие преимущества для трехмерной визуализации [6]. Она хорошо подходит для визуализации живых клеток, особенно в интактных тканях, таких как срезы мозга, эмбрионы, а так же целые органы или небольшие организмы. Эффективная чувствительность флуоресцентной микроскопии, особенно при работе с толстыми образцами, как правило, ограничена вспышкой без фокуса. Это ограничение значительно сокращается в конфокальном микроскопе, с помощью конфокального отверстия для отклонения фоновой флуоресценции фокуса и получения несжатых оптических секций менее 1 микрометра. Мультифотонная микроскопия имеет преимущества: 1. Вследствие значительно меньшего поглощения тканей и клеток в ИК – области по сравнению с УФ, уменьшается повреждение живых клеток фотоиндуцированными процессами. 2. Достигается большая глубина проникновения излучения в биологические объекты. 3. Отсутствует возбуждение и выцветание флуорохромов вне фокального микрообъема, поэтому конфокальная диафрагма не требуется.
Эпоха, когда оптическая микроскопия была чисто описательным инструментом прошла. В настоящее время формирование оптического изображения является лишь первым шагом к анализу данных. Микроскоп выполняет этот первый шаг в сочетании с электронными детекторами, процессорами изображений и устройствами отображения, которые можно рассматривать как расширения системы формирования изображения. Компьютеризированное управление фокусом, сценическим положением, оптическими компонентами, ставнями, фильтрами и детекторами широко распространено и позволяет проводить экспериментальные манипуляции, которые невозможны для человека при использовании механических микроскопов. Возрастающее применение электрооптики в флуоресцентной микроскопии привело к созданию оптических пинцетов, способных манипулировать субклеточными структурами или частицами, изображениями отдельных молекул и широким спектром сложных спектроскопических приложений.
Световая, или оптическая, микроскопия — это один из основных методов исследования частиц, неразличимых человеческим глазом. Данный метод имеет широкое распространение в медицине, фармакологии, биологии, металлографии, криминалистике и других сферах.
Увеличение изображения в световом микроскопе обеспечивается системой собирательных линз, расположенных в окуляре и объективе.

Световой микроскоп — оптический прибор, позволяющий рассмотреть мелкие детали.
Метод световой микроскопии
Предельная разрешающая способность человеческого глаза составляет около 0,1 мм. Это понятие отражает минимальное расстояние, на котором 2 соседние точки определяются как отдельные объекты. Микрочастицы, клеточные структуры и дефекты поверхности имеют размер менее 100 мкм, поэтому для их исследования требуется специальное оборудование.
Историческая справка
Первые оптические микроскопы были изобретены в XVI-XVII вв. Первым, кто заметил увеличительный эффект комбинации из нескольких линз, был венецианский врач Джироламо Фракасторо. В 1609 г. Галилео Галилей представил собственный вариант прибора с 2 стеклами: выпуклым и вогнутым. Первое устройство называлось оккиолино (occhiolino).
Через 10 лет после этого голландский ученый Корнелиус Дреббель усовершенствовал конструкцию, использовав для объектива 2 выпуклые линзы.
Практическое применение микроскопа началось с конца XVII в., когда Антони Ван Левенгук использовал собственное оптическое устройство для исследования биологических структур. Его микроскоп содержал всего одно мощное стекло, что уменьшало количество дефектов картинки.
Приборы Левенгука позволяли увеличить изображение в 275 раз и рассмотреть строение бактерий, дрожжей, эритроцитов, одноклеточных микроорганизмов и насекомых.

Методы микроскопии выбираются в зависимости от характера и свойств изучаемых объектов.
В течение следующих столетий конструкция оптического микроскопа непрерывно совершенствовалась. Несмотря на то, что в первой половине XX в. были изобретены электронные приборы, которые позволяли рассмотреть нанообъекты, световой метод не теряет своей популярности. В 2006 г. группа немецких ученых разработала оптическое устройство под названием наноскоп, которое обладает разрешающей способностью 10 нм.
Подробно о принципе действия
Принцип работы оптического микроскопа основывается на прохождении прямого или отраженного луча света через систему линз.
Объектив прибора содержит до 14 стекол. При прохождении светового пучка через эту часть устройства изображение увеличивается до 100 раз, а при прохождении окуляра — в 20-24 раза. Выпуклые и вогнутые стекла позволяют сфокусировать картинку на сетчатке или приспособлениях для документирования информации.
Видимое излучение, которое создает осветительная система прибора, ограничивают несколькими диафрагмами. Это повышает четкость изображения.
Увеличивающие линзы имеют 2 дефекта. Сферическая аберрация мешает фокусировать сразу все поле исследования, а хроническая приводит к появлению яркой каймы по контуру изображения. Чтобы компенсировать дефекты, окуляр и объектив оснащаются корригирующими стеклами.
Где применяется
Методы световой микроскопии применяют в следующих областях науки и промышленности:
- медицине и лабораторной диагностике;
- биологии;
- металлографии, неразрушающих методах контроля на производстве;
- микроэлектронике;
- минералогии, кристаллографии;
- археологии, геологии;
- криминалистике;
- пищевой промышленности;
- ювелирном деле и др.
.jpg)
Световая микроскопия применяется в медицине и биологии.
В целом об устройстве светового микроскопа
Оптический микроскоп состоит из следующих элементов:
- штатива;
- тубуса;
- окуляра;
- объектива;
- призмы;
- источника света;
- конденсора;
- апертурной и полевой диафрагм;
- фокусировочного механизма;
- светофильтра;
- зеркала;
- предметного столика.
.jpg)
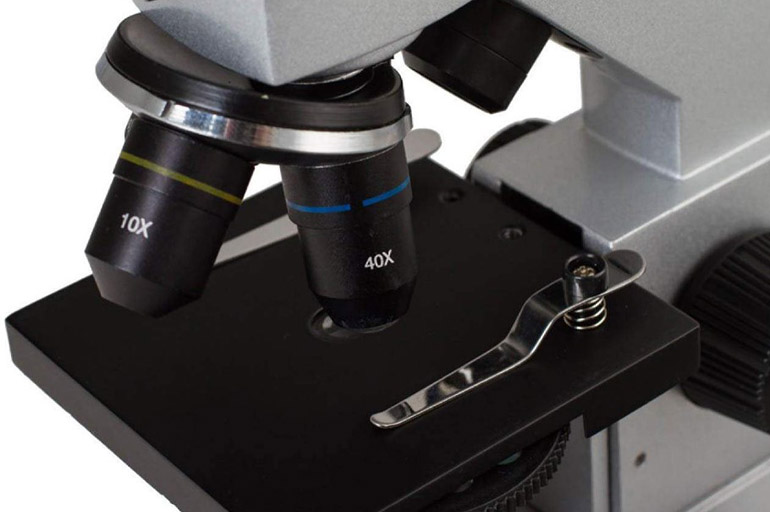
Устройство светового микроскопа.
Некоторые модели прибора оборудованы дополнительными объективами, системами записи и передачи информации.
Виды световых микроскопов с описанием
Особенности конструкции зависят от предназначения микроскопа. Для увеличения четкости изображения используют методы флуоресценции, люминесценции, инверсии и др.
Биологическое оборудование
Биологические приборы позволяют исследовать прозрачные или полупрозрачные объекты. Принцип их работы основан на изучении светлого поля в потоке проходящего света. Такие микроскопы применяют в лабораторной диагностике, ботанике, цитологии, микроэлектронике, археологии и пищевой промышленности.

Биологическое оборудование позволяет исследовать прозрачные объекты.
Для повышения разрешающей способности используют иммерсионные оптические системы. В этом случае между образцом и первым стеклом вводится жидкость с высоким коэффициентом преломления (минеральное масло, раствор глицерина, дистиллированная вода и др.).
Криминалистическое оборудование
Главная особенность криминалистического микроскопа — это возможность сравнения 2 объектов. Такое исследование помогает найти сходство между компонентами взрывных устройств, гильзами, пулями, волосами, волокнами и другими уликами.
Приборы для криминалистики оснащают фото- и видеокамерами, а также программным обеспечением.
Это позволяет снизить вероятность ошибок, построить модели объектов и сравнить с данными из электронных источников.
Флуоресцентные микроскопы
Флуоресцентные, или люминесцентные, микроскопы позволяют исследовать объекты, которые испускают световой поток после облучения ультрафиолетом. Они оборудованы коротковолновым источником освещения, светофильтрами и интерференционной пластинкой.

Флуоресцентный микроскоп — оптический прибор, показывающий в увеличенном виде клетки.
Флуоресцентные микроскопы активно применяют в лабораторной диагностике, в частности, при изучении клеток крови и антигенов. Для анализа предметов, которые не излучают свет, используют люминесцентные красители и порошки.
Поляризационные микроскопы
Поляризационный прибор является наиболее сложным из всех представленных видов микроскопов. Его используют для исследования анизотропных материалов, полимеров, некоторых клеток и микробиологических объектов.
Источник света со специальными фильтрами формирует поляризованный поток, который облучает образец.
Оптическая система интерпретирует двойное лучепреломление среды и позволяет изучить ее структуру.
Инвертированные с перевернутым положением объектива
В инвертированном микроскопе объектив располагается не над образцом, а под предметным столиком. Такие приборы применяют в биологии, медицине, промышленности, металлографии, криминалистике и других сферах.

Инвертированный микроскоп имеет особенную конструкцию.
Перевернутое положение оптической системы позволяет изучать более крупные образцы и работать со специальной посудой.
Микроскопы для металлографии
Металлографические микроскопы предназначены для исследования поверхности непрозрачных объектов. Изображение получают путем преломления отраженного светового луча.
Предметом изучения являются микродефекты поверхности и зерна сплавов. Помимо металлургии и промышленности, такие устройства применяют в геологии и археологии. Для обеспечения четкости используют специальные системы линз и зеркал.
Стереомикроскопы (дают объемное изображение)
Стереомикроскопы оснащены 2 объективами, что позволяет получать объемное изображение исследуемого образца. По сравнению с устройствами плоского поля они дают более резкую, четкую и контрастную картинку.

Стереомикроскопы позволяют получать объемное изображение.
Такие приборы используют в точном машиностроении, ювелирном деле и других областях промышленности.
Моновидеомикроскопы с возможностью получения видео
Видеомикроскопы предназначены для динамического наблюдения за образцом и фиксации изображения. Для повышения эффективности работы их оснащают специальными линзами, светофильтрами и адаптерами.
Разновидности методов световой микроскопии
Выбор метода оптической микроскопии определяется особенностями объектов и целью исследования.
Светлое поле в потоке проходящего света
Данный метод основан на принципе прохождения потока света через образец. Предмет частично поглощает и рассеивает попадающие на него лучи, что позволяет сформировать изображение.

Светлое поле в потоке — метод, который построен на принципе прохождения света.
Светлопольную микроскопию применяют для изучения окрашенных тканей животных и растений, тонких шлифов и др. Для прохождения светового пучка препарат должен быть прозрачным.
Косое освещение
Данный метод является разновидностью микроскопии светлого поля. Чтобы выявить рельеф и сделать изображение более контрастным, поток направляют под большим углом к образцу.
Светлое поле в отраженном свете
Светопольная микроскопия в отраженном свете позволяет исследовать поверхности непрозрачных предметов (сплавов, покрытий, руд и др.). Свет падает на образец сверху, а основная оптическая система исполняет роль объектива и конденсора.
Светлое поле в отраженном свете позволяет исследовать поверхности непрозрачных предметов.
Изображение формируется за счет того, что элементы поверхности по-разному отражают и рассеивают попадающие лучи. Травление дает возможность изучить не только дефекты, но и микроструктуру и фазовый состав образца.
Темное поле
Метод темного поля предназначен для изучения прозрачных образцов, которые не абсорбируют свет. Специальный конденсор направляет лучи так, что они формируют полый конус, в центре которого находится объектив. Таким образом, большая часть лучей не попадает в оптическую систему.
Изображение представляет собой темное поле с небольшими светлыми включениями, которые формируются за счет рассеяния света частицами препарата.
Ультрамикроскопия
Метод ультрамикроскопии является разновидностью темнопольного. Для исследования образцов используют сильные источники света, а лучи направляют перпендикулярно предметному столу. Эффект рассеяния волн позволяет обнаружить частицы менее 10 нм.

Ультрамикроскопия — метод наблюдения и анализа коллоидных частиц.
Фазовое контрастирование
Метод фазового контраста позволяет изучать прозрачные и неокрашенные образцы. При малом различии в коэффициенте преломления изображение нельзя получить ни на светлопольном, ни на темнопольном микроскопе, поскольку разница в поглощении и рассеянии света будет минимальной.
Однако при прохождении через образец волна приобретает фазовый рельеф, который фиксируется специальным объективом. В изображении он отображается как различие в яркости элементов.
Аноптральный контраст
Данная методика является подвидом фазовой микроскопии. На иммерсионную линзу наносят кольцо из сажи, которое пропускает 10% лучей и совпадает с контуром кольцевой диафрагмы конденсора. При отсутствии образца амплитуда световых волн уменьшается на 90%.
Проходя через среды разной плотности, лучи дифрагируют, в результате чего их амплитуда остается неизменной.
За счет этого поле исследования получается темным, а частицы образца — светлыми.
Поляризационный метод
Анализ анизотропных материалов проводят в свете, пропущенном через специальную фильтрующую пластинку. При прохождении через образец плоскость поляризации лучей меняется.
По разнице между начальными и конечными характеристиками волн определяют количество оптических осей, их ориентацию и др.
Интерференционная микроскопия
Интерференционный метод основан на параллельном прохождении 2 лучей через предметный столик и мимо него. В окуляре микроскопа когерентные волны соединяются и интерферируют между собой.
При прохождении через образец первый луч запаздывает по фазе, что влияет на результирующую амплитуду и яркость изображения.
Люминесценция или флуоресценция
Принцип люминесцентной микроскопии основан на том, что некоторые образцы испускают видимый свет после облучения ультрафиолетом. Перед исследованием препараты обрабатывают флуоресцирующими антисыворотками, порошками или маркерами.
Волны ультрафиолетового спектра применяют для повышения разрешающей способности микроскопа. Для изучения препаратов, которые не испускают видимый свет после воздействия УФ-лучей, используют фотокамеры и кварцевые линзы.
Методы освещения и наблюдения (микроскопия). Структуру препарата можно различить лишь тогда, когда разные его частицы по-разному поглощают или отражают свет либо отличаются одна от другой (или от окружающей среды) показателем преломления. Эти свойства обусловливают разницу амплитуд и фаз световых волн, прошедших через различные участки препарата, от чего, в свою очередь, зависит контрастность изображения. Поэтому методы наблюдения в М. выбираются (и обеспечиваются конструктивно) в зависимости от характера и свойств изучаемых объектов.
v Метод светлого поля.
Метод светлого поля в проходящем свете применяется при исследовании прозрачных препаратов, у которых различные участки структуры по-разному поглощают свет (тонкие окрашенные срезы животных и растительных тканей, тонкие шлифы минералов и другие). Пучок лучей из осветительной системы проходит препарат и объектив и дает равномерно освещенное поле в плоскости изображения. Поглощающие элементы структуры препарата частично поглощают и отклоняют падающий на них свет.
Метод светлого поля в отраженном свете применяется для наблюдения непрозрачных объектов, к примеру, травленых шлифов металлов и различных минералов. Освещение препарата производится сверху, через объектив, который одновременно выполняет и роль осветительной системы. Изображение, как и при проходящем свете, создается за счет того, что разные участки препарата неодинаково отклоняют падающий на них свет, а отраженные лучи имеют различную интенсивность.
v Метод темного поля в проходящем свете.
Метод тёмного поля в проходящем свете применяется для получения изображений прозрачных неабсорбирующих объектов, невидимых при освещении по методу светлого поля.Свет от осветителя и зеркала направляется на препарат конденсором специальной конструкции — т. н. конденсором тёмного поля. По выходе из конденсора основная часть лучей света, не изменившая своего направления при прохождении через прозрачный препарат, образует пучок в виде полого конуса и не попадает в объектив (который находится внутри этого конуса). Изображение в микроскопе создаётся лишь небольшой частью лучей, рассеянных микрочастицами находящегося на предметном стекле препарата внутрь конуса и прошедшими через объектив. В поле зрения на тёмном фоне видны светлые изображения элементов структуры препарата, отличающихся от окружающей среды показателем преломления. У крупных частиц видны только светлые края, рассеивающие лучи света. При этом методе по виду изображения нельзя определить, прозрачны частицы или непрозрачны, больший или меньший показатель преломления они имеют по сравнению с окружающей средой.Настройка микроскопа аналогична для микроскопов с различными типами освещения любого производства. Метод исследования в темном поле впервые был предложен австрийскими учеными Р.Зигмонди и Р. Зидентопфом в 1903 г.
Наибольшее применение метод нашел для подсчета бактерий. Этот наиболее простой в реализации метод контрастирования. В темнопольном освещении объекты освещены световым кольцом, внутренний диаметр которого больше, чем диаметр поля зрения объектива. Таким образом прозрачные объемные объекты освещены вследствие рассеяния светового потока, а фон препарата остается не подсвеченным (темным).
v Метод фазово-контрастной микроскопии.
Метод может быть реализован двумя способами:
1. расположением элементов с фазовым и световым кольцами внутри оптических систем объектива и конденсора, соответственно;
2. расположением этих элементов вне объектива и окуляра внутри самого микроскопа.
Первый способ реализуется с помощью фазово-контрастных устройств, содержащих фазовые объективы и специальный конденсор с набором световых колец (встроенных в конденсор или выполненных в виде вкладышей). Приобретаются отдельно от микроскопа.
Второй способ реализуется с помощью соответствующих колец, которые устанавливаются в плоскости апертурной диафрагмы конденсора и в вынесенную с помощью дополнительных линзовых элементов плоскость выходного зрачка объектива. При этом и конденсор, и объектив — обычные. Чаще всего этот способ реализуется в современных инвертированных микроскопах.
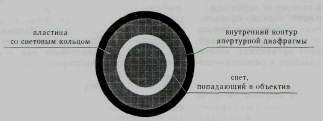
Фазовые объективы внутри имеют фазовый элемент (линза или пластина) с нанесенным кольцом, которое изменяет фазу и уменьшает амплитуду световой волны. Середина кольца в среднем составляет 1 /2— 2 /3 от диаметра выходного зрачка объектива при этом светопропуска-ние кольца — 10—30% в зависимости от типа фазового контраста.
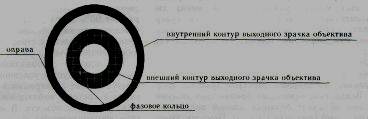
Фазовый конденсор в плоскости апертурной диафрагмы имеет пластину с прозрачным световым кольцом. Размер светового кольца, вернее его изображение, подбирается таким образом, чтобы оно соответствовало (или даже было чуть меньше) размеру фазового кольца объектива.
В типичной для этого метода схеме (рис. на стр.9) в переднем фокусе конденсора 3 устанавливается апертурная диафрагма 2, отверстие которой имеет форму кольца. Её изображение возникает вблизи заднего фокуса объектива 5, и там же устанавливается т. н. фазовая пластинка 6, на поверхности которой имеется кольцевой выступ или кольцевая канавка, называемая фазовым кольцом. Фазовая пластинка может быть помещена и не в фокусе объектива (часто фазовое кольцо наносят прямо на поверхность одной из линз объектива), но в любом случае неотклонённые в препарате 4 лучи от осветителя 1, дающие изображение диафрагмы 2, должны полностью проходить через фазовое кольцо, которое значительно ослабляет их (его делают поглощающим) и изменяет их фазу на l/4 (l — длина волны света).
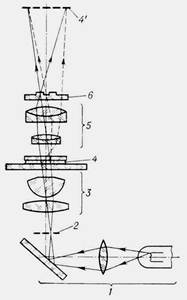
В то же время лучи, даже ненамного отклоненные (рассеянные) в препарате, проходят через фазовую пластинку, минуя фазовое кольцо (штриховые линии), и не претерпевают дополнительного сдвига фазы. С учётом фазового сдвига в материале препарата полная разность фаз между отклоненными и неотклонёнными лучами оказывается близкой к 0 или l/2, и в результате интерференции света в плоскости изображения 4' препарата 4 они заметно усиливают или ослабляют друг друга, давая контрастное изображение структуры препарата. Отклоненные лучи имеют значительно меньшую амплитуду по сравнению с неотклонёнными, поэтому ослабление основного пучка в фазовом кольце, сближая значения амплитуд, также приводит к большей контрастности изображения. Метод позволяет различать малые элементы структуры, чрезвычайно слабо контрастные в методе светлого поля. Прозрачные частицы, сравнительно не малые по размерам, рассеивают лучи света на столь небольшие углы, что эти лучи проходят вместе с неотклонёнными через фазовое кольцо. Для подобных частиц фазово-контрастный эффект имеет место только вблизи их контуров, где происходит сильное рассеяние.
v Метод инвертированной световой микроскопии.
v Метод флуоресцентной (люминесцентной) микроскопии.
Освещение объектов светом, возбуждающим люминесценцию, производится сверху через опак-иллюминатор и объектив. Современные люминесцентные микроскопы обычно являются вариантом модульной конструкции основной серии биологического микроскопа. Люминесцентный микроскоп отличается от биологического (проходящего света) наличием осветителя падающего (отраженного) света и дополнительных узлов, связанных со светофильтрами. В качестве источника света для люминесцентного осветителя используются ртутные лампы. При работе в свете люминесценции необходимо пользоваться только специальными люминесцентными объективами и нелюминесцирующими иммерсионными жидкостями (водная иммерсия и нелюминесцирующее масло).
Различают первичную флюоресценцию (собственной флюоресценцию, нередко проявляемой витаминами, многими пигментами, некоторыми жировыми веществами и антибиотиками, встречающимися в живых организмах, некоторыми продуктами нормального и патологического обмена) и вторичную, или наведенную (возникает в результате поглощения объектом лучистой энергии).
Флуорохромы — красители, не вызывающие сильной окраски объектов в обычном свете, но флуоресцирующие при облучении ультрафиолетовыми лучами. Из синтетических флюорохромов наилучшие результаты дают акридин оранжевый, корифосфин, примулин, родамин, ФИТЦ (флюоресцеинизотиоцианат), которые обычно применяют в виде слабых водных растворов.
v Метод иммунофлуоресценции.
Иммуноцито-, гистохимические методы позволяют локализовать и идентифицировать клеточные и тканевые антигены, основываясь на их связывании с антителам. Использование антител лежит в основе исследований самых разных молекулярных образований:
― структурных компонентов клетки,
― клеточных продуктов (гормонов, ферментов, иммуноглобулинов),
― рецепторов клеточной поверхности.
Для визуализации места связывания антигена с антителом используется целый ряд меток: флуоресцентные красители, ферментные метки, металлы, металлопротеины, радиоизотопы.
Выделяют 2 метода иммунофлуоресценции.
1. Прямой метод. Визуализация тканевых антигенов производится непосредственным конъюгированием их с антителами известной антигенной специфичности. Этот метод появился первым и является низкочувствительным.
2. Непрямой метод. Чувствительность иммуногистохимического окрашивания была значительно повышена с развитием непрямого способа. В непрямом методе в качестве первых антител используют немеченые антитела к клеточным антигенам а в качестве вторых – меченые флуорохромом антитела. В результате первые антитела соединяются с антигеном, а вторые – с первыми. Следует отметить, что при непрямом методе увеличивается чувствительность (усиливается окрашивание) и специфичность (способность связываться только с определенными антигенами) метода.
Типы антител:
Моноклональные антитела вырабатываются клонами плазматических клеток. Антитела определенного клона иммунохимически идентичны и реагируют со специфическим эпитопом антигена, против которого они образованы (рис. 5). Возможно, по причине экономии, мышей принято использовать почти эксклюзивно для продукции моноклональных антител. После достижения иммунного ответа выделяют В-лимфоциты из селезенки и лимфатических узлов и соединяют их в специальных условиях с клетками несекретирующей мышиной миеломы. В то время как В-лимфоциты производят специфические антитела, клетки миеломы дают гибридные клетки (гибридомы), которые долго живут в культуральных условиях. Нереактивные В-клетки и клетки миеломы убирают и культивируют антителопродуцирующую гибридому, тестируя ее на желанную реактивность. Размножение можно проводить в культуре или трансплантацией гибридомы в брюшную полость сингенной мыши. Так можно получить большое и, по крайней мере теоретически, неограниченное количество моноклональных антител со специфическими характеристиками.
Таким образом, моноклональные антитела – это гомогенные антитела, продуцируемые гибридными клетками, в которых сочетаются способность синтеза специфических иммуноглобулинов одного изотипа с неограниченной пролиферацией. Методику получения таких гибридных клеток, иначе называемых гибридомами (hybridomas), разработали Дж. Колер и К. Мильштейн в 1975 г. В общих чертах она состоит в том, что лимфоциты иммунизированного животного, например, мыши, гибридизуются с культивируемыми в среде опухолевыми клетками, в данном примере — мышиными миелобластами; в процессе пассажей гибридом удается проводить отбор клонов, синтезирующих антитела с интересующей исследователя специфичностью. Главным преимуществом моноклональных антител является именно стандартная и воспроизводимая в пассажах специфичность в отношении конкретного эпитотипа (химическая структура на поверхности сложно построенного антигена; в силу особенности своей конфигурации способна взаимодействовать с комплиментарной ей структурой в составе антитела (паратопом), определяя тем самым специфичность данной серологической реакции).
Изобретение технологии получения МКА было отмечено в 1980 году Нобелевской премией. Оно, прежде всего, явилось мощным инструментом для научных исследований в области биологии, иммунологии и медицины и открыло широкие перспективы для создания новых диагностических и лечебных средств в онкологии. К настоящему времени получено громадное количество гибридом-продуцентов моноклональных антител к различным, в том числе к опухоле-ассоциированным антигенам.
v Поликлональные антитела продуцируются различными клетками, и как следствие, иммуннохимически разнородны. Они реагируют с разнообразными эпитопами антигена, против которого они продуцированы. Наиболее часто используемое животное для получения поликлональных антител - кролик, далее следует козел, свинья, овца, лошадь, морская свинка и другие животные. В зависимости от иммуногенности антигена дозы от 10 до 200 мг часто употребляются для индукции иммунного ответа у животных. Антиген часто вводят внутри- или подкожно, однако также часто используют внутримышечные инъекции или инъекции в перитонеальную полость. У кроликов небольшие объемы (0,1-0,5 мл) обычно вводят внутрикожно; антиген разведен или суспензирован в равном объеме адъюванта, например таком как полный или не полный адъювант Фрэйда. Вспомогательную дозу постоянно раз в месяц или при уменьшении титра, увеличивает или поддерживает уровень антител. Кровь добывается из уха у кроликов, яремной вены (у больших животных) или из сердца, часто убийством животного. После удаления клеток, поликлональные антитела могут быть получены или в форме цельной стабилизированной антисыворотки, или разделено на фракции различной степени отчистки. Осаждение солями, после которой используется ионообменная хроматография, способствует удалению большей части других сывороточных протеинов. Афинная хроматография может быть использована для изотипии антигенспецифических антител и отделения их от перекрестнореагирующих антител к другим видам, особенно иммуноглобулинов человека.
v Метод поляризационной микроскопии.
v Метод конфокальной микроскопии.
Конфокальный микроскоп впервые был сконструирован в 1957г. Конфокальный микроскоп дает две неоценимые возможности - исследование тканей на клеточном уровне в состоянии физиологической жизнедеятельности и демонстрации результатов исследования (т.е. клеточной активности) в четырех измерениях - высота, ширина, глубина и время. Использование микроскопа дает возможность получения “оптических срезов” толстых полупрозрачных объектов без их препарирования.
v Метод наблюдения в УФ-лучах.
Метод наблюдения в ультрафиолетовых (УФ) лучах позволяет увеличить предельную разрешающую способность микроскопа, т. е. понизить его предельное разрешение, которое зависит (см. выше) от длины волны λ применяемого излучения (для используемых в микроскопии УФ лучей λ = 400—250 нм, тогда как для видимого света λ = 700—400 нм). Но главным образом этот метод расширяет возможности микроскопических исследований за счёт того, что частицы многих веществ, прозрачные в видимом свете, сильно поглощают УФ излучение определённых длин волн и, следовательно, легко различимы в УФ изображениях. Характерными спектрами поглощения в УФ области обладает, например, ряд веществ, содержащихся в растительных и животных клетках (пуриновые основания, пиримидиновые основания, большинство витаминов, ароматические аминокислоты, некоторые липиды, тироксин и др.); это обусловило широкое применение УФ микроскопии в качестве одного из методов цитохимического анализа. Ультрафиолетовые лучи невидимы для человеческого глаза. Поэтому изображения в УФ микроскопии регистрируют либо фотографически, либо с помощью электронно-оптического преобразователя или люминесцирующего экрана. Распространён следующий способ цветового представления таких изображений. Препарат фотографируется в трёх длинах волн УФ области спектра; каждый из полученных негативов освещается видимым светом определённого цвета (например, синим, зелёным и красным), и все они одновременно проектируются на один экран. В результате на экране создаётся цветное изображение объекта в условных цветах, зависящих от поглощающей способности препарата в ультрафиолете.
v Метод наблюдения в ИК-лучах.
Метод наблюдения в инфракрасных (ИК) лучах также требует преобразования невидимого для глаза изображения в видимое путём его фотографирования или с помощью электронно-оптического преобразователя. ИК микроскопия позволяет изучать внутреннюю структуру объектов, непрозрачных в видимом свете, например тёмных стекол, некоторых кристаллов и минералов и пр.
v Методы обработки изображения.
Современное развитие науки и техники предусматривает применение современных методов обработки изображения и документирования с элементами сбора, систематизации и анализа информации. К таким приборам относятся анализаторы изображения, получившие свое развитие с конца 80-х годов ХХ-го века. Базовым микроскопом может служить в принципе любой микроскоп, имеющий дополнительный вывод изображения в плоскость, сопряженную с фотопленкой или видиконом передающей камеры.
В зависимости от задач применяется цветная или черно-белая телевизионная камера. С ее помощью изображение препарата передается на видеоконтрольный монитор. Монитор выполняет несколько задач:
— позволяет сберечь зрение, облегчая поиск нужного участка изображения,
— делает работу с микроскопом более комфортной,
— позволяет демонстрировать и обсуждать интересующие и спорные участки изображения.
Изображение с монитора передается в компьютер, оснащенный специальной программой для анализа изображений. С помощью компьютера выполняется та часть работы, которая связана с получением и анализом необходимой информации по изображению и его элементам.

МИКРОСКОПИЧЕСКИЕ МЕТОДЫ И ИХ РОЛЬ В СОВРЕМЕННЫХ БИОЛОГИЧЕСКИХ НАУКАХ
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке "Файлы работы" в формате PDF
Микроскопия – это изучение объектов и элементов чрезвычайно малых размеров. Человеческий глаз имеет предел разрешения и детализации таких объектов, диктуемый его природными свойствами. Для преодоления этого биологического ограничения используются различные приборы-микроскопы. На сегодняшний день, одним из ведущих методов исследования микрообъектов в биологических науках является оптическая (она же световая) микроскопия. Световые микроскопы являются важнейшими инструментами как при проведение некоторых рутинных медицинских анализов, так и в биологических и медико-биологических научных исследованиях. Они незаменимы при изучении морфологических свойств микробиологических объектов, к которым относятся насекомые и их части, многие паразиты, клетки растений и животных, простейшие и бактерии. Возможность изучения топографии, морфологии, ультраструктуры позволило человеку значительно расширить свои знания о микроорганизмах. В медицине, микроскопы позволяют проводить подсчёт клеток крови, анализ биопсий на структуру, морфологию и наличие определённых включений. С применением молекулярно-биологических техник, появилась возможность выявить локализацию отдельных химических веществ.
Сущность оптических методов
Современная световая микроскопия обеспечивает увеличение до 2-3 тысяч раз, что является достаточным для изучения различных форм жизни на клеточном уровне и других биологических объектов [1, 2]. Основными характеристиками любого микроскопа являются разрешающая способность и контраст. Разрешающая способность - минимальное расстояние, на котором находятся две точки, различаемые как раздельные объекты. Контраст –возможность различать объекты и отдельные детали от их фона. Если различие в яркости объекта и фона составляет менее 3 - 4 %, то его невозможно различить, даже если оптика микроскопа теоретически способна разрешить его детали. На контраст влияют как свойства объекта, которые изменяют световой поток по сравнению с фоном, так и способности оптики прибора уловить возникающие различия в свойствах луча. Главным ограничением для возможностей светового микроскопа является волновая природа света, которое не позволяет увидеть объекты, размеры которых сопоставимы с волновой длиной электромагнитного излучения светового диапазона, т.е. меньше 1 микрометра.
Для различных нужд создаются оптические системы различной конструкции [3, 4]:
Прямой микроскоп является наиболее часто встречаемой конструкцией. Такая схема используется чаще всего при изучение прозрачных и полупрозрачных микрообъектов размеров, сопоставимых с клетками. Лабораторные микроскопы особенно широко применяются в различных областях биологии (ботанике, микробиологии, цитологии) и медицины (обычно это микробиологический и гистологический анализ материала).
Инвертированная схема микроскопа отличается от прямой тем, что в ней объективы находятся не над, а под исследуемым предметом. Это позволяет оптимизировать конструкцию инструмента для работы с достаточно большими по своему объему объектами, вроде флаконов для культивирования клеток. В зависимости от назначения и особенностей конструкции, инвертированные микроскопы могут быть биологическими, люминесцентными, металлографическими и др. Подобные приборы широко используются при различных научных и лабораторных исследованиях в микробиологии и медицине.
Стереоскопические или стереомикроскопы имеют в своей конструкции два расположенных под углом объектива, и благодаря этому позволяют получать стереоскопическое изображение исследуемого объекта. Стереомикроскопы обладают существенно большей глубиной резкости, чем обычные, что позволяет использовать их для изучения относительно крупных и выпуклых микрообъектов – таких как части растений, грибов, колонии микроорганизмов. Выделяют два типа конструкции световых микроскопов: схема Грену и оптическая система с общим главным объективом.
Светлопольная микроскопия позволяет исследовать объекты в проходящем свете в светлом поле [2,5]. Данный вид микроскопии предназначен для исследования морфологии, размеров клеток, их взаимного расположения, структурной организации клеток и других особенностей. У светового микроскопа максимальная разрешающая способность составляет 0,2 мкм, что обеспечивает высокоточное увеличение микроскопа до 1500х.
Фазово-контрастная микроскопия (рисунок 1) используется для получения высококонтрастных изображений прозрачных образцов, таких как живые клетки, микроорганизмы, тонкие кусочки ткани, литографические узоры, волокна, латексные дисперсии, осколки стекла и субклеточные частицы, включая ядра и другие органеллы. Метод контраста участка использует оптический механизм для того, чтобы перевести мельчайшие изменения в участке в соответствующие изменения в амплитуде, которые можно визуализировать как разницы в контрасте изображения. Одно из главных преимуществ микроскопии контраста участка в том, что живущие клетки можно рассмотреть в их естественном положении, без предварительного убийства. В результате динамика протекающих биологических процессов может наблюдаться и регистрироваться в высоком контрасте, с высокой четкостью мельчайших деталей образца.
Рисунок 1. Интернет: Stormoff , stormoff . ru , 2018
Рисунок 2. Интернет: Studopedia , studopedia . ru , 2018
Лазерная конфокальная микроскопия
Рисунок 3. Интернет: 5 fan , 5 fan . ru , 2018
Мультифотонная микроскопия схожа с конфокальной и обеспечивает четкие преимущества для трехмерной визуализации [6]. Она хорошо подходит для визуализации живых клеток, особенно в интактных тканях, таких как срезы мозга, эмбрионы, а так же целые органы или небольшие организмы. Эффективная чувствительность флуоресцентной микроскопии, особенно при работе с толстыми образцами, как правило, ограничена вспышкой без фокуса. Это ограничение значительно сокращается в конфокальном микроскопе, с помощью конфокального отверстия для отклонения фоновой флуоресценции фокуса и получения несжатых оптических секций менее 1 микрометра. Мультифотонная микроскопия имеет преимущества: 1. Вследствие значительно меньшего поглощения тканей и клеток в ИК - области по сравнению с УФ, уменьшается повреждение живых клеток фотоиндуцированными процессами. 2. Достигается большая глубина проникновения излучения в биологические объекты. 3. Отсутствует возбуждение и выцветание флуорохромов вне фокального микрообъема, поэтому конфокальная диафрагма не требуется.
Эпоха, когда оптическая микроскопия была чисто описательным инструментом прошла. В настоящее время формирование оптического изображения является лишь первым шагом к анализу данных. Микроскоп выполняет этот первый шаг в сочетании с электронными детекторами, процессорами изображений и устройствами отображения, которые можно рассматривать как расширения системы формирования изображения. Компьютеризированное управление фокусом, сценическим положением, оптическими компонентами, ставнями, фильтрами и детекторами широко распространено и позволяет проводить экспериментальные манипуляции, которые невозможны для человека при использовании механических микроскопов. Возрастающее применение электрооптики в флуоресцентной микроскопии привело к созданию оптических пинцетов, способных манипулировать субклеточными структурами или частицами, изображениями отдельных молекул и широким спектром сложных спектроскопических приложений.
Потатуркина-Нестерова Н. И. и др. Современные методы микроскопии в изучении биологических объектов //Современные проблемы науки и образования. – 2012. – №. 6.
Spasov A.A., Bugaeva L.I., Bukatin M.V., Kuzubova E.A., Rebrova D.N. The influence of a new antioxidatic preparation on the reproductive function of male-rats // European Journal of Natural History. 2007. № 1. С . 115-116.
Stevens A. et al. Compressive Sensing in Microscopy: a Tutorial //Microscopy and Microanalysis. – 2016. – Т . 22. – №. S3.
Л.В Снегирева, Оптические методы исследования в биологии и медицине/ Международный журнал экспериментального образования
//Пенза, "Академия Естествознания", 2017
Феофанов А.В. Cпектральная лазерная сканирующая конфокальная микроскопия в биологических исследованиях //Успехи биол. Химии.-2007.-№ 47.
Надеждин С.В. Теоретические основы современных методов микроскопии: Надеждин С.В., Федорова М.З., Буржинская; БелГУ, 2008.
Читайте также:

