Методы оценки качества питательных сред реферат
Обновлено: 05.07.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Питательная среда – это однокомпонентный или многокомпонентный субстрат, который применяют для культивирования микроорганизмов. Питательные среды являются не заменяемой составляющей для работы микробиологов.
Актуальность темы заключается в том, что не одно исследование в микробиологии не проходит без питательных сред. Все живые существа контактируют с микробами, являясь не только их распространителями, но и носителями. Самые первые среды были сконструированы и применены Пастером и Кохом. Особая роль в этом открытие принадлежит Роберту Коху. Постулировав необходимость выделения чистой культуры микроба, он определил необходимые условия решения этой задачи.
Важнейшим из них явился состав питательной среды, на которой можно было бы получить рост микроорганизмов. Внедрение в микробиологическую практику в 1881 г. плотных питательных сред позволило осуществить в контролируемых условиях рост колоний. Был предложен желатин как компонент твердой среды. Впоследствии стали использовать агар-агар[1].
В 19 – 20 веке разработки Роберта Коха по питательным средам интенсивное развитие. В 20 веке большое развитие получило конструирование питательных сред это развитие связано с развитий микробиологических технологий. Чтобы получить жизнеспособный посев микроорганизмов нужно правильно подобрать питательную среду.
Питательная среда нужна для жизнедеятельности и накопления, выделения и сохранения микроорганизмов и синтеза целевого продукта. Питательная среда должна состоять из макроэлементов и микроэлементов, которые должны входить в среду в легкоусвояемом для микроорганизмов виде.
Цель данной работы изучить питательные среды, их классификацию, и требования к ним.
Данная цель определила для изучения следующие задачи:
1. Изучить искусственные питательные среды;
2. Рассмотреть классификацию питательных сред, и способы их получения;
3. Изучить требования, предъявляемые к питательным средам.
Искусственные(синтетические)питательные среды - имеют определенный химический состав и точное количественное содержание питательных веществ. Они используются для изучения метаболизма, бактерий, исследования физиологии и биохимии микроорганизмов. К синтетическим среды могут служить среды Козера и Симмонса, используемые для изучения способности бактерий утилизировать цитраты. В состав этих сред, наряду с другими солями, входят цитрат натрия и индикатор.
Предназначена для приготовления жидких и плотных питательных сред, которые используются при проведении микробиологических исследований.
Среда Симмонса-питательная среда для распознавания энтеробактерий, сухая представляет собой некий мелкодисперсный гомогенный, гигроскопичный, светочувствительный порошок, который светло-бежевого цвета [5].
Состав (в пересчете на 1 л готовой среды):
•Аммоний фосфорнокислый - 2,0 г.
•Калия фосфат однозамещенный - 0,7 г.
•Магний сернокислый 7-водный - 0,8 г.
•Натрий лимоннокислый трехзамещенный 5,5-водный пищевой - 3,0 г.
•Агар микробиологический - 11,5 г.
•Бромтимоловый синий водорастворимый, индикатор - 0,04 г.

Рисунок 1. Среда Симмонса
Среда Козера(рис.2).
Предназначена для идентификации энтеробактерий по признаку утилизации цитрата натрия при санитарном обследовании пищевых продуктов и объектов внешней среды.
Представляет собой мелкодисперсный гигроскопичный порошок желтого цвета. Фасовка в пластиковые банки по 100 г.

И так, искусственные среды готовят по определенным рецептам из всевозможных настоев или отваров животного, а также растительного происхождения с добавлением неорганических солей, углеводов и азотистых веществ [4].
Например, в бактериологической практике в большинстве случаев применяют сухие питательные среды, которые чаще всего получают на основе достижений современной биотехнологии. Для их приготовления применяют экономически выгодное непищевое сырье: утратившие срок годности кровезаменители (гидролизин-кислотный гидролизат крови животных, аминопептид-ферментативный гидролизат крови; продукты биотехнологии (кормовые дрожжи, кормовой лизин, виноградная мука, белколизин). Сухие питательные среды имеют длительный срок годности, а так же удобны при транспортировке и могут иметь относительно стандартный состав.
Питательные среды имеют следующую классификацию:
1)по консистенции питательные среды бывают:
Плотные среды делают путем добавления к жидкой среде 1,5-2% агара, полужидкие - 0,3-0,7 % агара. Агар, как вам известно, представляет собой продукт переработки особого вида морских водорослей, он плавится при температуре 80-86 °С, затвердевает при температуре около 40 °С и в застывшем состоянии делает среду плотной. В тех или иных случаях для получения плотных питательных сред используют желатин (10-15%). Ряд естественных питательных сред (свернутая сыворотка крови, свернутый яичный белок) сами по себе являются плотными.
Следующим будет целевое назначение среды, и классифицируют их на:
К основным можно отнести среды, применяемые для выращивания многих бактерий. Это триптические гидролизаты мясных, рыбных продуктов, крови животных или казеина, из которых готовят жидкую среду - питательный бульон, а также плотную среду - питательный агар.
Такие среды являются основой для приготовления сложных питательных сред - сахарных, кровяных и др., удовлетворяющих пищевые потребности патогенных бактерий.
Элективные питательные среды нужны для выборочного выделения и накопления микроорганизмов определенного вида из материалов, которые содержат всевозможную постороннюю микрофлору. При создании элективных питательных сред исходят из биологических особенностей, которые отличают данные микроорганизмы от большинства других. К примеру, избирательный рост стафилококков может наблюдаться при повышенной концентрации хлорида натрия, холерного вибриона -- в щелочной среде.
Дифференциально-диагностические питательные среды обычно применяются для разграничения отдельных видов (или групп) микроорганизмов. Принцип построения этих сред основан на том, что разные виды бактерий имеют различие между собой по биохимической активности в результате разного набора ферментов.
Ну и наконец, особую группу составляют синтетические и полусинтетические питательные среды. В состав синтетических сред входят, как правило, химически чистые вещества, а именно: аминокислоты, минеральные соли, углеводы, витамины. В полусинтетические среды дополнительно включают пептон, дрожжевой экстракт и другие питательные вещества. Эти среды обычно применяют в научно-исследовательской работе и в микробиологической промышленности при получении антибиотиков, вакцин и других препаратов. В последние годы в целях экономии питательных сред и ускоренном распознавании некоторых микроорганизмов (энтеробактерии, стафилококки, стрептококки и др.) применяются так называемые микротест-системы (МТС). Они состоят из полистироловых пластин с лунками, в которых содержатся стерильные дифференциально-диагностические среды. Стерилизацию осуществляют обычно УФ-облучением.
К питательным средам предъявляют следующие основные требования:
1) питательными, они содержать в просто усвояемом виде все вещества, нужные для удовлетворения потребностей таких как пищевых и энергетических. Ими являются источники органогенов и минеральных (неорганических) веществ, в том числе микроэлементы. Минеральные вещества не только входят в структуру клетки и активизируют ферменты, но и определяют физико-химические свойства сред (осмотическое давление, рН и др.). При культивировании ряда микроорганизмов в среды вносят факторы роста - витамины, некоторые аминокислоты, которые клетка не может синтезировать;
Микроорганизмы, как все живые существа, нуждаются в большом количестве воды [3].
2) иметь лучшую сосредоточение водородных ионов - рН так, как при хорошей реакции среды, которая влияет на проницаемость оболочки, мельчайшие организмы могут усваивать питательные вещества. Для большинства патогенных бактерий оптимальна слабощелочная среда (рН 7,2-7,4). Исключение будет холерный вибрион - его оптимум находится в щелочной зоне (рН 8,5-9,0) и возбудитель туберкулеза, нуждающийся в слабокислой реакции (рН 6,2-6,8).
Чтобы во время роста микроорганизмов кислые или щелочные продукты их жизнедеятельности не изменили рН, среды должны обладать буферностью, т. е. содержать вещества, нейтрализующие продукты; обмена;
3) быть изотоничными для микробной клетки; т. е. осмотическое давление в среде должно быть аналогичным, как внутри клеточки. Для большей части микробов наилучшая среда, которая соответствует пол процента раствора натрия хлорида;
4) быть стерильными, в связи с тем, что посторонние бактерии препятствуют росту изучаемого микроорганизма, определению его параметров и изменяют характеристики среды (состав, рН и др.);
5) плотные среды должны быть влажными и иметь оптимальную для микроорганизмов консистенцию;
6) обладать определенным окислительно-восстановительным потенциалом, т. е. соотношением веществ, отдающих и принимающих электроны, выражаемым индексом RH2. Этот потенциал показывает насыщение среды кислородом. Для одних микроорганизмов нужен высокий потенциал, для других - низкий. Например, анаэробы размножаются при RH2 не выше 5, а аэробы - при RH2 не ниже 10. Окислительно-восстановительный потенциал большинства сред удовлетворяет требованиям к нему аэробов и факультативных анаэробов [4];
Лучше, чтоб среды были прозрачными - удобнее смотреть за ростом культур, легче чтобы не было загрязнение среды сторонними микробами.
Заключение
И так, в заключение хотелось бы отметить, для выделения и культивирования микроорганизмов могут применяться разные питательные среды, состоящие из различного сырья.
Подбор и оптимизация питательных сред является одной из важнейших задач при культивировании микроорганизмов. При подборе сред необходимо учитывать не только компоненты, необходимые для роста биомассы, но также включать соединения, необходимые для роста микроорганизмов.
Микробиологию представить без питательных сред представить невозможно. Так как современные требования к микробиологии диктуют свои правила, и без питательных сред существовать сама наука не может. Что существенно помогает определяет информативность, и точность микробиологического анализа.
Также существует классификация питательных сред по их назначению. Вследствие этого среды делятся на общего назначения (универсальные) и специального. Общего назначения питательные среды используются для культивирования многих видов бактерий. К ним можно отнести, мясопептонный бульон, мясопептонный агар.
Специальные питательные среды используют для некоторых видов микроорганизмов, с целью изучения их свойств, хранения и определения видовой принадлежности. Питательные среды имеют разнообразный состав. Широко известным является среда агар-агар. Она состоит из самого агара – агара, представляющего собой полисахарид, выделяемый из морских водорослей. Особенностью агар-агара является образование в воде геля, который расплавляется при температуре 80-100 0С.
И твердеющую при температуре 37-400С. Бактерии не расщепляют агар ввиду отсутствия у них фермента целлюлозы. Устойчивость его к разжижающемуся действию большинства микроорганизмов, и также способность образовывать студни что поспобствовала широкому её распространению в науке бактериологии. Наличие в составе крови и сыворотки, обеспечивает абсорбирование продуктов метаболизма. Присутствие соли, буферной смеси обеспечивает нормальное развитие микроорганизмов. Восстанавливающие вещества применяют чтобы снизить окислительное - восстановительный потенциал. Углеводы, многоатомные спирты, индикаторы, красители и ингибиторы применяют для питания микроорганизмов, для выявления патогенных форм и окрашивания [5].
Подводя итог всего вышеизложенного, можно прийти к следующим выводам, что питательная среда должна отвечать следующим требованиям: содержать в себе все необходимые для размножения бактерий вещества в легкоусвояемой форме; иметь оптимальные влажность, вязкость, рН, быть изотоничной и по возможности прозрачной. Каждая питательная среда проходит стерилизацию определенным способом в зависимости от ее состава.
1. Воробьев А. А. Медицинская и санитарная микробиология / А. А. Воробьев, Ю. С. Кривошеин, В.П. Широбоков. - М.: Академия, 2017. - 17 c
2. Емцев В.Т. Микробиология / В В.Т..Т. Емцев, Е.Н. Мишустин. - М.: Дрофа, 2016. - 176 c.
3. Меджидов, М.М. Справочник по микробиологическим питательным средам. - М.: Медицина, 2003.- С.15-19
4. Поляк, М.С. Питательные среды для медицинской и санитарной микробиологии//Поляк М.С. В.И. Сухаревич, М.Э. Сухаревич. СПБ.:элби – СПБ.- 2008. С.19-23
5. Шепелин А.П., Дятлов И.А. Питательные среды для энтеробактерий М.; Издательство "Династия", 2017, - 232 ст.
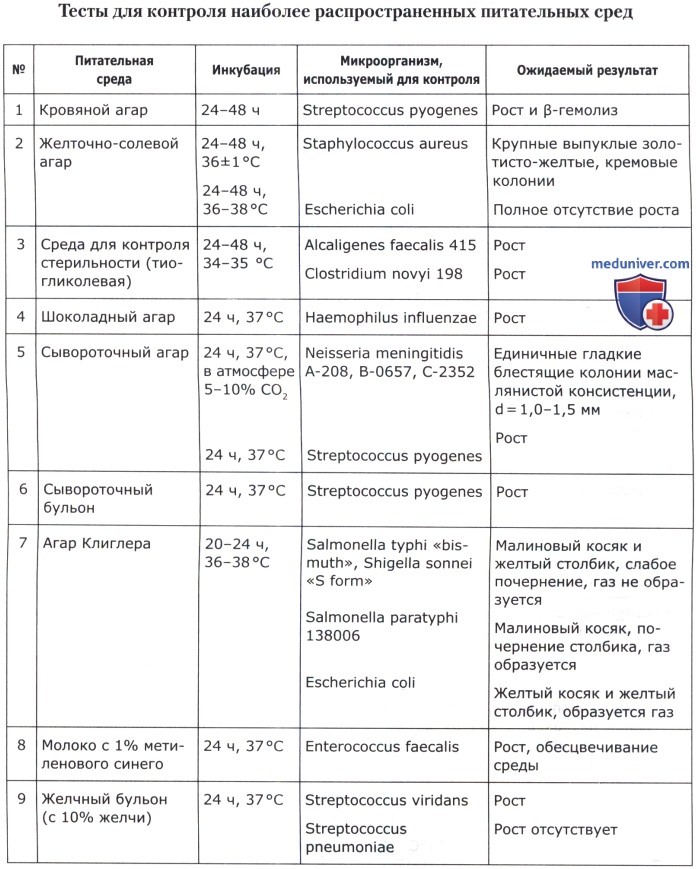
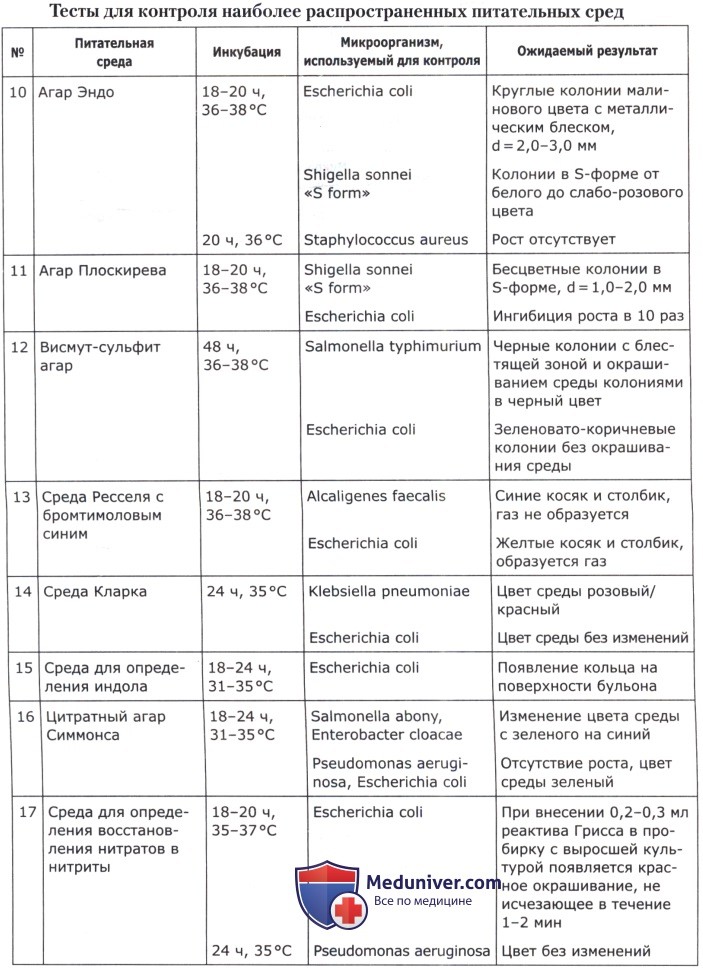
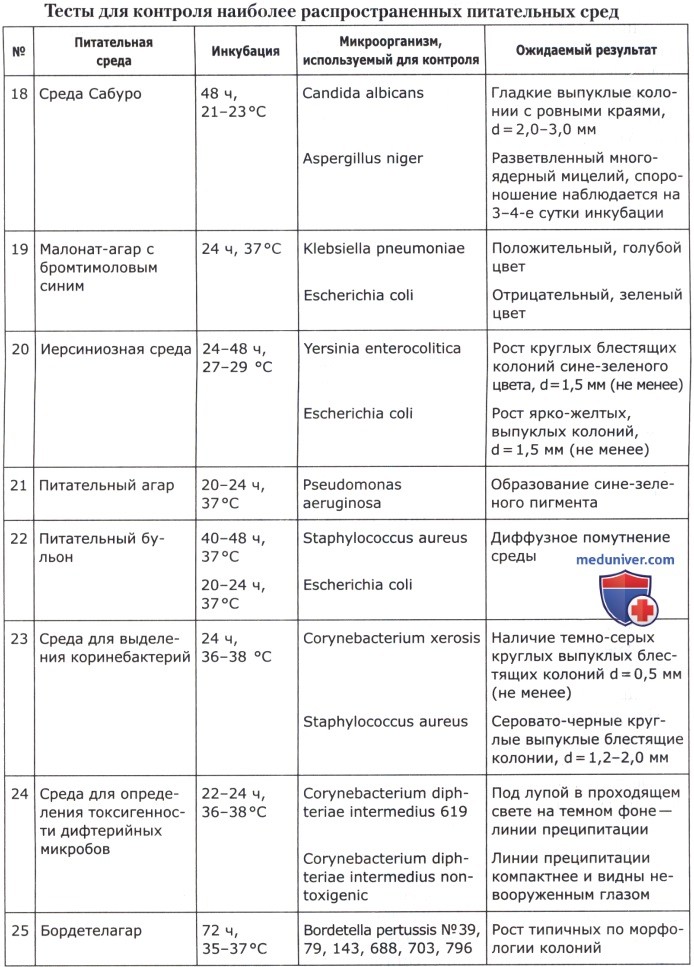
Оценка качества питательных сред и их компонентов проводится по следующим показателям, выбираемым в соответствии с назначением среды.
1. Чувствительность. Определяется по максимальному разведению культуры, при котором на всех засеянных чашках (в пробирках) обнаруживается рост. Результат указывается по соответствующему разведению (10 -1 —10 -9 ) для всех групп питательных сред.
2. Эффективность. Определяется по выходу микробных тел с 1 мл питательной среды в млрд/мл (для накопительных сред и стимуляторов роста).
3. Показатель стабильности основных свойств микроорганизмов. Определяется по отношению числа атипичных по морфологии, биохимическим, серологическим, фаголизабельным и другим свойствам колоний к общему числу колоний на чашках с испытуемой средой в % (для всех сред, кроме предназначенных для контроля качества препаратов).
4. Дифференцирующие свойства. Определяются по выраженности отличительных признаков патогенных микроорганизмов от непатогенных видов и естественных ассоциантов на основании структурных особенностей колоний, их окраски, изменения цвета и других признаков (для дифференциальных сред и сред для идентификации).
5. Скорость роста. Определяется по минимальному времени инкубации после посева культур, достаточному для их выявления, и выражается в часах (для всех групп питательных сред).
6. Показатель ингибиции. Определяется по степени подавляющего воздействия на постороннюю микрофлору. Выражается либо кратностью того минимального разведения, при котором полностью отсутствует рост посторонней микрофлоры, либо величиной отношения числа сформировавшихся клеток тест-штамма к расчетному количеству посеянных при соответствующем разведении клеток (для всех сред, кроме предназначенных для выращивания и для контроля качества препаратов).
7. Показатель прорастания микробных клеток. Данный показатель определяют для плотных питательных сред. Подготовку тест-штаммов для контроля, их посев в среду осуществляют по аналогии с методикой определения показателей чувствительности и скорости роста. Посев осуществляют параллельно на испытуемую и контрольную среду, как правило, из двух разведений, обеспечивающих формирование на чашке Петри не менее 25 и не более 150 колоний. В случае забора клинического материала при помощи тампонов посев на среды осуществляют с соблюдением равнозначности посева материалов на испытуемую и контрольные среды.
В качестве контрольной может быть использована среда, на которой формируется максимальное число колоний из числа засеянных. Показатель прорастания микробных клеток определяют отношением среднего числа колоний, образовавшихся на испытуемой среде, к среднему числу колоний на контрольной среде в процентах.
а) Тест-штаммы культур. Порядок хранения и подготовка для контроля. Набор тест-штаммов для оценки соответствующей питательной среды авторы определяют в процессе экспериментальной работы и рекомендуют их для контроля питательной среды.
Необходимым условием качества среды является сохранение тест-культурами своих тинкториальных, морфологических, культуральных и физиолого-биохимических свойств.
Рекомендуемые для контроля свежевыделенные штаммы с момента выделения и получения их в виде чистых культур не должны проходить более 3-5 последовательных пересевов на питательных средах с последующим (обязательным) лиофильным высушиванием в большом количестве ампул.
Для проведения внутрилабораторного контроля качества бактериологическая лаборатория должна иметь коллекцию типовых культур. Эталонные штаммы культур разрешается получать в специализированных коллекциях, функционирующих в системе М3 РФ:
— Государственная коллекция патогенных микроорганизмов Государственного института стандартизации и контроля (ГИСК) им. Л. А. Тарасевича;
— Всероссийская коллекция промышленных микроорганизмов (ВКПМ);
— Всесоюзная коллекция непатогенных микроорганизмов (ИБФМ).
Из международных коллекций:
— Американская коллекция типовых культур (АТСС);
— Английская национальная коллекция типовых культур (ЛСТС);
— другие коллекции.
Из организаций, получивших статус референтных лабораторий.
От коммерческих производителей.
Изоляты микроорганизмов, выделенные из клинического материала и используемые для контроля, должны по свойствам соответствовать микроорганизмам признанных национальных и международных коллекций. Чаще для контроля используют штаммы в лиофилизированном виде.
Лиофилизированные музейные и свежевыделенные культуры хранят при температуре 4-6 °С. Восстановление культур из лиофилизированного состояния проводят с использованием жидкой и плотной питательных сред, принятых для определенной группы микроорганизмов.
Далее изучают культурально-морфологические и биохимические свойства и определяют стабильность биологических свойств.
Из 4 последних разведений (10 -5 , 10 -6 , 10 -7 , 10 -8 ) по 0,1 мл взвеси из каждого вносят в 3 хорошо подсушенные чашки (пробирки) с плотной средой или в 3 пробирки с 10 мл жидкой (полужидкой) питательной среды.
При пересеве в жидкие (полужидкие) питательные среды обогащения посевы производят из разведений (10 -4 , 10 -5 , 10 -6 , 10 -7 ) по 1,0 мл взвеси в каждую пробирку с 9 мл среды.
При посевах на чашки и пробирки с плотной средой взвесь культуры распределяют на поверхности среды, используя для каждой чашки новый шпатель, а на пробирках со скошенным агаром взвесь культуры распределяют путем обкатывания. Метод обкатки можно использовать и для чашек. Посевы помещают в соответствующие условия выращивания.
После инкубации производят учет результатов. Чувствительность среды определяют по наибольшему разведению, обеспечивающему формирование колоний или визуально видимый рост на всех засеянных чашках (пробирках) с питательной средой.
При определении показателя чувствительности в жидких средах обогащения в случае отсутствия визуально обнаруживаемого роста после соответствующей инкубации посевов из каждой пробирки производят высев на чашки с питательным агаром, разделенном на 4-8 секторов, на каждый из которых засевают по одной петле культуры из каждой пробирки с жидкой средой.
Учет результатов скорости роста культуры в каждом взятом в опыт разведении микробной взвеси производят для плотных сред через 12-24-48 ч инкубации, для жидких (обогащения) — через 3-6 ч и далее. Показатель скорости роста определяют по минимальному времени инкубации посевов, за которое при соответствующем разведении обеспечен отчетливый видимый невооруженным глазом рост культуры (помутнение, наличие пленки, осадка, роста по уклону и др.) во всех засеянных пробирках с жидкими (полужидкими) питательными средами или формирование типичных легко дифференцируемых колоний на чашках (пробирках) с плотной средой.
в) Определение стабильности биологических свойств культур. Определение этого показателя проводят на чашках, где выросло не менее 25 и не более 100-150 колоний. Изучают свойства культур, выращенных на питательных средах, по культурально-морфологическим, биохимическим, серологическим, фаголизабельным и другим признакам. При этом оцениваются:
1. Характер роста культур (равномерное помутнение среды, формирование пленки на поверхности среды, придонно-пристеночный рост, рост в виде осадка и др. — в жидких средах; равномерное зональное помутнение среды, рост по уколу, сталактитовый рост, в виде елочки и др. — в полужидких средах; форма, структура, характер роста колоний, диаметр — на плотных средах).
2. Морфология микроорганизмов — форма (кокки, палочки, отсутствие полиморфизма в размерах, окраске и др.), расположение (одиночное, парное, гроздевидное, цепочки и др.), строение (наличие капсулы, жгутиков, спор, включений и др.), подвижность.
3. Серологические признаки, которые изучают в реакции агглютинации на стекле с агглютинирующими сыворотками, с антительными диагностикумами или с люминесцирующими сыворотками. Проверяют физико-химическое состояние клеток — стабильность взвеси микробов (отсутствие спонтанной агглютинации) в растворе трипофлавина, в 0,85% и 4% NaCl.
4. Биохимические свойства (ферментация углеводов, образование H2S, индола и др.), пигментообразование.
6. Биологические свойства (гемолиз) и др.
Бактериальный стандарт мутности и работа с ним. При некоторых микробиологических исследованиях возникает необходимость посева определенного количества микробных тел в жидкую или плотную среду. В таких случаях из микробной культуры, предназначенной для посева, в соответствии с бактериальным стандартом мутности готовят взвесь, содержащую в единице объема (1 мл) заданное количество микробных тел.
Для ОСО 5 ед. концентрация соответственно в 2 раза меньше, чем для ОСО 10 ед. мутности. В комплект с эталоном входит: таблица сравнения, содержащая набор полос различной толщины, и 2 пустые пробирки, диаметр, толщина стенок и цвет стекла которых точно соответствует пробирке-эталону, так как при сравнении микробной взвеси одной концентрации, содержащейся в пробирках различного диаметра, мутность жидкости будет неодинаковой.
Сравнение степени мутности в опытной и эталонной пробирках производят визуально. Для этого необходимо совместить пробирки с ОСО и исследуемую в вертикальном положении, разместить их на уровне глаз и, плотно приложив к их задним стенкам сравнительную таблицу, осветить их источником света таким образом, чтобы пробирки не экранировали друг друга от света. Если видимые элементы сравнительной таблицы видны через ОСО и пробирку с исследуемой взвесью с одинаковой четкостью, мутность их считают одинаковой и равной мутности, указанной на этикетке ОСО. Если мутность в пробирке с исследуемой взвесью не соответствует мутности ОСО, то необходимо изменить концентрацию взвеси таким образом, чтобы ее мутность совпала с мутностью ОСО. Срок годности ОСО — 12 мес., после чего он вновь должен быть переаттестован в ГИСК им. Л. А. Тарасевича.
Стандарт мутности по Мак-Фарланду служит для аналогичных целей. В качестве эталона бактериальной взвеси в оригинальных стандартах используется суспензия Ba2SO4, а в эквивалентах — латексные частицы. Стандарты Мак-Фарланда 0,5; 1,0; 2,0; 3,0; 4,0; 5,0 ед. содержат суспензию, соответствующую 1,5х10 8 , 3,0х10 8 , 6,0х10 8 , 9,0х10 8 , 12,0х10 8 , 15х10 8 КОЕ/мл.
Оригинальные стандарты мутности по Мак-Фарланду имеют непродолжительные (до 1/2 года) сроки годности, а эквиваленты долговечны и стабильны.
Безусловным критерием качества приготавливаемых сред является работа на валидированном оборудовании при одновременной закладке как современных химических тестов для контроля стерилизации, так и стандартных буферов для рН-метрии.
Микробы, как любые другие живые организмы свое развитие и рост, обновление строительного материала, обеспечение энергетических процессов осуществляют за счёт постоянного обмена веществ с окружающей его внешней средой, т.е. путём питания и дыхания. В зависимости от типа питания микробы подразделяют на аутотрофы (способные усваивать углерод из СО2 , а также молекулярный азот из воздуха, а минеральные вещества путём хемо- или фотосинтеза) и гетеротрофы (способны усваивать углерод и другие вещества только из готовых органических соединений). К аутотрофам относятся в основном многие почвенные бактерии, к гетеротрофам (параторофам) – микробы инфекционных болезней животных и растений.
Типы питания, дыхания (аэробы и анаэробы), индукцию и активность ферментов, токсинов, пигментов, рост и размножение являются основными физиологическими параметрами, которые учитывают при разработке составов питательных сред и условий культивирования микробов invitro.
2. Культивирование микроорганизмов .
Культивировать микроорганизмы – это значит искусственно создавать условия для их роста и размножения invitro, взаимосвязанных, но не обязательно сопряжённых процесса. Рост и размножение –циклический 4-х фазный процесс (латентная, логарифмического роста, стационарная, гибель). Период между образованием новых клеток и их делением называется периодом генерации, на длительность которого, кроме особенностей микроба, влияет состав питательной среды. Формы колоний разных микробов на питательной среде одного и того же состава отличаются, что учитывают при их дифференциации.
Для культивирования invitro необходимы субстраты, которые микроорганизмы могут использовать в качестве питательных веществ для своего роста и размножения. Такие питательные субстраты – плотные или жидкие – называют культуральными или питательным средами. В большинстве случаев в микробиологических лабораториях микроорганизмы культивируют invitro, т.е. в стеклянных колбах, пробирках и других сосудах.
К любой питательной среде предъявляют ряд основных требований:
1). Стерильность и по возможности прозрачность.
2). При составлении питательных сред учитывают потребность микроорганизмов в элементах питания (необходимые для жизнедеятельности клеток биохимические факторы – источники энергии, С, N, S, а также неорганические ионы – доступные для усвоения микроорганизмами).
3). Оптимальные значения ряда биофизических показателей: концентрации водородных ионов (pH), окислительно-восстановительного потенциала (Eh), активности воды (aw ), осмотического давления.
3. Классификация питательных сред и способы их получения.
В зависимости от видовой принадлежности микробов и целей культивирования консистенция и составы культуральных сред бывают разными и варьируют в широких пределах. Среда, отвечающая биологическим особенностям микроба и обеспечивающая его рост и размножение, называется полноценной, не имеющая какого- либо компонента, необходимого для его жизнедеятельности – дефицитной .
Питательные среды классифицируют в зависимости от:
- химического состава и исходных компонентов;
В зависимости от химического состава и исходных компонентов различают следующие типы питательных сред:
- среды неопределенного химического состава (естественные или натуральные среды) – это среды, которые состоят из продуктов животного или растительного происхождения, имеющие сложный неопределенный химических состав:
1) среды животного происхождения (исходные продукты – мясо, рыба, яйца, молоко и т.д.)
2) среды растительного происхождения (исходные продукты – соя, горох, картофель, морковь и т.д.)
* Данная работа не является научным трудом, не является выпускной квалификационной работой и представляет собой результат обработки, структурирования и форматирования собранной информации, предназначенной для использования в качестве источника материала при самостоятельной подготовки учебных работ.
Классификация питательных сред.
Состав питательных сред.
Агар-агар — растительный коллоид, получаемый из некоторых морских водорослей. В его состав входят главным образом полисахариды с ничтожным содержанием азотистых веществ. Желатина — кислый азотсодержащий продукт, добываемый путем выварки костей и хрящей. В качестве плотных питательных сред широко применяют также гелевые пластины, введенные в микробиологическую практику С. Н. Виноградским. Для выращивания микроорганизмов, использующих органические формы азота, часто употребляют мясопептонные среды: мясопептонный бульон, мясопептонный агар и мясопептонную желатину. Мясопептонный бульон (МПБ). Для приготовления мясо-пептонных сред используют мясной бульон, который получают так: 500 г мелко изрубленного свежего мяса без костей, жира и сухожилии заливают в эмалированной кастрюле 1 л водопроводной воды, нагретой до 50°С, и оставляют настаиваться 12 ч при комнатной температуре или 1 ч при 50—55°С. Мясо отжимают, экстракт процеживают через марлю со слоем ваты, кипятят в течение 30 мин для свертывания коллоидных белков и фильтруют дважды (первый раз через марлю с ватой, второй — через бумажный фильтр). Фильтр доливают водой до 1 л, разливают в колбы, закрываю! ватными пробками и стерилизуют при 120°С 20 мин (пробки колб закрывают сверху колпачками из бума ги). Ватные пробки должны быть плотными, так как они являются фильтром, препятствующим проникновению бактерий из воздуха после стерилизации. Мясной бульон может быть использован в любое время для приготовления соответствующих сред. Если их готовят сразу, то предварительная стерилизация излишня. Нередко в лабораторных условиях мясной настой кипятят вместе с мясом, а затем мясо отжимают. Бульон получается хорошего качества. Если желательно иметь мясной бульон особо высокой питательности, во время настаивания мяса с водой добавляют немного пепсина и подкисляют бульон соляной кислотой. Пепсин дополнительно гидролизует белковые соединения мяса, и количество усвояемых бактериями питательных веществ возрастает. Мясо можно заменить мясным экстрактом, беря его по 5 г на 1 л среды. Для приготовления мясопептонного бульона к 1 л мясного бульона добавляют 5—10 г пептона (пептон — первый продукт гидролиза белка с высокой молекулярной массой) для повышения калорийности среды и 5 г поваренной соли с целью создания осмотической активности. Среду нагревают до растворения пептона, постоянно помешивая. Затем устанавливают нейтральную или слабощелочную реакцию среды, приливая 20%-ный раствор NagCOa (до посинения влажной красной лакмусовой бумажки; при этом фенолфталеин еще не показывает щелочную реакцию — при добавлении его к среде в фарфоровой чашке розовая окраска не выявляется). Удобно использовать индикатор бромтимолблау. 1—2 капли его вносят стеклянной палочкой в фарфоровую чашку и добавляют каплю бульона. В нейтральной среде бромтимолблау бутылочно-зеленый, в кислой — желтый, в щелочной — синий. После установления реакции среду снова кипятят 5—10 мин и белки, свернувшиеся от изменения реакции, отфильтровывают через бумажный фильтр без осветления бульона или осветлив его белком. Прозрачный Мясо-пептонный бульон разливают в пробирки, закрывают ватными пробками и стерилизуют при 120°С в течение 20 мин. Мясо-пептонный агар (МПА). К 1 л мясо-пептонного бульона добавляют 15—20 г мелко нарезанного агар-агара. Среду нагревают до растворения агара (температура плавления его 100°С, застывания —40°С),устанавливают слабощелочную реакцию среды 20%-ным раствором Na2COa и через воронки разливают в пробирки (но 10 мл для разливок в чашки — агар столбиком и по 5 мл для получения скошенного, наклонного агара). При разливе агара необходимо следить затем, чтобы края пробирки были сухими, иначе пробки прилипают к стеклу. Пробирки со средой стерилизуют в автоклаве при 120°С в течение 20 мин. Мясо-пептонная желатина (МПЖ). В 1 л мясопептонного бульона помешают 100—150 г желатины. Температура плавления зависит от процентного содержания в среде. 10%-ная желатина плавится при 24°С, 15%-пая — при 25°. В летнее время среды готовят, добавляя 15% желатины. После растворения желатины при осторожном нагревании в среде устанавливают слабощелочную реакцию (как и для МПБ и МПА), кипятят в течение 5мин, затем охлаждают -до 40—50°С. Одновременно яичный белок взбивают с небольшим количеством воды, вливают его в охлажденную желатиновую среду, хорошо взбалтывают и снова нагревают. Среда после выпадения белков становится прозрачной. Ее фильтруют через горячую воронку, разливают в пробирки и стерилизуют в кипятильнике Коха текучим паром, прогревая среду по 30 мин через 24 ч 3 раза.
Картофельный агар. 200 г очищенного и промытого водой картофеля нарезают ломтиками, заливают 1 л водопроводной воды, варят 30 мин. Отвар фильтруют через вату и доводят до первоначального объема. К полученной жидкости прибавляют 2% агара, кипятят до его растворения и устанавливают нейтральную реакцию среды (рп 7,0). Среду стерилизуют при 1 атм в течение 20 мин. Пивное сусло. Зерна ячменя замачивают в холодной воде и проращивают при 35°С. После того как ростки будут вдвое больше длины зерна, последнее высушивают до воздушно-сухого состояния (можно при слабом подогревании) и получают солод. Для приготовления сусла солод крупно размалывают и 250 г его берут на 1 л воды. Смесь подогревают при 57°С (для лучшего выделения фермента амилазы) до исчезновения реакции на крахмал (синее окрашивание с йодом). Пробы на осахаривание крахмала проводят в фарфоровой чашке в капле жидкости. Сусло процеживают через вату, затем фильтруют через бумажный фильтр. Такое сусло содержит 10— 20% сахара. Определив его содержание по плотности раствора с помощью сахариметра, сусло разбавляют водой до концентрации сахара 6—8%, стерилизуют при 115°С (давление 0,5 атм) в течение 30 мин. Готовое сусло можно получить на пивоваренном заводе. Сусло-агар. К приготовленному суслу добавляют 2,5—3% агара, кипятят до его расплавления, фильтруют через вату и стерилизуют таким же способом, как пивное. Обезжиренное молоко. Для приготовления питательных сред употребляют снятое молоко, так называемый обрат (жир в молоке неблагоприятно влияет на рост некоторых микроорганизмов). Обрат получают сепарированием молока, нагретого до 34°С. Жир можно удалять и при отстаивании молока. При стерилизации молока следует учитывать, что его нельзя длительное время выдерживать в автоклаве, так как лактоза (молочный сахар), содержащаяся в молоке, может карамелизоваться. Обезжиренное молоко разливают в стерильные пробирки и выдерживают при 115°С (давление 0,5 атм) 15 мин. Перед стерилизацией кислотность обрата не должна превышать 22° Тернера, иначе молоко свернется. После стерилизации его выдерживают трое суток в термостате при 30°С, чтобы спровоцировать развитие спорообразующих и других стойких к нагреванию форм. Через 3 дня каждую пробирку с молоком просматривают и пробирки, в которых развились микроорганизмы, выбраковывают. При стерилизации в автоклаве иногда наблюдается побурение молока вследствие карамелизации молочного сахара и пептонизации казеина. При длительной стерилизации на дно пробирки выпадает осадок казеина, который может частично пептонизироваться. Перегретое побуревшее молоко в качестве среды использовать нельзя. Дрожжевые среды. Дрожжевая вода. 50—100 г сухих дрожжей размешивают в 1 л воды, кипятят 10 мин, фильтруют через бумажный фильтр и стерилизуют текучим паром по полчаса в течение трех дней ежедневно. Дрожжевой автолизат. 200 г прессованных дрожжей разводят в 1 л воды, добавляют 2 г Na2HPO4, 1 н. раствор NaOH (до рН 6,1) и 5 мл хлороформа, выдерживают при 37°С двое суток, доводят до рН 7,4, кипятят 30 мин, фильтруют через бумажный фильтр, разливают в посуду и стерилизуют при 115°С полчаса. Дрожжевой экстракт. 1 кг прессованных дрожжей разводят в 1 л воды, смесь кипятят 1 ч, трижды отфильтровывают через бумажный фильтр и стерилизуют при 115°С 30 мин. Бобовый отвар. 50 г фасоли (лучше белой) заливают 1 л водопроводной воды и варят до готовности так, чтобы бобы не разварились. Полученный отвар фильтруют через вату, добавляют к нему 10 г сахара и доводят до первоначального объема. Устанавливают слабощелочную реакцию среды, разливают в колбы и стерилизуют в автоклаве при давлении пара 1,5 атм в течение 30 мин.
Элективное культивирование.
Читайте также:

