Методы линеаризации кинетической кривой реферат
Обновлено: 04.07.2024
Простейшим методом изучения нелинейных систем является линеаризация. Суть ее состоит в том, что нелинейная система заменяется эквивалентной линейной. Очевидно, линеаризованная модель не может полностью заменить нелинейную систему, но в некоторых отношениях поведение линеаризованной модели может быть почти идентичным поведению нелинейной системы. Таким образом, имеется возможность применить некоторые хорошо разработанные методы анализа линейных систем для изучения линеаризованных моделей.
Оглавление
Файлы: 1 файл
Metody_linearizvatsii_Ver_2.docx
2 МЕТОД ГАРМОНИЧЕСКОГО БАЛАНСА…..……………………………
4 МЕТОД АППРОКСИМИРУЮЩЕГО ПРОГРАММИРОВАНИЯ.………
Простейшим методом изучения нелинейных систем является линеаризация. Суть ее состоит в том, что нелинейная система заменяется эквивалентной линейной. Очевидно, линеаризованная модель не может полностью заменить нелинейную систему, но в некоторых отношениях поведение линеаризованной модели может быть почти идентичным поведению нелинейной системы. Таким образом, имеется возможность применить некоторые хорошо разработанные методы анализа линейных систем для изучения линеаризованных моделей.
1 СУТЬ ЛИНЕАРИЗАЦИИ
Простейший пример линеаризации функции
Замените данную функцию линейной вблизи нуля:
Если , то так же стремятся к нулю, поэтому ими можно пренебречь, то есть отбросить. В результате получаем .
2 МЕТОД ГАРМОНИЧЕСКОГО БАЛАНСА
Метод гармонической линеаризации (по другой терминологии – гармонического баланса) относится к приближенным аналитическим методам исследования нелинейных систем. Этот метод имеет давнюю историю. Он восходит к работам Н.М. Крылова и Н.Н. Боголюбова (1934), Л.С.Гольдфарба (1957), Р.Коченбургера (1950), Е.П.Попова (1960). Метод широко используется в инженерной практике, применяется в теоретических исследованиях и продолжает развиваться.
Приближенный метод исследования нелинейных колебательных систем, описываемых нелинейными обыкновенными дифференциальными уравнениями. Суть метода состоит в замене в колебательных системах нелинейных сил специальным образом построенными линейными функциями, в силу чего он позволяет использовать теорию линейных дифференциальных уравнений для приближенного анализа нелинейных систем.
Следует особо подчеркнуть, что линеаризация допустима, если функция, выражающая нелинейную зависимость, дифференцируема по меньшей мере один раз и (или) касательная к характеристической кривой достаточно хорошо аппроксимирует кривую вблизи рабочей точки.
Линейные функции строятся с помощью специального приема, называемого гармонической линеаризацией. Пусть задана нелинейная функция (сила)
где ԑ - малый параметр. Гармонической линеаризацией называется замена линейной функцией где параметры вычисляются по формулам:
Если то нелинейная сила является периодической функцией времени, и ее разложение в ряд Фурье содержит, бесконечное число гармоник с частотами т. е. оно имеет вид:
Слагаемое называется основной и гармоникой разложения (1). Амплитуда и фаза линейной функции совпадают с аналогичными характеристиками основной гармоники нелинейной силы. Применительно к дифференциальному уравнению
типичному для теории квазилинейных колебаний, метод заключается в замене линейной функцией . Тогда вместо уравнения (2) рассматривается уравнение:
Где Принято называть эквивалентной линейной силой, - эквивалентным коэффициентом затухания, - эквивалентным коэффициентом упругости. Доказано, что если нелинейное уравнение (2) имеет решение вида
то разность между решениями уравнений (2) и (3) имеет порядок . В методе гармонического баланса частота колебаний зависит от амплитуды а (посредством величин ).
3 МЕТОД АППРОКСИМИРУЮЩЕГО ПРОГРАММИРОВАНИЯ
Метод аппроксимирующего программирования (МАП) основан на линеаризации исходной задачи НП и замене ее последовательностью промежуточных задач ЛП. Его называют также градиентным методом с малой длиной шага в отличие от обычных градиентных методов
Итак, пусть задача НП задана в виде:
После линеаризации в окрестности точки задача формулируется следующим образом:
минимизировать при условии, что имеют место ограничения в виде равенств
и неравенств ,где .
Метод гармонического баланса применяется для отыскания периодических и квазипериодических колебаний, периодических и квазипериодических режимов в теории автоматического регулирования, стационарных режимов и для исследования их устойчивости. Особенно большое распространение он получил в теории автоматического регулирования.

ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ, 2008, том 42, № 5, с. 544-549
ЛИНЕАРИЗАЦИЯ КИНЕТИЧЕСКИХ КРИВЫХ НА ПРИМЕРЕ ОЗОНИРОВАНИЯ КРАСИТЕЛЕЙ И ГУМИНОВЫХ КИСЛОТ
© 2008 г. В. В. Тарасов
Российский химико-технологический университет им. Д.И. Менделеева, Москва
valeri_tarasov@mail. ru Поступила в редакцию 19.06.2006 г.
Проведена операция линеаризации кинетических кривых на примере обесцвечивания красителей прямого зеленого и метиленового голубого, а также гуминовых кислот. Показано, что кинетические кривые могут быть линеаризированы в координатах время-корень квадратный из отрицательного логарифма приведенного оптического поглощения света или концентрации озона. Это открывает простую возможность моделирования и оптимизации процессов озонирования.
Линеаризация кинетических кривых и их производных (анаморфоз) является действенным приемом [1, 2], который может быть использован при моделировании и оптимизации процессов обесцвечивания воды методом озонирования. Сказанное относится, прежде всего, к описанию процессов в периодических реакторах. Если найден способ преобразования кинетической кривой в прямые линии, то можно считать, что успех описания процесса предопределен. Исключительно важно, чтобы прямая линия охватывала как можно более широкую область степеней конверсии (обесцвечивания). Для линеаризации особенно часто используют изменение функций по осям. При этом очень важно, чтобы не терялся физический смысл производимых по осям трансформаций.
В данной статье описывается способ линеаризации кинетических кривых процесса обесцвечивания красителей и гуминовых кислот, производимого на периодическом реакторе-абсорбере.
В работе предпринята попытка линеаризации кинетических кривых химической абсорбции озона на примере красителей прямого зеленого, метиленового голубого и гуминовых кислот, т.е. растворимой части гумусовых кислот. Первый объект выбран нами скорее для разработки методологии описания кинетики. Он наиболее прост. Второй -демонстрирует пример нелинейной калибровочной кривой, вследствие несоблюдения закона прямолинейности (закон Бера). Третий - демонстрирует соответствие закону прямолинейности, но полимерные молекулы гуминовых кислот сложны и имеют большую и непостоянную молекулярную массу 104-106 дальтон. Этот класс соединений имеет большое практическое значение, поскольку по-
верхностные воды гумидных зон земли всегда содержат гумусовые кислоты, окрашивающие воды в бурый цвет, что крайне нежелательно.
В книге [3] описываются концентрационные пределы закона Бера, влияние электронных переносов, интегрирование интенсивностей света, источники ошибок и точность измерений, ошибки приготовления образцовых растворов, влияние толщины кюветы, количественные измерения, анализ "следов"и др.
Закон Бера имеет вид полулогарифмической зависимости log (P0/P) = A = ebc, где P0 и P - мощности падающего и прошедшего света через слой толщиной b при концентрации c и молярном поглощении £. Таким образом, между поглощением света A и концентрацией окрашивающего вещества c наблюдается прямая пропорциональность.
Установка озонирования, на которой были получены 40 кинетических кривых и проведена последующая их обработка, подробно рассмотрена в [4].
Схема установки озонирования состоит из компрессора, нагнетающего воздух, кислородного концентратора, служащего для получения кислорода из воздуха адсорбцией на молекулярных ситах в циклическом режиме. Концентрация кислорода составляет 90-95%. Прибор, который обеспечивает это разделение, имеет медицинское назначение, но приспособлен нами для озонирования. Он называется NewLife и выпускается компанией "ArcSep" (США). Производительность установки по кислороду составляет до 0.33 дм3/с.
Поток кислорода регулируется вентилем и измеряется ротаметром поплавкового типа, встроенным в кислородный концентратор. Сухой и освобожденный от азота кислород подается в генератор озона марки "0Б-30" (изготовитель - Всероссийский электротехнический институт, Москва). Генератор 0Б-30 работает на принципе коронного разряда и
имеет максимальную производительность по озону 0.0022 г/с. Концентрация озона в потоке может поддерживаться в пределах 0-100 г/м3. Измерение концентрации озона в кислородно-озоновой смеси производится прибором марки "Медозон" (Россия), имеющим возможность измерения концентрации озона в диапазоне 1-600 г/м3. Автоматический анализ озона осуществляется хемилюминесцентным методом. Описанный комплекс приборов составляет блок приготовления рабочих газовых смесей.
Реактор обесцвечивания является копией зарубежного реактора Я-1. Его объем немного больше 5 литров. Он снабжен двухлопастной двухъярусной мешалкой (расстояние между ярусами составляло 50 мм) диаметром 60 мм, приводимой во вращение электродвигателем с тахометром. Перечисленные устройства составляют второй блок установки. Этот блок помещен в водяной термостат и служит для проведения процессов газовой химической абсорбции при определенных интенсивностях перемешивания, содержании газа, размере пузырьков газа и нужных коэффициентах массоотдачи. Рабочий объем реактора 2 литра, остальное пространство заполняется газом и остается свободным. Реактор (диаметром 150 мм и высотой 250 мм) снабжен крышкой, к которой крепятся 4 отражательные перегородки шириной 20 мм, предотвращающие образование воронки при вращении мешалки. Размер пузырей газа составлял от 0.5 до 3 мм.
В крышке реактора имеются четыре отверстия: два - для входа и выхода озона, два - для отбора проб и присоединения дифференциального манометра. Этот манометр предназначен для измерения небольшого отрицательного давления в реакторе по сравнению с атмосферным давлением, что нужно для устранения проницания озона в окружающую среду. Небольшое разрежение (2-5 мм водного столба) под крышкой реактора регулируется с помощью водоструйного насоса. Для обеспечения безопасной работы используется отсос отработавшего озона с помощью того же водоструйного насоса через сосуд с гопкалитом.
В качестве основного способа аналитического определения окрашенных примесей выбран фотометрический метод. Калибровочные функции, необходимые для пересчета оптического поглощения в концентрации, получали в виде зависимостей А = /(С), которые легко переводятся в функции С = ДО и А = Дг). При отсутствии линейности калибровочных функций А = /(С) пользовались только функциями С = /(г). Концентрацию окрашенных форм красителей и гуминовых кислот выражали в мг/дм3.
Уравнение калибровочной функции для красителя прямого зеленого имеет вид А = 0.0099 С. Величина А достигала 1 при концентрации этого красителя 100 мг/дм3. Величина доверительной аппроксимации равнялась И2 = 0.9996.
В случае нарушения линейности функции А = = / (С) рассчитывали непосредственно концентрацию окрашенной формы красителя метиленового голубого. Нарушение закона линейности связано с процессом электролитической диссоциации солевой формы этого красителя. Уравнение калибровочной функции в этом случае имеет вид А = = 0.2348 1пС - 0.1771, Я2 = 0.99.
Калибровочная линия в случае гуминовых кислот записывается следующим образом: А = 0.0158 С, Я2 = 0.9957. Величина А достигает 0.47 при концентрации гуминовых кислот, равной 30 мг/дм3.
При соблюдении закона линейности основными переменными являются отрицательные логарифмы приведенных величин оптического поглощения - 1пА*, где А* = А/А0, причем А0 и А - начальная и текущая оптические поглощения, а величина А* - приведенное оптическое поглощение. Оно изменяется в пределах от 0 до 1. При нарушении линейности калибровочной функции А = =/(С) находили графики приведенных концентраций С* = /(г) и величины их отрицательных логарифмов -1п С*. Приведенная величина С* также изменяется в пределах от 1 до 0.
Наиболее глубокие разработки кинетики химической абсорбции озона и математического моделирования этого процесса мы встретили в работе итальянских ученых [5], которые изучали деструкцию бензолсульфоновой кислоты в воде под воздействием озона. Работа имела практический характер. Ее авторы изучали процесс периодической химической абсорбции озона в присутствии бензолсульфоновой кислоты. Им удалось получить кривые распределения во времени озона в обеих фазах, бензолсульфоновой кислоты в воде и озона в газовой фазе. Для этой цели авторы работы [5] использовали численное решение следующей системы уравнений:
йс^йг = к1а(а с^) - еь) - 6к!свзАс/ - ^С/., (1)
йсВБА/йг = —k1CBSACL, (2)
Ийс^ / йг = О (40) - 4°) - ка(а 4° - СЬ)У. (3)
Уравнение (1) отражает процесс накопления озона в водной фазе, представляющий собой разность скорости увеличения концентрации озона
ка(ас^ - сь) за счет его массопереноса в воду и скорости расходования его в реакциях (-6к1сВЗАс/ - к2с/). Первый член этой алгебраической суммы (в скобках) - скорость реакции второго порядка. Второй член в скобках представляет скорость реакции нулевого порядка по бензолсульфоновой кислоте, но первого - по озону.
Рис. 1. Кинетические кривые обесцвечивания красителя прямого зеленого при различных концентрациях озона в газовой фазе: 1 - 5; 2 - 10; 3 - 15 г/м3.
Уравнение (2) отражает уменьшение концентрации бензолсульфоновой кислоты за счет химической реакции второго порядка, а уравнение (3) описывает процесс уменьшения озона в газовой фазе.
Упрощенная нами модель основана на следующих допущениях:
1) независимость концентрации озона в газовой фазе от времени, причиной которой является малая растворимость этого газа в водной фазе и достаточно высокая скорость его подачи;
2) линейность изменения концентрации растворенного озона от времени; этот факт эмпирически установлен, но не обсуждается авторами работы [5] (мы подтвердим его в последующем исследовании, вплоть до очень высоких степеней конверсии);
3) медленность реакции, что приводит к основному падению концентрации окрашивающих форм красителей и гуминовых кислот в водной пленке (если следовать двухпленочной модели [6]).
Учитывая принятые допущения, мы исключаем из рассмотрения первое и третье уравнение, оставив лишь
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.
МАКСИМОВ А.И., ХЛЮСТОВА А.В. — 2013 г.
БАТИНА М.В., ПАТРАКОВ Ю.Ф., СЕМЁНОВА С.А. — 2008 г.
АУТЛОВ С.А., БАЗАРНОВА Н.Г., ЛУНИН В.В., МАМЛЕЕВА Н.А., ФИОНОВ А.В. — 2009 г.
Методы определения констант скорости и порядков реакций. Данные методы можно использовать, если процесс описывается основным постулатом химической кинетики. В случае простых реакций будем получать величины истинных констант скорости, для сложных – некие эффективные константы.
1) Метод линеаризации кинетических кривых.
Вид кинетической кривой самой по себе позволяет делать предположения о природе процесса (рисунок 1). Если подобрать координаты, в которых экспериментальная кинетическая зависимость линеаризуется, то можно достаточно точно установить порядок реакции (рисунок 2).
 |  |
  |  |
| Рисунок 1 – Вид типичных кинетических кривых: а) – кривые с насыщением; б) – параболические кривые (обычно изменение концентрации промежуточных продуктов); в) 1 – кривая реакции нулевого порядка (скорость процесса не зависит от концентрации); 2 – концентрация не меняется; г) 1 – S-образная кривая; д) 1 – кривая реакции с автоускорением (автокаталитическая). |
 |  |   |
| Рисунок 2 – Линеаризация кинетических кривых реакций первого (а), второго (б) и третьего (в) порядков в соответствующих координатах. C0 – начальная концентрация реагента, С – концентрация реагента в момент времени t. |
2) Метод Вант-Гоффа

Так как (то есть, исходные концентрации веществ равны), тогда
 | (1) |
n– общий порядок реакции, логарифмируем:
 | (2) |
По сути, мы линеаризовали основной постулат химической кинетики, в который подставили данные нескольких параллельных экспериментов (несколько различных начальных скоростей при различных начальных концентрациях) Получили уравнение прямой, из которого легко определить порядок реакции как тангенс угла наклона (рисунок 3).
Таким образом порядок часто определяют по начальным скоростям.
 |
| Рисунок 3 – Определение константы скорости и порядка реакции по методу Вант-Гоффа. |
Любую реакцию n-го порядка можно перевести в реакцию псевдопервого порядка. Для этого все реагенты, кроме одного, берут в избыточных концентрациях (не менее, чем десятикратный избыток) и эти концентрации считают постоянными.
 | |
 | (3) |
Проведя реакцию при избытке всех исходных веществ, кроме одного, можно вычислить, например, по выражению (3) некую эффективную константу (которая будет включать истинную константу скорости и концентрации всех реагентов, взятых в избытке, которые мы считаем постоянными) и частный порядок реакции по этому веществу. Таким образом проводится серия экспериментов при недостатке всех реагентов по очереди, определяются частные порядки, а значит, и суммарный порядок реакции. Подставив значения частных порядков по веществу в основной постулат химической кинетики, можно определить константу скорости.
Кинетический анализ сложных реакций.До этого момента рассматривались простые реакции, которые представляют собой элементарный акт взаимодействия. Существуют сложные реакции, во время которых протекает несколько простых. Хотя бы одно исходное вещество или продукт одной реакции участвует и в другой. Эта совокупность простых является механизмом сложной реакции. Различают сложные реакции:

- обратимые

- последовательные

- параллельные
И их более сложные сочетания.
Признаки, по которым можно заподозрить сложную реакцию:
- несовпадение порядка реакции и стехиометрических коэффициентов;
- изменение состава продуктов при изменении условий (температура, давление, начальные концентрации и т.д.);
- сильное влияние на скорость небольших добавок других веществ, материала и размеров реакционного сосуда;
- небольшие воздействия могут привести к взрыву или к полному прекращению реакции.
При анализе сложных реакций используют принципы:
1) Принцип независимости элементарных стадий: константа скорости любой элементарной стадии сложного процесса не зависит от скорости любой другой реакции и для каждой из данных реакций можно использовать основной постулат.
Согласно основному постулату, скорость зависит только от константы скорости и концентраций реагентов (вот концентрации как раз могут зависеть от скорости других реакций, например, если реагент образуется на предыдущей стадии, но реакция все равно описывается основным постулатом).
Принцип независимости предполагает независимость частиц, участвующих в разных реакциях в одном объеме. Он не является абсолютным, может нарушаться в случае очень быстрых реакций или очень высоких концентраций.
Зная элементарные стадии механизма, можно составить уравнения скорости для каждой из них. Суммарная скорость процесса будет равна алгебраической сумме скоростей стадий:
 | (4) |
Если рассматриваемое вещество накапливается, скорость реакции считают положительной, расходуется – отрицательной. Например, в реакции
 | (5) |
скорость изменения концентрации вещества В равна:
 | (6) |
То есть, вещество В накапливается в реакции с константной скорости k1 и расходуется в реакции с k2.
Существует понятие лимитирующей стадии. Если процесс включает несколько последовательных стадий, та из них, константа скорости которой наименьшая, будет ограничивать – лимитировать – скорость всего процесса. Если медленная стадия находится в середине цепочки последовательных реакций, следующая за ней быстрая будет идти с небольшой скоростью из-за того, что в каждый момент времени будет доступно небольшое количество ее исходного вещества (продукта медленной стадии). Это не противоречит принципу независимости, так как величины констант остаются неизменными и основной постулат выполняется.
2) Принцип микрообратимости элементарных стадий (принцип детального равновесия): если в сложном процессе устанавливается химическое равновесие, то скорости прямой и обратной реакций будут равны для каждой из элементарных стадий.
С точки зрения статистической вероятности, любой химический процесс является условно обратимым. Вероятность протекания прямого или обратного процесса определяется скоростью соответствующей реакции. Если она ненулевая, то и вероятность ненулевая. В связи с этим, критерием состояния равновесия может служить равенство прямой и обратной реакций.
3) Принцип стационарности и квазистационарностиБоденштейна-Семенова. Используется для анализа последовательных реакций. Например, в реакции (5) в самом начале в системе отсутствует вещество В. Про мере его накопления в первой реакции начинается образование вещества С во второй реакции и [В] не поднимается выше некоторой [В]max. Если k2 >> k1, то есть, скорость расходования промежуточного веществаВ значительно больше скорости его образования на первой стадии, то в течение всего времени протекания реакции [B] очень мала и практически постоянна – квазистационарна:
 | (7) |
Следовательно, скорость образования продукта С практически равна скорости расходования реагента А:
 | (8) |
Этот принцип позволяет заменить часть дифференциальных уравнений простыми алгебраическими, выразить концентрации неустойчивых промежуточных продуктов через концентрации исходных веществ, которые задаются экспериментатором, и продуктов, которые можно определить различными методами.
4) Принцип квазиравновесности (квазиравновесное приближение). Применяется для описания последовательных процессов в которых первая стадия обратима, например,
 | (9) |
Если k-1 >> k2, то есть, скорость расходования промежуточного вещества В значительно меньше скорости обратной реакции на первой стадии, то превращение Вв продукт происходит значительно медленнее, чем устанавливается равновесие на первой стадии и [B] квазиравновесна. Так что концентрации исходного вещества и продукта связаны через константу равновесия:
Метод статистической линеаризации - замена нелинейного преобразования процессов статистически эквивалентными им линейными преобразованиями. Цель применения – линеаризация системы, что необходимо для применения методов исследования линейных систем.
| Рубрика | Коммуникации, связь, цифровые приборы и радиоэлектроника |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 21.01.2009 |
| Размер файла | 101,8 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ИНФОРМАТИКИ И РАДИОЭЛЕКТРОНИКИ
"Метод статистической и гармонической линеаризации. Расчет автоколебаний по критерию Найквиста"
Метод статистической линеаризации
Метод основан на замене нелинейного преобразования процессов статистически эквивалентными им линейным преобразованиями. Нелинейный элемент заменяется линейным эквивалентом (рис.1). В результате замены система линеаризуется, что позволяет использовать методы исследования линейных систем.
Замена нелинейного преобразования линейным является приближенной и справедливой лишь в некоторых отношениях. Поэтому не существует однозначной эквивалентности при использовании различных критериев.
В частности, если нелинейность определяется безинерционной зависимостью вида
используется два критерия эквивалентности.
Первый критерий предполагает равенство на выходе нелинейного элемента и его линейного эквивалента математических ожиданий и дисперсий процессов.
Второй критерий - минимум среднего квадрата разности процессов на выходе нелинейного элемента и его линейного эквивалента.
Процесс на входе и выходе нелинейного элемента представим в виде:
где- математическое ожидание процесса на выходе НЭ;
- центрированная случайная составляющая.
Процесс на выходе линейного эквивалента представляется в следующем виде:
где - коэффициент передачи линейного эквивалента по математическому ожиданию; - коэффициент передачи по центрированной случайной составляющей.
Воспользуемся первым критерием эквивалентности:
Из этих уравнений находим
где - плотность вероятности процесса на входе нелинейного элемента.
- коэффициент передачи линейного эквивалента по центрированной случайной составляющей (по первому критерию).
По второму критерию эквивалентности:
Для определения и , при которых выполняется условие эквивалентности, найдем частные производные и приравняем их нулю:
При расчете этих коэффициентов полагают, что распределение на входе нормальное:
Определив величины
для типовых нелинейностей, заменяют последние коэффициентами передачи линейного эквивалента и анализируют систему линейными методами.
Для основных типов нелинейностей и нормальном распределении входного процесса коэффициенты рассчитаны и представлены в виде табличных значений. В частности, для характеристики релейного типа (рис.2)
Рис.2. Характеристика релейного типа:
коэффициенты равны:
Метод гармонической линеаризации
Основы метода.
Метод используется для исследования нелинейных систем, описываемых дифференциальными уравнениями различного порядка. Эффективен для расчета параметров собственных колебаний в системе, используется также для анализа точности при гармоническом задающем воздействии.
Рассмотрим метод применительно к расчету параметров собственных колебаний в нелинейной системе.
Разделим систему на линейную часть и нелинейное звено (рис.3).
Рис.3. Модель нелинейной системы.
Уравнение линейной части:
При возникновении автоколебаний процесс на выходе линейной части не является строго гармоническим, но мы будем полагать, что линейное звено является фильтром нижних частот и подавляет все гармоники, за исключением первой. Это предположение называется гипотезой фильтра. Если она не подтверждается, то ошибки при применении гармонической линеаризации могут быть значительными.
Пусть
Представим в виде ряда Фурье:
Полагаем, что
Это справедливо, если симметрична относительно начала координат и отсутствует внешнее воздействие. Полагая, что высшие гармоники подавляются, будем искать только и
Из уравнения (7) находим:
Подставив (8. 20) в (8. 19) и ограничив ряд слагаемыми первой гармоники, получим:
Таким образом, нелинейное уравнение для заменили приближенным линейным уравнением (11) для первой гармоники.
и называют гармоническими коэффициентами передачи нелинейного звена. Коэффициенты и в рассматриваемом случае зависят от амплитуды, при более сложной нелинейной зависимости зависят еще и от частоты.
Рассчитанные значения коэффициентов гармонической линеаризации для типовых нелинейностей можно найти в учебниках и справочной литературе.
Передаточная функция разомкнутой системы может быть представлена в следующем виде:
где - эквивалентная передаточная функция нелинейно - го звена.
Частотная передаточная функция разомкнутой системы
Характеристическое уравнение
Модуль частотной передаточной функции нелинейного звена
Фазочастотная характеристика
Модуль определяет отношение амплитуд, а фазовый сдвиг на выходе относительно входного сигнала.
Если симметрична относительно начала координат, однозначна и не имеет гистерезиса, то и тогда
Часто при анализе используется величина обратная . Она называется гармоническим импедансом нелинейного звена:
Расчет автоколебаний по критерию Найквиста
В соответствии с критерием Найквиста строится годограф частотной передаточной функции разомкнутой системы
Условием возникновения в системе колебаний является прохождение амплитудно-фазовой характеристики через точку (-1,j0) комплексной плоскости. Для определения условий прохождения годографа через эту точку приравняем
Чтобы решить это уравнение можно, задавая значение амплитуды, строить амплитудно-фазовую характеристику(рис.8.18) Значение амплитуды а=А, при которой АФХ пройдет через точку (-1,j0) будет соответствовать амплитуде собственных колебаний. Значение частоты определяют по частоте в точке (-1,j0).
Рис.4. Амплитудно-фазовая характеристика нелинейной системы.
Тогда искомое колебание
При нелинейной зависимости вида передаточную функцию разомкнутой системы можно представить в виде
Рис.5. Графический метод решения уравнения (13).
Это уравнение решается графическим методом (рис.5).
Строим амплитудно-фазовую характеристику линейного звена и кривую импеданса нелинейного звена. Определяем точку пересечения. Частоту определим по АФХ линейного звена в точке пересечения. Амплитуду А определим по кривой импеданса нелинейного звена.
Чтобы определить являются ли колебания устойчивыми автоколебаниями, нужно задать приращение амплитуды ; при этом точка на импедансе смещается влево вниз. Это будет соответствовать уменьшению, следовательно, кривая годографа ПФ разомкнутой системы не будет охватывать точку с координатами . Поэтому амплитуда колебаний начнет уменьшаться, и система вернется в исходное состояние. То же будет и при отрицательном приращении.
Критерий устойчивости периодического режима сводится к тому, чтобы часть кривой соответствующая меньшим амплитудам, охватывалась амплитудно-фазовой характеристикой линейной части.
При отсутствии в системе периодических режимов (решения уравнения (8.23)) можно предположить, что система будет устойчива.
Условие устойчивости равновесного состояния (отсутствия автоколебаний): при устойчивой или нейтральной в разомкнутом состоянии линейной части её АФХ не охватывает годограф .
ЛИТЕРАТУРА
2. Радиоавтоматика: Учеб. пособие для вузов. / Под ред. .А. Бесекерского. - М.: Высш. шк., 2005.
3. . Первачев.С.В Радиоавтоматика: Учебник для вузов. - М.: Радио и связь, 2002.
4. Цифровые системы фазовой синхронизации Под ред. .И. Жодзишского - М.: Радио, 2000
Подобные документы
Нелинейные системы, описываемые нелинейными дифференциальными уравнениями. Методы анализа нелинейных систем: кусочно-линейной аппроксимации, гармонической линеаризации, фазовой плоскости, статистической линеаризации. Использование комбинации методов.
реферат [230,8 K], добавлен 21.01.2009
Исследование системы автоматического управления с заданной структурной схемой, видом нелинейности и числовыми параметрами методом фазовой плоскости и гармонической линеаризации. Влияние входного воздействия и параметров нелинейности на динамику системы.
курсовая работа [905,6 K], добавлен 01.10.2012
Основные характеристики импульса. Генераторы линейно изменяющегося (пилообразного) напряжения, их назначение и область применения. Методы линеаризации пилообразного напряжения. Требования к устройству. Основные характеристики и принцип построения ГПН.
курсовая работа [2,5 M], добавлен 07.08.2013
Условия разрешимости синтеза на примере линейных и нелинейных систем. Методы синтеза линейных систем. Метод разделения движений и область их применения. Особенности синтеза систем с вектором скорости в управлении. Свойства систем со скользящими режимами.
шпаргалка [1,7 M], добавлен 25.05.2012
Тензометрический метод оценки состояния двигательных отделов центральной нервной системы. Структурная организация тензометрического треморографа. Основные задачи статистической обработки изометрических данных. Методы корреляции и главных компонент.
курсовая работа [757,7 K], добавлен 15.06.2014
Исследование динамики элементов систем автоматического управления. Анализ устойчивости и режима автоколебаний нелинейной САУ температуры в сушильной камере с использованием методов фазовых траекторий, гармонической реализации, алгебраическим и частотным.
курсовая работа [1,3 M], добавлен 06.12.2012
Классический метод оценки качества методом решения неоднородных дифференциальных уравнений. Проектирование систем управления методами моделирования: аналогового, цифрового, имитационного. Метод корневого годографа и применение критерия Найквиста.
Одним из характерных проявлений жизни является удивительная способность живых организмов кинетически регулировать химические реакции, подавляя стремление к достижению термодинамического равновесия. Ферментативная кинетика занимается исследованием закономерностей влияния химической природы реагирующих веществ (ферментов, субстратов) и условий их взаимодействия (концентрация, рН среды, температуры, присутствие активаторов или ингибиторов) на скорость ферментативной реакции. Главной целью изучения кинетики ферментативных реакций является получение информации, которая может способствовать выяснению молекулярного механизма действия фермента.
Общие принципы кинетики химических реакций применимы и к ферментативным реакциям. Известно, что любая химическая реакция характеризуется константой термодинамического равновесия. Она выражает состояние химического равновесия, достигаемого системой, и обозначается Кр. Так, для реакции:
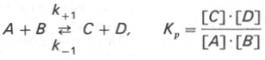
Константа равновесия равна произведению концентраций образующихся веществ, деленному на произведение концентрации исходных веществ. Значение константы равновесия обычно находят из соотношения констант скоростей прямой (k+1) и обратной (k–1 ) реакций, т.е. Кp = k+1/k–1. В состоянии равновесия скорость прямой реакции: v+1 = k+1[ А ]•[ B ] равна скорости обратной реакции: v–1 = k – 1 [ С ] • [ D ] , т. е. v+1 = v–1 соответственно k+1[А]•[B] = k–1[С]•[D], или
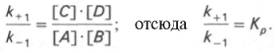
Таким образом, константа равновесия равна отношению констант скоростей прямой и обратной реакций. Величину, обратную константе равновесия, принято называть субстратной константой, или, в случае ферментативной реакции, константой диссоциации фермент–субстратного комплекса, и обозначать символом KS. Так, в реакции
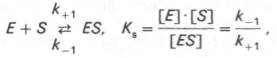
т.е. KS равна отношению произведения концентрации фермента и субстрата к концентрации фермент-субстратного комплекса или отношению констант скоростей обратной и прямой реакций. Следует отметить, что константа KS зависит от химической природы субстрата и фермента и определяет степень их сродства. Чем ниже значение KS, тем выше сродство фермента к субстрату.
При изучении кинетики ферментативных реакций следует учитывать одну важную особенность этих реакций (не свойственную обычным химическим реакциям), связанную с явлением насыщения фермента субстратом. При низкой концентрации субстрата зависимость скорости реакции от концентрации субстрата (рис. 17) является почти линейной и подчиняется кинетике первого порядка. Это означает, что скорость реакции S —> Р прямо пропорциональна концентрации субстрата S и в любой момент времени t определяется следующим кинетическим уравнением:
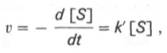
где [S] – молярная концентрация субстрата S; –d[S]/dt – скорость убыли субстрата; k' – константа скорости реакции, которая в данном случае имеет размерность, обратную единице времени (мин –1 или с –1 ).
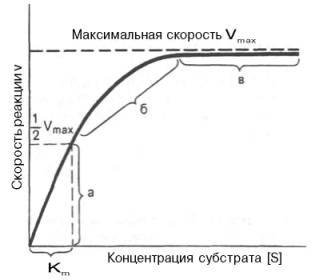
а - реакция первого порядка (при [ S ] 1 /2 Vmaх. Подставляя значение v в уравнение Бриггса–Холдейна, получаем:
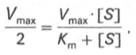
разделив обе части уравнения на Vmах, получим
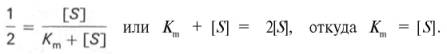
Таким образом, константа Михаэлиса численно равна концентрации субстрата (моль/л), при которой скорость данной ферментативной реакции составляет половину от максимальной.
Определение величины Кm имеет важное значение при выяснении механизма действия эффекторов на активность ферментов и т.д. Константу Михаэлиса можно вычислить по графику (рис.18). Отрезок на абсциссе, соответствующий скорости, равной половине максимальной, будет представлять собой Кm.
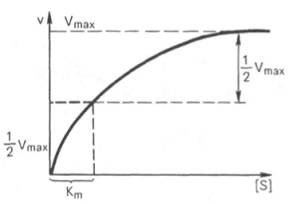
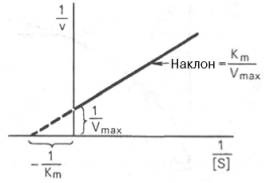
Рисунок 19-График Лайнуивера-Бэрка
Пользоваться графиком, построенным в прямых координатах зависимости начальной скорости реакции v0 от начальной концентрации субстрата [S0], неудобно, поскольку максимальная скорость Vmax в данном случае определяется недостаточно точно.
Для более удобного графического представления экспериментальных данных Г. Лайнуивер и Д. Бэрк преобразовали уравнение Бриггса–Холдейна и после преобразования получаем уравнение:
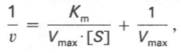
которое получило название уравнения Лайнуивера–Бэрка. Если теперь в соответствии с этим уравнением построить график в координатах 1/v (y) от l/[S] (x), то получим прямую линию (рис. 19), тангенс угла наклона который будет равен величине Km/Vmax; отрезок, отсекаемый прямой от оси ординат, представляет собой l/Vmax(обратная величина максимальной скорости). Если продолжить прямую линию за ось ординат, тогда на абсциссе отсекается отрезок, соответствующий обратной величине константы Михаэлиса – 1/Кm (см. рис. 4.14). Таким образом, величину Кm можно вычислить из данных наклона прямой и длины отрезка, отсекаемого от оси ординат, или из длины отрезка, отсекаемого от оси абсцисс в области отрицательных значений.
Читайте также:

