Механизмы развития метаболической иммуносупрессии у животных реферат
Обновлено: 05.07.2024
Иммуносупрессия, иммунодепрессия, или иммунодефицит — все это иммунодефицитные состояния — угнетение иммунитета обусловленные выпадением одного или нескольких компонентов иммунного ответа или тесно взаимодействующих с ним неспецифических факторов. Это приводит к ослаблению сопротивляемости организма по отношению к различным инфекционным и неинфекционным заболеваниям.
Иммуносупрессия бывает физиологической (необходимой в определённых ситуациях для организма), патологической (при различных заболеваниях и болезненных состояниях) и искусственной, вызываемой приёмом ряда иммуносупрессивных препаратов или ионизирующими излучениями.
Физиологическая иммуносупрессия отмечается при беременности. Она необходима для предотвращения иммунологического отторжения эмбриона, который является, по существу, генетически и иммунологически наполовину чужеродным трансплантатом в матке беременной женщины.
Патологическая иммуносупрессия отмечается, прежде всего, при различных состояниях врождённого или приобретённого иммунодефицита, в частности, при инфицировании ВИЧ, при лучевой болезни и др.
Искусственная иммуносупрессия применяется при лечении аутоиммунных заболеваний, при трансплантации органов и тканей и др.
Иммунодефициты можно разделить на первичные и вторичные.
Причины развития вторичного иммунодефицита
Факторы, способные вызвать вторичный иммунодефицит, весьма разнообразны. Вторичный иммунодефицит может быть вызван как факторами внешней среды, так и внутренними факторами организма.
В целом, все неблагоприятные факторы окружающей среды, способные нарушить обмен веществ организма, могут стать причиной развития вторичного иммунодефицита. К наиболее распространенным факторам окружающей среды, вызывающим иммунодефицит относятся загрязнение окружающей среды, ионизирующее и СВЧ излучение, отравления, длительный прием некоторых лекарственных препаратов, хронический стресс и переутомление.
К внутренним факторам, способным спровоцировать вторичный иммунодефицит относятся:
- Хронические бактериальные и вирусные инфекции, а также паразитарные инвазии (туберкулез, стафилококкоз, пневмококкоз, герпес, хронические вирусные гепетиты, краснуха, ВИЧ, малярия, токсоплазмоз, лейшманиоз, аскаридоз и др.). При различных хронических заболеваниях инфекционного и паразитарного характера иммунная система претерпевает серьезные изменения. Нарушается иммунореактивность, развивается повышенная сенсибилизация по отношению к различным антигенам возбудителей. Кроме того, на фоне хронического воспалительного процесса наблюдается интоксикация организма и угнетение функции кроветворения. Иммунодефицит во время инфекции ВИЧ опосредован избирательным поражением клеток иммунной системы вирусом.
- Потери организмом электролитов, минералов и белков вследствие некоторых заболеваний и синдромов, особенно при диарейном синдроме, частой рвоте и различных дизурических явлениях при патологии почек.
- Интоксикация, сопровождающая многие хронические заболевания, чаще при уремии и кетоацидозе.
- Стресс- синдром на первичном этапе характеризуется иммуноактивацией, однако достаточно быстро наступает истощение и вторичная иммуносупрессия.
- Злокачественные новообразования (опухоли) – нарушают деятельность всех систем организма. Наиболее выраженное снижение иммунитета наблюдается в случае злокачественных заболеваний крови (лейкемия) и при замещении красного костного мозга метастазами опухолей. На фоне лейкемии количество иммунных клеток в крови порой повышается в десятки, сотни и тысячи раз, однако эти клетки нефункциональны и потому не могут обеспечить нормальной иммунной защиты организма.
- Нарушение питания и общее истощение организма также приводит к снижению иммунитета. На фоне общего истощения организма нарушается работа всех внутренних органов. Иммунная система особенно чувствительна к недостатку витаминов, минералов и питательных веществ, так как осуществление иммунной защиты это энергоемкий процесс. Часто снижение иммунитета наблюдается во время сезонной витаминной недостаточности (зима-весна).
- Аутоиммунные заболевания возникают из-за нарушения функции иммунной системы. На фоне заболеваний этого типа и при их лечении иммунная система работает недостаточно и, порой, неправильно, что приводит к повреждению собственных тканей и неспособности побороть инфекцию.
- Потеря факторов иммунной защиты наблюдается во время сильных потерь крови и ее компонентов особенно при ожогах или при заболеваниях почек. Причиной развития этих патологий является значительная потеря плазмы крови или растворенных в ней белков, часть их которых является иммуноглобулинами и другими компонентами иммунной системы (белки системы комплимента, С-реактивный белок). Во время кровотечений теряется не только плазма, но и клетки крови, поэтому на фоне сильного кровотечения снижение иммунитета имеет комбинированный характер (клеточно-гуморальный).
- Различные эндокринные заболевания (сахарный диабет, гипотиреоз, гипертиреоз) приводят к снижению иммунитета за счет нарушения обмена веществ организма. Наиболее выраженное снижение иммунной реактивности организма наблюдается при сахарном диабете и гипотиреозе. При этих заболеваниях снижается выработка энергии в тканях, что приводит к нарушению процессов деления и дифференциации клеток, в том числе и клеток иммунной системы. На фоне сахарного диабета частота различных инфекционных заболеваний значительно повышается. Связано это не только с угнетением функции иммунной системы, но и с тем, что повышенное содержание глюкозы в крови больных диабетом стимулирует размножение бактерий.
- Тяжелые травмы и операции также протекают со снижением функции иммунной системы. Вообще любое серьезное заболевание организма приводит к вторичному иммунодефициту. Отчасти это связано с нарушением обмена веществ и интоксикацией организма, а отчасти с тем, что во время травм или операций выделяются большие количества гормонов надпочечников, которые угнетают функцию иммунной системы
- Прием различных лекарственных препаратов и наркотических средств оказывает выраженное иммунодепрессивное действие. Особенно выражено снижение иммунной защиты во время приема цитостатиков, глюкокортикоидных гормонов, антиметаболитов.
- Снижение иммунной защиты у людей старческого возраста, беременных женщин и детей связано с возрастными и физиологическими особенностями организма этих категорий людей.
Клиническая картина Иммунодефицитных состояний
- Рецидивирующие и хронические инфекции верхних дыхательных путей, придаточных пазух, кожи, слизистых оболочек, желудочно-кишечного тракта, часто вызываемые условнопатогенными бактериями, простейшими, грибами, имеющие тенденцию к генерализации, септицемии и невосприимчивые к обычной терапии.
- Гематологические дефициты: лейкоцитопении, тромбоцитопении, анемии (гемолитические и мегалобластические).
- Аутоиммунные расстройства: СКВ- подобный синдром, артриты, склеродермия, хронический активный гепатит, тиреоидит.
- Нередко ИДС сочетается с аллергическими реакциями 1 типа в виде экземы, отека Квинке, аллергическими реакциями на введение лекарственных препаратов, иммуноглобулина, крови.
- Опухоли и лимфопролиферативные заболевания при иммунодефиците встречаются в 1000 раз чаще, чем без иммунодефицитного состояния.
- У больных с ИДС часто отмечаются расстройства пищеварения, диарейный синдром и синдром мальабсорбции (неспособность пищеварительной системы должным образом расщеплять пищу и соответственно всасывать питательные вещества в кровь).
- Больные с ИДС отличаются необычными реакциями на вакцинацию, а применение у них живых вакцин опасно развитием сепсиса.
- Первичные ИДС часто сочетаются с пороками развития, прежде всего с гипоплазией клеточных элементов хряща и волос. Кардиоваскулярные пороки описаны, главным образом, при синдроме Ди-Джоржи.
- У лиц с иммунодефицитным состоянием резко снижена эффективность вакцинации и крайне высок риск развития поствакцинальных осложнений.
Диагностика иммунодефицита
Первичный иммунодефицит обычно проявляется сразу после рождения ребенка или спустя некоторое время после него. Для точного установления типа патологии проводят ряд сложных иммунологических и генетических анализов – это помогает определить место нарушения иммунной защиты (клеточное или гуморальное звено), а также определить тип мутации, которая вызвала заболевание.
Вторичные иммунодефициты могут развиться в любой период жизни. Заподозрить иммунодефицит можно в случае часто рецидивирующих инфекций, перехода инфекционного заболевания в хроническую форму, неэффективности обычного лечения, небольшого, но длительного повышения температуры тела. Установить точный диагноз иммунодефицита помогают различные анализы и тесты: общий анализ крови, определение фракций белков крови, специфические иммунологические тесты.
Лечение иммунодефицита
Лечить первичные иммунодефициты не просто. Прежде всего, необходим точный диагноз для определения нарушенного звена иммунной защиты и назначения комплексного лечения.
При недостатке иммуноглобулинов проводят пожизненную заместительную терапию сыворотками, содержащими антитела или обычной донорской плазмой. Также применяют иммуностимулирующую терапию препаратами типа Бронхомунал, Рибомунил, Тактивин.
При возникновении инфекционных осложнений назначают лечение антибиотиками, противовирусными или противогрибковыми препаратами.
При вторичных иммунодефицитах, нарушения иммунной системы выражены в меньшей степени, чем при первичных. Как правило, вторичные иммунодефициты носят приходящий характер. В связи с этим лечение вторичных иммунодефицитов гораздо проще и эффективнее по сравнению с лечением первичных нарушений функции иммунной системы.
Обычно лечение вторичного иммунодефицита начинают с определения и устранения причины его возникновения. Например, лечение иммунодефицита на фоне хронических инфекций начинают с санации очагов хронического воспаления.
Иммунодефицит на фоне витаминно-минеральной недостаточности начинают лечить при помощи комплексов витаминов и минералов и различных пищевых добавок, содержащих эти элементы. Восстановительные способности иммунной системы велики, поэтому устранение причины иммунодефицита, как правило, приводит к восстановлению иммунной системы.
Для ускорения выздоровления и специфической стимуляции иммунитета проводят курс лечения иммуностимулирующими препаратами. На данный момент известно большое количество различных иммуностимулирующих препаратов, с различными механизмами действия. Препараты Рибомунил, Кристин и Биостим содержат антигены различных бактерий и будучи введенными в организм, стимулируют выработку антител и дифференциацию активных клонов лимфоцитов. Тималин, Тактивин – содержат биологически активные вещества, экстрагированные из вилочковой железы животных. Кордицепс — является наиболее эффективным иммуномодулятором, нормализующим иммунитет в целом как систему.
Эти препараты оказывают выборочное стимулирующее действие на субпопуляцию Т-лимфоцитов. Нуклеинат натрия стимулирует синтез нуклеиновых кислот (ДНК и РНК), деление и дифференциацию клеток. Различные виды интерферонов повышают общую сопротивляемость организма и с успехомиспользуются в лечении различных вирусных заболеваний.
Заслуживают особого внимания иммуномодулирующие вещества растительного происхождения: Иммунал, экстракт Эхинацеи розовой, и особенно Кордицепс.
Особенности диагностики и лечения в Клинико-диагностической лаборатории БИОМАРКЕР:
- Детоксикационная терапия.
- Лечение хронических инфекций и гельминтозов.
- Лечение сопутствующих патологий.
- Коррекция гормональных нарушений.
- Иммунотерапия.
В результате такого подхода к лечению иммунодефицитное состояние достоверно проходит. Мы имеем возможность отслеживать его регрессию по результатам контрольных анализов.
5.6. МЕХАНИЗМЫ СУПРЕССИИ ИММУННОГО ОТВЕТА
До недавнего момента казалось очевидным, что супрессирующая функция в иммунной системе обеспечивается одной субпопуляцией Т-лимфоцитов-супрессоров. В настоящее время указанная субпопуляция не идентифициро-вана, однако все большее количество фактов указывает на то, что супрессия иммунного ответа является многокомпонентным процессом.
Какие же механизмы супрессии иммунного ответа очевидны?
Прежде всего важная роль в подавлении специфических иммуно-логических механизмов защиты может быть отведена субпопуляции Тh3, ко-торая продуцирует трансформирующий фактор роста (TGF В). Последний останавливает пролиферацию антигенстимулированных лимфоцитов и про-дукцию ими провоспалительных лимфокинов.
-интерферон, продуцируемый Тh1, супрессирует дифференцировку Тh2, эффекторные реакции эозинофилов, тормозит функцию IgE-проду-цирующих клеток и обеспечивает снижение титра IgE.
Определенная супрессорная функция может быть отведена и ИЛ-10, про-дуцируемому Тh3 и Тh4.
ИЛ-10 может продуцироваться также макрофагами, В-лимфоцитами, ке-ратиноцитами. ИЛ-10 является ингибитором синтеза цитокинов макрофага-ми, подавляет образование -интерферона, ИЛ-2, ИЛ-3, ФНО, гранулоцитар-ного и макрофагального колониестимулирующего факторов.
Важная роль в супрессии иммунного ответа на фоне массивной антиген-ной стимуляции бактериально-токсическими факторами отводится гипотала-мо-гипофизарно-надпочечниковой системе.
Динамика взаимодействия различных цитокинов и гормональных факто-ров в иммунном ответе при инфекционном стрессе может быть представлена следующим образом.
Антигенстимулированный макрофаг продуцирует ИЛ-1, ИЛ-6, ФНО, во-влекает в процессы дифференцировки Тh1, секретирующие ИЛ-2, ФНО, -интерферон, лимфотоксин.
В свою очередь, ИЛ-1, ИЛ-6, ФНО с кровотоком достигают гипо-таламических структур, связываются со специфическими рецепторами и стимулируют продукцию кортикотропинреализующего фактора (CRF). По-следний, как известно, усиливает секрецию АКТГ гипофизом с последую-щим усилением освобождения глюкокортикоидов надпочечниками.
Глюкокортикоиды снижают продукцию многих провоспалительных цито-кинов в клетках мононуклеарной фагоцитирующей системы и в лимфоидной ткани, подавляют активность Тh1 и продукцию ими ИЛ-2, -интерферона, стимулируют апоптоз тимоцитов и периферических антигенстимулирован-ных лимфоцитов. Снижение продукции -интерферона приводит к подавле-нию макрофагальной реакции.
Защитный характер иммуносупрессии, обеспечиваемый глюкокор-тикоидами, заключается еще и в том, что беспредельная активация продук-ции цитокинов при септической инфекции может явиться одним из факторов развития бактериально-токсического шока и гибели организма.
Индуцируемый различными факторами, в том числе и глюкокор-тикоидами, апоптоз является генетически запрограммированной гибелью лимфоцитов, связавших антиген вне связи с МНС или другими необходимы-ми сигналами. Морфологически апоптоз проявляется постепенной фрагмен-тацией ДНК, ядра, цитоплазматических структур, которые остаются окру-женными цитоплазматической мембраной, не поступают в межклеточное пространство и, соответственно, не индуцируют развитие воспаления.
Академия Естествознания приняла участие в Московском Международном Салоне образования-2021

Академия Естествознания приняла участие в состоявшейся в Москве 33-ей Международной книжной ярмарке.

Российская Академия Естествознания приняла участие в прошедшей 27-29 октября 2020 года в г. Барселоне (Испания) международной книжной выставке LIBER MADRID 2021.
Проведены вебинары Наука и образование в современной России. Оформление документов

Российская Академия Естествознания приняла участие в прошедшей 13-15 октября 2021 года в г. Мадрид (Испания) международной книжной выставке LIBER MADRID 2021.
Понятие иммунодефицита, его виды. Основные причины и механизм формирования вторичных иммунодефицитов. Классификация и клинические признаки приобретенных нарушений иммунитета. Этиологические факторы вторичной иммуносупрессии. Методы стимуляции иммунитета.
| Рубрика | Медицина |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 25.11.2014 |
| Размер файла | 639,2 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Иммунодефицит: общие понятия
В иммунной системе, как и в любой другой системе организма, возможны различные поломки, в результате которых она начинает функционировать неправильно, в результате чего иммунитет снижается, и развивается иммунная недостаточность (иммунодефицит).
Иммунодефицит - это нарушение структуры и функции какого-либо звена целостной иммунной системы, потеря организмом способности сопротивляться любым инфекциям и восстанавливать нарушения своих органов. Кроме того, при иммунодефиците замедляется или вообще останавливается процесс обновления организма.
При иммунодефиците человек становится беззащитным не только перед обычными инфекциями, как грипп или дизентерия, но также перед бактериями и вирусами, которые ранее не могли вызвать заболевания, так как иммунная система не позволяла им размножаться в большом количестве. Один из примеров - пневмоциста карини - бактерия, живущая в легких практически каждого человека. При здоровой иммунной системе она не причиняет человеку никакого вреда, но при иммунодефиците может вызвать серьезное поражение легких - пневмоцистную пневмонию.
Кроме того, иммунодефицит приводит к обострению тех хронических заболеваний, которые были у человека, но не имели ярко выраженных симптомов и, может быть, никогда бы не привели к серьезным проблемам со здоровьем.
Иммунодефицит - врожденный или приобретенный дефект иммунной системы, проявляющийся резким снижением количества отдельных популяций иммунокомпетентных клеток или нарушением синтеза иммуноглобулинов (агаммаглобулинемия).
Повреждение или недостаточность функции одного или нескольких звеньев в иммунной системе приводит к нарушению иммунного ответа, к той форме иммунопатологии, которая получила название иммунодефицитных состояний.
Все иммунодефицитные состояния делятся на две большие группы:
- врожденный (наследственно обусловленный) иммунодефицит и
Иммунодефицит вторичный (приобретенный)
Приобретенный (вторичный) иммунодефицит возникает в течение жизни пациентов и является результатом действия на организм целого ряда химических, радиоактивных, медикаментозных и других веществ, а также влияния вирусных инфекций, хронических воспалительных процессов, сложных операций, травм, стресса. Приобретенные иммунодефициты представляют собой группу заболеваний, в основе которых лежат нарушения либо отдельных звеньев иммунитета, либо комплексное повреждение этой системы под влиянием факторов внешней среды или патологических процессов, в своей этиологии не связанных с иммунной системой, но оказывающих на нее подавляющее действие.
иммунодефицит вторичный этиологический лечение
Факторы, способные вызвать вторичный иммунодефицит, весьма разнообразны. Вторичный иммунодефицит может быть вызван как факторами внешней среды, так и внутренними факторами организма. В целом, все неблагоприятные факторы окружающей среды, способные нарушить обмен веществ организма, могут стать причиной развития вторичного иммунодефицита. К наиболее распространенным факторам окружающей среды, вызывающим иммунодефицит относятся загрязнения окружающей среды, ионизирующее и СВЧ излучение, отравления, длительный прием некоторых лекарственных препаратов, хронический стресс и переутомление. Общей чертой описанных выше факторов является комплексное негативное воздействие на все системы организма, в том числе и на иммунную систему. Кроме того, такие факторы как ионизирующее излучение оказывают избирательное ингибирующее действие на иммунитет связанное с угнетением системы кроветворения. Люди, проживающие или работающие в условиях загрязненной окружающей среды, чаще болеют различными инфекционными заболеваниями и чаще страдают онкологическими болезнями. Очевидно, что такое повышение заболеваемости у этой категории людей связано со снижением активности иммунной системы.
Причины
Вторичные иммунодефициты являются частым осложнением многих заболеваний и состояний. Основные причины вторичных ИДС:
· дефект питания и общее истощение организма также приводит к снижению иммунитета. На фоне общего истощения организма нарушается работа всех внутренних органов. Иммунная система особенно чувствительна к недостатку витаминов, минералов и питательных веществ, так как осуществление иммунной защиты это энергоемкий процесс. Часто снижение иммунитета наблюдается во время сезонной витаминной недостаточности (зима-весна)
· хронические бактериальные и вирусные инфекции, а также паразитарные инвазии (туберкулез, стафилококкоз, пневмококкоз, герпес, хронические вирусные гепатиты, краснуха, ВИЧ, малярия, токсоплазмоз, лейшманиоз, аскаридоз и др.). При различных хронических заболеваниях инфекционного характера иммунная система претерпевает серьезные изменения: нарушается иммунореактивность, развивается повышенная сенсибилизация по отношению к различным антигенам микробов. Кроме того, на фоне хронического инфекционного процесса наблюдается интоксикация организма и угнетение функции кроветворения. Иммунодефицит во время инфекции ВИЧ опосредован избирательным поражением клеток иммунной системы вирусом
· гельминтозы
· потеря факторов иммунной защиты наблюдается во время сильных потерь крови, при ожогах или при заболеваниях почек (протеинурия, ХПН). Общей особенностью этих патологий является значительная потеря плазмы крови или растворенных в ней белков, часть их которых является иммуноглобулинами и другими компонентами иммунной системы (белки системы комплимента, C-реактивный белок). Во время кровотечений теряется не только плазма, но и клетки крови, поэтому на фоне сильного кровотечения снижение иммунитета имеет комбинированный характер (клеточно-гуморальный)
· диарейный синдром
· стресс-синдром
· тяжелые травмы и операции также протекают со снижением функции иммунной системы. Вообще любое серьезное заболевание организма приводит к вторичному иммунодефициту. Отчасти это связано с нарушением обмена веществ и интоксикацией организма, а отчасти с тем, что во время травм или операций выделяются большие количества гормонов надпочечников, которые угнетают функцию иммунной системы
· эндокринопатии (СД, гипотиреоз, гипертиреоз) приводят к снижению иммунитета за счет нарушения обмена веществ организма. Наиболее выраженное снижение иммунной реактивности организма наблюдается при сахарном диабете и гипотиреозе. При этих заболеваниях снижается выработка энергии в тканях, что приводит к нарушению процессов деления и дифференциации клеток, в том числе и клеток иммунной системы. На фоне сахарного диабета частота различных инфекционных заболеваний значительно повышается. Связано это не только с угнетением функции иммунной системы, но и с тем, что повышенное содержание глюкозы в крови больных диабетом стимулирует размножение бактерий
· прием различных лекарственных препаратов и наркотических средств оказывает выраженное иммунодепрессивное действие. Особенно выражено снижение иммунной защиты во время приема цитостатиков, глюкокортикоидных гормонов, антиметаболитов, антибиотиков
· низкая масса тела при рождении
· снижение иммунной защиты у людей старческого возраста, беременных женщин и детей связано с возрастными и физиологическими особенностями организма этих категорий людей
· злокачественные новообразования - нарушают деятельность всех систем организма. Наиболее выраженное снижение иммунитета наблюдается в случае злокачественных заболеваний крови (лейкемия) и при замещении красного костного мозга метастазами опухолей. На фоне лейкемии количество иммунных клеток в крови порой повышается в десятки, сотни и тысячи раз, однако эти клетки нефункциональны и потому не могут обеспечить нормальной иммунной защиты организма
· аутоиммунные заболевания возникают из-за нарушения функции иммунной системы. На фоне заболеваний этого типа и при их лечении иммунная система работает недостаточно и, порой, неправильно, что приводит к повреждению собственных тканей и неспособности побороть инфекцию
Классификация вторичных иммунодефицитов
I. Комбинированные ВИД.
1. Общий лимфоцитопенический синдром.
2. Синдром поликлональной активации лимфоцитов.
3. Общий вариабельный иммунодефицит.
4. Синдром гиперплазии лимфоидной ткани (лимфоаденопатии, тимико-лимфатический синдром, тонзилогенный синдром).
5. Посттонзилэктомический синдром.
II. Т-клеточные ВИД.
1. Т-лимфоцитопенический синдром.
2. Синдром Т-клеточного иммунорегуляторного дисбаланса.
3. Дефициты интерлейкинов, лимфокинов и их рецепторов.
III. В-клеточные ВИД.
1. Общий вариабельный В-клеточный иммунодефицит.
IV. Дефициты мононуклеарно-фагоцитарной системы.
2. Дефициты рецепторов и адгезинов нейтрофилов.
3. Дефициты фагоцитоза.
V. Дефициты молекул взаимодействия лейкоцитов.
VI. Дефициты системы комплемента.
1. Синдром гипокомплементемии.
2. Дефициты отдельных факторов.
VII. Дефициты нормальных киллеров.
VIII. Дефициты неспецифических факторов иммунитета.
IX. Метаболические ВИД.
Этиологические факторы приобретённых иммунодефицитов
- инфекции (ВИЧ, вирус Эпштейн-Барр, ЦМВ, протозойные и глистные инвазии и др.);
- акцидентальная инволюция тимуса у детей;
- тимомегалия у детей;
- возрастная недостаточность тимуса;
- продолжительное стрессовое воздействие;
- длительная неадекватная физическая нагрузка на организм;
- резкая смена условий жизни (дисадаптационный синдром);
- оперативное вмешательство, травмы;
- патологические состояния, связанные с потерей белка (ожоговая болезнь, экссудативные энтеропатии и др.);
- патология обмена веществ (сахарный диабет, гипербилирубинемия, дефицит микроэлементов и.т.д.);
- эндокринопатии (нарушение межсистемных связей гормональной-нервной-иммунной);
- онкопатология (онкологические процессы сопровождаются резким угнетением иммунной системы);
- проживание в экологически неблагоприятных условиях;
- работа в условиях профвредностей;
- физические факторы воздействия: СВЧ-облучение, ионизирующая радиация, избыточная инсоляция и др.;
- иммуносупрессивная терапия (лучевая терапия, химиопрепараты, клюкокортикостероиды, НСПВ, некоторые антибиотики и др.).
Кроме того, изменения в иммуной системе наблюдаются в детском возрасте и связаны с особенностями формирования, становления иммунной системы. Физиологическая иммуносупрессия определяется у женщин во время беременности. Периоды гормональной перестройки организма могут сопровождаться изменениями в иммунном статусе. Снижение иммунологической реактивности наблюдается в старости.
Выделяют следующие особенности ВИД:
- ВИД возникают при действии на иммунокомпетентный организм практически любого неблагоприятного внешнего фактора как инфекционной, так и неинфекционной природы;
- ВИД в большинстве случаев имеют обратное развитие, если действие пускового фактора прекращается (исключение СПИД, лучевая болезнь);
- ВИД являются динамическими процессами, характеризующимся последовательной сменой разных форм иммунологической недостаточности;
- ВИД служит входными воротами для патогенных и УП организмов. С ВИД ассоциируется развитие многих вторичных инфекций;
- ВИД обнаруживается при основных формах патологии человека (эндокринные заболевания, аутоиммунные болезни, онкологические процессы, аллергопатология, оперативные вмешательства и.т.д)
- ВИД в большом проценте случаев выявляется у населения, проживающего или работающего в экологически неблагоприятных условиях.
Вторичные иммунодефициты могут сформироваться в любом возрасте. Клинически чаще всего проявляют себя инфекционным синдромом либо сочетанием инфекционного и аллергического. При наличии генетической предрасположенности могут проявлять себя изолированно аллергическим, онкологическим синдромами. В отличие от первичных вторичные иммунодефициты в большинстве своём обратимые состояния и "благодарные" в плане лечения. При вторичных ИДС широко применяется иммуностимулирующая, иммуномодулирующая терапия. При первичных ИДС проводится в основном заместительная терапия.
o Признаки вторичного иммунодефицита
o Признаки вторичного иммунодефицита являются предвестниками аллергических проявлений или заболеваний. Поэтому необходимо обратить внимание на них и обратится к врачу - иммунологу, который определит степень нарушений. При небольших изменениях иммунитета не потребуется радикального вмешательства, так как организм человека имеет способность самовосстанавливаться. Однако при серьезных нарушениях врач назначит иммуномодулирующую терапию.
o Признаками вторичного иммунодефицита могут считаться следующие отклонения в здоровье:
o Частые простуды (2 и более раз в месяц), а также простудные заболевания, не поддающиеся традиционной терапии и протекающие на фоне субфебрильной температуры (37,0 - 37,5С) или вообще без ее повышения, осложнения в виде гайморитов, бронхитов и пневмоний.
o Рецидивирующая герпесвирусная инфекция разной локализации - на губах, на половых органах (генитальный герпес), коже (герпес зостер).
o Рецидивирующий папилломатоз - бородавки разной локализации.
o Рецидивирующие грибковые инфекции ногтей, кожи стоп и ладоней.
o Кандидоз слизистых.
o Дисбактериоз кишечника.
o Впервые возникшая лекарственная аллергия.
Лечение вторичных ИДС
Механизмы подавления иммунитета при вторичных ИДС различны, и, как правило, имеется сочетание нескольких механизмов, нарушения иммунной системы выражены в меньшей степени, чем при первичных. Как правило, вторичные иммунодефициты носят приходящий характер. В связи с этим лечение вторичных иммунодефицитов гораздо проще и эффективнее по сравнению с лечением первичных нарушений функции иммунной системы. Обычно лечение вторичного иммунодефицита начинают с определения и устранения причины его возникновения. Например, лечение иммунодефицита на фоне хронических инфекций начинают с санации очагов хронического воспаления. Иммунодефицит на фоне витаминно-минеральной недостаточности начинают лечить при помощи комплексов витаминов и минералов. Восстановительные способности иммунной системы велики, поэтому устранение причины иммунодефицита, как правило, приводит к восстановлению иммунной системы. Для ускорения выздоровления и стимуляции иммунитета проводят курс лечения иммуностимулирующими препаратами. В настоящее время известно большое число иммуностимулирующих препаратов, с различными механизмами действия.
Подобные документы
Патология местного иммунитета. Малые или компенсированные аномалии иммунной системы. Танзиторные (преходящие) формы ИДС. Этиологические факторы приобретённых иммунодефицитов. Классификация вторичных иммунодефицитов. Причины аутоиммунной реакции.
реферат [42,2 K], добавлен 30.11.2010
Понятие, виды иммунитета в зависимости от механизма развития и факторы, способствующие его ослаблению. Главные и вторичные органы иммунной системы. Признаки и причины иммунодефицитного состояния. Семь простых правил укрепления и повышения иммунитета.
научная работа [24,2 K], добавлен 27.01.2009
Врожденные нарушения системы иммунитета. Классификация первичных иммунодефицитов. Длительно удерживающаяся гипертермическая реакция. Использование заместительной терапии и трансплантации костного мозга. Постоянная профилактика инфекционных заболеваний.
презентация [136,4 K], добавлен 12.01.2015
Вирус иммунодефицита человека; история и общая характеристика ВИЧ-инфекции: этиология, патогенез, группы риска. Генетические факторы иммунитета к ВИЧ. Клиническая классификация, стадии инфекционного процесса. Лечение и профилактика ВИЧ-инфекции и СПИД.
реферат [49,0 K], добавлен 21.04.2015
Понятие и причины возникновения приобретенного (вторичного) иммунодефицита. Факторы, неспецифически снижающие иммунореактивность. Факторы окружающей среды, непосредственно и косвенно воздействующие на развитие вторичного иммунодефицита (по Белозерову).
Что такое метаболический синдром? Причины возникновения, диагностику и методы лечения разберем в статье доктора Чернышев А. В., кардиолога со стажем в 33 года.
Над статьей доктора Чернышев А. В. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Метаболический синдром (синдром Reaven) представляет собой симптомокомплекс, сочетающий в себе абдоминальное ожирение, инсулинорезистентность, гипергликемию (повышенное содержание глюкозы в крови), дислипидемию и артериальную гипертензию. Все эти нарушения связаны в одну патогенетическую цепь. Кроме того, такой синдром часто сочетается с гиперурикемией (избытком мочевой кислоты в крови), нарушением гемостаза (свёртываемости крови), субклиническим воспалением, синдромом обструктивного апноэ-гипопноэ сна (остановкой дыхания во сне). [4]
Метаболический синдром – хроническое, распространённое (до 35% в российской популяции), полиэтиологическое заболевание (возникающее по многим причинам), в котором главная роль принадлежит поведенческим факторам (гиподинамия, нерациональное питание, стресс). Имеет значение также наследственная предрасположенность к артериальной гипертензии, атеросклероззависимым заболеваниям и сахарному диабету второго типа. [5]
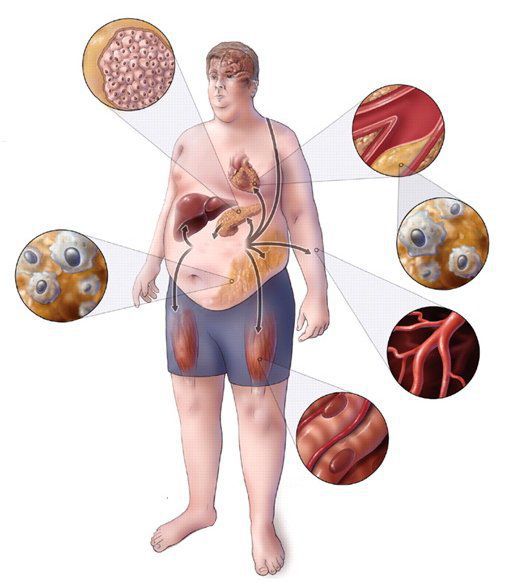
Практикующим врачам важно выделять группу риска метаболического синдрома. К данной группе относятся пациенты с начальными признаками заболевания и его осложнениями: артериальная гипертензия, углеводные изменения, ожирение и повышенное питание, ишемическая болезнь сердца, атеросклеротические заболевания периферических и мозговых артерий, нарушение пуринового обмена, жировая болезнь печени; синдром поликистозных яичников; постменопаузальный период у женщин и эректильная дисфункция у мужчин; гиподинамия, злоупотребление алкоголем, табакокурение, наследственная отягощенность по сердечно-сосудистым и обменным заболеваниям. [3] [7]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы метаболического синдрома
Клинические проявления метаболического синдрома соответствуют симптомам его составляющих:
- абдоминального ожирения;
- артериальной гипертензии;
- изменениям углеводного, липидного и пуринового обмена.
Если изменения составляющих синдрома Reaven носят субклинический характер (что встречается довольно часто), то и течение заболевания носит асимптомный характер.
Патогенез метаболического синдрома
Классификация и стадии развития метаболического синдрома
Чёткой классификации и стадийности метаболического синдрома не существует. Его деление некоторыми авторами на полный, включающий все составляющие синдрома, и неполный представляется необоснованным. Несмотря на это, выраженность симптомов, количество компонентов синдрома Reaven и наличие осложнений оказывают влияние на стратификацию риска и выбор тактики лечения у конкретного пациента. Для этого следует учитывать:
- степень ожирения и артериальной гипертензии;
- выраженность метаболических изменений;
- наличие или отсутствие сахарного диабета и заболеваний, связанных с атеросклерозом.
В зависимости от индекса массы тела (ИМТ), который рассчитывается делением веса (кг) на рост (м 2 ), классифицируются следующие типы массы тела (МТ):
-
нормальная МТ — ИМТ ≥18,5
Второй тип ожирения является более патогенным в плане риска возникновения сердечно-сосудистых заболеваний и сахарного диабета. Это связано с ожирением внутренних органов, в том числе печени (висцеральное ожирение, неалкогольная жировая болезнь печени), снижением сатурации крови кислородом из-за перехода дыхания на грудной, поверхностный тип и эндокринной активностью висцеральной жировой ткани с патологическим изменением выработки адипокинов (лептин, грелин, адипонектин). Выявлена чёткая корреляция между увеличением абдоминальной жировой ткани и индекса массы тела с риском сопутствующих заболеваний. Считается, что риски начинают нарастать при увеличении окружности талии (ОТ) >80 см у женщин и 94 см у мужчин, а при ОТ >88 см и 102 см соответственно риск возрастает значительно.
Осложнения метаболического синдрома
Так как метаболический синдром является сочетанием факторов риска сердечно-сосудистых и обменных заболеваний, именно эти патологии и являются его осложнениями. Речь идёт, в первую очередь, о сахарном диабете, ишемической болезни сердца и их осложнениях: диабетическая ангио-, нейро- и нефропатия, острая коронарная недостаточность, сердечная недостаточность, нарушение сердечного ритма и проводимости, внезапная сердечная смерть, цереброваскулярные заболевания и болезни периферических артерий. [17] Прогрессирование артериальной гипертензии также приводит к поражению органов-мишеней и ассоциированным клиническим состояниям.
Диагностика метаболического синдрома
Для диагностики метаболического синдрома необходимо выявить у пациента основной признак — абдоминальное ожирение по измерению ОТ (>80 см у женщин и >94 см у мужчин) и хотя бы два дополнительных критерия, которые включают в себя:
- артериальную гипертензию (артериальное давление ≥140/90 мм рт.ст.);
- липидные показатели (ммоль/л) — повышение концентрации в крови триглицеридов ≥1,7; снижение ХС ЛПВП 3,0;
- углеводные показатели (ммоль/л) — гипергликемия натощак ≥6,1 и НТГ 7,8 – [8]
В клинических условиях нужно дифференцировать метаболический синдром от механического сочетания факторов риска, например артериальной гипертензии, избыточной массы тела без признаков абдоминального ожирения и повышения уровня ОХ крови, что встречается довольно часто (до 30%). В сомнительных случаях рекомендовано дополнительное определение инсулинорезистентности по следующим методикам:
- оценка базальной гиперинсулинемии в крови натощак (гиперинсулинемия — >18 мкед/мл);
- показатель HOMA-IR — произведение значения инсулина натощак (мкед/мл) на величину глюкозы (ммоль/л), разделить на 22,5 (значение большее, чем 2,27, считается инсулинорезистентностью);
- индекс Caro — соотношение тощаковой глюкозы (в ммоль/л) к инсулину (в мкед/мл) (инсулинорезистентность – значение [12]
Лечение метаболического синдрома
Лечение метаболического синдрома следует разделить на немедикаментозное и медикаментозное.
Немедикаментозное лечение синдрома Reaven — это ведение здорового образа жизни, отказ от курения и злоупотребления алкоголем, оптимальная двигательная активность [14] , рациональное питание, а также разумное использование природных и преформированных физических лечебных факторов (массаж, подводный душ-массаж, гипокситерапия и гиперкапния, водолечение, талассотерапия, бальнео- и термотерапия, внутренний прём минеральных вод, общие магнитотерапевтические воздействия) [15] , психотерапевтических методик и обучающих программ. [13]
Медикаментозное лечение метаболического синдрома, в зависимости от наличия тех или иных его компонентов, может включать гиполипидемические, антигипертензивные препараты, медикаменты для снижения инсулинорезистентности, постпрандиальной гипергликемии и веса.
Основными препаратами, которые используют при лечении артериальной гипертензии у больных синдромом Reaven и сахарным диабетом, являются ингибиторы ангиотензинпревращающего фермента, сартаны и агонисты имидазолиновых рецепторов. Однако для достижения целевого уровня артериального давления часто необходимо сочетание различных классов медикаментов, таких как пролонгированных блокаторов медленных кальциевых каналов, высокоселективных бета-адреноблокаторов и тиазидоподобных диуретиков (индапамид) в сочетании с медикаментами первой линии. [10]
Для коррекции нарушений липидного обмена при метаболическом синдроме первоначально используются статины, возможно их сочетание с эзетролом и фибратами. Основной механизм действия статинов — снижение внутриклеточного синтеза ОХ за счёт обратимого блокирования фермента 3-гидрокси-3-метилглютарил-кофермент А редуктазы. Оно ведёт к увеличению количества рецепторов к ХС-ЛПНП на поверхности гепатоцита и снижению концентрации ХС-ЛПНП в крови. Помимо этого, статины имеют плейотропные эффекты, такие как антитромбогенный, противовоспалительный, улучшение функции эндотелия, что приводит к стабилизации атеросклеротической бляшки. Современные статины способны вместе со снижением ХС-ЛПНП до 55% уменьшать триглицериды до 30% и повышать ХС-ЛПВП до 12%. В то же время, ключевое достоинство статинотерапии — снижение сердечно-сосудистых осложнений и общей смертности [1] . Эффективней всего использовать аторвастатин (10-80 мг/сут) или розувастатин (5-40 мг/сут). [11]
При неэффективности монотерапии статинами целесообразно присоединение эзетрола в дозе 10 мг/сут, который препятствует всасыванию ОХ в кишечнике и может усиливать снижение ХС-ЛПНП на 15-20%.
Фибраты — ещё один класс липидснижающих препаратов. Они расщепляют богатые триглицеридами жировые частицы, снижают синтез свободных жирных кислот и повышают ХС-ЛПВП путём увеличения распада ЛНП. Это приводит к значительному уменьшению триглицеридов (до 50%), ХС-ЛПНП (до 20%) и увеличению ХС-ЛПВП (до 30%). Фибраты также имеют плейотропные эффекты: снижают концентрацию мочевой кислоты, фибриногена и улучшают инсулиночувствительность, однако их положительное влияние на прогноз пациентов не доказано. Наиболее эффективный и безопасный препарат этой группы — фенофибрат 145 мг/сут.
Для снижения инсулинорезистентности препаратом выбора является метформин, который обладает доказанным положительным эффектом на тканевую инсулинорезистентность через усиление поглощения глюкозы тканями-мишенями. Метформин уменьшает скорость всасывания углеводов в тонкой кишке, оказывает периферическое анорексигенное действие, уменьшает продукцию глюкозы печенью, улучшает транспорт глюкозы внутри клеток. Положительное воздействие метформина (1500-3000 мг/сутки) на конечные точки обусловлено снижением инсулинорезистентности, системными метаболическими эффектами (снижение веса, липидных нарушений, факторов свёртываемости крови и т.д.). [9]
Для снижения постпрандиальной гипергликемии используют акарбозу, которая обратимо блокирует глюкоамилазы, сахарозы и мальтазы в верхнем отделе тонкой кишки. В итоге непереваренные углеводы достигают нижние отделы кишечника, и абсорбция углеводов пролонгируется. Вместе с тем, у акарбозы выявлены дополнительные эффекты. В исследовании STOP-NIDDM (2002 год) у больных метаболическим синдромом, принимающих акарбозу дозировкой 300 мг/сут, продемонстрировано снижение развития сахарного диабета на 36%, новых случаев артериальной гипертензии на 34% и суммарного показателя сердечно-сосудистых событий на 46% [6] .
При наличии у пациента с синдромом Reaven сахарного диабета второго типа могут применяться современные классы сахароснижающих препаратов, такие как аналог глюкагоноподобного пептида-1, ингибитор дипептидилпептидазы-4 и ингибитор натрийзависимого переносчика глюкозы второго типа. Представитель последнего класса эмпаглифлозин (Джардинс) в исследовании EMPA-REG OUTCOME (2016 год) снизил сердечно-сосудистую смертность у больных сахарным диабетом второго типа на 36%.
Медикаментозная коррекция морбидного ожирения показана, если немедикаментозное лечение не приводит к снижению массы тела более чем на 5% от исходного. Препараты для лечения ожирения делятся на аноретики центрального действия (сибутрамин), и средства, воздействующие на желудочно-кишечный тракт, например орлистат (Ксеникал).
Препарат для снижения аппетита сибутрамин в меньшей степени воздействует на дофаминовые и холинергические процессы, но уменьшает потребление жиров и углеводов, что приводит к похудению и улучшает жировой и углеводный метаболизм. Артериальное давление и частота сердечных сокращений при этом повышается только на 5%.
Орлистат является ингибитором желудочной и панкреатической липаз, вследствие чего треть пищевых триглицеридов не всасывается и снижается их концентрация в крови, что приводит к уменьшению калоража пищи и веса. Кроме того, снижается артериальное давление, уровень глюкозы и инсулинорезистентности.
В медицинской практике лечение метаболического синдрома зависит от наличия и выраженности его компонентов. В таблице ниже показана тактика подбора терапии при вариантах синдрома Reaven, которые встречаются наиболее часто.
Читайте также:

