Малая аномалия развития сердца реферат
Обновлено: 02.07.2024
В последние годы большое внимание уделяется дисплазии соединительной ткани (ДСТ) у детей. Под ДСТ понимают врожденную аномалию соединительно-тканной структуры различных органов и систем, в основе которой лежит снижение содержания отдельных
В последние годы большое внимание уделяется дисплазии соединительной ткани (ДСТ) у детей. Под ДСТ понимают врожденную аномалию соединительно-тканной структуры различных органов и систем, в основе которой лежит снижение содержания отдельных видов коллагена и/или нарушение их соотношения, приводящее к снижению прочности соединительной ткани [12, 13, 24, 26].
В развитии ДСТ принимают участие эндогенные (хромосомные и генетические дефекты) и экзогенные (неблагоприятная экологическая обстановка, неадекватное питание, стрессы) факторы [12, 30, 43]. Особенность морфогенеза соединительной ткани заключается в том, что она участвует в формировании каркаса сердца практически на всех этапах онтогенеза, следовательно, влияние любого повреждающего фактора может привести к развитию ДСТ сердца [15].
В 1990 г. в классификации заболеваний сердечно-сосудистой системы Нью-Йоркской ассоциации кардиологов, а также в Омске, на симпозиуме, посвященном проблеме дисплазии соединительной ткани, был впервые выделен синдром ДСТ сердца, сопровождающий как дифференцированные, так и недифференцированные ДСТ. При синдроме ДСТ сердца в патологический процесс вовлекается его соединительно-тканный каркас — сердечные клапаны (атриовентрикулярные, полулунные, евстахиев клапан), подклапанный аппарат, перегородки сердца и магистральные сосуды.
Классификация МАРС по С. Ф. Гнусаеву, 2001 (с изменениями)
предсердия и межпредсердная перегородка: пролабирующий клапан нижней полой вены, увеличенный евстахиев клапан более 1 см, открытое овальное окно, небольшая аневризма межпредсердной перегородки, пролабирующие гребенчатые мышцы в правом предсердии;
трикуспидальный клапан: смещение септальной створки в полость правого желудочка в пределах 10 мм, дилатация правого атриовентрикулярного отверстия, пролапс трикуспидального клапана;
легочная артерия: дилатация ствола легочной артерии, пролапс створок;
аорта: погранично узкий и широкий корень аорты, дилатация синуса Вальсальвы, двустворчатый клапан аорты, асимметрия и пролапс створок клапана аорты;
левый желудочек: трабекулы (поперечная, продольная, диагональная), небольшая аневризма межжелудочковой перегородки;
До сих пор нет единого мнения о клиническом значении МАРС, многие из которых имеют нестабильный характер, связанный с ростом ребенка. Так, возможно обратное развитие увеличенного евстахиева клапана, пролабирующих гребенчатых мышц в правом предсердии, пролапса митрального клапана (ПМК), закрытие открытого овального окна, нормализация длины хорд митрального клапана и диаметра магистральных сосудов. В ряде случаев МАРС изменяются не только в качественном, но и в количественном отношении [3]. Превышение установленного порогового уровня сердечной стигматизации у здоровых детей (более 3 МАРС), по мнению С. Ф. Гнусаева (1995), свидетельствует о возможном неблагополучии как в отношении факторов, влияющих на формирование здоровья, так и показателей, характеризующих его [8].
Клиническая значимость патологии соединительной ткани у лиц с ДСТ подтверждается данными о высокой частоте нейровегетативных расстройств, изменений центральной нервной системы (энурез, дефекты речи, вегетососудистая дистония (ВСД)), нарушений психики [5, 12, 24]. Как правило, у таких пациентов всегда выявляется ВСД, что, вероятно, обусловлено наследуемыми (наследственными) особенностями структуры и функции лимбико-ретикулярного комплекса, определяющими аномальный характер нейровегетативных реакций [12]. Е. В. Буланкиной (2002) установлена отчетливая взаимосвязь между вегетативной дисфункцией и ДСТ [4]. При этом выраженность диспластических изменений сочеталась с тяжестью процессов дезадаптации регуляторных механизмов и снижением стрессовой устойчивости организма. Наиболее распространенными проявлениями вегетативной дисфункции являются цефалгии, вегетативные кризы, вегетовисцеральные пароксизмы, пре- и синкопальные состояния [12, 16]. Согласно данным С. Ф. Гнусаева (1995), у лиц с ПМК выявлена недостаточность сегментарных вегетативных структур [8]. Исследования Т. М. Домницкой (2000) позволили установить прямую зависимость между ПМК, аномально расположенными трабекулами (АРТ) и распространенностью невротических (невротические реакции, невроз навязчивых состояний, панические расстройства) и энцефалопатических (церебрастенический синдром, заикание, тики, нарушения сна, энурез, гипердинамический синдром, страхи) расстройств [10].
Нередко МАРС сопровождают такие патологические состояния, как нарушения сердечного ритма и проводимости, в том числе синдром ранней реполяризации, синдром слабости синусового узла, синдром Вольф–Паркинсон–Уайта, повышение электрической активности левого желудочка, блокада правой ножки пучка Гиса, экстрасистолия и пароксизмальная тахикардия [4, 6, 8, 34]. По данным Л. А. Балыковой и соавт. (2002), у 90% больных с нарушениями сердечного ритма с помощью эхографии были выявлены МАРС (преимущественно ПМК) [2]. Однако не все МАРС сопровождаются нарушениями сердечного ритма и (или) могут являться их причиной. К аритмогенным МАРС относятся фиброзно-мышечные аномально расположенные хорды (АРХ) и АРТ, ПМК и пролапс трикуспидального клапана (ПТК), аневризма межпредсердной перегородки, увеличенный и/или пролабирующий евстахиев клапан.
Наличие проводящих кардиомиоцитов в фиброзно-мышечных АРХ и АРТ формирует дополнительные проводящие пути, чем объясняется происхождение импульса, опережающего внутрижелудочковое проведение и вызывающего раннее возбуждение прилежащих к нему сегментов с последующей их более ранней реполяризацией [12, 15, 19, 20, 28]. Имеется гистологическое подтверждение наличия проводящих клеток в АРТ с диагонально-базальной, срединно-поперечной и продольной локализацией и в АРХ, соединяющих базальные септальные отделы и боковую стенку левого желудочка [3, 10, 33]. M. Suwa и соавт. (1986) отметили возрастание частоты желудочковых экстрасистол с увеличением толщины хорды. По мнению E. Chesler и соавт. (1983), появление желудочковых экстрасистол связано с миксоматозно измененными хордами, вызывающими механическое раздражение стенки левого желудочка [27]. Факт аритмогенности АРХ и АРТ также подтверждается исчезновением у пациентов экстрасистолии в случае их самостоятельного разрыва или оперативного рассечения либо при физической нагрузке, когда уменьшается степень их натяжения [8, 10, 12]. Довольно распространенным нарушением сердечного ритма при АРХ и АРТ является и синдром раннего возбуждения желудочков [6, 12].
Аритмии при ПМК и ПТК, по данным разных авторов, встречаются от 15 до 90% случаев [11]. Среди причин аритмий рассматриваются вегетативные дисфункции, механическая стимуляция эндокарда, дефицит внутритканевого магния, психологический стресс и миксоматозная дегенерация створок клапанов [3, 10–12, 18, 27, 29, 37, 39]. Установлена прямая корреляционная зависимость между частотой, а также степенью тяжести нарушений ритма и глубиной ПМК [1]. Ряд авторов полагают, что причиной развития аритмий при ПМК и ПТК может являться турбулентный поток, возникающий в результате регургитации через клапанное кольцо во время систолы желудочков, особенно при ПТК, когда происходит механическое раздражение зоны синусового узла [3, 8, 23]. Возможным механизмом развития желудочковых экстрасистол при ПМК большинство исследователей считают избыточное натяжение папиллярных мышц вследствие их аномальной тракции при пролабировании створок [12, 14, 25, 38].
Развитие аритмий может провоцировать пролабирующий евстахиев клапан и аневризма межпредсердной перегородки: условия для возникновения аритмий возникают в результате их холмистых движений и рефлекторного раздражения ими пейсмекерных образований в правом предсердии [42].
Согласно исследованиям О. А. Дианова (1999), нарушения сердечного ритма встречались у детей с погранично узкой аортой, у которых в 32,4% случаев регистрировалась суправентрикулярная и в 10,8% — желудочковая экстрасистолии, свидетельствующие о декомпенсации адаптации, особенно в условиях физической нагрузки [4].
По данным Ю. М. Белозерова, дети с МАРС отличаются сниженными возможностями кардиогемодинамики и демонстрируют плохую переносимость физических нагрузок [3]. По данным Н. А. Мазура, установлена связь между ПМК и синдромом внезапной смерти у взрослых. Накоплено достаточно сведений о том, что дети с МАРС относятся к группе риска по развитию инфекционного эндокардита.
Таким образом, существующие результаты исследований о том, что МАРС в ряде случаев являются основой кардиоваскулярной патологии у детей. В то же время неоправданным было бы преувеличение их роли в функциональных нарушениях сердечно-сосудистой системы. Очевидно, в каждом конкретном случае значимость структурных аномалий сердца должна рассматриваться индивидуально.
Принципы терапии детей с МАРС еще до конца не сформулированы. Однако на сегодняшний день можно предложить следующую тактику ведения детей с МАРС:
- Комплексная оценка состояния здоровья, включающая различные виды исследования детей.
- Выбор терапии в зависимости от клинико-электрофизиологических и эхокардиографических изменений.
- Применение препаратов, направленных на нормализацию метаболизма соединительной ткани.
- Определение адекватной физической активности в зависимости от функционального состояния миокарда.
Общепризнанным является применение немедикаментозных методов лечения, включающих:
Вопрос о допуске к занятиям спортом решается индивидуально. При наличии ПМК необходимо учитывать семейный анамнез (случаи внезапной смерти у родственников), наличие жалоб на сердцебиения, кардиалгии; синкопальные состояния; изменения на ЭКГ (нарушения сердечного ритма, синдром укороченного и удлиненного QT) являются основанием для принятия решения о противопоказании спортивных тренировок. Это касается и наличия АРХ, АРТ с синдромом раннего возбуждения желудочков, которые, являясь аритмогенными МАРС, могут спровоцировать нарушения сердечного ритма у спортсменов в условиях физического и психоэмоционального напряжения.
Медикаментозное лечение включает применение:
- препаратов магния;
- кардиотрофической терапии (при нарушении процессов реполяризации в миокарде);
- антибактериальной терапии при обострении очагов инфекции, оперативных вмешательствах (профилактика инфекционного эндокардита);
- антиаритмических препаратов (по показаниям, при чистой групповой экстрасистолии с нарушением процессов реполяризации).
В настоящее время терапия препаратами магния при МАРС приближается к патогенетической. Это обусловлено тем, что магний входит в состав основного вещества соединительной ткани и необходим для правильного формирования волокон коллагена. В условиях магниевой недостаточности нарушается способность фибробластов продуцировать коллаген [29, 31]. Кроме того, магний оказывает мембраностабилизирующее действие, удерживает калий внутри клетки, препятствует симпатикотоническим влияниям, что делает возможным его применение для лечения нарушений сердечного ритма [40, 41].
В работах О. Б. Степуры (1999), О. Д. Остроумовой и соавт. (2004) имеются сведения о достоверном уменьшении степени ПМК, симптомов ВСД, количества желудочковых экстрасистол на фоне терапии препаратами магния [17, 18].
Целесообразным может быть признано назначение следующих препаратов:
Магнерота, содержащего соль магния и оротовую кислоту. Последняя не только усиливает реабсорбцию Mg в кишечнике, но и обладает самостоятельным метаболическим действием. Детям назначают по 500 мг магнерота (32,8 мг магния 3 раза в день в течение 1 нед, затем 250 мг 3 раза в день в течение последующих 5 нед. Принимается препарат за 1 ч до еды).
Магне В6. Выпускается в таблетках (48 мг магния или в растворе для приема внутрь (100 мг магния). Детям с массой тела более 10 кг (старше 1 года) — 5–10 мг/кг/сутки в 2–3 приема. Детям старше 12 лет — 3–4 табл. в сут, в 2–3 приема. Продолжительность курса 6–8 нед.
Калия оротата. Детям препарат назначают из расчета 10–20 мг/кг/сут в 2–3 приема за 1 ч до еды или через 4 ч после еды. Продолжительность курса — 1 мес.
Следует проводить повторные курсы терапии этими препаратами (3–4 раза в год).
Для улучшения клеточной энергетикии миокарда применяют препараты, обладающие комплексным влиянием на метаболические процессы в организме, а также являющиеся активными антиоксидантами и мембраностабилизаторами:
- L-карнитин (элькар — 20% раствор карнитина гидрохлорида). Дозы: 1–6 лет по 0,1 г/сут (14 капель) 3 раза в день; 6–12 лет — 0,2–0,3 г/сут (1/4 ч. л.) 3 раза в день. Курс — 1–1,5 мес.
- Коэнзим Q10 (убихинон) назначается детям старше 12 лет по 1 капсуле (500 мг) 1–2 раза в сут. К препаратам, содержащим убихинон, относится кудесан: по 1 капле на год жизни (до 12 лет), далее по 12 капель 1 раз в день. Продолжительность курса должна составлять не менее 1 мес.
- Цитохром С (цито-мак). Выпускается в ампулах (по 4 мл = 15 мг). Назначают внутримышечно по 4 мл, № 10. Проводится 2–4 курса в год.
Кроме указанных препаратов для улучшения метаболических процессов в соединительной ткани, миокарде и в организме в целом показано применение:
- никотинамида (витамин PP) — 20 мг/сут 1,5–2 мес;
- рибофлавина (витамин В2) — 10– 15 мг/сут 1,5–2 мес;
- тиамина (витамин В1) — 10 мг/сут и липоевой кислотой 100–500 мг/сут 1,5 мес;
- лимонтара (комплекс лимонной и янтарной кислоты) 5 мг/кг/сут 3–4 дня еженедельно в течение 2 мес;
- биотина — 2–5 мг/сутки — 1,5–2 мес.
Показаны повторные курсы лечения (до 3 раз в год).
При наличии ВСД проводится комплексная длительная терапия по восстановлению баланса между симпатическим и парасимпатическим отделами вегетативной нервной системы (дифференцированная фитотерапия, вегетотропные препараты, ноотропы, вазоактивные препараты — кавинтон, вазобрал, инстенон, циннаризин и др.).
Таким образом, все вышесказанное позволяет сделать вывод, что МАРС, являясь висцеральным проявлением дисплазии соединительной ткани, составляют морфологическую основу функциональных изменений сердечной деятельности и нейровегетативных расстройств. Выбор индивидуальной программы курсового лечения способствует улучшению обменных процессов в соединительной ткани и профилактирует возможные осложнения ДСТ у детей и подростков.
По вопросам литературы обращайтесь в редакцию.
Н. А. Коровина, доктор медицинских наук, профессор
А. А. Тарасова, кандидат медицинских наук, доцент
Т. М. Творогова, кандидат медицинских наук, доцент
Л. П. Гаврюшова, кандидат медицинских наук, доцент
М. С. Дзис
РМАПО, Москва
Малые аномалии развития сердца — это группа врожденных или приобретенных структурных нарушений миокарда и прилегающих к нему магистральных сосудов, которые не приводят к явным нарушениям гемодинамики, но иногда провоцируют развитие патологических состояний в течение жизни. Могут осложняться внезапной кардиальной смертью, бактериальным эндокардитом, митральной, трикуспидальной недостаточностью, разрывом хорд. При значимых отклонениях внутрисердечной гемодинамики от нормы отмечается цианоз кожи, одышка, быстрая утомляемость, редкие загрудинные боли. Лечение чаще консервативное, по показаниям осуществляются кардиохирургические операции.
МКБ-10
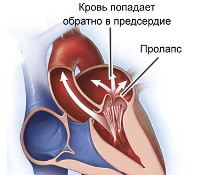
Общие сведения
Малые аномалии сердца (МАС) широко распространены, представляют собой разнородную группу патологических состояний, обусловленных изменениями соединительной ткани сердца. Рассматриваются как частный случай висцеральных соединительнотканных дисплазий, нередко сочетаются с дисплазией кожи, костно-мышечной системы, других внутренних органов. В 96-99% случаев не обнаруживаются при осмотре, остаются недиагностированными или выявляются случайно при обследовании по поводу другой патологии. Встречаемость у новорожденных колеблется от 40 до 69%. Чаще страдают мальчики – 58% от общего числа детей с установленными нарушениями. Самыми часто диагностируемыми отклонениями от нормы являются дефект межпредсердной перегородки (26%) и функционирующий артериальный проток (6%).

Причины
В настоящее время МАС рассматриваются как полиэтиологическое состояние, которое возникает под действием различных факторов и приводит к стойким анатомическим или функциональным дефектам соединительнотканных структур, являющихся основой сердечного каркаса. Большинство подобных дефектов обусловлено дисплазией соединительной ткани (ДСТ). Основными причинами развития МАС считаются:
- Недифференцированная ДСТ. Является обширной группой состояний, не укладывающихся в картину определенных наследственных болезней. Отличается полиморфностью проявлений. Наряду с поражением сердца часто обнаруживается гипермобильность суставов, вегето-сосудистые расстройства, нарушения со стороны внутренних органов различной степени выраженности.
- Наследственные заболевания. Включают группу генных и хромосомных патологий, характеризующихся нарушением дифференцировки клеток соединительной ткани, изменением их нормальной структуры, снижением функции, дефицитом энзимов, каркасных белков и гликопротеинов. Примерами являются синдромы Марфана, Элерса-Данлоса.
- Патология беременности. Отклонения от нормы возникают на этапе внутриутробного развития, обычно связаны с нарушением закладки органов на ранних сроках — до 8 недели. Доступные исследования не позволяют диагностировать отклонения ввиду малого их размера. Предрасполагающими факторами кардиальной патологии становятся употребление будущей матерью алкоголя и наркотиков, курение.
- Экзогенные влияния. Нерезко выраженные малые патологии миокарда могут формироваться у детей, имеющих изначально здоровое сердце. Особое значение в этом случае отводится неблагоприятному состоянию окружающей среды, воздействию вредоносных химических соединений, инфекционным заболеваниям. Патологические состояния, как правило, диагностируются в возрасте до трех лет, имеют скудную симптоматику. С возрастом возможно ухудшение самочувствия.
Патогенез
Классификация
Малые аномалии представляют собой патологии собственно сердечной мышцы и прилегающих магистральных артерий. Нарушения систематизируют по локализации дефекта с последующим уточнением наличия гемодинамических нарушений и степени их выраженности. Выделяют шесть основных групп изменений миокарда и сосудов, которые определяются с помощью ультразвукового исследования сердца:
Симптомы
У 96% пациентов система кровообращения и организм в целом никак не страдают от стромальных дефектов, клиническая симптоматика отсутствует. При значимом поражении различных кардиальных отделов могут определяться неспецифические проявления: цианоз кожи, особенно – в области носогубного треугольника, быстрая утомляемость, одышка, незначительные редко возникающие кардиальные боли. Чаще всего малые аномалии манифестируют в период гормональной перестройки (подростковый период, беременность). Наблюдается тахикардия, аритмии, давящие ощущения за грудиной, тошнота, снижение физической выносливости, головные боли и головокружения. Возможно появление признаков вегетососудистой дистонии, в том числе субфебрильное повышение температуры тела.
У новорожденных патология может проявляться частым глубоким дыханием, ускорением сокращений сердца при кормлении, купании. Существуют симптомы, характерные для отдельных дефектов. Добавочные хорды левого желудочка становятся этиологическим фактором синусовой тахикардии. Регургитация крови из-за неплотного смыкания трикуспидального клапана или ее нефизиологическая циркуляция при открытом овальном окне могут приводить к застойным явлениям в малом круге кровообращения, что сопровождается выраженной одышкой даже при незначительной физической активности.
Осложнения
Несмотря на отсутствие прямого патологического влияния, малые аномалии снижают общую резистентность миокарда к воздействию повреждающих факторов, что повышает риск формирования сердечно-сосудистых патологий. К примеру, на фоне пролапса митрального клапана развивается до 30% всех инфекционных эндокардитов, вероятность внезапной смерти при массивной регургитации повышается в 50 раз, особенно у молодых людей обоих полов. У отдельных пациентов возникают фатальные нарушения ритма, проводимости, наблюдается образование аневризм аорты и коронарных артерий с их последующим разрывом. Дегенерация клапанных структур становится предрасполагающим фактором атеросклероза и кальциноза, которые сопровождаются сужением просвета отверстий (стенозом) между полостями сердца и/или сосудами.
Диагностика
Иногда врачу-кардиологу удается заподозрить наличие малых аномалий при проведении первичного осмотра, однако это происходит только при обнаружении характерной достаточно выраженной симптоматики, сопутствующих состояний. Патология сердца, обусловленная соединительнотканной дисплазией, у детей раннего возраста часто сопровождается грыжами, врожденными вывихами суставов, их повышенной мобильностью, удлиненными конечностями и пальцами на руках, ногах, деформациями грудной клетки. Аускультативно изменения миокарда проявляют себя шумами во время систолы или определением нескольких звуковых феноменов одновременно. В качестве дополнительных методов исследования обычно используются:
Лечение малых аномалий сердца
Лечение патологии необходимо лишь в тех случаях, когда диспластические явления в сердце влияют на его работу, функционирование магистральных сосудов. При отсутствии симптоматики рекомендуется общая профилактика сердечно-сосудистых заболеваний с ежегодным посещением кардиолога для консультации и проведения УЗИ. Выделяют несколько направлений коррекции состояния пациентов:
- Немедикаментозная терапия. Из-за выраженности вегетативных проявлений существенную роль в улучшении состояния больного играют мероприятия по нормализации образа жизни. Пациенту или его родителям разъясняют важность соблюдения режима труда и отдыха в соответствии с возрастными особенностями, необходимость исключить переутомление, стрессы и чрезмерные физические нагрузки, обеспечить здоровое сбалансированное питание. Дополнительно назначают массаж, лечебную гимнастику, водные процедуры, по показаниям – консультации психолога.
- Медикаментозное лечение. Требуется при существенных нарушениях внутрисердечной циркуляции крови или множественных аномалиях органа. Обычно применяют препараты калия и магния, медикаменты, улучающие доставку и потребление миокардом кислорода (убихинон, цитохром С, карнитин), витамины (В1, В2, В3, РР), кардиопротекторы (триметазидин, таурин, никорандил). При аритмиях, нарушениях проводимости используют антиаритмические средства (амиодарон, бета-адреноблокаторы, прокаинамид).
- Хирургические методы. Показаны, если у пациента выявляются массивные гемодинамические нарушения с потенциальным развитием жизнеугрожающих осложнений. Аномалии межжелудочковой, межпредсердной перегородки оперируют в условиях искусственного кровообращения, гипотермии. Небольшие дефекты ушивают, крупные закрывают искусственным барьером из синтетических или биоорганических материалов. При стенозах, пролапсах клапанов выполняют их протезирование.
Прогноз и профилактика
Поскольку малые аномалии в большинстве случаев никак не сказываются на состоянии здоровья больного, прогноз почти всегда благоприятный. При наличии нарушений оперативное вмешательство позволяет полностью устранить последствия дисплазии и предупредить развитие осложнений. Общая летальность при применении хирургических методик не превышает 1%. Первичная профилактика предусматривает исключение вредных влияний на плод и ребенка в первые годы жизни, вторичная заключается в предупреждении возможных осложнений, включает регулярные (1-2 раза в год) осмотры кардиолога с проведением инструментальных исследований. Рекомендуется соблюдение здорового образа жизни, отказ от вредных привычек, дозирование физических нагрузок, правильное питание с большим количеством овощей и фруктов, ограничением жиров и соли, избегание стрессовых ситуаций.
1. Малые аномалии сердца (клиническое значение, диагностика, осложнения)/ Бова А.А., Трисветова Е.Л. - 2001.
2. Малые аномалии сердца/ Земцовский Э.В., Малев Э.Г., Лобанов М.Ю., Парфенова Н.Н., Реева С.В., Хасанова С.И, Беляева Е.Л.// Российский кардиологический журнал. - 2012 - №1(93).
3. Малые аномалии сердца: диагностика и клиническое течение// Романова Е.Н., Говорин А.В. Забайкальский медицинский вестник. — 2009 — №2.
4. Малые аномалии развития сердца и их значение в генезе нарушений сердечного ритма у детей и подростков: Автореферат диссертации/ Сурова О.В. - 2005.
Малые аномалии развития сердца (МАРС) считают вариантами нормы или пограничными состояниями. Однако МАРС могут с годами сами становиться причиной развития самых разнообразных осложнений или усугублять другие патологические состояния или заболевания. Цель исследования. Выявить распространенность и структуру МАРС у детей и подростков по данным ЭхоКГ. Материал и методы исследования. Были проанализированы результаты 3552 ЭхоКГ детей и подростков в возрасте от 1 года до 16 лет, проведенных в отделении ультразвуковой диагностики клиники Рост ГМУ в период с 2009 по 2013 гг. Результаты исследования и их обсуждение. Выявлены МАРС в следующих группах: аномалий предсердий и межпредсердной перегородки, аорты, левого желудочка и митрального клапана. Выводы. 1.Частота встречаемости малых аномалий развития сердца остается стабильной за последние пять лет. 2.Наиболее часто выявляются малые аномалии левого желудочка: дополнительные хорды и трабекулы, пролапс митрального клапана.

2. Гнусаев С.Ф., Белозеров Ю.М. Эхокардиографические критерии малых аномалий сердца // Ультразвуковая диагностика.- 1997.- № 3. - С.23-27.
4. Мутафьян О.А. Пороки и малые аномалии сердца у детей и подростков. СПб: Изд. дом СПбМАПО, 2005.-480 с.
6. Eidem B.W., Cetta F., O′Leary P.W. Echocardiography in Pediatric and Adult Congenital Heart Disease. Philadelphia, 2009.- 500 p.
Малые аномалии развития сердца (МАРС) анатомические изменения архитектоники сердца и магистральных сосудов, причиной возникновения которых является наследственно детерминированная соединительнотканная дисплазия сердца 3. МАРС в ряде случаев являются основой кардиоваскулярной патологии у детей, вместе с тем, некоторые исследователи считают их вариантами нормы или пограничными состояниями. Однако МАРС могут с годами сами становиться причиной развития самых разнообразных осложнений или усугублять другие патологические состояния или заболевания [6]. Превышение установленного порогового уровня сердечной стигматизации у здоровых детей (более 3 малых аномалий развития сердца) свидетельствует о возможном неблагополучии как в отношении факторов, влияющих на формирование здоровья, так и показателей, характеризующих его [2]. Частота выявления их при эхокардиографическом исследовании (ЭхоКГ) среди детей и подростков колеблется от 39 до 68,9 % [2, 6].
Цель исследования. Выявить распространенность и структуру МАРС у детей и подростков по данным ЭхоКГ.
Материал и методы исследования. Были проанализированы результаты 3552 ЭхоКГ детей и подростков в возрасте от 1 года до 16 лет, проведенных в отделении ультразвуковой диагностики клиники Рост ГМУ в период с 2009 по 2013 гг.
Исследования проводили на ультразвуковых сканерах в B-режиме, режимах импульсно-волновой, постоянно-волновой и цветовой допплерографии. Статистическая обработка полученных результатов проводилась методами вариационной статистики, все значения результатов обработаны с использованием компьютерных стандартных программ Microsoft Windows VISTA , Microsoft Excel 2007.
Результаты исследования и их обсуждение. В соответствие с классификацией [2] были выявлены МАРС в следующих группах: аномалий предсердий и межпредсердной перегородки, аорты, левого желудочка и митрального клапана.
1.Аномалии предсердий и межпредсердной перегородки: увеличенная заслонка нижней полой вены более 1 см, открытое овальное окно (рис.1), небольшая аневризма межпредсердной перегородки (рис.2).
Рис.1. Ультразвуковая томограмма сердца. Апикальная четырехкамерная позиция. Открытое овальное окно. RA – правое предсердия, RV – правый желудочек, LA – левое предсердие, LV – левый желудочек.
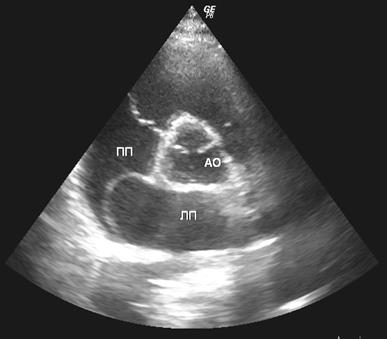
Рис.2. Ультразвуковая томограмма сердца. Парастернальная позиция по короткой оси левого желудочка на уровне аортального клапана. Аневризма межпредсердной перегородки. АО – восходящая аорта, ЛП – левое предсердие, ПП – правое предсердие.
2.Аномалии аорты: дилатация синусов Вальсальвы, клапан аорты с двумя (рис.3) или четырьмя заслонками (рис.4), асимметрия заслонок клапана аорты, пролабирование заслонок клапана аорты.
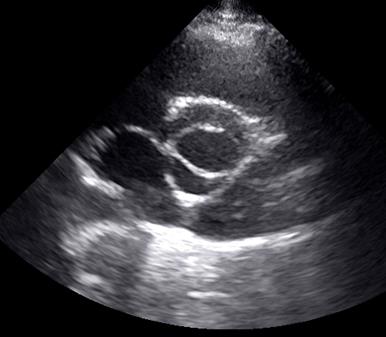
Рис.3. Ультразвуковая томограмма сердца. Парастернальная позиция по короткой оси левого желудочка на уровне аортального клапана. Двустворчатый аортальный клапан.
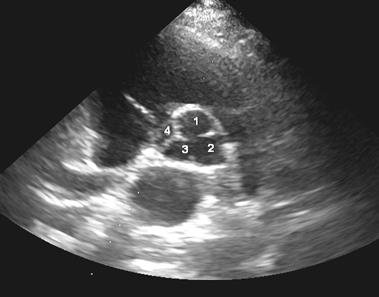
Рис.4. Ультразвуковая томограмма сердца. Парастернальная позиция по короткой оси левого желудочка на уровне аортального клапана. Четырехстворчатый (1-4) аортальный клапан.
3.Аномалии левого желудочка: деформация выносящего тракта желудочка с систолическим валиком в верхней трети межжелудочковой перегородки, разнонаправленные трабекулы в полости левого желудочка (рис.5), небольшая аневризма межжелудочковой перегородки.
Рис.5. Ультразвуковая томограмма сердца. Парастернальная позиция по короткой оси левого желудочка на уровне митрального клапана. Малая аномалия развития – дополнительная хорда в полости левого желудочка. RV – правый желудочек, LV – левый желудочек.
4.Аномалии митрального клапана: пролабирование митрального клапана (рис.6), эктопия крепление сухожильных хорд створок клапана, аномальное расположение оснований сосочковых мышц.
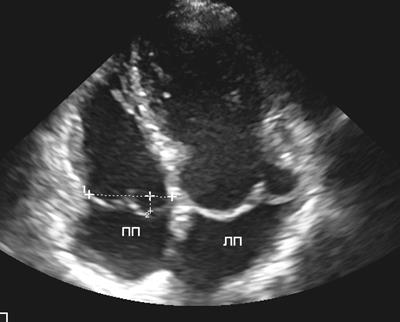
Рис. 6. Пролапс митрального и трехстворчатого клапанов. Апикальная четырехкамерная позиция.
Выявлены следующие малые аномалии развитиях сердца: ложные хорды левого желудочка и дополнительные трабекулы - 2900 случаев (81,6%), увеличенный евстахиев клапан - 398 случаев (11%), аневризма межпредсердной перегородки - 62 случая (2%), пролабирование митрального клапана (ПМК) - 693 случая (19,5%), дилятация синусов Вальсальвы – 129 случаев (3,6%), асимметрия створок клапана аорты – 78 случаев (2,1%), открытое овальное окно – у 28 ребенка (0,78%). Причем, у 3161 ребенка (70,8% от всех выявленных МАРС), выявлено различное сочетание аномалий. Так одновременно были диагностированы ПМК и ложные хорды левого желудочка (693 случая - 19,5%), ПМК (498 случаев – 12%), ложные хорды левого желудочка и увеличенный евстахиев клапан (352 случая - 8%).
Малые аномалии развития сердца (МАРС) — анатомические врождённые изменения сердца и магистральных сосудов, не приводящие к грубым нарушениям функций ССС. Ряд МАРС имеет нестабильный характер и с возрастом исчезает. Частота — 2,2–10% в популяции, у детей с различной сердечной патологией — 10–25%, увеличивается при наследственных заболеваниях соединительной ткани. Преобладающий возраст — дети первых 3 лет жизни. Этиология. Наследственно детерминированная соединительнотканная дисплазия. Ряд МАРС имеют дизэмбриогенетический характер. Не исключается воздействие различных экологических факторов (химическое, физическое воздействие).
Сопутствующая патология • Синдром Марфана • Синдром Элерса–Данло–Русакова • Первичный гипогонадизм • Синдром Бехчета • Врождённые пороки сердца (ВПС) • Аритмии сердца • Инфекционный эндокардит • Клапанная регургитация.
Диагностические критерии • Анамнестические данные (профессиональные вредности, алкоголизм матери в период беременности, заболевания соединительной ткани в семье и др.) • Признаки диспластического развития (внешние малые аномалии развития — короткая шея, высокое нёбо и др.) • Характерная аускультативная картина в зависимости от варианта МАРС • Изменения на ЭКГ • ЭхоКГ-критерии • Рентгенологические критерии.
Дифференциальная диагностика • ВПС • Большие аномалии развития сердца.
Функциональная значимость • Зависит от возраста пациента, варианта МАРС, наличия сопутствующих заболеваний • Маркёр дизэмбриогенетического развития сердца • Предрасполагают к развитию аритмий, клапанной регургитации, левожелудочковой дисфункции.
Лечение определяют вариант МАРС и сопутствующая патология.
Сокращение. МАРС — малые аномалии развития сердца
МКБ-10. Q20.9 Врождённая аномалия сердечных камер и соединений неуточненная
Примечание. Большие аномалии развития сердца — анатомические изменения сердца и магистральных сосудов, сопровождающиеся грубыми нарушениями функций ССС (например, пролапс митрального клапана с регургитацией III степени).
Код вставки на сайт
Малые аномалии развития сердца (МАРС) — анатомические врождённые изменения сердца и магистральных сосудов, не приводящие к грубым нарушениям функций ССС. Ряд МАРС имеет нестабильный характер и с возрастом исчезает. Частота — 2,2–10% в популяции, у детей с различной сердечной патологией — 10–25%, увеличивается при наследственных заболеваниях соединительной ткани. Преобладающий возраст — дети первых 3 лет жизни. Этиология. Наследственно детерминированная соединительнотканная дисплазия. Ряд МАРС имеют дизэмбриогенетический характер. Не исключается воздействие различных экологических факторов (химическое, физическое воздействие).
Сопутствующая патология • Синдром Марфана • Синдром Элерса–Данло–Русакова • Первичный гипогонадизм • Синдром Бехчета • Врождённые пороки сердца (ВПС) • Аритмии сердца • Инфекционный эндокардит • Клапанная регургитация.
Диагностические критерии • Анамнестические данные (профессиональные вредности, алкоголизм матери в период беременности, заболевания соединительной ткани в семье и др.) • Признаки диспластического развития (внешние малые аномалии развития — короткая шея, высокое нёбо и др.) • Характерная аускультативная картина в зависимости от варианта МАРС • Изменения на ЭКГ • ЭхоКГ-критерии • Рентгенологические критерии.
Дифференциальная диагностика • ВПС • Большие аномалии развития сердца.
Функциональная значимость • Зависит от возраста пациента, варианта МАРС, наличия сопутствующих заболеваний • Маркёр дизэмбриогенетического развития сердца • Предрасполагают к развитию аритмий, клапанной регургитации, левожелудочковой дисфункции.
Лечение определяют вариант МАРС и сопутствующая патология.
Сокращение. МАРС — малые аномалии развития сердца
МКБ-10. Q20.9 Врождённая аномалия сердечных камер и соединений неуточненная
Примечание. Большие аномалии развития сердца — анатомические изменения сердца и магистральных сосудов, сопровождающиеся грубыми нарушениями функций ССС (например, пролапс митрального клапана с регургитацией III степени).
Читайте также:

