Люминесцентный метод анализа реферат
Обновлено: 05.07.2024
Люминесцентным анализом называется обнаружение и исследование различных объектов с помощью явлений люминесценции. Наиболее важной задачей люминесцентного анализа является определение химического состава исследуемых веществ и установление процентного содержания в них отдельных компонентов. Анализ такого вида носит соответственно название качественного и количественного химического люминесцентного анализа.
Качественный химический люминесцентный анализ основан на том, что люминесцентные свойства являются характерным признаком излучающего вещества, тесно связанным с его составом, общим состоянием и структурой его молекул.
Количественный химический люминесцентный анализ основан на использовании определенной зависимости между интенсивностью люминесценции и концентрацией люминесцентного вещества. В большинстве случаев условия анализа подбираются так, чтобы осуществлялась пропорциональность между интенсивностью свечения и концентрацией вещества. Однако такая зависимость имеет место лишь в случаях, когда концентрации невелики. При высоких концентрациях определяемого вещества для осуществления анализа приходится тем или иным способом учитывать сложную зависимость интенсивности свечения от концентрации.
К люминесцентному анализу относится также изучение структуры и колебательных частот молекул по спектрам излучения, создающее фундамент для качественного люминесцентного анализа.
Чисто химические задачи не исчерпывают возможностей люминесцентного анализа. С его помощью можно обнаруживать и выявлять различные объекты и их детали, изучение которых оказывается невозможным при обычных условиях наблюдения и освещения. Люминесцентный анализ такого рода получил название люминесцентного анализа обнаружения или сортового люминесцентного анализа.
В то время как при химическом и эмиссионном спектральном анализе анализируемые вещества разлагаются, при люминесцентном анализе они, как правило, не подвергаются изменениям и их можно использовать в дальнейшей работе. Это преимущество люминесцентного анализа особенно существенно при исследовании трудно синтезируемых уникальных веществ, получаемых в ничтожных количествах. В отдельных случаях возбуждения люминесценции коротковолновыми ультрафиолетовыми лучами в веществе могут происходить фотохимические превращения. Однако соответствующим подбором условий опыта эти трудности обычно могут быть обойдены.
Перечисленные свойства люминесцентного анализа дают представление о его исключительных возможностях, в определенных отношениях значительно превосходящих возможности других видов анализа. Однако следует отметить, что необычайно высокая чувствительность люминесцентного анализа одновременно создает и серьезные трудности его проведения, существенно ограничивая области его применения. Присутствие в образце даже ничтожных количеств люминесцирующих примесей обусловливает появление нового свечения, которое накладывается на люминесценцию основного вещества, искажая как спектральный состав, так и интенсивность его излучения. Поэтому значительные успехи в применении люминесцентного анализа могли быть достигнуты лишь на основе всестороннего развития учения о люминесценции в целом, после того как были установлены общие законы свечения и накоплен большой материал о люминесцентных свойствах различных классов соединений.
Наиболее распространенным и хорошо разработанным является люминесцентный анализ, основанный на возбуждении фотолюминесценции. При анализе кристаллических неорганических веществ (минералов, алмазов и др.) применяют катодное и рентгеновское возбуждения. В отдельных случаях в аналитических целях используют явления хемилюминесценции и радиолюминесценции.
1.9 Рентгенофлуоресцентный метод
Метод основан на зависимости интенсивности рентгеновской флуоресценции от концентрации элемента в образце. При облучении образца мощным потоком излучения рентгеновской трубки возникает характеристическое флуоресцентное излучение атомов, которое пропорционально их концентрации в образце. Излучение разлагается в спектр при помощи кристалл-анализаторов, далее с помощью детекторов и счетной электроники измеряется его интенсивность. Математическая обработка спектра позволяет проводить количественный и качественный анализ.
1.10 Рентгеновская флуоресценция
Когда атомы образца облучаются фотонами с высокой энергией - возбуждающим первичным излучением рентгеновской трубки, это вызывает испускание электронов. Электроны покидают атом. Как следствие, в одной или более электронных орбиталях образуются "дырки" - вакансии, благодаря чему атомы переходят в возбужденное состояние, т.е. становятся нестабильны. Через миллионные доли секунды атомы возвращаются к стабильному состоянию когда вакансии во внутренних орбиталях заполняются электронами из внешних орбиталей. Такой переход сопровождается испусканием энергии в виде вторичного фотона - этот феномен и называется "флуоресценция''. Энергия вторичного фотона находится в диапазоне энергий рентгеновского излучения, которое располагается в спектре электромагнитных колебаний между ультрафиолетом и гамма-излучением.


Различные электронные орбитали обозначаются K, L, M и т.д., где К – орбиталь, ближайшая к ядру. Каждой орбитали электрона в атоме каждого элемента соответствует собственный энергетический уровень. Энергия испускаемого вторичного фотона определяется разницей между энергией начальной и конечной орбиталей, между которыми произошел переход электрона.

Длина волны испускаемого фотона связана с энергией формулой E = E1-E2 = hc/l , где E1 и E2 – энергии орбиталей, между которыми произошел переход электрона, h – постоянная Планка, с - скорость света, l - длина волны испускаемого(вторичного) фотона. Таким образом, длина волны флуоресценции является индивидуальной характеристикой каждого элемента и называется характеристической флуоресценцией. В то же время интенсивность (число фотонов, поступающих за единицу времени) пропорциональна концентрации (количеству атомов) соответствующего элемента. Это дает возможность элементного анализа вещества: определение количества атомов каждого элемента, входящего в состав образца.
ГЛАВА 2. ОБЛАСТИ ПРИМЕНЕНИЯ ФЛУОМЕТРИИ В АНАЛИЗЕ ОБЪЕКТОВ ОКРУЖАЮЩЕЙ СРЕДЫ
Сегодня люминесцентный метод анализа охватывает широкий круг методов определения разнообразных объектов от простых ионов и молекул до высокомолекулярных соединений и биологических объектов. Детектируется люминесценция самого объекта или его производных, возможно также использование изменения люминесценции специфичных агентов. Для сложных проб люминесцентное детектирование сочетается с химическим разделением (хроматография, электрофорез) или с биологическим выделением (иммуноанализ, метод полимеразной цепной реакции - ПЦР).
2.1 Важные для химического анализа свойства люминесценции
1. Возможность различения объектов по способам возбуждения люминесценции и его параметрам, например:
§ фотолюминесценция (спектр возбуждения)
§ хемилюминесценция (параметры реакции)
§ перенос энергии (характер донорно-акцепторного взаимодействия и условия возбуждения донора).
2. Возможность различения объектов по параметрам излучения:
§ кинетика высвечивания (при импульсном возбуждении фотолюминесценции или при импульсном смешении хемилюминесцентных реагентов)
3. Возможность регистрации люминесценции в отсутствии иных свечений в спектральном диапазоне регистрации.
4. Интенсивность люминесценции прямо пропорциональна интенсивности возбуждения.
5. Параметры люминесценции молекул и ионов в конденсированной среде, как правило, сильно зависят от свойств матрицы и, в первую очередь, ближайшего окружения.
Благодаря этим особенностям, достигнуты очень низкие пределы определения (до 1 ppt и ниже) и высокая селективность (например, разделение ПАУ).
Выбор оптимальных условий градуирования методик рентгенофлуоресцентного анализа (РФА) фильтров, нагруженных атмосферными аэрозолями
Для определения тяжелых металлов в атмосферных аэрозолях, собранных на фильтр, метод РФА является одним из самых перспективных. Однако градуирование методик РФА и контроль правильности результатов анализа затруднен из-за отсутствия отечественных стандартных образцов (СО) состава аэрозолей. Решение этой проблемы видится в создании синтетических СО и изыскании способов учета различия физико-химических свойств СО и реальных проб.
Испытано два приема приготовления СО: осаждение порошкового препарата на фильтр; введение порошка в раствор полимера и получение из смеси тонкой пленки. В качестве носителя частиц аэрозоля использован материал ГСО почв с добавками соединений тяжелых металлов. Первый прием оказался мало пригодным из-за потерь определяемых компонентов и неоднородности распределения порошка по фильтру: при нагрузке менее 5 мкг/см 2 (соответствует пробам аэрозолей) погрешность получения СО характеризуется относительным стандартным отклонением, равным 0,3. Для пленочных СО эта погрешность, обусловленная неоднородностью пленки по составу и толщине, не превышает 0,07.
Изучено влияние крупности D частиц порошкового препарата в пленочном образце на интенсивность Ii флуоресценции в области средних и коротких длин волн. Установлено, что для пленок на основе мономинеральной фракции при уменьшении D от 60 до 5 мкм Ii возрастает на 60 %. Для смеси минералов это изменение не превышает 30 %, для ГСО почв зависимость Ii =f(D) выражена слабо. Рекомендовано порошок, используемый при изготовлении СО доизмельчать со спиртом в агатовой ступке в течение 3 ч.
Для учета различия физико-химических свойств пленочных СО и реальных проб аэрозолей испытаны способы РФА, использующие в качестве корректирующих параметров интенсивность I рассеянного излучения, измеренного на различных участках рентгеновского спектра и интенсивность Iп флуоресценции атомов подложки, помещенной под анализируемый образец. Даны рекомендации по выбору оптимальных условий градуирования методики РФА аэрозолей.
Определение содержания вещества в пробе люминесцентным методом основано на сравнении интенсивности люминесценции пробы и стандартных образцов. Последние должны отвечать ряду требований:
1. содержание определяемого вещества в стандартном образце должно быть точно известно;
2. химический состав матрицы (основы) стандартного образца должен быть идентичен (или подобен в практически достижимой мере) матрице пробы;
3. стандартный образец и проба должны обладать близкими физическими свойствами.
Содержание
Вложенные файлы: 1 файл
физикохим4.doc
1. Люминесцентные методы анализа………………………………………5
3. Аппаратура для люминесцентных измерений…… ……………………13
4. Практическое применение………………………………………………15
Люминесценция – это излучение ,представляющая собой избыток над тепловым излучением тела при данной температуре и обладающее длительностью не менее чем 10-10с,что превышает период светового колебания.
Первая часть определения предложено Э.Видоманом и отделяет люминесценцию от равновесного теплового излучения. Вторая часть – признак длительности – введена С.И. Вавиловым для того, чтобы отделить люминесценцию от других явлений вторичного свечения – отражения и рассеяния света ,а так же от вынужденного испускания ,тормозного излучения заряженных частиц.
От излучения нагретых тел она отличается своей неравновесностью: люминесценция практически не использует тепловую энергию излучающей систему, поэтому ее часто называют холодным светом. Это определение отличает люминесценцию также от всех других видов неравновесного свечения – рассеяния и отражения света, комбинационного рассеяния, излучения Вавилова – Черенкова и т.д.
Люминесценция возникает в результате электронного перехода при возвращении частиц из возбужденного состояния в нормальное. Таким образом, молекула преобразует поглощенную энергию в собственное излучение. Этим люминесценция также отличается от несобственного излучения – рассеяния и отражения света. Люминесцирующие вещества могут находиться в любом агрегатном состоянии. В возбужденное состояние частицы люминесцирующего вещества могут переходить под действием света и тогда люминесцирующие называют фотолюминесценцией( флуоресценцией или фосфоресценцией),под действием рентгеновского излучения – рентгенолюминесценцией, в результате химической реакции – хемилюминесценцией и т.д.
Условия, в которых возбуждаются и светят частицы люминесцентного вещест ва, совершенно отличны от условий, в которых находятся частицы раскаленного тела. В то время как при нагревании тела увеличивается энергия всех его частиц, при возбуждении люминесценции энергию получают лишь отдельные частицы, остающиеся в окружении огромного числа невозбужденных частиц.
Наиболее простым способом возбуждение люминесценции является освещение люминесцентного вещества ультрафиолетовыми лучами и коротковолновыми лучами видимого света; при этом в каждый данный момент свет поглощает лишь некоторые частицы люминесцентного вещества, которое и приходят в возбужденное состояние. Кроме того, как указывал С.И. Вавилов важным признаком люминесценции ее заметная длительность по сравнению со световыми колебаниями, имеющим период 10-10 сек.
Свечение люминесценции продолжается, по крайней мере десятимиллиардную долю секунды после прекращения возбуждения, т.е. энергия, поглощенная частицами вещества, не излучается мгновенно. Этим люминесценция отличается от других видов свечения, например от излучения поверхностей, отражающих и рассеивающих свет какого-нибудь постороннего источника.
Природное применение люминесцентного свечения – наблюдали еще первобытные люди, но более конкретное, сознательное описание явлений и их способностей началось более нескольких веков назад.
Систематические количественные исследование холодного свечения, были начаты более века назад трудами английского физика Э.Беккереля.
Следует отметить, что два величайших открытия конца XIX века: лучей Рентгена и радиоактивности неразрывно связаны с исследованием люминесценции.
1. Люминесцентные методы анализа
Определение содержания вещества в пробе люминесцентным методом основано на сравнении интенсивности люминесценции пробы и стандартных образцов. Последние должны отвечать ряду требований:
1. содержание определяемого вещества в стандартном образце должно быть точно известно;
2. химический состав матрицы (основы) стандартного образца должен быть идентичен (или подобен в практически достижимой мере) матрице пробы;
3. стандартный образец и проба должны обладать близкими физическими свойствами.
В практике люминесцентного анализа используют как жидкие, так и твердые стандартные образцы. Жидкие стандартные образцы готовят растворением определяемого вещества в подходящем растворителе. При этом в раствор добавляют в необходимых количествах вещества, составляющие основу пробы. Применение люминесценции кристаллофосфоров для определения неорганических веществ связано с использованием твердых стандартных образцов. Как правило, процедура их приготовления трудоемка, требует тщательности и особых мер предосторожности и обычно проводится на специальной аппаратуре.
Для расчета содержания вещества в пробе по результатам люминесцентных измерений чаще всего используют метод градуировочного графика, сравненияидобавок.
Метод градуировочного графика. В этом методе измеряют интенсивность люминесценции серии стандартных образцов (обычно не менее пяти), охватывающих весь диапазон ожидаемых содержаний определяемого вещества в пробе, и строят график зависимости интенсивности люминесценции от массовой доли определяемого вещества. В идеальном случае градуировочный график должен быть линейным и проходить через начало координат. На практике он оказывается линейным лишь в узком диапазоне содержаний определяемого вещества и редко выходит из начала координат.
В аналитической практике наиболее широкое применение получила фотолюминесценция, а именно флуоресценция.
Флуоресценция - это характерное свечение анализируемых растворов и кристаллофоров в ультрафиолетовом свете.
Флуориметрия -метод определения содержания люминофора в растворе,основанный на измерении спектра его флуоресценции. В основе этого метода лежат следующие закономерности.
Независимость спектра люминесценции от длины волны возбуждающего света. Это объясняется тем, что возбужденные молекулы, поглотившие кванты различной величины, попадают на уровни разных возбужденных электронно-колебательных состояний. После такого перераспределения избыточной энергии происходит излучательный переход с одних и тех же электронных уровней, поэтому спектр люминесценции не изменяется.
Рисунок - Зеркальная симметрия спектров поглощения ε = f (v)
(кривая 1) и флуоресценции I/v = f(v) (кривая 2) родамина 6Ж в ацетоне.
Вещества-люминофоры определяют по их собственной флуоресценции. Если определяемые вещества не являются люминофорами, то для их определения используют люминесцентные реакции. Последние должны сопровождаться возникновением или ослаблением флуоресценции раствора. Как и каждая реакция, применяемая в анализе, люминесцентная реакция должна протекать быстро, количественно, быть воспроизводимой и по возможности избирательной. При флуориметрическом определении ионов металлов чаще всего используют реакции комплексообразования с органическими реагентами. В идеальном случае применяемые для анализа реагенты не должны флуоресцировать, а образующиеся комплексы, напротив, должны обладать интенсивной флуоресценцией. Молекулы таких реагентов обычно имеют неплоскую и нежесткую ароматическую структуру и содержат электронодонорные заместители. В результате комплексообразования они приобретают плоскую жесткую конфигурацию, склонную к флуоресценции.
Для определения анионов часто используют косвенный флуориметрический метод, основанный на тушении люминесценции. Примером такого метода может служить определение иодид-ионов по тушению флуоресценции флуоресцеина.
Пределы обнаружения веществ флуориметрическим методом составляют от 10-8 до 10-4 %.
2. Теоретические основы
Способность атомов и молекул поглощать энергию, поступающую к ним извне, вызывает новое энергетическое состояние вещества, которое называется возбужденным. Избыточная энергия атомов или молекул, полученная при возбуждении, может быть израсходована на отрыв электронов - ионизацию вещества; на какие-либо фотохимические реакции; на нагрев вещества, т. е. переход избыточной энергии в тепловую. Кроме того, возбужденные атомы или молекулы способны отдавать всю избыточную энергию или часть ее в виде света. Как правило, большинство твердых веществ, при сильном нагревании светятся. Такое свечение раскаленных тел называют температурным или тепловым излучением. Чем больше энергии при данной температуре поглощает тело, тем оно больше ее излучает.
У некоторых веществ наблюдается свечение и без нагревания при комнатной температуре, которое называют холодным свечением или люминесценцией. В отличие от температурного люминесцентное излучение является неравновесным и продолжается относительно долгое время после прекращения действия внешнего возбуждающего фактора.
Люминесценция – свечение вещества после поглощения им энергии возбуждения.
Переходя в более низкое энергетическое состояние, возбужденные частицы испускают квант света – люминесцируют. Длительность послесвечения для различных люминесцирующих веществ различна: от миллиардных долей секунды (для отдельных атомов и молекул) до часов и даже нескольких суток (для кристаллофосфоров).
Явления люминесценции многообразны по свойствам и происхождению. Различные виды люминесценции определяются характером энергии возбуждения, продолжительностью свечения и химическими свойствами люминесцирующих веществ. В зависимости от вида люминесценции рассматривают следующие разделы люминесцентного анализа: 1) фотолюминесценция, или флуоресценция, основанная на свечении вещества при поглощении лучистой, или световой энергии;
2) катодолюминесценция, вызванная бомбардировкой быстролетящих электронов;
3) хемилюминесценция - свечение веществ под действием некоторых химических процессов;
4) триболюминесценция - люминесценция трения и т.п.
Все люминесцирующие вещества имеют общее название люминофоры.
Неорганические люминофоры называют чаще всего просто люминофорами, а органические - органолюминофорами. Органические и неорганические люминофоры существенно отличаются по природе свечения. У первых процессы поглощения возбуждающего света и излучения протекают в пределах каждой способной люминесцировать молекулы. У вторых, чаще всего активированных и имеющих кристаллическую структуру, в акте люминесценции участвуют не отдельные атомы и молекулы, а кристаллы. Эти люминофоры называют кристаллофосфорами.
Известно два механизма возникновения свечения:
1) свечение отдельных центров, когда процесс возникновения люминесценции протекает лишь в одной частице (центр свечения), являющейся как поглотителем энергии, так и излучателем световых квантов;
2) рекомбинационные процессы свечения, при которых, как правило, поглощение энергии осуществляется не теми частицами, которые излучают световые кванты.
По первому механизму осуществляется свечение большинства органических веществ в растворе, в том числе и внутрикомплексных соединений органических люминесцентных реагентов с катионами. Свечение кристаллов с решетками молекулярного типа, например, нафталина, антрацена и их производных, определяется рекомбинационными процессами. Такое свечение наблюдается и у сульфида цинка, сульфида кадмия, оксида кальция и т. п., кристаллические решетки, которых обладают некоторыми дефектами, вызванными внедрением примесей (или активаторов) - ионов тяжелых металлов. В этом случае в возникновении флуоресценции принимает участие весь кристалл в целом, такой вид свечения называют свечением кристаллофосфоров.
Люминесцентный метод анализа ( реферат , курсовая , диплом , контрольная )
Люминесценция ослабевает при повышении температуры и характеризуется испусканием квантов, отличающихся по энергии от ранее поглощенных.
По виду возбуждения различают фотолюминесценцию (возбуждение светом), радиолюминесценцию (возбуждение проникающей радиацией), к ней, в частности, относят рентгено-, катодо-, ионои а-люминесценцию, электролюминесценцию (возбуждение электрическим полем), триболюминесценцию (возбуждение при механических воздействиях), хемилюминесценцию, которая возникает при химических реакциях, и др.
Причиной всех люминесцентных явлений является перевод частиц люминесцирующего вещества в возбужденное состояние. Этот перевод осуществляется за счет энергии, доставляемой источником, вызывающим появление люминесценции. Переход возбужденного центра люминесценции в нормальное или менее возбужденное сопровождается испусканием света. Это и есть люминесцентное свечение вещества.
Обычно в возбужденном состоянии частицы вещества находятся в течение 10 -8 с. Такая длительность возбужденного состояния характерна для люминесценции, называемой флуоресценцией. Она наблюдается при облучении светом некоторых жидкостей и газов.
Иногда возбужденное состояние центров люминесценции сохраняется достаточно долго: от 10~ 4 с до нескольких минут. Такое люминесцентное свечение называется фосфоресценцией.
Фотолюминесценция, как правило, возбуждается ультрафиолетовым или близкими к нему участками спектров электромагнитных волн. Дж. Стокс (J. G. Stokes — английский физик и математик, 1819—1903) установил, что вещество испускает, как правило, свет, имеющий большую длину волны, чем свет, который вызывает явление фотолюминесценции.
При количественном и качественном люминесцентном анализе чаще всего регистрируют самостоятельное свечение вещества.
Качественный химический люминесцентный анализ позволяет обнаруживать и идентифицировать некоторые вещества в смесях.
В сортовом анализе по характеру свечения вещества различают предметы, кажущиеся одинаковыми. Его применяют при диагностике заболеваний, определении пораженное™ семян и растений болезнями, для измерения содержания органических веществ в почве и т. п. Из всех видов люминесценции для анализа чаще используют фотолюминесценцию.
При малых концентрациях С наблюдается прямолинейная зависимость интенсивности флуоресценции от концентрации.

где /(|)л — интенсивность флуоресценции; k — коэффициент пропорциональности.
Для измерения флуоресценции используют спектрофлуориметры и флуориметры, для измерения фосфоресценции — фосфориметры.
При измерении люминесценции источник возбуждения, кювету с исследуемым раствором и детектор располагают в зависимости от способа измерения излучения: под прямым углом к падающему свету (рис. 6.16, а), под небольшим углом к падающему свету (фронтальное освещение, рис. 6.16, б), без изменения направления (рис. 6.16, в).

Рис. 6.16. Способы наблюдения люминесценции:
а — способ перпендикулярных пучков; б — фронтальный способ; в — без изменения направления; 1 — источник; 2 — первичный светофильтр; 3 — кювета с пробой;
4 — вторичный светофильтр; 5 — фотоприемник Обычно в конструкциях флуориметров используют первый способ. В этом случае на фотоприемник попадает меньшая доля постороннего излучения от источника возбуждения. Во флуориметре свет попадает на первичный светофильтр, пропускающий излучение с длинами волн возбуждения, и далее на кювету с исследуемым раствором. Испускаемое люминесцентное излучение попадает на вторичный светофильтр, пропускающий люминесцентное излучение и задерживающий возбуждающее и рассеянное излучения.
Люминесценция — один из самых чувствительных методов анализа — применяется для определения следовых количеств элементов. В отличие от спектрофотометрии, где измеряют разность двух сигналов (/0 и /[), в люминесценции измеряют сам сигнал и предел обнаружения зависит от интенсивности источника и чувствительности детектора. Метод люминесценции позволяет определять 10 -10 —10 -4 мкг-мл -1 вещества.
Схема флуоресцентного газоанализатора, реализующая способ перпендикулярных пучков (рис. 6.16, а), показана на рис. 6.17.

Рис. 6.17. Структурная схема флуоресцентного газоанализатора:
- 1 — источник света; 2 — первичная оптическая схема; 3 — интерференционный световой фильтр; 4— флуоресцентная камера; 5 — светофильтр; 6 — фотоприемник;
- 7 — усилитель электрического сигнала; 8 — вторичный прибор
Излучение от источника 1 с помощью оптической системы 2 фокусируется в флуоресцентной камере 4. Интерференционный фильтр 3 служит для выделения спектральной области возбуждения флуоресценции. Через камеру 4 прокачивают анализируемый воздух.
Хемилюминесценция — люминесценция, сопровождающая химические реакции. Излучение испускается продуктами реакции или другими компонентами, возбуждаемыми в результате переноса энергии к ним от продуктов реакции. Частный случай хемилюминесценции — биолюминесценция (свечение гниющего дерева, некоторых насекомых и морских животных). Эффективность биолюминесценции некоторых светляков приближается к 100%. Для возбуждения хемилюминесценции в видимой области спектра требуется более 160 кДж/моль энергии. Яркость хемилюминесценции пропорциональна скорости реакции и эффективности хемилюминесценции (числу квантов хемилюминесценции на один акт реакции).
Низкая интенсивность собственно хемилюминесценции оказалась главным препятствием на пути к ее широкому использованию в аналитических целях. Значительное распространение получило измерение хемилюминесценции в присутствии определенных соединений, которые в отечественной литературе называют активаторами, а за рубежом — усилителями хемилюминесценции. По механизму действия активаторы разделяют на две группы — физические и химические.
В хемилюминесцентном методе анализе нет необходимости в применении источников возбуждения, поэтому аппаратура метода более простая по сравнению с той, которую используют в люминесцентном анализе.
Преимуществом хемилюминесцентного метода анализа являются низкие пределы обнаружения 10 -10 — 10 -4 г/мл при объеме кюветы 2—5 мл, достаточная точность определения, экспрессность, простота аппаратуры. Недостатком является малая селективность реакций, однако варьирование условий определения и применение маскирующих агентов часто позволяют устранить этот недостаток.
С помощью хемилюминесценции определяют содержание перекиси водорода, спиртов, производных анилина, некоторых отравляющих веществ, глюкозу, некоторые металлы, а также окислы азота и серы в воздухе.
Фосфоресценция — люминесценция, продолжающаяся значительное время после прекращения возбуждения (в отличие от флуоресценции).
Фосфоресценция может продолжаться от нескольких микросекунд до нескольких часов и даже суток.
Яркость фосфоресценции органических молекул обычно уменьшается со временем по экспоненциальному закону. Закон затухания яркости люминесценции кристаллофосфоров сложен, в некоторых случаях он приближенно описывается формулой Беккереля.

где В0 — начальная яркость; t — время; а и, а — постоянные.
Задачи
6.3.1. При фотометрировании пламени для Na получили следующие данные:
lgC-4,5 -4,0 -3,5 -3,0 -2,5 -2,0 -1,5 -1,0 -0,5.
gl -3,0 -2,5 -2,0 -1,5 -1,3 -1,0 -0,7 -0,4 -0,2.
В какой области интенсивность спектральных линий / пропорциональна концентрации С и в какой пропорциональна >/с?
6.3.2. При фотометрировании пламени при определении натрия в растворе получили следующие данные:
С, мкг/мл х 10 20.
данные вторичного прибора 35,5 20,5 39,5.
Рассчитайте концентрацию х исследуемого раствора.

6.3.3. Рассчитайте концентрацию элемента в растворе при спектральном анализе по следующим данным:
IgC x x + 0,05 * + 0,10.
Поскольку концентрация достаточно мала, то / = кС. В этом случае — =.
= 1,62, откуда * = 0,081. Или-= 2,22, откуда * = 0,082.
6.3.4. При определении калия фотометрированием пламени методом добавок были получены следующие данные:
С, мкг/мл * *+10 * + 20.
Определите концентрацию калия в исследуемом растворе.
- 6.3.5. Рассчитайте процентное содержание марганца в стали по следующим данным сравнения линии марганца (X = 293,911 нм) и железа (294,440 нм):
- 5Мп* 0,59 0,74 1,43 *
- 5Мп 0,896 1,020 1,349 1,105
SFe 0,764 0,748 0,763 0,760.
Ответ: данную задачу лучше решить графически построением графика Д5Мп = — *?Мп — Fe = /08О> х = 0,88.
6.3.6. При люминесцентном определении концентрации А1 3+ в дистиллированной воде взято 5 мл этой воды, добавлены сульфосалицилаль-о-амидофенол и вода до объема 10 мл. В аналогичных условиях приготовили растворы известной концентрации алюминия. При измерении интенсивности люминесценции растворов получены следующие результаты:
С, мкг А1/10 мл 0,04 0,05 0,08 *.
интенсивность люминесценции 11 17 23 19.
Определите концентрацию алюминия в воде.
При концентрации до 2 мкг/100 мл в плаве интенсивность света холостого опыта составляет 0,0001—0,02 мкг на 1 г фторида натрия, поэтому в данной задаче ее можно не учитывать.
6.3.7. Вычислите содержание алюминия в соляной кислоте (плотность 1,18) по данным его определения с салицилаль-о-аминофенолом.
На 5 мл анализируемой кислоты (после выпаривания в кислотном буфере) приготовили три раствора:
- а) без добавления А1 3+ ;
- б) с добавлением 0,03 мкг А1 3+ ;
- в) с добавлением 0,05 мкг А1 3+ .
К этим растворам, а также к холостому раствору добавили одинаковое количество салицилаль-о-аминофенола. При измерении люминесценции получили следующие результаты:
количество А1 3+ , мкг 0 * * + 0,03 * + 0,05.
интенсивность люминесценции 2 10 16 20.
6.3.8. При определении в сплаве никеля фотометрическим методом взяли навеску весом 0,1248 г, после соответствующей обработки ее растворили в мерной колбе емкостью 100 мл, затем 10 мл полученного раствора растворили в мерной колбе вместимостью 200 мл. Оптическая плотность соответствовала по калибровочной кривой 0,3 г никеля. Рассчитайте процентное содержание никеля в анализируемом сплаве.
6.3.9. В процессе выделения робенитина (ЗДД'Д'Д'-пентаоксифлавона) из растений получили пять этанольных растворов неизвестной концентрации. Оптические плотности растворов на шести длинах волн в кювете с длиной 1,00 см приведены в таблице.
Все вещества при сильном нагревании начинают излучать электромагнитную энергию. Излучение нагретых веществ называют тепловым равновесным излучением. Однако некоторые вещества излучают электромагнитную энергию без нагревания – при комнатной температуре. Такое излучение называют люминесценцией, а люминесцентные вещества – люминофорами. В отличие от теплового, люминесценция является неравновесным излучением.
По В. Л. Левшину, люминесценция – это свечение атомов, молекул, ионов и других более сложных комплексов, возникающее в результате электронного перехода в этих частицах при их возвращении из возбужденного состояния в нормальное.
Метод молекулярной люминесцентной спектроскопии характеризуется высокой чувствительностью (порядок обнаружения 10 -3 мг/мл), так как относится к силовым – выходной сигнал увеличивается с увеличением интенсивности источника излучения. В идеальных условиях удается достичь пределов обнаружения на уровне пикограммов в миллилитре.
В реферате приведена классификация методов люминесценции по способу возбуждения, механизму и длительности, описаны схемы Яблонского.
2. Классификация методов люминесценции
2.1 По способу возбуждения
Из определения люминесценции следует, что для её возбуждения необходимо подводить энергию извне, так как она теряется при излучении. Поэтому виды люминесценции естественно классифицировать по внешнему источнику возбуждения энергии.
Наиболее часто в аналитической практике используют фотолюминесценцию и хемилюминесценцию.
2.2 По длительности
Тип люминесценции зависит от того, какие переходы осуществляются в молекуле при поглощении ею квантов возбуждающего излучения.
Молекулярная люминесценция по длительности и спектральному составу:
- Флуоресценция (Фл)
кратковременная
замедленная - Фосфоресценции (Фс)
Испускание фотонов флуоресценции происходитпри переходе электрона с нулевого колебательного уровня состояния на любой колебательный уровень основного состояния. Флуоресценция является кратковременным излучением с длительностью 10 -10 -10 -7 секунд и наблюдается при комнатной температуре. Энергия фотонов флуоресценции меньше энергии фотонов поглощения.
При определенных условиях (обычно при температуре -196 °С, в отсутствие парамагнитных молекул) для триплетных молекул оказывается возможнымзапрещенный переходс излучением фотонов фосфоресценции. Это излучение имеет значительно большую длительность 10 -4 -10 -2 секунд. Энергия фотонов фосфоресценции меньше энергии фотонов кратковременной флуоресценции.
Помимо флуоресценции и фосфоресценции существует еще один вид люминесценции, который идентичен по спектральному составу флуоресценции, но характеризуется длительностью, свойственной фосфоресценции. Этот вид люминесценции называют замедленной флуоресценцией, поскольку перед излучением фотонов молекула некоторое время находится в триплетном состоянии.Этот тип молекулярной люминесценции наблюдается в весьма ограниченных диапазонах температур, вязкостей и концентраций растворов. По сравнению с флуоресценцией и фосфоресценцией ее интенсивность невелика и достигает максимальных значений при комнатной и более высоких температурах, заметно ослабевая с понижением температуры.
2.3 По механизму свечения
Свечение дискретных центров
- резонансная (Рисунок 1а) – квант излучения, испускаемый частицей, равен поглощенному кванту.
- спонтанная (Рисунок 1б) – возникает при переходе частицы с возбужденного уровня 2 на основной уровень. Уровень испускания 2 лежит ниже уровня 3, поэтому излучаемый квант оказывается меньше поглощенного.
- вынужденная (Рисунок 1в) – возбужденная частица, прежде чем перейти на излучательный уровень 2, оказывается на промежуточном метастабильном уровне 4, непосредственный переход с которого на основной уровень является запрещенным. Для перехода на излучательный уровень 2 частице необходимо сообщить дополнительную энергию в виде тепла или света.
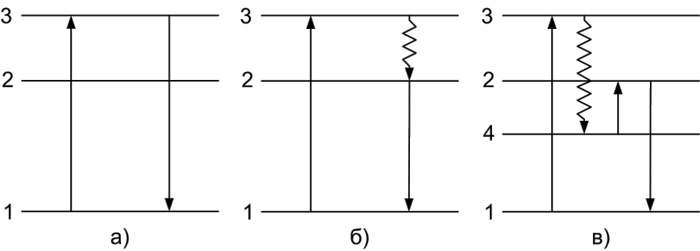
Рисунок 1. Схемы энергетических уровней и электронных переходов.
1 – основной уровень; 2, 3 – возбужденные уровни; 4 – метастабильный уровень; ↑ – поглощение; ↓ – люминесценция; – безызлучательный переход.
Поглощающими и излучающими центрами являются одни и те же частицы (атомы, ионы или молекулы). Этот вид свечения присущ в основном веществам в газообразном состоянии, органическим и неорганическим веществам в растворах и чистым органическим веществам.
Резонансная люминесценция характерна преимущественно для атомов, простейших молекул, находящихся в газообразном состоянии при низких давлениях, спонтанная — для паров и растворов сложных молекул, вынужденная — для сложных органических молекул, находящихся при низкой температуре или помещенных в вязкие или стеклообразные среды (полимерные пленки, сахарные леденцы).
Рекомбинационное свечение
Акты поглощения и излучения разделены не только во времени, но и пространственно. В процессе возбуждения происходит разделение частицы на две противоположно заряженные. Последовательность их рекомбинации сопровождается выделением энергии. Этот вид свечения является основным в свечении кристаллофосфоров – сложных кристаллических веществ с дефектной структурой.
3. Схемы Яблонского
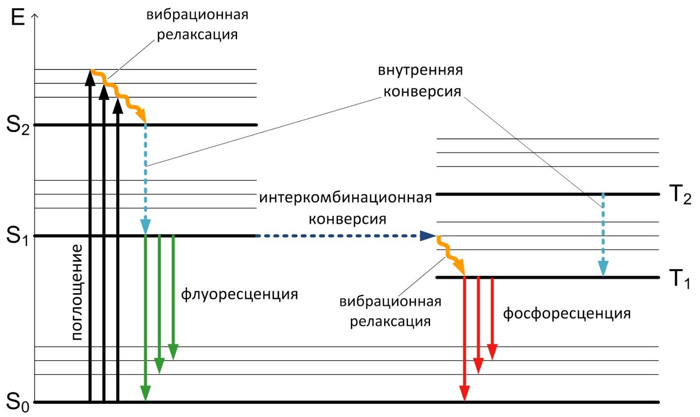
Поглощение и испускание света хорошо иллюстрирует диаграмма уровней энергии, предложенная Яблонским (Рисунок 2).
Рисунок 2. Диаграмма уровней энергии Яблонского
Основное, первое и второе электронные состояния обозначают S0, S1, и S2 соответственно.
Каждый из этих уровней энергии может состоять из множества колебательных энергетических уровней, обозначаемых 0, 1, 2 и т. д. Влияние растворителя во внимание не принимается.
Переходы между различными электронными уровнями обозначены вертикальными линиями. Такое представление используется, чтобы наглядно показать мгновенную природу поглощения света. Этот процесс происходит примерно за 10-15 с, время, слишком короткое для заметного смещения ядер (принцип Франка-Кондона).
В возбуждённых состояниях молекулы находятся очень недолго (в синглетном состоянии обычно значительно меньше, чем в триплетном) и становятся очень реакционноспособными.
В соответствии с распределением Больцмана, при комнатной температуре большинство молекул находятся на самом нижнем колебательном уровне основного синглетного состояния S0. Именно такие молекулы преимущественно и будут поглощать излучение.
Из-за большой разности энергий между уровнями S0 и S1 по существу, ни у каких флуорофоров состояние S1 не может быть заселено термическим путем. Даже малое термически активированное заселение первого возбужденного колебательного состояния молекул можно зарегистрировать, используя различие спектров поглощения при разных температурах.
За поглощением света обычно следует несколько других процессов. Возбуждение флуорофора, как правило, происходит до некоторого высшего колебательного уровня состояний (S1 либо S2).
3а некоторыми редкими исключениями, для молекул в конденсированной фазе характерна быстрая релаксация на самый нижний колебательный уровень состояния S1. Этот процесс называется внутренней конверсией и происходит большей частью за 10 -12 с. Поскольку типичные времена затухания флуоресценции близки к 10 -8 с, внутренняя конверсия обычно полностью заканчивается до процесса испускания. Следовательно, испускание флуоресценции чаще всего осуществляется из термически равновесного возбужденного состояния.
Аналогично поглощению обратный переход электронов на самый нижний электронный уровень также приводит к колебательно возбужденному состоянию. Термическое равновесие достигается за время порядка 10 -12 с. Интересным следствием из такого рассмотрения является то, что спектр поглощения молекулы отражает колебательную структуру возбужденных электронных состояний, а спектр испускания — колебательную структуру основного электронного состояния. В большинстве случаев электронное возбуждение не сильно изменяет расположение колебательных уровней энергии. В результате этого колебательные структуры, проявляющиеся в спектрах поглощения и испускания, сходны.
Молекулы в состоянии S1 могут также подвергаться конверсии в первое триплетное состояние Т1. Испускание из Т1 называемое фосфоресценцией, обычно сдвинуто в сторону больших длин волн (меньших энергий) по сравнению с флуоресценцией. Конверсия из S1 в Т1 называется интеркомбинационной конверсией. Переход из Т1 в основное состояние запрещен, в результате чего константа скорости такого испускания на несколько порядков меньше соответствующей константы для флуоресценции.
На испускание флуоресценции могут влиять и другие факторы, не показанные в явном на диаграмме Яблонского: влияние растворителей, релаксация растворителя, тушение, а также реакции, происходящие в возбужденных состояниях.
4. Заключение
Люминесценция — один из видов излучения вещества, избыточного над тепловым излучением тела при данной температуре. Излучение наблюдается вследствие перехода электронно-возбужденных атомов, молекул, радикалов, ионов — так называемых центров люминесценции, в основное состояние. По длительности процесса излучения различают кратковременную люминесценцию, называемую флуоресценцией и медленную люминесценцию, называемую фосфоресценцией
В 1852 году Джордж Стокс установил, что длина волны фотолюминесценции больше длины волны возбуждающего света (правило Стокса). В 1864 году им предложено использование явления люминесценции для качественного анализа органических веществ. Широкое применение люминесцентные методы анализа получили в 30-е годы XX века благодаря работам Вавилова и его школы.
Процесс люминесценции может происходить в различных веществах, находящихся в разных агрегатных состояниях. Особенности излучения различных люминесцентных центров могут быть использованы в аналитических целях.
Для возбуждения люминесцентного центра могут быть использованы различные источники. Необходимым условием их эффективности является величина энергии излучения, которая должна быть достаточной для возбуждения электронного перехода в исследуемом веществе. Разные виды люминесценции находят применение в различных вариантах метода люминесцентного анализа.
Наиболее универсальный метод возбуждения люминесценции — фотовозбуждение исследуемого вещества. Он используется чаще всего как в атомных, так и в молекулярных методах анализа. При фотовозбуждении легко регулировать длину волны возбуждающего излучения, его интенсивность и поляризацию. При анализе многокомпонентной смеси возможно возбудить электронный переход, сопровождающийся люминесценцией только у одного из компонентов смеси. Таким образом, становится возможным проводить избирательный (селективный) анализ смеси веществ.
Наиболее широкое применение в аналитических целях имеет молекулярная фотолюминесценция для веществ, находящихся в растворе.
Некоторые вещества при их облучение (например, видимым, ультрафиолетовым или рентгеновским излучением) испускают собственное свечение, спектр которого отличается от спектра поглощенного излучения и определяется химическим составом и внутренней молекулярной структурой этих веществ. Такого рода свечение называется люминесцентным излучением или просто люминесценцией, а испускающие их вещества – люминофорами.
Содержание
Введение
Основная часть:
Природа люминесценции
Характеристики люминесцирующих веществ
Гашение люминесценции
Применение люминесценции
Заключение
Список литературы
Работа состоит из 1 файл
физика реферат,.doc
Министерство Здравоохранения Российской Федерации
Иркутский Государственный Медицинский Университет
Кафедра математики и физики
Студент фарм. фака.
Профессор Шевченко Е. В.
- Введение
- Основная часть:
- Природа люминесценции
- Характеристики люминесцирующих веществ
- Гашение люминесценции
- Применение люминесценции
Некоторые вещества при их облучение (например, видимым, ультрафиолетовым или рентгеновским излучением) испускают собственное свечение, спектр которого отличается от спектра поглощенного излучения и определяется химическим составом и внутренней молекулярной структурой этих веществ. Такого рода свечение называется люминесцентным излучением или просто люминесценцией, а испускающие их вещества – люминофорами.
На рисунке показана схема установки для изучения люминесценции различных веществ: И – источник возбуждающего излучения (для детальных исследований он должен давать монохроматические участки спектра различных длин волн); Л1 – линза, фокусирующая это излучение на исследуемое вещество В; Л2 - линза, собирающая люминесцентное излучение на спектральный аппарат С, с помощью которого определяются состав излучения и распределение по спектру.
- пары и газы некоторых элементов (натрий, сера, иод, кислород);
- соли некоторых веществ и их растворы (большинство неорганических солей не люминесцируют; исключение составляют соединения лантаноидов: цезия, празеодима, неодима и др.)
- ряд органических веществ (бензол и его производные, нафталин, антрацен и др.; красители: флуоресцеин, родамины и др.)
- кристаллические неорганические веществ, содержащие в своей структуре (в небольшом количестве) примеси ионов тяжелых металлов (например, сернистый цинк, в кристаллическую структуру которого введены ионы меди или марганца).
Металлы ни в твердом, ни в жидком состояние не люминесцируют. Некоторые вещества обнаруживают люминесцентные свойства только при определенных условиях (низкие температуры, выбор специального растворителя, необходимая концентрация в растворе и т.п.)
Возбуждение люминесценции может быть произведено различными способами, в связи с чем употребляются следующие названия:
- фотолюминесценция, вызванная облучением, содержащим оптический участок спектра – видимый и ультрафиолетовый (свечение некоторых красок, керосина, флуоресцеина и других веществ под действием света или ультрафиолетовых лучей);
- рентгенолюминесценция, вызванная рентгеновским лучами;
- катодолюминесценция, вызванная бомбардировкой вещества потоком быстрых электронов (свечение экрана телевизора, осциллографа, свечение минералов, облучаемых потоком электронов);
- электролюминесценция, вызванная электрическими полями, которые освобождают слабо связанные в структуре кристалла электроны и сообщают им энергию, достаточную для возбуждения вещества;
- хемилюминесценция, возникающая при химических реакциях; возбуждение вещества происходит под действием выделяющейся при реакции энергии (свечение фосфора, гниющего дерева, светлячков, моллюсков, вызываемое окислением, и др.)
Люминесцентное излучение отличаются от других видов излучения следующими характерными особенностями:
Различная длительность люминесценции после прекращения внешнего возбуждающего действия послужила основной для разделения люминесценции на:
- Флуоресценцию, исчезающую одновременно с прекращением облучения (таким свойством обладает, например, минерал флуорит);
- Фосфоресценцию, продолжающуюся некоторое время после устранения возбуждающего воздействия.
- спонтанное (самостоятельно) излучение; оно происходит при переходе почти свободной частицы (атома, молекулы) из возбужденного состояния в нормальное с излучением фотона определенной энергии:
Однако исследования показали, что длительность люминесценции можно изменять в широких пределах; увеличивать у флуоресцирующих веществ и уменьшать у фосфоресцирующих веществ. Ввиду этого деление люминесценции по продолжительности свечения потеряло однозначный смысл. В настоящее время флуоресценцией называют спонтанное (самостоятельное) излучение возбужденных молекул при переходе их в нормальное состояние под действием внутренних электрических и магнитных полей; фосфоресценцией же называют излучение, которое возникает при рекомбинации частиц, разделенных при облучение, которое возникает при рекомбинации частиц, разделенных при облучении (например, электрона и иона или двух частей диссоциированной молекулы).
Заметим, что тепловое излучение не может быть ослаблено или устранено какими-либо примесями, так как оно не зависит от вещества, а определяется только температурой. Поэтому зависимость интенсивности излучения от наличия примесей является весьма характерной отличительной особенностью люминесценции.
Перечисленные выше особенности люминесцентного излучения получают удовлетворительное объяснение только на основе квантовых представлений. Существование продолжительного свечения после прекращения внешнего воздействия свидетельствует о том, что частицы вещества, поглотившие излучение, переходят не на обычные уровни энергии (с которых возможно спонтанное излучение), а на особые метастабильные уровни, среднее время пребывания на которых велико. Свободные атомы таких уровней не имеют, поэтому среднее время пребывания электрона на каком-нибудь возбужденном уровне оказывается порядка 10 -10 с. Метастабильные уровни образуются только в сложных системах: молекулах, ячейках кристаллических решеток и т.п.
Люминесцентное излучение в зависимости от характера вызывающих его процессов делят, по предложению С. И. Вавилова, на следующие виды:
Характерная особенность такого свечения: вероятность перехода определяется внутренними полями, но не внешним воздействием на возбужденную частицу.
На рисунке а стрелка 1 указывают на процесс возбуждения, стрелка 2 – на разрешенный переход из возбужденного состояния в нормальное. Продолжительность люминесценции, т.е. среднее время пребывания частицы в возбужденном состоянии, составляет 10 -9 – 10 -10 с;
Читайте также:

