Квант саны паули принципі хунд ережесі клечковский ережесі реферат
Обновлено: 05.07.2024
1. При увеличении заряда ядра заполнение электронами атомных орбиталей с меньшим значением (n+l) к орбитали с большим значением, т.е. электроны предпочитают располагаться на орбитали с меньшей энергией.
2. Если сумма n+l одинакова, то электрон располагается на орбитали с меньшим значением n, т.е. ближе к ядру.
В соответствии с правилами Клечковского s- и p-элементы заполняют уровень, номер которого равен номеру периода, в котором находится элемент (внешний уровень). D-элемент заполняет предвнешний уровень, номер которого на 1 меньше номера периода. F-элементы – препредвнешний уровень, номер которого на 2 единицы меньше номера периода, в котором находится электрон.
In 5s 2 d 10 5p 1
Принцип Паули (принцип запрета):
Принцип Паули, который часто называют еще принципом запрета, ограничивает число электронов, которые могут находиться на одной орбитали. Согласно принципу Паули, на любой орбитали может находиться не более двух электронов и то лишь в том случае, если они имеют противоположные спины (неодинаковые спиновые числа). Поэтому в атоме не должно быть двух электронов с одинаковыми четырьмя квантовыми числами (n, l, ml, ms).
Атом лития имеет три электрона. Орбиталь с самой низкой энергией - 1s-орбиталь - может быть заселена лишь двумя электронами, причем у этих электронов должны быть разные спины. Если обозначать спин +1/2 стрелкой, направленной вверх, а спин −1/2 - стрелкой, направленной вниз, то два электрона с противоположными (антипараллельными) спинами на одной орбитали можно схематически представить так:

Третий электрон в атоме лития должен занимать орбиталь, следующую по энергии за самой низкой орбиталью, то есть 2s-орбиталь.
Правило Гунда (Хунда):
Правило Гунда (Хунда) определяет порядок заселения электронами орбиталей, имеющих одинаковую энергию. Оно было выведено немецким физиком-теоретиком Ф. Гундом (Хундом) в 1927 г. на основе анализа атомных спектров.
Правило Гунда определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное значение спинового квантового числа электронов данного подслоя должно быть максимальным.
Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют двухэлектронное облако) и, в результате, суммарный спин орбитали становится равным нулю.
Строение вещества. Ядерная модель строения атома. Состояние электрона в атоме.
Заполнение электронами орбиталей, принцип наименьшей энергии, правило Клечковского,
принцип Паули, правило Хунда
Ядерная модель строения атома:
Состояние электрона в атоме:
Заполнение электронами орбиталей, принцип наименьшей энергии, правило Клечковского, принцип Паули, правило Хунда:
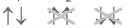
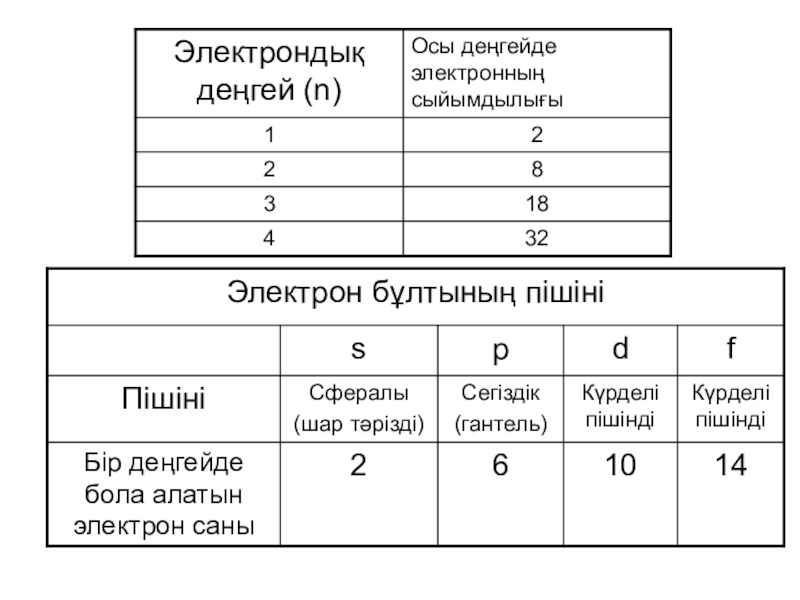
- На энергетическом уровне n находится n подуровней.
- На подуровне l находится 2l+1 орбиталь.
- На одной орбитали может находится максимум два электрона, обладающих противоположным спином:
- Максимальное число электронов на энергетическом уровне: N=2n 2
- На внешнем энергетическом уровне может находится не более 8 электронов.
- Завершенный энергетический уровень содержит максимально возможное количество электронов.
- Незавершенный энергетический уровень содержит электроны, но их число меньше максимально возможного.
- Принцип наименьшей энергии. Электрон в атоме занимает такое положение, чтобы его энергия была максимальна.
- Правило Клечковского. Заполнение электронами орбиталей происходит так, чтобы n+l(главное квантовое чилоn плюс орбитальное квантовое числоl) было минимально.
- 1s
- Принцип Паули. В атоме не может быть электронов с одинаковыми значениями всех четырех квантовых чисел.
- Принцип Хунда. Наименьшей энергией обладает электронная конфигуряция с максимальным спином.
Дополнительная информация от Инженерного cправочника DPVA, а именно - другие подразделы данного раздела:
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста.
Вложите в письмо ссылку на страницу с ошибкой, пожалуйста.Связь электронного строения атома со свойствами хим. элементов. Периодическое изменение свойств хим. элементов: энергия ионизации, сродство к электрону, размеры атомов и ионов.
Химическая связь, основные виды связи. Ковалентная связь и ее характеристики. Ионная связь.
Метод валентных связей: валентность, гибридизация атомных орбиталей, пространственная конфигурация молекул. Донорно-акцепторный механизм образования связей.
Межмолекулярное воздействие: силы Ван-дер-Ваальса, водородная связь.
Свойства веществ в различных состояниях. Химическая связь в твердых телах.
Основные понятия химической термодинамики. Энергетические эффекты хим. реакция, закон Гесса. Тепловые эффекты хим. реакций. Методы расчета теплот образования и тепловых эффектов реакции.
9. Направление течения химических процессов, энтропия, энергия Гиббса, энергия Гельмгольца. – эти вопросы лучше возьмите из лекций, в учебнике слишком много и запутанно.
Химическое равновесие, обратимые и необратимые реакции, константа равновесия и способы ее расчета.
Принцип Ле-Шателье. Смещение хим. равновесия при изменении концентрации, температуры и давления реагирующих веществ, применение катализаторов.
Химическая кинетика. Скорость гомогенных хим. реакций, закон действия масс, кинетическая классификация реакций. Гетерогенные хим. реакции.
Константа скорости хим. реакции и ее зависимость от температуры. Правило Вант-Гоффа, уравнение Аррениуса.
Адсорбция физическая и химическая, изотерма адсорбции, константа адсорбционного равновесия.
Комплексные соединения. Номенклатура комплексных соединений.
1.
Способы выражения концентрации растворов
Отношение количества или массы вещества, содержащегося в системе, к объему или массе этой системы называют концентрацией. Известно несколько способов выражения концентрации.
1) Молярная концентрация с – отношение количества вещества, содержащегося в растворе, к объему этого раствора.(моль/л). Раствор, имеющий концентрацию 1 моль/л, называют молярным раствором и обозначают 1 М раствор.
2) Молярная концентрация эквивалентов сэк(нормальная концентрация) – это отношение количества вещества эквивалентов к объему раствора. (моль/л). Раствор, в одном литре которого содержится 1 моль вещества эквивалентов, называют нормальным и обозначают 1 н.
3) Моляльность b –отношение количества растворенного вещества к массе растворителя. (моль/кг)
4) Молярная доля – отношение количества вещества данного компонента, содержащегося в растворе, к общему количеству вещества.
5) Массовая доля – отношение массы данного компонента, содержащегося в растворе, к общей массе этого раствора.
6) Объемная доля – отношение объема компонента, содержащегося в растворе, к общему объему раствора.
7) Массовая концентрация – отношение массы компонента, содержащегося в растворе, к объему этого раствора. (кг/метр кубический).
8) Титр раствора Т – масса вещества, содержащегося в одном миллилитре раствора.
Химический эквивалент.
Эквивалентом называют реальную или условную частицу вещества, которая может замещать, присоединять, высвобождать или быть каким либо другим способом эквивалента атому водорода в кислотно-основных или ионообменных реакциях или одному электрону в ОВР. (Закон эквивалентов: все вещества реагируют в эквивалентных отношениях).
2.
Строение многоэлектронных атомов: правило Клечковского, принцип Паули, правило Хунда.
Атом любого химического элемента состоит из положительно заряженного тяжелого ядра и отрицательно заряженной электронной оболочки. Строение многоэлектронных атомов описывается электронными конфигурациями элемента – записью распределения электронов в атоме по оболочкам, подоболочкам и орбиталям. При записи электронной конфигурации указывают цифрами главное квантовое число, буквами подоболочки, а степень буквенных подоболочек обозначает число электронов в данной подоболочке. При составлении электронных конфигураций многоэлектронных атомов учитывают:
1) Принцип минимальной энергии – согласно этому принципу электроны в основном состоянии заполняют орбитали в порядке повышения уровня энергии орбиталей.
2) Правило Клечковского – увеличение энергии и соответственно заполнение орбиталей происходит в порядке возрастания суммы главного и орбитального квантовых чисел ,а при их равной сумме, в порядке возрастания главного кв. числа.
3) Принцип запрета Паули – в атоме не может быть больше двух электронов, обладающих одинаковым набором квантовых чисел, т. Е. на каждой орбитали не может быть больше двух электронов, причем они должны иметь противоположные спины.
4) Правило Гунда – заполнение орбиталей одой подоболочки в основном состоянии атома начинается одиночными электронами с одинаковыми спинами. После того как одиночные электроны займут все орбитали в данной подоболочке, заполняются орбитали вторыми электронами с противоположными спинами.
Презентация на тему движение электронов, предмет презентации: Химия. Этот материал в формате pptx (PowerPoint) содержит 10 слайдов, для просмотра воспользуйтесь проигрывателем. Презентацию на заданную тему можно скачать внизу страницы, поделившись ссылкой в социальных сетях! Презентации взяты из открытого доступа или загружены их авторами, администрация сайта не отвечает за достоверность информации в них, все права принадлежат авторам презентаций и могут быть удалены по их требованию.
Слайды и текст этой презентации
![Атомдардағы электрондардың қозғалысы]()
Атомдардағы электрондардың қозғалысы
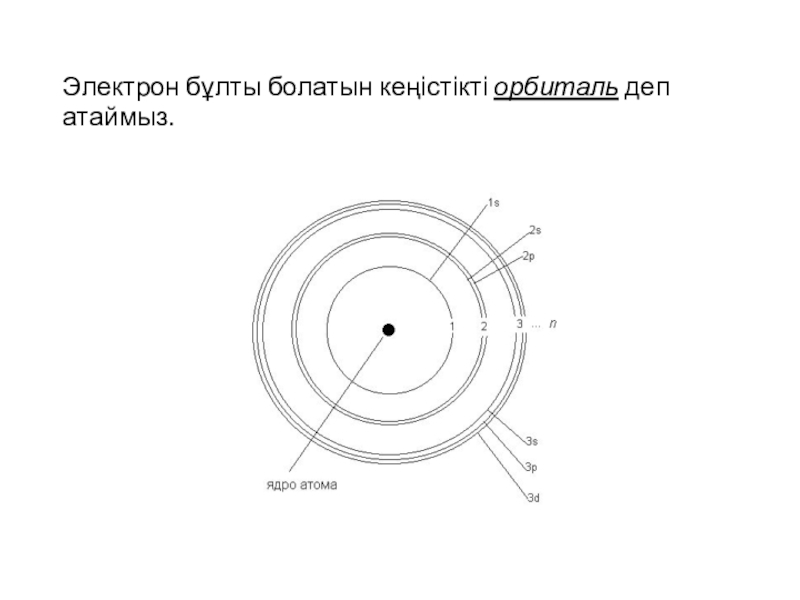
![Электрон бұлты болатын кеңістікті орбиталь деп атаймыз.]()
Электрон бұлты болатын кеңістікті орбиталь деп атаймыз.
![Электрондық қауыз:Атомның барлық электрондары жиналып электрондық қауызын құрайды. (n+L+ m + s) n=1,2,3. ; L= n -1; m]()
Атомның барлық электрондары жиналып электрондық қауызын құрайды. (n+L+ m + s) n=1,2,3. ; L= n -1; m =2(n+1); s =+-1/2 h/2
n- бас квант саны; L- орбиталь квант саны ; m магнит квант саны; s – спин.
Өзара энергиясы жуық электрондар атомның электрондық қабатын түзеді.
Электрондық қабаттар рет нөміріне қарай 1,2,3,4… деп белгіленеді. Np=
электрондық қабаттар саны
Әр қабаттағы орбитальдардың өзіндік энергиясы мен пішіндері болады.
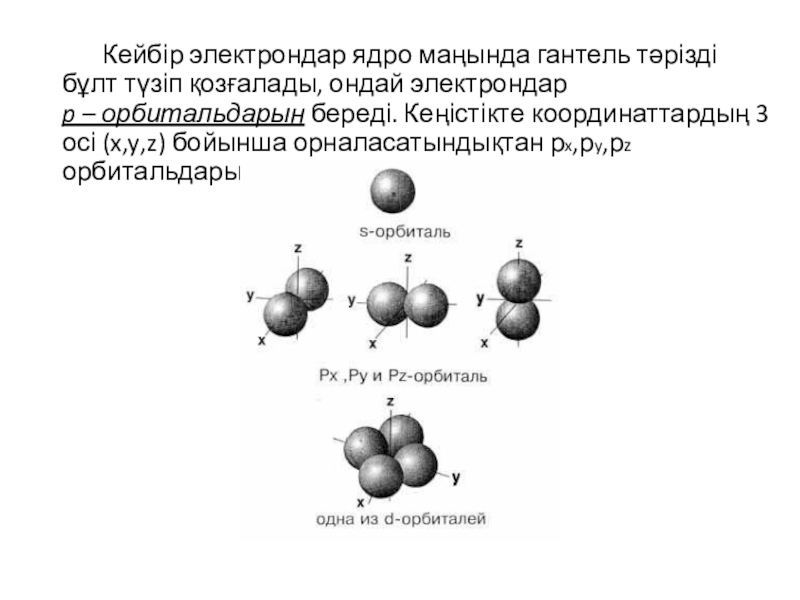
Шар тәрізді электрон бұлтын s-электрондар деп, ал орбитальдарды s-орбиталь д.с.а.![Кейбір электрондар ядро маңында гантель тәрізді бұлт түзіп қозғалады, ондай электрондар p – орбитальдарын береді. Кеңістікте]()
Кейбір электрондар ядро маңында гантель тәрізді бұлт түзіп қозғалады, ондай электрондар p – орбитальдарын береді. Кеңістікте координаттардың 3 осі (x,y,z) бойынша орналасатындықтан рx,рy,рz орбитальдары деп бөлінеді
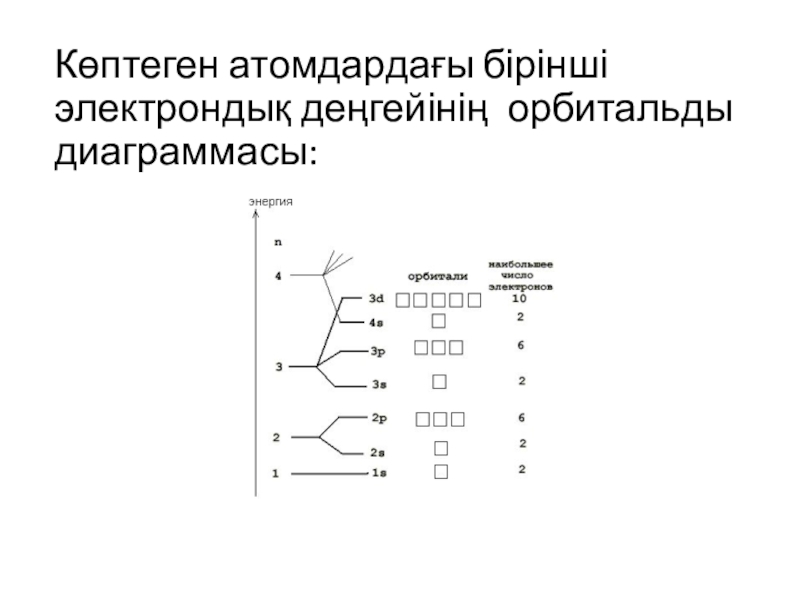
![Көптеген атомдардағы бірінші электрондық деңгейінің орбитальды диаграммасы:]()
Көптеген атомдардағы бірінші электрондық деңгейінің орбитальды диаграммасы:
![Электрондық бұлттарды толтыру ережесі келесі:1. Ең алдымен элемент атомында қанша электрон бар екендігін анықтап алу. Ол үшін]()
Электрондық бұлттарды толтыру ережесі келесі:
1. Ең алдымен элемент атомында қанша электрон бар екендігін анықтап алу. Ол үшін сол элементтің ядро зарядын білсек болғаны, ол Д.И. Менделеевтің периодтық жүйедегі элементтің реттік нөміріне тең. Реттік нөмірі (ядродағы протон саны) барлық атомдағы электрон санына тең.
2. Бар электронмен 1s – орбитальдан бастап ұяшықтарды толтырамыз. Әрбір ұяшықта 1 не 2 электрон бола алады. Бір ұяшықта орналасқан
екі электронды қарама – қарсы бағдаршамен
белгілейді. (Хунд ережесі)
3. Элементтің электрондық формуласын жазамыз.![]()
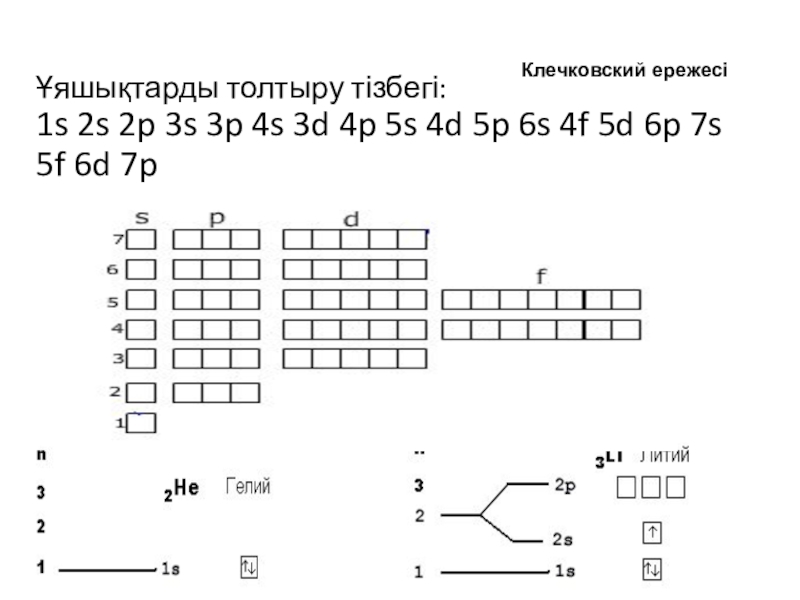
![Ұяшықтарды толтыру тізбегі: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d]()
Ұяшықтарды толтыру тізбегі: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
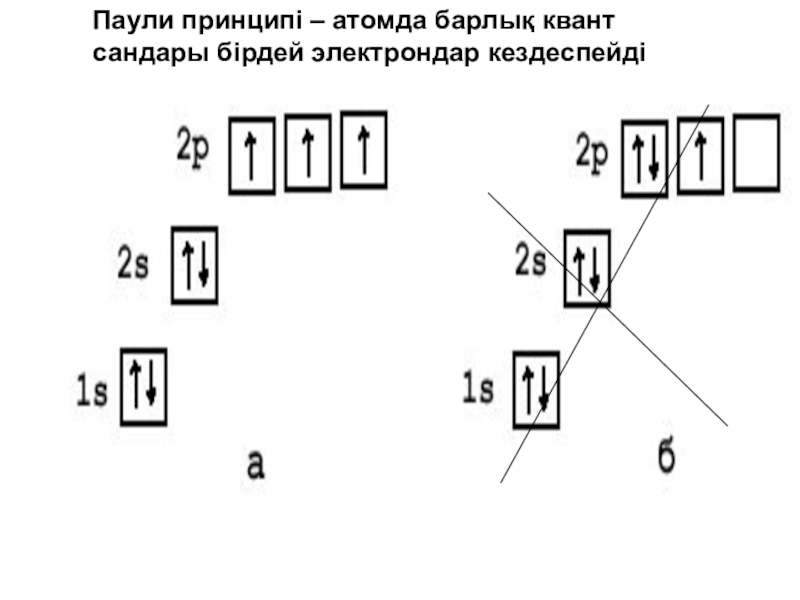
![Паули принципі – атомда барлық квант сандары бірдей электрондар кездеспейді]()
Паули принципі – атомда барлық квант сандары бірдей электрондар кездеспейді
![Үйге:§ 57 Атомдардағы электрондардың қозғалысы. Есептер мен жаттығулар жинағы: 104-105 бет 5-56, 5-57, 5-67, 5-68 жаттығуларды орындау]()
§ 57 Атомдардағы электрондардың қозғалысы.
Есептер мен жаттығулар жинағы: 104-105 бет 5-56, 5-57, 5-67, 5-68 жаттығуларды орындауЧитайте также: