Коктейль яманаки почему его автор получил нобелевскую премию по физиологии и медицине реферат
Обновлено: 05.07.2024
Японский ученый Синья Яманака, несколько лет подряд называемый одним из главных претендентов на Нобелевскую премию по медицине и физиологии, сегодня совместно с британцем Джоном Гордоном удостоился награды на церемонии вручения премии в Стокгольме за работу по стволовым клеткам и клонированию животных.
С.Яманака – для мира науки фигура во многом значимая. Именно ему впервые удалось получить индуцированные плюрипотентные стволовые клетки, по-другому называемые iPS-клетками. Их главная особенность состоит в том, что они получены из каких-либо иных клеток путем перепрограммирования клеточной информации.
Благодаря открытию С.Яманаки стало возможным получать iPS-клетки из фибропластов ("переделанные" клетки кожи). Таким образом, снижается риск иммунного отторжения, и, кроме того, не возникает этических проблем, связанных с необходимостью убийства человеческих эмбрионов, ранее являвшихся главным источником стволовых клеток.
В ходе исследований, проводимых с эмбриональными стволовыми клетками, С.Яманака выяснил, какие именно гены определяют их способность дифференцироваться во все остальные типы клеток. Путем поочередного тестирования "подозрительных" генов японцу вместе с коллегами удалось модифицировать геном взрослых клеток соединительной ткани. Затем был подобран "ключ", который позволял перепрограммировать их, причем методика переделывания клеточной информации, по словам самих ученых, оказалась удивительно простой. Говоря простым языком, подобранный С.Яманакой "код" позволил создавать из iPS-клеток клетки всех остальных типов, присутствующих в человеческом организме.
Сейчас iPS-клетки являются одной из наиболее прогрессивных направлений в регеративной медицине: с их помощью в скором времени могут быть разработаны новые клинические методы лечения таких серьезных патологий, как онкологические заболевания, юношеский диабет, синдром Паркинсона, слепота, нарушения работы спинного мозга и др.
Так, лейкемию (рак крови) уже сейчас лечат использованием стволовых клеток в эритроцитах: больному делают обильное переливание крови и операцию по пересадке костного мозга, таким образом подсаживая в организм донорские клетки, дающие начало здоровым клеткам крови.

— С тех пор, как вы получили Нобелевскую премию, прошло шесть лет. Какое влияние премия оказала на ваши исследования? А именно: меньше ли времени стало оставаться на собственно исследования или, наоборот, после получения премии вырос интерес к клеткам iPS и легче стало получать инвестиции? Изменилась ли ваша собственная жизнь после получения премии? Что бы вы могли посоветовать тем, кто станет ее лауреатами?
— После изобретения клеток iPS моя роль как исследователя сильно изменилась, я стал директором центра CiRA (Центр прикладных исследований iPS-клеток — ред.) в университете Киото, и основным видом моей деятельности стал менеджмент по организации и созданию среды для исследователей, которые занимаются изучением клеток iPS. После получения Нобелевской премии в 2012 году это соотношение (в пользу административной работы — ред.) стало еще больше.
Присужденную мне Нобелевскую премию я считаю прежде всего премией в области физиологии (а не медицины и физиологии — ред.). Благодаря усилиям многих ученых, которые занимаются исследованиями клеток iPS, уже началось изучение их применения для человека, но до создания лекарств, которые могли бы помочь большой части больных людей, дело пока не дошло. Моя цель как ученого заключается в том, чтобы научиться лечить заболевания, которые современная наука лечить еще не умеет, однако пока этот результат так и не достигнут. Эта цель так и осталась неизменной, но после получения премии я еще более укрепился в этом намерении. И еще я чрезвычайно рад, что получение Нобелевской премии способствовало тому, что многие люди заинтересовались клетками iPS. Мне нечего в особенности пожелать лауреатам Нобелевской премии — они уже достигли выдающихся результатов в своих областях, кроме разве что одного: еще больше берегите свое собственное время. Наверное, вот так.
— За шесть лет исследования в области клеток iPS сильно продвинулись вперед. Начались клинические исследования, созданы клетки различных органов. Какое из этих направлений, на ваш взгляд, ближе всего стоит к практической реализации в ближайшем будущем? Например, к проведению операции по пересадке органов? К исследованиям в какой области вы сейчас прикладываете больше всего сил? Из тех клеток, что уже созданы с помощью iPS, какие, по вашему мнению, имеют наилучшую перспективу в будущем?

— Сейчас в применении клеток iPS есть два направления. Одно — это регенеративная медицина, второе — создание лекарств. В области регенеративной медицины уже начались клинические эксперименты по лечению возрастной макулярной дегенерации (макулодистрофия — возрастное заболевание глаз, грозящее полной слепотой,- ред.) и болезни Паркинсона. Кроме того, есть планы клинических экспериментов и лечения с использованием клеток iPS болезней сердца, крови, повреждений и болезней спинного мозга. Сейчас продвигаются и привлекают большое внимание исследования с использованием клеток iPS в таких областях, как предоставление компонентов крови взамен донорской, нехватка которой прогнозируется в развитых странах в ближайшем будущем, а также их использование для создания лекарства от рака, от которого страдают много людей.
Что касается лекарственной стороны, то мы направляем свои силы на создание препаратов от редких и неизлечимых заболеваний — области, труднодоступной для фармацевтических компаний. Так, на основе результатов наших исследований (клеток iPS — ред.) уже начато экспериментальное лечение фибродисплазии (фибродисплазия оссифицирующая прогрессирующая, ФОБ, редкое генетическое заболевание, при котором мягкие ткани — мышцы, сухожилия и связки — превращаются в кость, на сегодняшний день лекарств от нее не существует — ред.). Кроме этого мы уже нашли перспективные и внушающие надежду вещества (компоненты — ред.) для создания многообещающих лекарств против бокового амиотрофического склероза (БАС или болезнь моторных нейронов, заболевание, при котором наступает постепенная атрофия всех мышц организма, что в результате приводит к полному параличу; крайне редкое заболевание, во многом стало широко известным из-за того, что такой диагноз был поставлен знаменитому английскому ученому Стивену Хокингу, скончавшемуся в марте этого года, — ред.) и болезни Альцгеймера.
Думаю, что в дополнение к таким прикладным исследованиям крайне важны и фундаментальные. Фундаментальные исследования создают инновационные технологии и концепции, они незаменимы для долгосрочного развития научных технологий. Для этого наш центр CiRA ведет научную деятельность, фокусируясь на обоих направлениях — фундаментальной науке и прикладных исследованиях.
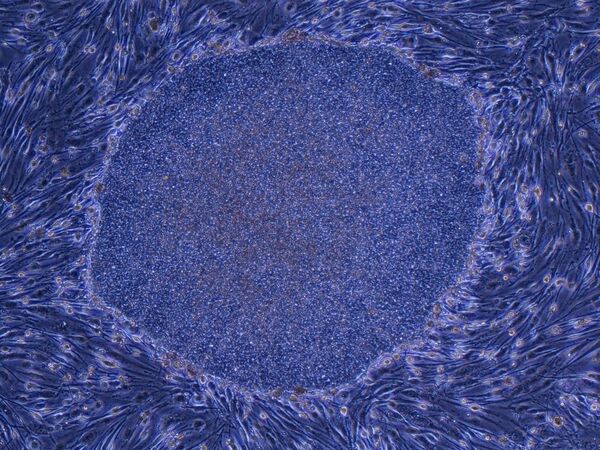
© Фото : предоставлено Центром CiRA (Center for iPS Cell Research and Application, Kyoto University) Клетка iPS
— Исходной точкой русского космизма — философией, которую разделяли Циолковский, Федоров, Вернадский и которая дала толчок для поисков и теоретического обоснования путешествий в космическом пространстве, стала идея о том, что человечество однажды научится излечивать болезни, заменять пришедшие в негодность органы, человек станет жить очень долго или вообще обретет бессмертие. Таким образом, избавить Землю от перенаселения смогут только поиски новых мест обитания во Вселенной. Изобретение клеток iPS приблизили осуществление этих пророчеств. Если заглянуть в далекое будущее, смогут ли они продлить человеческую жизнь до нескольких сотен лет или сделать человека бессмертным?

— Цель не в том, чтобы человек жил долго, но в том, чтобы он жил долго, оставаясь при этом здоровым. Благодаря совершенствованию лечения и улучшению условий гигиены в обществе, средняя продолжительность жизни возросла, но в Японии, например, разница между средней продолжительностью жизни и продолжительностью здоровой жизни составляет 10 лет. Не только в Японии, но и для устойчивого развития общества в целом важно как можно больше сократить этот разрыв. Я хотел бы внести свой вклад в то, чтобы продлить продолжительность здоровой жизни, чтобы как можно большее число людей были довольны своей жизнью.
— Как вы считаете, через 10, 50 и 100 лет насколько продвинутся исследования клеток iPS? Поделитесь, пожалуйста, вашим прогнозом. Как изменится мир благодаря исследованиям и лечению на основе клеток iPS?
— Технология клеток iPS родилась в 2006 году и еще очень молода. Поэтому до того момента, когда она сможет дойти до многих пациентов в виде новых способов лечения, потребуется время из расчета около 10 лет. Очень сложно делать прогнозы на будущее, но думаю, что через 10 лет будет начато лечение или клинические эксперименты с использованием технологии клеток iPS в отношении многих болезней. Конечно, нужно прежде всего посмотреть, каков будет прогресс в этой области, но если исследования принесут плоды, то надеюсь, что через 50 лет регенеративная медицина и новые лекарства с использованием технологий клеток iPS будут широко применяться для большого числа пациентов с различными заболеваниями. Через 100 лет на основе технологий клеток iPS появятся лекарства, о которых мы сейчас даже не подозреваем и не можем и думать. Я был бы рад, если смогу внести свой вклад и оказаться полезным для пациентов.
— Долгое время я не решалась обратиться к вам с просьбой об интервью, потому что считаю, что ваше время принадлежит людям с различными заболеваниями и отнимать его ради интервью неправильно. Как вы сами распределяете свое время между личным и общественным? Например, находясь на отдыхе, не испытываете ли вы какого-то давления, что это время могло быть посвящено исследованиям, которые пошли бы на пользу многим людям? Или, наоборот, что нужно отдыхать, иначе исследования и работа будут недостаточно эффективными? Какие методы вы применяете, чтобы найти баланс между личным временем и временем, посвященным работе и исследованиям?
— Как и многие исследователи, я не провожу четкой границы между on и off. Я все время думаю об исследованиях, но при этом каждый день занимаюсь бегом — это мое хобби, которое помогает освежить душу и тело. Очень часто именно во время пробежки мне приходят хорошие идеи и по поводу исследований, и по поводу другой моей работы.

Это фото LAKI 4F мышей с факторами Яманаки при приеме доксициклина и без, а также долгоживущие WT мыши с доксициклином (антибиотик) и факторами Яманаки. Смотрите на кривую изгиба позвоночника.
Сама статья в Cell. Для тех, у кого нет доступа — пользуйтесь sci-hub.io — пиратские научные статьи.
Опыт был проведен в институте Салка в Ла Холле, Южная Калифорния испанцем Бальмонте.
Все началось в 2006 году, когда японец Яманаки открыл 24 фактора (сейчас основные только 4 OSKM, с помощью которых и был проведен опыт) де-дифференциации или плюрипотентности клеток по обращению клеток, например кожи, обратно в стволовые клетки.
Затем, в 2013 году немец Хорватс нашел 353 эпигенитических маркера старения человека, по которым с точностью в 1.5 года определялся хронологический возраст человека. Для стволовых клеток этот возраст равнялся 0.
Для тех, кто интересуется: недавно ученый Гарвардского и Московского университета Вадим Гладышев, получивший мегагрант, определил те же эпигенетические биомаркеры биологического возраста мыши — популярно об этом сказано в блоге fightaging. Это очень важно для ускоренных разработок новых терапий или геропротекторов на мышах.
И небольшой инсайд на десерт. Сейчас компания Calico проводит опыт на 1000 мышах в Jackson Lab Стэнфорд разделенных на две группы — обычные долгоживущие мыши и те же мыши но на голодной диете, продлевающий жизнь мышей на рекордные 50% (и всего на 5% по последним данным на приматах). Когда опыт завершится таким образом спинофф компании Гугл надеется установить биомаркеры биологического возраста мыши, которые нужны для ускоренной разработки терапий или геропротекторов.(очевидно в процессе они берут анализы крови).
Так вот оказалось, что процесс обнуления не бинарный (либо стволовая, либо нет), а вполне себе постепенный. И если по клетке не шарахать лошадиными дозами коктейля Яманаки, а дать ей его лишь отхлебнуть, то эпигенетические маркеры не обнуляются, а лишь откатываются назад. Клетка при этом не меняет свой фенотип и так клеткой кожи или сердца и остается (то есть, в отличии от плюрипотентной, ещё не экспрессирует маркер Nanog — это для ботанов).
Таким образом Бальмонте откатил эпигенетические часы мышей у которых в геноме были кассеты Яманаки, которые активировались доксициклином и продлил мышам жизнь максимум на 33% и по медиане на 50%.
Если лабораторные мыши пили воду с доксициклином, — но только два дня в неделю, — они жили более, чем на тридцать процентов дольше. У диких мышей (которым только 12 месяцев), подвергнутых такой же те терапии, обновились мышцы и поджелудочные железы.
Слайды выступления Юрия Дейгина на Научной Среде в Библиотека им. Братьев Гримм. Нововаганковский переулок 22.

Это график дожития LAKI 4F мышей без факторов Яманаки и с факторами Яманаки, без доксициклина, с доксициклином.
Снизились критические маркеры старения:
— маркеры сенесцентных клеток p16Ink4a и бета галактодиаза
— маркер двухцепочечных разрывов ДНК gamma-H2AX
— маркер противоракового белка p53
— метталопротеазы
— интерлейкин-6
— митохондриальные активные формы кислорода
— удлинились теломеры(по опыту М. Бласко поставленном в Барселонне на тех же LAKI)
Напомню что Бальмонте провел опыт не самым оптимальным путем (но опыт сын ошибок трудных) — он вывел трансгенную линию мышей с генами Яманаки OSKM, у которых включалась транскрипция этих генов при приеме доксициклина (антибиотик) два раза в неделю подряд после чего они 5 дней отдыхали.
Как видно из графика ниже, если доксициклин давать не 2, а 3 дня, то мыши уже начинают дохнуть, при чём на 5-й день терапии дохнет половина:

Теперь остается подобрать оптимальные пропорции и тайминг этих факторов, а также способ доставки и режим дозирования, которые смогут продлить жизнь мышам гораздо дольше.
Обзор простым языком про открытие Бальмонте в журнале Science.
Чтобы провести этот опыт на человеке нужен AAB вирусный носитель с факторами Яманаки. Как предлагает Юрий Дейгин можно упростить опыт и делать AAB заточенный исключительно на гипоталамус (ну или шишковидное тело или гипофиз) и другие модификаторы развития и старения головного мозга. Также перспективно вообще не давать организму проводить эпигенетический сдвиг, но опыт который докажет такую возможность пока неизвестен.

Тем временем открылся сайт пациенской организации Open Longevity Фонда Наука за продление жизни.
Грядут Клинические испытание геропротекторов, пока специалистами предложена комбинация сартаны+статины, но сайт индифферентен к любым терапиям, в том числе к приему таких будущих геропротекторов как магний,NAC — N-acetyl-L-cysteine, глицин, гинко билоба (GinkGo Leaf)
На нем можно загружать анализы крови по биомаркерам старения выбранным специалистами.
В том числе автоматическая загрузка данных по кодам анализов лаб ИнВитро.
Эти данные потом будут указывать ваш биологический возраст, а также будет открытые данные с возможностью кросс-сравнения и любого исследования на этих биомаркеров людей от 20 до 70 лет.
Внизу 7 часовое видео лекций со встречи 26 ноября в техноХабе Ключ.Москва.Трехгорная мануфактура.
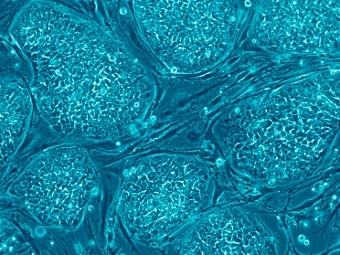
Лауреатами Нобелевской премии по медицине и физиологии в 2012 году стали Джон Гардон и Синъя Яманака. Оба они посвятили свою жизнь исследованию того, как клетки приобретают свою тканевую специализацию и как можно обратить этот процесс вспять. Главные публикации лауреатов разделили 40 лет бурного развития биологии: когда Гардону удалось получить яйцеклетку с пересаженным от фибробласта ядром, Яманака еще только родился. В 2006 году японский исследователь в каком-то смысле завершил тот путь, по которому впервые пошел Гардон: ему впервые удалось перепрограммировать зрелую специализированную клетку и превратить ее в плюрипотентную стволовую, от которой она когда-то произошла. Медицинские перспективы этих исследований настолько широки, что некоторые уже сейчас сравнивают их с открытием антибиотиков.
Необратимость специализации
Все многоклеточные организмы вырастают из одной-единственной клетки - зиготы, то есть оплодотворенной яйцеклетки. Как только зигота начинает делиться и образовывать новые клетки, их судьбы расходятся: какие-то клетки становятся нейронами, какие-то - клетками жировой ткани. Отдельная линия клеток со временем дает начало новым яйцеклеткам или сперматозоидам.

Дифференцировку клеток иногда сравнивают с падением с горы: упасть и попасть в определенную "долину специализации" легко, но вернуться назад невозможно. Нажмите, чтобы увеличить.
Хотя каждая из клеток организма (за редкими особыми исключениями) имеет геном, идентичный геному зиготы, приобретенная специализация накладывает отпечаток на ее дальнейшую судьбу. Полностью созревшая клетка обычно не только не способна поменять свою специализацию, но часто даже не может делиться.
К примеру, фибробласт, полученный из брюшины мыши и пересаженный в культуральную среду, скорее всего просто погибнет спустя несколько делений. Чтобы этого не произошло, мы можем взять вместо обычных клеток раковые, то есть получить так называемую бессмертную (иммортализованную) линию. Раковые клетки способны делиться неограниченно долго, однако даже спустя десятки лет и десятки тысяч клеточных поколений они остаются такими же, как и были: фибробласты остаются фибробластами, а гепатоциты - гепатоцитами.
Конечно, даже у взрослого организма существуют слабо специализированные клетки, из которых получаются несколько видов зрелых клеток. Такие слабо специализированные клетки делятся и восполняют потери организма. В широком смысле их называют стволовыми клетками, а точнее - мультипотентными клетками. Именно из них формируются новые клетки крови, из них образуются новые клетки эпителия (смена которого, между прочим, так же важна для существования организма, как и гематопоэз), они осуществляют регенерацию поврежденных тканей.
Для человека необратимость клеточной специализации означает одно: возможности регенерации тканей у взрослого организма оказываются крайне стесненными. Потеряв значительное число стволовых клеток, организм со временем перестает возобновляться, начинается необратимое старение. Например, хорошо известно, что стволовые клетки мозга почти полностью исчезают еще во время внутриутробного развития и в дальнейшем не восстанавливаются. Они остаются в дремлющем состоянии и активируются например, при инсульте. Однако, тот нейрогенез, который происходит во взрослом возрасте, расходует невосполнимый ресурс этих клеток и в конце концов заканчивается.
Интересно, что даже естественный отбор в данном случае играет против человека. Ресурса оставшихся с эмбрионального развития стволовых клеток обычно хватает на то, чтобы дожить до репродуктивного возраста, а то, что происходит потом, отбор "не интересует". Скорее наоборот - при появлении мутации, которая хоть немного способствует размножению, но при этом сокращает возможности регенерации во взрослом возрасте, она будет отобрана и сохранится в поколениях.
Фантастический эксперимент

Джон Гардон (Sir John B. Gurdon). Фото пользователя Rubenstein с сайта Flickr
Представление о необратимости клеточной специализации сформировалось в первой половине двадцатого века, еще задолго до открытия структуры ДНК. Биологи прошлого, конечно, не знали всех тех деталей этого процесса, которые мы знаем теперь, но они твердо понимали одно: животные не размножаются почкованием и, в отличие от растений, из их клеток нельзя получить эмбрион.
Тем не менее, еще в это время, в 1935 году, немецкий эмбриолог Ханц Шпеман предположил, что каким-то образом процесс клеточной специализации можно повернуть вспять.
В своем классическом эксперименте он показал, что клетки эмбриона на самых ранних стадиях развития обладают тотипотентностью, то есть способны развиться в полноценный организм. Для этого он перетягивал оплодотворенную икринку саламандры с помощью волоска так, чтобы ядро оказалось отделено от цитоплазмы. После того как ядро проходило несколько первых делений, Шпеман ослаблял натяжение и позволял одному из 16 образовавшихся ядер проникнуть через перемычку в цитоплазму. Затем, ученый перемычку затягивал вновь, и на этот раз до конца. При этом у него получалась клетка, имеющая цитоплазму зиготы и ядро одного из бластоцитов. Оказалось, что из такой клетки впоследствии развивается полноценное животное, а значит, по крайней мере во время первых четырех делений, никакой специализации в эмбрионе не происходит.
Именно Шпеман первым предложил "фантастический эксперимент", в ходе которого ядро зрелой клетки предполагалось пересадить в некую лишенную ядра цитоплазму, в которой оно сможет проявить свой потенциал развития.
В 1955 году такой эксперимент на леопардовой лягушке Rana pipiens удалось осуществить Бригсу и Кингу. Они показали, что ядро зрелой клетки при переносе в цитоплазму не способно, в отличие от ядра эмбриона, дать полноценный организм. Из чего ученые сделали вывод о том, что после какого-то деления специализация становится необратимой и ядро теряет свой потенциал развития.
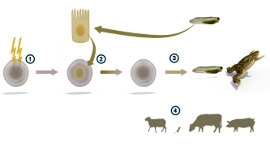
Гардон удалял ядро из яйцеклеток при помощи УФ-облучения, а затем инъецировал в них ядро из эпителия головастика. Из полученной клетки развивалась нормальная лягушка. Впоследствии эту технологию применили для овец, мышей, свиней, собак и других животных.
Однако то, что основано, как полагали ученые, на фундаментальном законе природы, оказалось всего лишь неудачей при выборе объекта. Нынешнему нобелевскому лауреату, Джону Гардону, который в то время работал в Оксфорде, повезло гораздо больше: вместо леопардовой лягушки он для своих экспериментов выбрал шпорцеву (род Xenopus). И там, где Бригс и Кинг потерпели неудачу, Гардон добился блистательного успеха: ядра, взятые из эпителиальных клеток головастика, при переносе в безъядерные яйцеклетки амфибий оказались способны развиваться в полноценных лягушек.
Полученные Гардоном результаты были настолько удивительными, что очень многие биологи отнеслись к ним весьма настороженно. Ученому пришлось много раз повторять эксперимент во все новых вариациях, чтобы убедить научное сообщество в своей правоте. В частности, в 1966 году ему удалось повторить эксперимент, используя ядра не из головастиков, а из половозрелых лягушек. Кроме того, он также использовал эмбриональные ядра и добился идентичного результата.
Эксперимент Гардона изменил парадигму мышления эмбриологов его поколения и вошел во все приличные учебники биологии. Именно этот эксперимент стал основой технологии клонирования овечки Долли, которое по какой-то причине широкой публике известно лучше, чем открытие англичанина. За прошедшие 50 лет технология клонирования сильно изменилась технически и расширила спектр подвластных ей организмов, но принцип, заложенный Гардоном, остался тот же.
Японское чудо

Синъя Яманака (Shinya Yamanaka) Фото Rubenstein
К началу 2000-х годов биологи уже понимали, что перепрограммировать соматическую клетку и получить из нее стволовую вполне возможно. В это время ученые уже имели развитую технологию пересадки ядер и, что не менее важно, методы массового анализа активности генов в разных тканях и разных клетках. С другой стороны, все понимали, что такая работа потребует тщательного планирования, очень большого числа попыток и может длиться годами. Забавно, что проделать эту кропотливую работу впервые удалось именно японцу.
Синъя Яманака, как уже было сказано, родился в том же 1962 году, когда вышла статья Гардона. Он получил медицинское образование и даже проработал несколько лет в Национальном Госпитале в Осаке. В середине 90-х годов Яманака уехал в Америку и работал в Калифорнийском университете, но эксперименты, которые принесли ученому мировую славу и Нобелевскую премию, он осуществил на родине, где работает и до сих пор.
Японский ученый проанализировал те гены, которые всегда "включены" в эмбриональных стволовых клетках, но не работают у зрелых клеток организма. Среди них ученый выделил гены 24 транскрипционных факторов - регуляторных белков, которые включают или выключают работу других генов.
Обычно работа транскрипционных факторов построена по иерархическому принципу - транскрипционные факторы высокого уровня включают определенные гены более низкого уровня, которые, в свою очередь, также кодируют транскрипционные факторы. Все эти гены работают как некие переключатели, которые управляют "переводом стрелок" на путях развития клеток. Их взаимодействие происходит обычно очень сложно, и связи между транскрипционными факторами разного уровня часто представляют собой "мешанину", в которой очень непросто разобраться. Кроме того, говоря о работе генов, необходимо учитывать, что биология до сих пор, в общем-то, не количественная наука и информации о конкретных концентрациях, в которых работают транскрипционные факторы, обычно не существует.
Все это позволяет представить тот уровень смелости, который потребовался Яманаке, чтобы осуществить свой эксперимент. Чтобы включить в соматических клетках "стволовые" транскрипционные факторы, он вводил их гены в перманентно активном состоянии в составе вирусных частиц в зрелые клетки соединительной ткани. При этом активные гены транскрипционных факторов встраивались непосредственно в хромосомную ДНК этих клеток. Вместо того чтобы вводить эти гены постепенно, Яманака сразу внедрил 24 гена-кандидата, а затем по одному удалял их из этой гигантской конструкции, наблюдая за изменением поведения клеток.
Таким образом ему удалось найти четыре гена: Oct4, Sox2, Klf4, c-Myc, активации которых было достаточно для того, чтобы превратить фибробласт в стволовую клетку, способную стать любой клеткой организма (за исключением трофических клеток плаценты). Такие клетки Яманака назвал индуцированными плюрипотентными клетками (iPC), чтобы отличать их от исходных эмбриональных плюрипотентных клеток.
Работа японского ученого сразу стала настоящей сенсацией в биологии: в 2007 году уже был понятен потенциал использования стволовых клеток. Кроме того, ученые уже столкнулись с большими препятствиями при работе с эмбриональными стволовыми клетками: об их правах стали говорить организации озабоченных граждан. Использование же индуцированных стволовых клеток давало ученым карт-бланш, так как снимало все этические проблемы, связанные с работой с эмбрионами.
В последующие годы ученым удалось существенно улучшить технологию Яманаки и глубже понять механизм перепрограммирования.
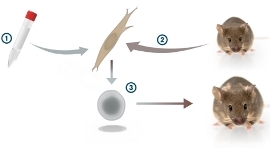
В мышиный фибробласт Яманака вводил гены транскрипционных факторов (представлены пробиркой). Нажмите, чтобы увеличить.
Основные сложности с оригинальной методикой заключались в том, что введенные гены продолжали работать даже тогда, когда это было не нужно. В следующем после публикации 2008 году стало понятно, что при работе с нервными стволовыми клетками можно для индукции плюрипотентности использовать не четыре, а всего два гена транскрипционных факторов. Кроме того, используя индуцированную рекомбинацию, эти гены можно было удалить после использования.
Затем, в 2009 году, той же группе ученых удалось перепрограммировать клетки вообще без встраивания генов транскрипционных факторов в ДНК - в новом варианте они вводились на временной "флешке", плазмиде, которая затем при делении клеток терялась.
В том же году группе китайских ученых удалось показать, что из полученных методом Яманаки клеток iPC могут развиться нормальные эмбрионы. Для этого ученым пришлось пойти на хитрость: использовать помимо iPC также их тетраплоидные гибриды - клетки, получившиеся в результате слияния исходных iPC. Из них в дальнейшем развивалась плацента, а из исходных клеток - эмбрион. Мышку, полученную таким образом, ученые назвали Tiny (подробнее об этом можно прочитать, например, здесь.)
Вместо заключения
Научное и медицинское значение работы Яманаки стало понятно специалистам еще в 2006 году. Мало кто из биологов сомневался, что японскому ученому когда-нибудь достанется Нобелевская премия. Неожиданностью оказалось скорее то, что это произошло так быстро. С другой стороны, Гардону заслуженной награды пришлось ждать ровно полвека.
Получение индуцированных стволовых клеток в произвольном количестве потенциально способно снабдить человека инструментами активации регенерации и продления жизни. Наиболее очевидное их применение связано с лечением болезни Паркинсона или бокового амиотрофического склероза. Однако до этого пока еще очень далеко. Все-таки те транскрипционные факторы, которые возрождают в соматических клетках былые эмбриональные способности, не зря называются онкогенами - безопасность их использования еще предстоит проверить и перепроверить.
Пока же ученые получили замечательную технологию для изучения механизмов дифференцировки клеток, а широкая публика - захватывающую научную историю протяженностью в 50 лет.
Читайте также:

