Катализ в биологии реферат
Обновлено: 05.07.2024
Это так называемая первичная структура фермента, где R - боковые остатки, или важнейшие функциональные группы белков, возможно, выступающие в качестве активных центров ферментов. На эти боковые группы и ложится основная нагрузка при работе фермента, пептидная же цепь играет роль опорного скелета. Согласно структурной модели Полинга - Кори, она свернута в спираль, которая в обычном состоянии стабилизирована водородными связями между кислотными и основными центрами:
Для некоторых ферментов установлены полный аминокислотный состав и последовательность расположения их в цепи, а также сложная пространственная структура. Но это все же очень часто не может помочь нам ответить на два главных вопроса:
1) почему ферменты так избирательны и ускоряют химические превращения молекул только вполне определенной структуры (которая нам тоже известна);
2) каким образом фермент снижает энергетический барьер, т. е. выбирает энергетически более выгодный путь, благодаря чему реакции могут протекать при обычной температуре.
Строгая избирательность и высокая скорость - два основных признака ферментативного катализа, отличающие его от лабораторного и производственного катализа. Ни один из созданных руками человека катализаторов (за исключением, пожалуй, 2-оксипиридина) не может сравниться с ферментами по силе и избирательности воздействия на органические молекулы.
Активность фермента, как и любого другого катализатора, тоже зависит от температуры: с повышением температуры возрастает и скорость ферментативной реакции. При этом обращает на себя внимание резкое снижение энергии активации Е по сравнению к некаталитической реакцией. Правда, это происходит не всегда. Известно много случаев, когда скорость возрастает благодаря увеличению независящего от температуры предэкспоненциального множителя в уравнении Аррениуса.
Для иллюстрации необычайно высокой эффективности ферментов приведем два примера и сравним действие обычного кислотного катализатора с ферментативными. В качестве меры активности приведем все три параметра уравнения Аррениуса - константу скорости (k, л/моль*сек), предэкспоненциальный множитель А и энергию активации (Е, ккал/моль).
Гидролиз мочевины:
Эти примеры особенно интересны в том отношении, что в первом случае увеличение константы скорости в присутствии уреазы обусловлено главным образом снижением энергии активации (на 17-18 ккал/моль), тогда как во втором - влияние миозина на константу скорости осуществляется за счет увеличения предэкспонциального множителя.
Активность фермента зависит также от кислотности среды, в которой протекает химическая реакция. Примечательно, что кривая этой зависимости от рН среды напоминает колоколообразные кривые кислотно-основного катализа.
Создается впечатление, что ферментам предоставлено право решать, что в данном конкретном случае им выгодно - организовать более прочную связь активного центра с молекулой субстрата или произвести разупорядочение своей структуры.
Увеличение кислотности среды будет благоприятно для одних элементарных стадий и неблагоприятно для других. При наличии таких конкурирующих фактов, как нетрудно догадаться, должна существовать некоторая оптимальная кислотность среды, при которой фермент может работать с максимальной эффективностью.
Итак, анализ зависимостей скорости от рН является весьма эффективным средством идентификации функциональных групп белковой молекулы фермента, участвующих в процессе активации молекул субстрата. Зная природу активных центров, можно представить себе, как они работают. Конечно, при этом приходится пользоваться теми же представлениями о механизме элементарных актов, которые сложились при изучении обычных реакций органической химии. Вводить какие-то особые механизмы нет никакой необходимости. Существует твердое убеждение в том, что работа фермента сводится, в конечном счете к совокупности простых операций, аналогичных тем, которые совершаются при взаимодействии органических молекул в обычных пробирочных условиях.
Выполнила студентка: гр.1912
Салеева Н.Н.Проверила: ХуснутдиноваГ.Р.
Нижнекамск 2013г
СОДЕРЖАНИЕ
Введение 3
Кислотный катализ 4
Основнойкатализ 7
Кислотно-основной катализ 8
Общий кислотный катализ 11
Список использованной литературы15
КАТАЛИЗ - ускорение химических реакций под действием малых количеств веществ (катализаторов), которые сами в ходе реакции не изменяются. Каталитические процессы играют огромную роль в нашей жизни. Биологические катализаторы, называемые ферментами, участвуют в регуляции биохимических процессов. Без катализаторов не могли бы протекать многиепромышленные процессы.
Важнейшее свойство катализаторов – селективность, т.е. способность увеличивать скорость лишь определенных химических реакций из многих возможных. Это позволяет осуществлять реакции, протекающие в обычных условиях слишком медленно, чтобы им можно было найти практическое применение, и обеспечивает образование нужных продуктов.
Применение катализаторов способствовало бурному развитию химическойпромышленности. Они широко используются при переработке нефти, получении различных продуктов, создании новых материалов (например, пластмасс), нередко более дешевых, чем применявшиеся прежде. Примерно 90% объема современного химического производства основано на каталитических процессах. Особую роль играют каталитические процессы в охране окружающей среды.
1.Кислотный катализ
Каталитическаяактивность большого класса катализаторов обусловливается их кислотными свойствами. Согласно И.Брёнстеду и Т.Лоури, кислота – это соединение, способное отдавать протон. Сильные кислоты легко отдают свои протоны основаниям. Концепция кислотности получила дальнейшее развитие в работах Г.Льюиса, который дал определение кислоты как вещества, способного принимать электронную пару от вещества-донора с образованиемковалентной связи за счет обобществления этой электронной пары. Эти идеи вместе с представлениями о реакциях с образованием карбений-ионов помогли понять механизм разнообразных каталитических реакций, особенно тех, в которых участвуют углеводороды.
Силу кислоты можно определить с помощью набора оснований, изменяющих цвет при присоединении протона. Оказывается, некоторые промышленно важныекатализаторы ведут себя как очень сильные кислоты. К ним относится катализатор процесса Фриделя – Крафтса, такой, как HCl-AlCl2O3 (или AlCl4), и алюмосиликаты. Сила кислоты – это очень важная характеристика, поскольку от нее зависит скорость протонирования – ключевого этапа процесса кислотного катализа.
Активность таких катализаторов, как алюмосиликаты, применяющихся при.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Биологические катализаторы"
Начнём с цитаты известного советского химика и инженера, академика Георгия Константиновича Борескова:
Неуютная картина, не правда ли? Поэтому сегодняшняя наша цель – разобраться, почему же Земля всё-таки выглядит более привычно для нашего глаза.

Для протекания многих химических реакций необходимы специальные условия. Чаще всего на скорость реакций влияют температура и давление. Чем они выше, тем быстрее протекает химическая реакция. Но её скорость можно увеличить, не изменяя внешних условий, а просто добавив к реагирующей смеси определённые вещества. Так, металлический родий почти в 10000 раз ускоряет разложение муравьиной кислоты на углекислый газ и водород. Такие вещества, увеличивающие скорость реакции, но не входящие в состав продуктов реакции, называются катализаторами.
В клетках живых организмов каждую секунду происходят тысячи химических реакций.
И это несмотря на то, что в живой клетке умеренная температура и нормальное давление. Например, бактерии из рода Азотобактер могут при обычных условиях разрывать прочнейшую молекулу азота, где атомы соединены тремя ковалентными связями и присоединять их к водороду. А для того, чтобы проделать то же самое человеку в промышленности, необходимо создать давление в 350 раз большее, чем на поверхности Земли и поднять температуру до 500 градусов Цельсия.
Естественно, бактерии не обходятся при этом без катализаторов. Кстати, люди также пытались применить их при получении аммиака. Перепробовав при этом более 20000 различных веществ.
Что же за всесильные вещества – эти катализаторы?
Катализаторами химических реакций в неживой природе могут быть самые различные вещества. Это и уже упомянутый нами экзотический родий, который используется для изготовления зеркал супермощных лазеров и обычный оксид марганца, применяемый для получения кислорода даже в школьной лаборатории.
Кроме того, неорганические катализаторы могут ускорять реакции с разными веществами. Например, родий не только эффективно разлагает муравьиную кислоту, но и борется с выбросами вредных оксидов азота в автомобильных катализаторах.
Другое дело – биологические, а значит, органические катализаторы. На них мы остановимся более подробно.
Многочисленные исследования прошлого нашей планеты говорят о том, что на начальном этапе зарождения жизни каталитической способностью обладали некоторые молекулы рибонуклеиновых кислот.

И тогда это свойство РНК имело очень важное значение. Сегодня же роль молекул РНК как катализаторов крайне мала. А основными биокатализаторами в клетке являются ферменты. Которых уже к 2013 году было описано более пяти тысяч видов.
Абсолютно все процессы в живом организме прямо или косвенно осуществляются с участием ферментов или энзимов, как их ещё называют. Это и фиксация углерода в процессе фотосинтеза, и расщепление питательных веществ в пищеварительном тракте, и синтез источника энергии для всех живых организмов – АТФ, и многое –многое другое.
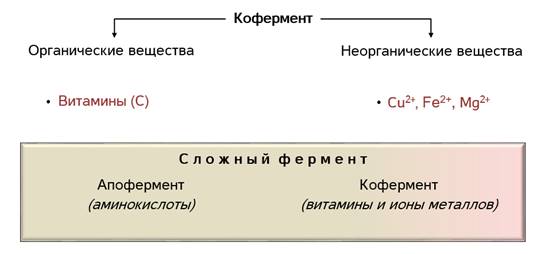
Как вы помните, по химической природе биологические катализаторы относятся к белкам. Они могут быть как простыми, состоящими только из аминокислот, так и сложными, включающими белок и небелковую часть – простетическую группу. Простетическая группа фермента называется кофермент, а белковая часть – апофермент.
В роли коферментов выступают органические и неорганические вещества. Среди органических это могут быть витамины, например, аскорбиновая кислота. А из неорганических – ионы различных металлов. Например, ионы меди, железа, магния.
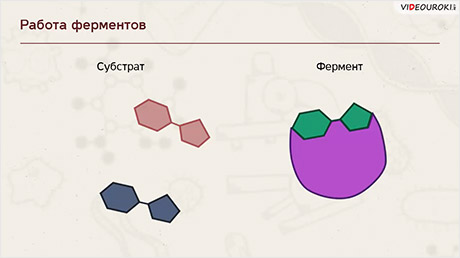
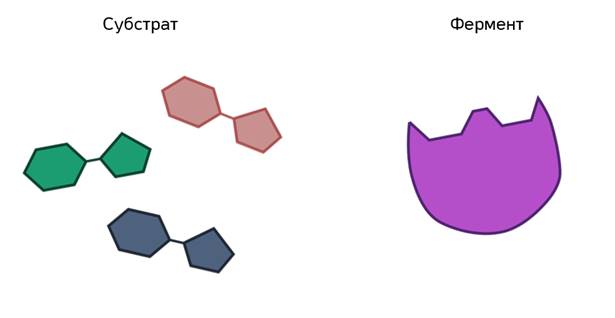
Ферменты ускоряют химические реакции за счёт тесного взаимодействия с молекулами исходных реагирующих веществ – так называемых субстратов. Зачастую размеры молекул субстратов значительно меньше размеров молекул самих ферментов, хотя, казалось бы, должно быть наоборот. Поэтому с субстратом или субстратами, потому что их может быть несколько, взаимодействует не вся молекула фермента, а лишь небольшой её участок – активный центр фермента. Построен он чаще всего из нескольких аминокислотных остатков, которые образуют его уникальную структуру. Почему уникальную? Дело в том, что форма и химическое строение активного центра таковы, что с ним могут связываться только те субстраты, структура которых подходит к структуре активного центра.
Магия этого процесса неизвестна до сих пор. Несмотря на то, что человечество в ближайшее время планирует полёты на Марс, оно не в состоянии разобраться со своим организмом. Но существует теория. Её выдвинул ещё в 1890 году немецкий химик Эмиль Фишер.
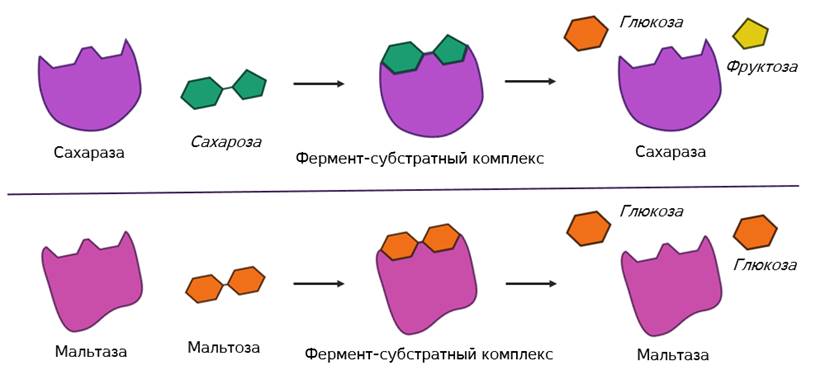
В этом комплексе молекула субстрата деформируется и в её структуре ослабляются определённые химические связи. Что приводит к облегчённому их разрыву и в конечном итоге к ускорению химической реакции.
После этого фермент-субстратный комплекс распадается на конечные продукты и свободный фермент, а активный центр последнего тут же готов принимать новые молекулы субстрата. Получаем такой же итог, как и в случае работы обычных химических катализаторов – скорость реакции увеличивается, а сам катализатор при этом не расходуется и может использоваться многократно.
Но в самом механизме работы органических и неорганических катализаторов есть кардинальное отличие. Каждый фермент действует только на определённый тип связи и ускоряет только одну определённую реакцию. То есть обладает специфичностью. Как вы поняли, специфичность объясняется соответствием активного центра только определённым субстратам. Поэтому, например, фермент мальтаза, разлагающий дисахарид мальтозу до двух молекул глюкозы оказывается не способным разрушать молекулы сахарозы. Несмотря на то, что сахароза также является дисахаридом.
Активирующее влияние на скорость ферментативной реакции оказывают разнообразные вещества органической и неорганической природы. Например, в желудке человека соляная кислота активирует фермент пепсин. Максимальная активность которого лежит в пределах рН от полутора до двух.
Ингибирование ферментов может быть обратимым и необратимым. Если вещество-ингибитор вызывает стойкое изменение пространственной структуры фермента, то такое ингибирование будет необратимым.
А вот обратимое ингибирование, в свою очередь, бывает двух типов. Давайте их рассмотрим.
С активным центром фермента могут связываться вещества, сходные по структуре с субстратом. Никакой реакции при этом нет, но между ингибиторами и субстратом происходит конкуренция за активный центр. Поэтому такой тип ингибирования называется конкурентным.
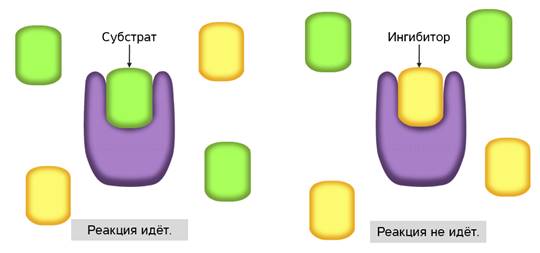
Конкурентное ингибирование широко используется в медицине. Антибиотики, противоопухолевые препараты, используемые в качестве лекарственных средств, являются конкурентными ингибиторами.
В неконкурентном ингибировании не участвуют вещества, сходные с субстратом. При таком типе ингибирования, молекулы ингибиторов присоединяются к регуляторному центру фермента. Это вызывает изменение пространственной структуры активного центра, что препятствует присоединению к нему молекул субстрата. Тем самым снижается скорость ферментативной реакции.
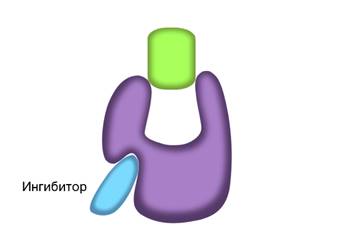
Уникальные способности ферментов уже много лет используются человеком в хозяйственной деятельности. В настоящее время развивается новая отрасль науки – промышленная энзимология. Которая, в свою очередь, является основой биотехнологии.
Мы уже упоминали об использовании ферментов в медицине. Фармацевтическая промышленность научилась производить искусственный аналог гормона надпочечников кортизола – преднизолон. Который используется при лечении ревматоидного артрита.
Широкое применение ферменты-энзимы находят также в пищевой промышленности. Их применяют в производстве сыров, соков, овощных и фруктовых пюре. Не обходится без применения ферментов хлебопечение, производство алкогольных напитков. Для улучшения вкуса, аромата и консистенции их применяют для обработки мяса.
В текстильной и кожевенной промышленности ферменты позволяют значительно увеличить выход овчины, а обработка кожи перед дублением делает её поверхность чистой, гладкой и тонкой.
Перспективным является применение ферментов, разлагающих целлюлозу. В результате этого из древесины, торфа, сельскохозяйственных и городских отходов можно получить ценные биотехнологические продукты: глюкозу, этанол, ацетон и другие. Особую актуальность это имеет в наши дни, когда проблема загрязнения окружающей среды выходит на передний план.

Скорость реакции часто зависит от присутствия в системе “постороннего” вещества с которым реагенты способны образовывать промежуточные соединения (активированный комплекс) и этим ускорять реакцию. Такие “посторонние” вещества называют катализаторами.
Катализатором называют такое вещество, которое своим присутствием и участием в реакции изменяет скорость, но в конечном итоге выделяется в первоначальном (качественном и количественном) виде. Увеличение скорости реакции при помощи катализатора называют катализом. Если катализатор находится в таком же агрегатном состоянии что и реагенты и между взаимодействующими веществами и катализатором нет поверхности раздела, то такой катализ называют гомогенным.
Сущность и механизм гомогенного катализа.
Исходные вещества (реагенты) превращаясь в продукты реакции должны преодолеть энергетический барьер, равный энергии активизации Еа.
Сущность гомогенного катализа заключается в том, что катализаторы уменьшают величину энергетического барьера. Это происходит по следующему механизму: катализатор взаимодействует с одним из реагентов, образуя промежуточный комплекс. Затем этот промежуточный (активированный) комплекс взаимодействует с вторым реагентом, образуя конечные продукты и высвобождая катализатор в неизменном первоначальном виде.
За счет образования промежуточного комплекса реагент-катализатор энергетический барьер уменьшается на величину ΔЕкат.. Примером гомогенного катализа может служить реакция окисления SO2 в SO3 в нитрозном способе получения серной кислоты.
Без катализатора реакция идет медленно и процесс неэффективный. Катализатор, оксид азота (II), первоначально взаимодействует с кислородом, образуя активированный комплекс NO2.
Затем это промежуточное соединение легко взаимодействует с оксидом серы (IV), окисляя его до SO3 и выделяя в первоначальном виде катализатор.
Применение катализатора NO сопровождается уменьшением энергетического барьера на величину ΔЕкат. и значительно ускоряет реакцию.
Особенности кинетики гетерогенных реакций.
Гетерогенные реакции – это реакции между химическими реагентами, находящимися в различных агрегатных состояниях. Таких процессов очень много. К ним относятся горение топлив, взаимодействие металлов с кислотами, получение азотной кислоты абсорбцией оксидов азота водой, выщелачивание кислотами руд, обработка нефтепродуктов серной кислотой и др.
Особенностью гетерогенных процессов является то, что взаимодействие между реагентами происходит на границе раздела фаз. На скорость таких реакций влияют как химические так и физические факторы. К последним относятся величина поверхности раздела фаз и быстрота переноса вещества из объема к границе раздела и от нее в объем. Для увеличения поверхности раздела фаз необходимо твердое вещество измельчать и распылять один из двух несмешивающихся жидких реагентов. Следовательно, на скорость гетерогенных реакций влияет степень дисперсности реагента. Так как твердое вещество в результате взаимодействия изменяет только свою массу (концентрация его всегда постоянна), то в кинетическое уравнение закона действующих масс твердое вещество не включается.
Как уже было сказано, химическая реакция в гетерогенных системах протекает на поверхности раздела фаз. Для того, чтобы непрерывно протекала реакция необходима постоянная доставка реагента к поверхности раздела фаз и уноса с нее уже образовавшегося вещества. Как видим, процесс делится на три последовательные стадии: диффузия реагента в зону взаимодействия, химическая реакция, удаление продукта реакции.
В соответствии с теорией диффузии: диффузионный поток тем интенсивнее, чем больше разность между концентрацией реагента в данной точке объема (Со) и в зоне реакции (Ср), больше коэффициент диффузии Д и меньше толщина слоя (δ), через который происходит массопередача. В случае стационарного режима (т.е. режима, при котором за рассматриваемый промежуток времени на реакцию расходуется все вещество, доставленное к поверхности раздела фаз), скорость реакции может быть рассчитана по следующему уравнению, связывающему скорость процесса с химическим (К) и диффузионным (Д/δ=β) факторами.
Здесь встречается два случая:
Медленно протекает сама химическая реакция. (K мало, “химическое сопротивление” К–1 значительное. Процесс протекает в так называемой кинетической области. Для увеличения скорости необходимо применять те же способы воздействия на реакцию, как в гомогенных системах.
Медленным является сам процесс переноса вещества (велико “диффузионное сопротивление” β–1). В этом случае для увеличения скорости применяют перемешивание.
Гетерогенный катализ.
Если взаимодействующие вещества и катализатор находятся в разных фазовых (агрегатных) состояниях, катализ – гетерогенный. В гетерогенных каталитических реакциях катализатором является твердое вещество. Например, платиновый катализатор используется при окислении аммиака, катализаторы на основе меди и золота – при синтезе высокомолекулярных соединений (пластмасс и смолы), цинка и хрома – в производстве метанола, ванадий – при получении серной кислоты и т.д.
В случае гетерогенного катализа взаимодействие между реагентами протекает на поверхности катализатора. Механизм процесса состоит из 5-и стадий.
Первая стадия – диффузия реагентов к катализатору.
Вторая стадия – адсорбция реагентов на поверхности катализатора. (на этой стадии происходят изменения в электронном строении реагентов и снижается энергетический барьер).
Третья стадия – реакция на поверхности катализатора.
Четвертая стадия – десорбция продуктов реакции.
Пятая стадия – диффузия продуктов в объем.
Ускорение процесса при гетерогенном катализе, как и в гомогенном, объясняется образованием активированного комплекса. Для увеличения поверхности катализатора его стараются делать губчатым. На выступающих точках (вершинах) катализатора, называемых активными центрами не только адсорбируются молекулы реагентов, но и претерпевают изменения, в результате которых облегчается образование конечных продуктов.
Рассмотрим этот процесс на примере синтеза аммиака:
После адсорбции азота и водорода на поверхности твердого катализатора происходит разрыв связей между атомами азота в молекуле азота N≡N и между атомами водорода в молекуле водорода Н–Н. На эту операцию затрачивается энергия. Однако каждая разорвавшаяся связь в молекуле азота, так же и в молекуле водорода насыщается за счет образования связи с катализатором. Образуется промежуточный комплекс Kat–N и Kat–H. Происходит выделение энергии, чем частично компенсируется затрата энергии на разрыв связей в молекулах реагентов. На последующем этапе происходит разрыв связей в промежуточных комплексах Kat–N и Kat–H и образование молекул продуктов реакции NH3. При этом выделяется значительная энергия и катализатор высвобождается для дальнейших актов взаимодействия.
Иногда для усиления эффективности катализатора применяют дополнительные вещества, называемые промоторами. Промоторы сами не являются катализаторами, но повышает активность катализаторов. Например, применяемый в производстве серной кислоты катализатор V2O5 повышает свою активность в присутствии оксида бария или алюминия.
За счет уменьшения энергии активации путем применения катализаторов скорость реакции возрастает во много раз. В следующей таблице 10.1. приведены значения энергии активации некоторых процессов без катализатора и с катализатором.
Читайте также:
- Реферат правовое регулирование деятельности политических партий
- Политические права и свободы человека и гражданина механизмы их реализации реферат
- Современные модели новых видов учреждений дополнительного образования реферат
- Реферат государственное управление понятия содержание цель и задачи
- Культурная политика россии история и современность реферат

