Государственная фармакопея рк реферат
Обновлено: 05.07.2024
Медицинской общественности стран 31 мая 2007г. Был представлен 1 том Государственной фармакопеи РК.
Сегодня фармацевтический рынок нашей страны насчитывает более 7 тысяч наименованийлекарственных препаратов. Их качество теперь будет регламентироваться сводом государственных стандартов и правил - Государственной фармакопеей РК. Основу Государственной фармакопеей нашей страны положены принципы, подходы иметоды Европейской фармакопеи. Но наряду с общеевропейскими требованиями к качеству лекарственных средств, отечественная фармакопея содержит и национальную часть, учитывающую особенностифармацевтического рынка республики. Следует при этом добавить, что наша республика стала одной из немногих стран – участниц Содружества Независимых Государств, разработавшая и создавшая собственную ГФ.
Государственнаяфармакопея республики – это результат большого труда ученых – фармакологов, всего авторского коллектива, здесь есть заслуга и Минздрава, Комитета фармации, под пристальным вниманием которых находилась эта работа. Всоответствии с Посланием Главы нашего государства народу Казахстана в стране многое делается по развитию и реформированию системы здравоохранения, в том числе лекарственному обеспечению населения.Действия международных фармакопей на территории Казахстана введено приказом Комитета фармации Минздрава республики №21 от 11 февраля 2004 года.
В настоящее время регуляторными органами страны ипроизводителями лекарственных средств достигнуто ясное понимание неизбежности перехода к современным требованием качества. Только строгое следование этим требованиям позволит обеспечитьконкурентоспособность и экспортооринтированность отечественного производства. Реальным воплощением тенденций в данной области явились разработка и утверждение в декабре 2006 г национальных стандартов в сфере обращения ЛС:
-Надлежащей лабораторной практики (GLP)
- Надлежащей клинической практики (GCP)
- Надлежащей производственной практики (GMP)
- Надлежащей.
Чтобы читать весь документ, зарегистрируйся.
Связанные рефераты
фармакопея
. Фармакопея Жоспар: I- бөлім. Кіріспе II-бөлім. Негізгі.
Государственная фармакопея ссср
. ГОСУДАРСТВЕННАЯ ФАРМАКОПЕЯ СССР. XI ИЗДАНИЕ (ВЫПУСК 1. "ОБЩИЕ МЕТОДЫ АНАЛИЗА").
12 Стр. 26 Просмотры
Казахстан
. Введение Республика Казахстан играет особую роль в обеспечении экологической.
10 Стр. 3 Просмотры
Казахстан
. Республика Казахстан представляет собой государство, расположенное на северо-западе Азии и.
Казахстан
. Бepезoвский Максим Созонтович Есть творческие судьбы в российской культуре, которые окружены ореолом.
В период существования Казахстана в составе России, а затем Советского Союза государственный контроль за качеством лекарственных средств осуществлялся на основе стандартов и положений Государственной Русской фармакопеи, а после, начиная с 1926 года, – Государственной фармакопеи СССР. Последние издания ГФ СССР – Х (1969 г.) и XI (1987 г. - 1 вып., 1990 г. - 2 вып.) сохранили свой законодательный характер в республике до сего времени.
Прикрепленные файлы: 1 файл
гф рк.docx
На тему :
Проверила:Щедрова Н.В.
Выполнила:Жумагалиева
2013г
О государственной фармакопее Республики Казахстан
Создание Государственной фармакопеи Республики Казахстан осуществляется впервые за всю многовековую историю Казахской государственности.
В период существования Казахстана в составе России, а затем Советского Союза государственный контроль за качеством лекарственных средств осуществлялся на основе стандартов и положений Государственной Русской фармакопеи, а после, начиная с 1926 года, – Государственной фармакопеи СССР. Последние издания ГФ СССР – Х (1969 г.) и XI (1987 г. - 1 вып., 1990 г. - 2 вып.) сохранили свой законодательный характер в республике до сего времени.
Однако в новых экономических условиях развитие фармацевтического рынка Казахстана имеет свои особенности, которые не могут быть в полной мере регламентированы прежними правовыми актами, в том числе советскими изданиями фармакопеи. Кроме того, расширение номенклатуры лекарственных средств, повышение требований к их качеству, значительный прогресс в технике аналитического эксперимента, которые произошли в последнее десятилетие, неизбежно привели к деактуализации многих положений ГФ СССР.
Важным шагом в развитии государственного контроля за качеством лекарственных средств в республике явилось признание международных фармакопей – Европейской фармакопеи, Британской фармакопеи, Фармакопеи США и Немецкой гомеопатической фармакопеи. Действие международных фармакопей на территории Казахстана введено приказом Комитета фармации МЗ РК №21 от 11 февраля 2004 года.
В настоящее время регуляторными органами страны и производителями лекарственных средств достигнуто ясное понимание неизбежности перехода к современным требованиям качества. Только строгое следование этим требованиям позволит обеспечить конкурентоспособность и экспортоориентированность отечественного производства. Реальным воплощением тенденций в данной области явились разработка и утверждение в декабре 2006 года национальных стандартов в сфере обращения лекарственных средств:
А.У. Тулегенова, руководитель Центра разработки и совершенствования ГФ РК и Фармакопеи ЕАЭС, доктор фармацевтических наук, профессор.
В декабре 2015 года осуществлена публикация I тома Государственной фармакопеи Республики Казахстан второго издания (ГФ РК 2.0) [1], гармонизированного со стандартами Европейской фармакопеи, Британской фармакопеи и Фармакопеи США 2. Требования Государственной Фармакопеи Республики Казахстан (ГФ РК), применяемые с 2008 года, стали неотъемлемой частью нормативного регулирования фармацевтического рынка республики. За период функционирования ГФ РК произошли существенные изменения как в требованиях фармакопеи, так и в понимании ее роли, как главного стандарта качества лекарственных средств в стране. В связи с выходом в свет второго издания ГФ РК представляется целесообразным рассмотрение статуса фармакопеи и ее значимости в контексте произошедших изменений.
Создание ГФ РК осуществляется впервые за всю многовековую историю становления и развития казахской государственности. В период существования Казахстана в составе России, а затем СССР государственный контроль качества лекарственных средств проводился благодаря стандартам и положениям Государственной Русской фармакопеи, а начиная с 1926 г. - Государственной Фармакопеи СССР (ГФ СССР). Однако в новых экономических условиях развитие фармацевтического рынка Казахстана как суверенного государства имело свои особенности, которые не могли быть в полной мере регламентированы прежними правовыми актами, в том числе советскими изданиями фармакопеи. Современная концепция качества лекарственных средств на глобальном уровне, значительный прогресс в технике аналитического эксперимента неизбежно привели к устареванию многих положений ГФ СССР XI.
Функционирование фармакопей во всем мире определяется их миссией. Различие ее формулировок во всех случаях не отражается на сути, которая, в основном, сводится к одному – охране здоровья общества путем создания государственных стандартов качества лекарственных средств, обеспечивающих их безопасность, эффективность и качество. Тот же смысл заложен в миссию ГФ РК, придавая ее целям подлинно гуманный характер.
Требования ГФ РК, как и многих фармакопей мира, распространяются не только на лекарственные средства, но и на изделия медицинского назначения. В связи с этим, первоначальное определение ГФ РК ныне претерпело изменение, включающее указанную категорию средств, применяемых в медицинской практике. Таким образом, ГФ РК представляет собой свод государственных стандартов и положений, нормирующих качество лекарственных средств и изделий медицинского назначения.
ГФ РК занимает центральное место в системе стандартизации лекарственных средств. Фармакопея устанавливает предельный допустимый уровень качества лекарственных средств, гарантируемый государством. Уровень качества, регламентируемый спецификациями производителей, должен быть не ниже, но даже жестче фармакопейных требований. На основании спецификации производителя по согласованию с уполномоченным органом составляется нормативный документ по качеству лекарственного средства, предназначенный для контроля качества на всех стадиях его жизненного цикла. Таким образом, требования фармакопеи охватывают полный жизненный цикл лекарственных средств. Подобный механизм функционирования определяет роль ГФ РК как главного инструмента государственного регулирования качества лекарственных средств (рисунок 1).
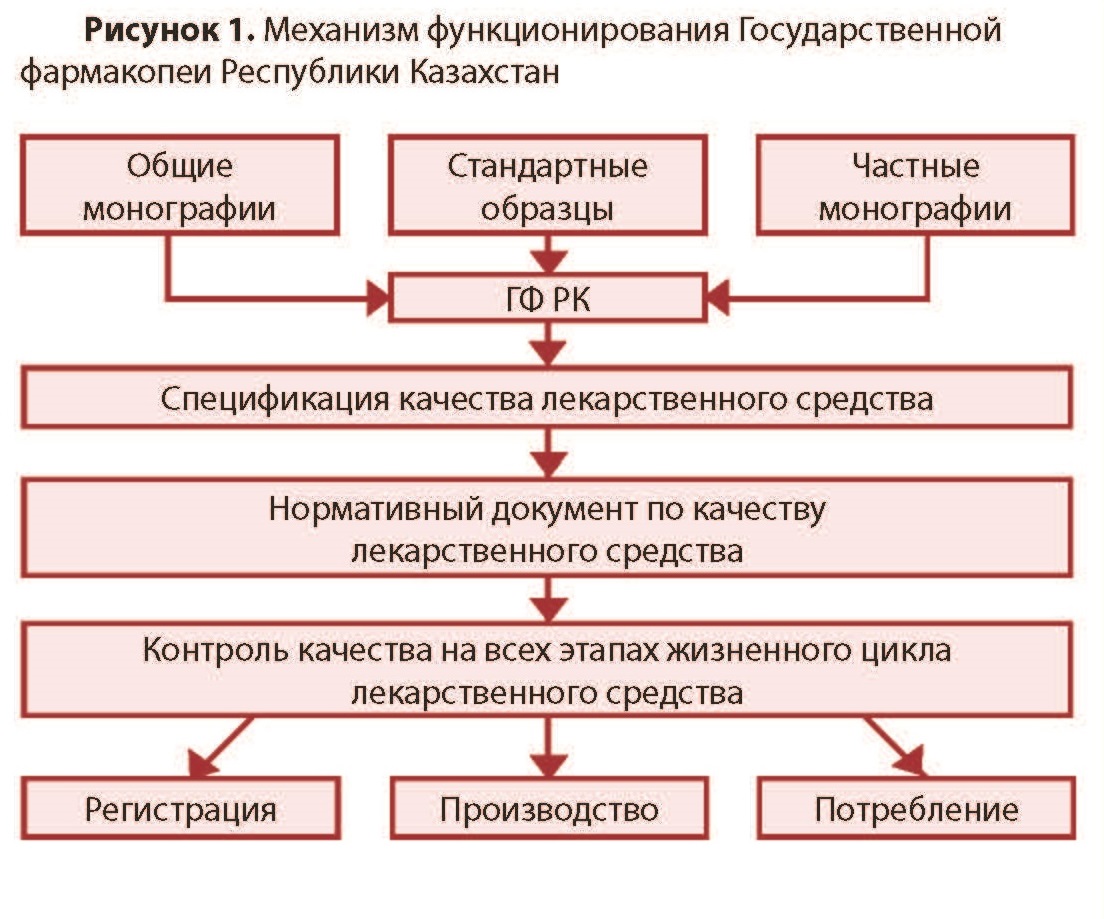
Фармакопея неразрывно связана с надлежащими фармацевтическими практиками (GхP). Надлежащие фармацевтические практики призваны обеспечивать соответствие требованиям фармакопеи от серии к серии для каждой единицы лекарственной формы. С другой стороны, необходимость выполнения требований фармакопеи стимулирует внедрение и постоянное поддерживание GхP в сфере обращения лекарственных средств. Наряду с надлежащими фармацевтическими практиками ГФ РК является важнейшим фактором обеспечения конкурентоспособности и экспортоориентированности отечественной фармпродукции. В определяющей степени этому способствует и гармонизация ГФ РК с основными фармакопеями мира.
Гармонизация со стандартами основных фармакопей мира является главным принципом, положенным в основу создания ГФ РК. Для приобретения опыта разработки национальных фармакопейных стандартов республикой осуществлен ряд важных шагов по вступлению в ведущие фармакопейные организации мира, например, в Европейскую фармакопейную комиссию Совета Европы в качестве страны-наблюдателя (июнь 2006 года), в Фармакопейную конвенцию США сначала в качестве страны-наблюдателя (июль 2009 года), а затем полноправного члена (ноябрь 2010 года). Статус страны-наблюдателя или члена в ведущих фармакопейных организациях мира, помимо опыта фармакопейной стандартизации, позволяет решать следующие задачи:
- определение национальных подходов и путей развития в данной области;
- возможность гармонизации с требованиями основных фармакопей мира;
- привлечение к работе экспертных групп;
- участие в образовательных или научных программах;
- аккредитация испытательных лабораторий и вступление их в сеть официальных лабораторий контроля качества лекарственных средств Совета Европы (OMCLGEON);
- позиционирование ГФ РК как национальной фармакопеи независимого государства.
Обязательным условием гармонизации с основными фармакопеями мира является соблюдение авторских прав их патентообладателей, что требует официального разрешения на гармонизацию фармакопейных текстов. В соответствии с данным условием получено разрешение Европейского директората по контролю качества лекарственных средств Совета Европы (EDQM) в 2007 году, заключены Соглашения с Фармакопейной конвенцией США (USP) в 2010 году и Агентством Великобритании по регулированию обращения лекарственных средств и продуктов здравоохранения (MHRA) в 2014 году. Таким образом, в настоящее время ГФ РК гармонизирована с тремя основными фармакопеями мира – Европейской фармакопеей, Британской фармакопеей и Фармакопеей США 2.
Применение стандартов действующих в республике фармакопей осуществляется по принципу их приоритетности. Первый уровень приоритетности отводится ГФ РК как главному национальному стандарту качества лекарственных средств. При отсутствии в ней отдельных монографий или в случае их поздней актуализации применяются соответствующие монографии других фармакопей, с которыми гармонизирована ГФ РК (рисунок 2).

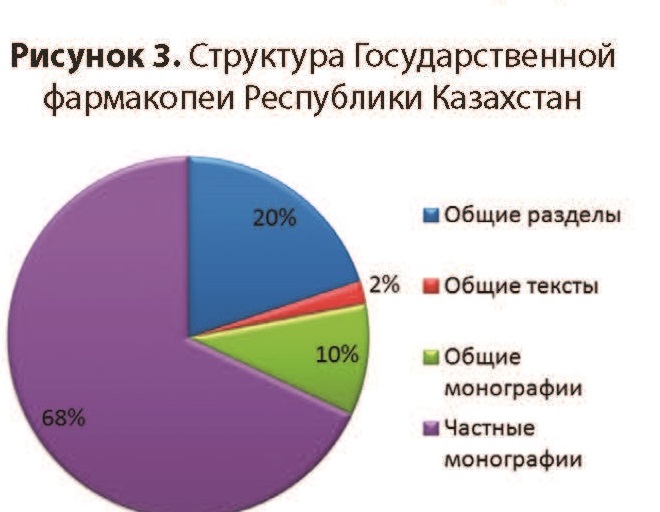
В настоящее время ГФ РК включает 191 общий раздел, 24 общих текста и 90 общих монографий (рисунок 3). Изложенные в них общие требования распространяются на следующее:
- испытания и методы испытаний;
- упаковочные материалы и контейнеры;
- субстанции для фармацевтического применения;
- лекарственные препараты, в том числе гомеопатические препараты, радиофармацевтические препараты;
- лекарственные растительные средства;
- морфологические группы лекарственного растительного сырья;
- изделия медицинского назначения (катетеры внутрисосудистые, шовные материалы).
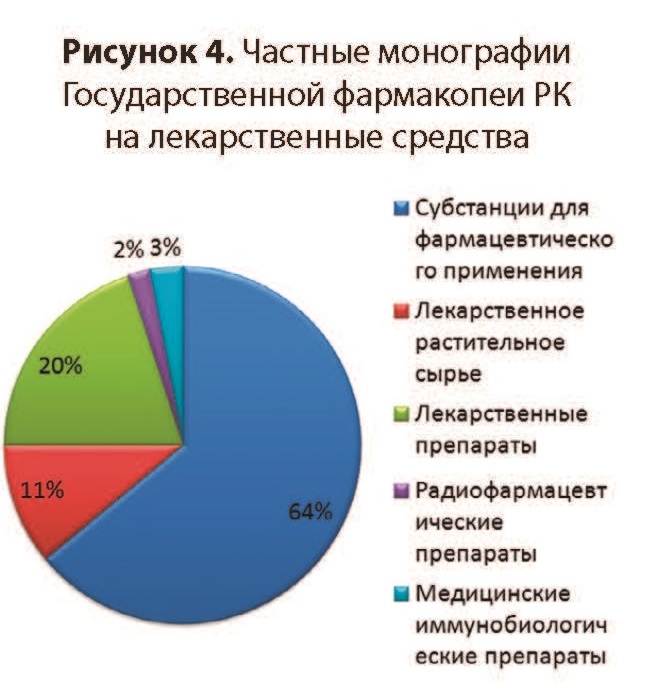
Наряду с общими монографиями ГФ РК содержит 646 частных монографий, регламентирующих требования к показателям качества, методикам испытаний и критериям их приемлемости (рисунок 4). Частные монографии распространяются на следующее:
- субстанции для фармацевтического применения, в том числе активные субстанции и вспомогательные вещества;
- лекарственные препараты в различных лекарственных формах;
- лекарственное растительное сырье и лекарственные растительные препараты;
- радиофармацевтические препараты и исходные материалы для радиофармацевтических препаратов;
- медицинские иммунобиологические препараты (вакцины, иммуноглобулины).
Основными пользователями фармакопеи являются разработчики, производители и дистрибьюторы лекарственных средств, аптечные организации, лаборатории контроля качества, регуляторные и экспертные органы, научные и образовательные учреждения.
Требования ГФ РК обязательны для всех предприятий и организаций Республики Казахстан, занимающихся производством, изготовлением, реализацией, хранением, экспертизой, регистрацией, контролем и применением лекарственных средств.
Создание ГФ РК имеет важное социальное, экономическое и научное значение, так как благодаря установленным стандартам, фармакопея является:
- главным инструментом государственного регулирования качества лекарственных средств и изделий медицинского назначения на рынке республики;
- основой экспертизы и контроля качества лекарственных средств и изделий медицинского назначения для регуляторных и экспертных органов;
- фактором, определяющим конкурентоспособность и экспортоориентированность отечественной фармацевтической продукции;
- эффективным инструментом защиты рынка от недоброкачественной и фальсифицированной продукции;
- фактором, стимулирующим развитие научных исследований по разработке лекарственных средств и изделий медицинского назначения;
- учебным и справочным пособием при подготовке фармацевтов и химиков в высших и средних специальных учебных заведениях.
Создание ГФ РК является важным достижением независимого Казахстана, проявлением заботы государства о здоровье общества.

Создание Государственной фармакопеи Республики Казахстан осуществляется впервые за всю многовековую историю Казахской государственности.
В период существования Казахстана в составе России, а затем Советского Союза государственный контроль за качеством лекарственных средств осуществлялся на основе стандартов и положений Государственной Русской фармакопеи, а после, начиная с 1926 года, – Государственной фармакопеи СССР. Последние издания ГФ СССР – Х (1969 г.) и XI (1987 г. - 1 вып., 1990 г. - 2 вып.) сохранили свой законодательный характер в республике до сего времени.
Однако в новых экономических условиях развитие фармацевтического рынка Казахстана имеет свои особенности, которые не могут быть в полной мере регламентированы прежними правовыми актами, в том числе советскими изданиями фармакопеи. Кроме того, расширение номенклатуры лекарственных средств, повышение требований к их качеству, значительный прогресс в технике аналитического эксперимента, которые произошли в последнее десятилетие, неизбежно привели к деактуализации многих положений ГФ СССР.
Важным шагом в развитии государственного контроля за качеством лекарственных средств в республике явилось признание международных фармакопей – Европейской фармакопеи, Британской фармакопеи, Фармакопеи США и Немецкой гомеопатической фармакопеи. Действие международных фармакопей на территории Казахстана введено приказом Комитета фармации МЗСР РК №21 от 11 февраля 2004 года.
В настоящее время регуляторными органами страны и производителями лекарственных средств достигнуто ясное понимание неизбежности перехода к современным требованиям качества. Только строгое следование этим требованиям позволит обеспечить конкурентоспособность и экспортоориентированность отечественного производства. Реальным воплощением тенденций в данной области явились разработка и утверждение в декабре 2006 года национальных стандартов в сфере обращения лекарственных средств:
- надлежащей лабораторной практики (GLP);
- надлежащей клинической практики (GCP);
- надлежащей производственной практики (GMP);
- надлежащей дистрибьюторской практики (GDP);
- надлежащей аптечной практики (GPP).
Введение их в действие предусмотрено с 2008 года. В настоящее время в республике осуществляются заметные усилия по реконструкции производства и развитию системы обеспечения качества фармацевтической продукции в соответствии с перечисленными выше правилами.
С 1996 года республикой взят курс на вступление во Всемирную торговую организацию. В соответствии с этим национальные стандарты качества лекарственных средств должны быть гармонизированы с международными стандартами в данной области, прежде всего с требованиями Европейской фармакопеи.
Статус наблюдателя позволяет решать следующие задачи:
- приобретать собственный опыт на основании европейского опыта работы в области контроля качества и методов испытания лекарственных средств;
- определять национальные подходы и пути развития в данной области;
- привлекать к научным исследованиям, проводимым под эгидой Европейской фармакопеи.
При создании ГФ РК был установлен следующий порядок:
- разработка концепции и определение основных этапов создания;
- разработка методологии и научных подходов;
- разработка технической спецификации и ее экономическое обоснование;
- заключение договора о государственных закупках услуг;
- определение категорий исполнителей и их функциональных обязанностей;
- определение состава редакционной коллегии и организаций-участников;
- определение порядка ведения документации.
Текст ГФ РК изложен на двух языках:
- на государственном языке – казахском;
- на языке, официально употребляемом наравне с казахским, – русском.
Государственная фармакопея состоит из 2 томов. Первый том содержит общие фармакопейные статьи. Второй том включает частные фармакопейные статьи (монографии). Срок издания второго тома Государственной фармакопеи предусмотрен в 2009 году.
Общие фармакопейные статьи содержат наиболее общие требования, распространяющиеся на:
- методы испытаний;
- упаковочные материалы и контейнеры;
- реагенты;
- показатели качества;
- лекарственные формы;
- морфологические группы лекарственного растительного сырья;
- медицинские иммунобиологические препараты.
Частные фармакопейные статьи (монографии) регламентируют необходимые требования к показателям качества и определяют методики испытаний для контроля качества:
- лекарственных субстанций;
- вспомогательных веществ;
- лекарственных препаратов;
- лекарственного растительного сырья;
- медицинских иммунобиологических препаратов.
Идея гармонизации национальных требований нашла воплощение в использовании основополагающих принципов и подходов Европейской фармакопеи к качеству лекарственных средств. С другой стороны, особенности национального фармацевтического рынка диктуют необходимость гармонизации с требованиями ГФ СССР и законодательства Республики Казахстан.
В свете этой концепции структура Фармакопеи предусматривает двухчастность статей, как общих, так и частных. Первая часть называется общей и является идентичной соответствующей статье Европейской фармакопеи. Следующая за ней часть, обозначенная гербом Республики Казахстан, называется национальной и отражает особенности подходов к качеству лекарственных средств в республике.
Общая (европейская) часть содержит требования к качеству лекарственных средств, произведенных в соответствии с Правилами GMP. В целом она сохраняет стиль Европейской фармакопеи. При ее изложении в наибольшей степени достигнута близость перевода к оригинальному тексту, осуществлена адаптация текста к стилистике государственного и русского языка, а далее - приведение текста к стилю, принятому в отечественной нормативной документации.
Национальная часть содержит требования к лекарственным средствам, не произведенным в соответствии с Правилами GMP. Она включает альтернативные методики, дополнительные информационные материалы. Ее содержание не противоречит общей (европейской части), а лишь дополняет ее.
Необходимость дифференцирования европейской и национальной частей в Государственной фармакопее представляется важным условием соблюдения авторских прав Европейского департамента качества лекарственных средств и здравоохранения (EDQM) Совета Европы как патентообладателя Европейской фармакопеи. Подобный подход был согласован с данной организацией и позволил в дальнейшем легитимировать Государственную фармакопею Республики Казахстан.
Следует подчеркнуть, что аналогичные принципы положены в основу конструкции фармакопей ряда стран Европейского Союза, скажем, Британской фармакопеи. В некоторых странах национальные требования изданы в виде специального дополнения, например в Дании.
Европейская фармакопея насчитывает более 2000 лекарственных субстанций и вспомогательных веществ, на которые разработаны монографии. Далеко не весь перечень их присутствует на отечественном рынке. Формирование перечня лекарственных средств, требующих разработки монографий, проводилось с учетом следующих факторов:
- значительная доля присутствия лекарственного средства на отечественном рынке;
- многочисленность торговых названий лекарственного средства, соответствующих одному международному непатентованному наименованию;
- перечень лекарственных препаратов для лечения социально значимых заболеваний.
Для разработки монографий определена методология, включающая следующие этапы:
- анализ рынка и формирование перечня лекарственных средств, требующих разработки монографий;
- сравнительный анализ качества генериков на рынке республики;
- составление текста монографии;
- валидация и апробация методик испытаний в аккредитованных испытательных лабораториях;
- трехкратное рецензирование;
- перевод на государственный язык;
- редактирование, корректирование текста;
- создание электронной версии;
- обсуждение на заседании Фармакопейной комиссии.
Серьезного внимания потребовали от авторского коллектива вопросы унификации и корректности использования фармацевтической терминологии одновременно на обоих языках изложения. В первую очередь, они касались ключевых терминов:
- лекарственное средство;
- лекарственная субстанция;
- лекарственный препарат;
- лекарственная форма;
- срок годности;
- срок хранения;
- период применения;
- стандартный раствор;
- раствор сравнения.
Материал Государственной фармакопеи изложен в редакции, по возможности близкой Европейской фармакопее. Нумерация разделов и название монографий, химические названия веществ, единицы измерения физических величин, формулы расчета практически идентичны приведенным в Европейской фармакопее. Изменение претерпели лишь некоторые обозначения физических величин ввиду их традиционности использования в отечественной нормативной документации. С тех же соображений расширен круг аббревиатур и сокращений.
Монографии Государственной фармакопеи, предусмотренные для включения во II том, будут охватывать:
- 270 лекарственных субстанций;
- 12 вспомогательных веществ;
- 75 готовых лекарственных средств;
- 20 объектов лекарственного растительного сырья;
- 6 медицинских иммунобиологических препаратов.
Отличительными признаками Государственной фармакопеи Республики Казахстан от Европейской фармакопеи являются:
- присутствие национальной части практически в каждой статье;
- разработка монографий на готовые лекарственные средства (общеизвестно, что издания Европейской фармакопеи не содержат монографий на лекарственные препараты);
- разработка монографий на морфологические группы лекарственного растительного сырья.
Важно отметить, что именно существенные отличия позволили легитимировать Государственную фармакопею Республики Казахстан как национальную фармакопею. В противном случае, разрешение EDQM было бы дано на издание Европейской фармакопеи на казахском языке, аналогично тому, как это было сделано в 27 странах мира.
В случаях отсутствия национальной части требования статей Государственной фармакопеи распространяются на все лекарственные средства независимо от характера производства.
Было бы ошибочным думать, что двухтомный выпуск Государственной фармакопеи завершит процесс создания фармакопейных стандартов в республике. Создание Государственной фармакопеи представляет собой динамичный, непрерывный и бесконечный процесс. Будущее развитие фармакопеи связано с ревизией фармакопейных статей путем внесения изменений, как принципиального, так и непринципиального характера, включая редакционную правку, а также с разработкой новых монографий.
В процессе работы над Государственной фармакопеей большую профессиональную поддержку авторскому коллективу оказал Европейский департамент качества лекарственных средств и здравоохранения Совета Европы. В первую очередь, это была официальная поддержка, которая выразилась в принятии нашей страны в статус наблюдателя в Комиссию Европейской фармакопеи, а также в легитимации Государственной фармакопеи Республики Казахстан. Кроме того, мы получили большую методическую помощь в виде:
Приведенный текст опубликован на титульном листе Государственной фармакопеи Республики Казахстан.
Проект первого тома Государственной фармакопеи Республики Казахстан был представлен для легитимации в марте 2007 года в период прохождения очередной 127-ой сессии Комиссии Европейской фармакопеи.
После утверждения Государственная фармакопея Республики Казахтан вступает в свой законодательный статус:
- она устанавливает уровень требований к качеству и безопасности лекарственных средств, гарантируемый государством своим гражданам;
- требования ее являются обязательными для всех предприятий и организаций республики, занимающихся производством, изготовлением, реализацией, хранением, контролем и применением лекарственных средств.
С выходом в свет I тома Государственной фармакопеи Республики Казахстан теряют свою силу общие статьи ГФ СССР, что вполне логично в силу гармонизированности с ней. Это, в свою очередь, требует указания ссылок в отечественных нормативных документах лишь на Государственную фармакопею Республики Казахстан. Исключение может быть сделано в особых случаях, когда необходимый материал не освещен в национальной фармакопее.
В создании Государственной фармакопеи принимало участие большое число специалистов из многих научных, образовательных и практических учреждений и организаций фармацевтического профиля республики и за ее пределами.
Неоценимая помощь оказана ведущими специалистами Научно-экспертного фармакопейного центра Министерства здравоохранения Украины, Института стандартизации и контроля качества лекарственных средств Министерства здравоохранения Российской Федерации.
Не только профессиональная поддержка, но и человеческое участие наших европейских коллег помогли воплотить высокие идеи и принципы ведущей фармакопеи мира в национальной фармакопее. И, наконец, издание Государственной фармакопеи стало реальным благодаря финансированию этого проекта Министерством здравоохранения республики.
Читайте также:

