Гиперинсулинизм причины метаболические последствия клинические проявления реферат
Обновлено: 17.05.2024
Синдром Харриса — это спонтанные приступы гипогликемии, вызванные повышенной нерегулируемой секрецией инсулина. В литературе встречаем синонимы: органический гиперинсулинизм, гипогликемический синдром, инсулинома, эндогенный гиперинсулинизм и гипогликемическая болезнь. Синдром впервые описал в 1924 г. американский врач Сил Харрис Harris Seale (1870–1957) [1]. В этом же году параллельно с ним это сделал отечественный хирург Владимир Оппель, но в медицинских кругах синдрому было присвоено имя Харриса.
Обнаружению и дальнейшему исследованию данной патологии предшествовали несколько важных научных открытий. Первое — открытие Паулем Лангергансом в 1869 г. островков в поджелудочной железе, ответственных за выработку инсулина. Эти островки были названы островками Лангерганса. Второе — революционное исследование, а именно выделение инсулина, проведенное в Канаде Фредериком Бантингом и Чарлзом Бестом в 1922 г., и появление информации о клинических признаках передозировки инсулина.
Этиология и патогенез
Развитие синдрома Харриса может быть обусловлено:
- доброкачественной или злокачественной опухолью бета-клеток островка Лангенгарса (инсулиномы)
- диффузным аденоматозом или диффузной гиперплазией островкового аппарата поджелудочной железы [3].
Инсулинома — одна из наиболее часто встречающихся нейроэндокринных опухолей поджелудочной железы. Она составляет почти 80 % от всех известных гормональных новообразований поджелудочной железы. Встречаются инсулиномы нечасто — 2–4 случая на 1 миллион населения в год. Инсулинсекретирующая опухоль описана во всех возрастных группах — от новорожденных до престарелых, тем не менее чаще она проявляется в наиболее трудоспособном возрасте — от 30 до 55 лет. Среди общего числа больных дети составляют около 5 %. У женщин инсулинома встречается в 2 раза чаще, чем у мужчин. У большинства больных инсулинома бывает доброкачественной (80–90 %), у 10–20 % имеет признаки злокачественного роста [1]. Инсулиномы могут быть как спорадическими (обычно одиночными) опухолями, так и множественными (наследственно обусловленными). Чаще инсулиномы локализуются в поджелудочной железе, но в 1–2 % случаев могут развиваться в воротах селезёнки, печени или в стенке двенадцатиперстной кишки [4].
Глюкоза — важнейший источник энергии для жизнедеятельности клеток, в частности клеток мозга. Внутри клеток свободная глюкоза практически отсутствует, накапливаясь в виде гликогена. Глюкоза входит в молекулы нуклеотидов и нуклеиновых кислот. Глюкоза необходима для синтеза некоторых аминокислот, синтеза и окисления липидов, полисахаридов. Концентрация глюкозы в норме в крови человека поддерживается в относительно узких пределах — 2,8–7,8 ммоль/л, вне зависимости от пола и возраста, несмотря на большие различия в питании и физической активности. Это постоянство обеспечивает ткани мозга достаточным количеством глюкозы, единственного метаболического топлива, которое они могут использовать в обычных условиях [5].
Инсулин — анаболический гормон, усиливающий синтез углеводов, белков, жиров и нуклеиновых кислот. Он влияет на углеводный обмен: увеличивает транспорт глюкозы из крови в клетки инсулинзависимых тканей (жировую, мышечную, печеночную), стимулирует синтез гликогена в печени и подавляет его расщепление, а также подавляет синтез глюкозы (гликонеогенез). Закономерно инсулин снижает уровень глюкозы в крови. Гиперинсулинизм вызывает многочисленные нарушения в гомеостазе и прежде всего в функциях центральной нервной системы, поскольку мозг не имеет запасов углеводов, в нем не происходит синтеза глюкозы, а расход ее велик и постоянен (до 20 % от циркулирующей в крови). Гипогликемия также влияет на кардиоваскулярную и гастроинтестинальную деятельность [4]. У здоровых людей угнетение выработки инсулина после всасывания глюкозы в кровь начинается при концентрации 4,2–4 ммоль/л, а при дальнейшем снижении концентрации глюкозы сопровождается выбросом контринсулярных гормонов.
Клинические проявления
Симптомы инсулином обусловлены гипогликемией, которая стимулирует секрецию катехоламинов — адреналина и норадреналина, и влечет за собой дефицит глюкозы в головном мозге, что равносильно снижению потребления кислорода нервными клетками [6].
Период хронической гипогликемии (межприступный период) характеризуется симптомами хронического повреждения ЦНС: головные боли, снижение памяти, умственной работоспособности, постоянное чувство голода (больные часто едят, особенно много употребляют углеводов и прибавляют в весе), патологические рефлексы Бабинского, неадекватное поведение [7].
Дифференциальный диагноз
Симптомы гипогликемии отличаются полиморфизмом и неспецифичностью. Наличие нервно-психических нарушений и малая распространённость заболевания часто приводят к диагностическим ошибкам. Как правило, требуется дифдиагностика с такими состояниями, как эпилепсия, кататония, гебефрения, неврастения, истерия, мигрень, психоз, алкогольная болезнь, опухоли головного мозга, нейровегетативная дистония с гипогликемическими состояниями. Однако для синдрома Харриса патогномоничной является триада Уиппла:
- возникновение приступов гипогликемии после длительного голодания или физической нагрузки
- снижение содержания глюкозы крови во время приступа ниже 1,7 ммоль/л у детей до двух лет и ниже 2,2 ммоль/л — старше двух лет
- купирование гипогликемического приступа внутривенным введением глюкозы или пероральным приемом растворов глюкозы [4].
Диагностика
На первом этапе золотой стандарт диагностики синдрома Харриса — не слишком гуманная проба с голоданием в течение 72 часов. Она считается положительной при развитии триады Уиппла. Начало голодания отмечают как время последнего приема пищи. Уровень глюкозы в крови оценивают через 3 часа после последнего приема пищи, затем через каждые 6 часов, а при снижении уровня глюкозы в крови ниже 3,4 ммоль/л интервал между ее исследованиями сокращают до 30–60 мин. Скорость секреции инсулина при инсулиноме не угнетается при снижении уровня глюкозы в крови.
Кроме того, при инсулиноме инсулин/гликемический индекс (отношение уровня инсулина к уровню глюкозы) превышает 1,0, а в норме составляет не более 0,3. Также при инсулиноме резко повышена концентрация С-пептида.
Второй этап диагностики инсулиномы — лоцирование опухоли. Используют УЗИ, компьютерную томографию, магниторезонансную томографию, эндоскопическое УЗИ, сцинтиграфию, ангиографию, интраоперационное УЗИ. Наиболее информативны в диагностике инсулином эндоскопическое ультразвуковое исследование (эндо-УЗИ) и забор крови из печеночных вен после внутриартериальной стимуляции поджелудочной железы кальцием. С помощью современных методов исследования удается на дооперационном этапе у многих пациентов установить локализацию опухоли, ее размер, стадию и темпы прогрессирования, выявить метастазы.
Лечение и прогноз
Лечение инсулиномы в большинстве случаев хирургическое: энуклеация опухоли, дистальная резекция поджелудочной железы при соответствующей локализации. Консервативная терапия проводится в случае нерезектабельной опухоли и ее метастазов, а также при отказе пациента от оперативного лечения. Пятилетняя выживаемость среди радикально прооперированных пациентов — 90 %, при обнаружении метастазов — 20 % [8].
Что такое метаболический синдром? Причины возникновения, диагностику и методы лечения разберем в статье доктора Чернышев А. В., кардиолога со стажем в 33 года.
Над статьей доктора Чернышев А. В. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Метаболический синдром (синдром Reaven) представляет собой симптомокомплекс, сочетающий в себе абдоминальное ожирение, инсулинорезистентность, гипергликемию (повышенное содержание глюкозы в крови), дислипидемию и артериальную гипертензию. Все эти нарушения связаны в одну патогенетическую цепь. Кроме того, такой синдром часто сочетается с гиперурикемией (избытком мочевой кислоты в крови), нарушением гемостаза (свёртываемости крови), субклиническим воспалением, синдромом обструктивного апноэ-гипопноэ сна (остановкой дыхания во сне). [4]
Метаболический синдром – хроническое, распространённое (до 35% в российской популяции), полиэтиологическое заболевание (возникающее по многим причинам), в котором главная роль принадлежит поведенческим факторам (гиподинамия, нерациональное питание, стресс). Имеет значение также наследственная предрасположенность к артериальной гипертензии, атеросклероззависимым заболеваниям и сахарному диабету второго типа. [5]
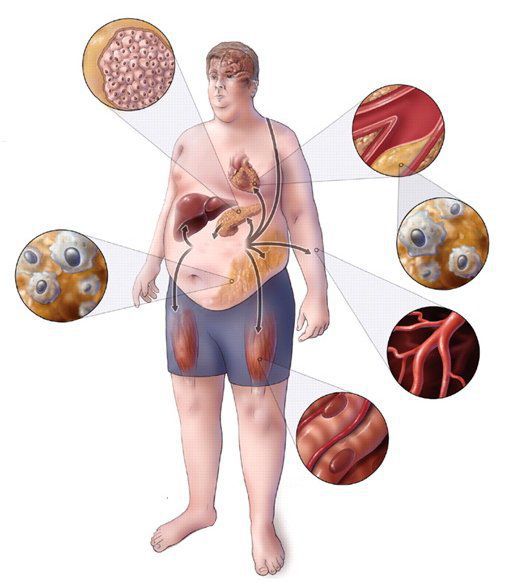
Практикующим врачам важно выделять группу риска метаболического синдрома. К данной группе относятся пациенты с начальными признаками заболевания и его осложнениями: артериальная гипертензия, углеводные изменения, ожирение и повышенное питание, ишемическая болезнь сердца, атеросклеротические заболевания периферических и мозговых артерий, нарушение пуринового обмена, жировая болезнь печени; синдром поликистозных яичников; постменопаузальный период у женщин и эректильная дисфункция у мужчин; гиподинамия, злоупотребление алкоголем, табакокурение, наследственная отягощенность по сердечно-сосудистым и обменным заболеваниям. [3] [7]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы метаболического синдрома
Клинические проявления метаболического синдрома соответствуют симптомам его составляющих:
- абдоминального ожирения;
- артериальной гипертензии;
- изменениям углеводного, липидного и пуринового обмена.
Если изменения составляющих синдрома Reaven носят субклинический характер (что встречается довольно часто), то и течение заболевания носит асимптомный характер.
Патогенез метаболического синдрома
Классификация и стадии развития метаболического синдрома
Чёткой классификации и стадийности метаболического синдрома не существует. Его деление некоторыми авторами на полный, включающий все составляющие синдрома, и неполный представляется необоснованным. Несмотря на это, выраженность симптомов, количество компонентов синдрома Reaven и наличие осложнений оказывают влияние на стратификацию риска и выбор тактики лечения у конкретного пациента. Для этого следует учитывать:
- степень ожирения и артериальной гипертензии;
- выраженность метаболических изменений;
- наличие или отсутствие сахарного диабета и заболеваний, связанных с атеросклерозом.
В зависимости от индекса массы тела (ИМТ), который рассчитывается делением веса (кг) на рост (м 2 ), классифицируются следующие типы массы тела (МТ):
-
нормальная МТ — ИМТ ≥18,5
Второй тип ожирения является более патогенным в плане риска возникновения сердечно-сосудистых заболеваний и сахарного диабета. Это связано с ожирением внутренних органов, в том числе печени (висцеральное ожирение, неалкогольная жировая болезнь печени), снижением сатурации крови кислородом из-за перехода дыхания на грудной, поверхностный тип и эндокринной активностью висцеральной жировой ткани с патологическим изменением выработки адипокинов (лептин, грелин, адипонектин). Выявлена чёткая корреляция между увеличением абдоминальной жировой ткани и индекса массы тела с риском сопутствующих заболеваний. Считается, что риски начинают нарастать при увеличении окружности талии (ОТ) >80 см у женщин и 94 см у мужчин, а при ОТ >88 см и 102 см соответственно риск возрастает значительно.
Осложнения метаболического синдрома
Так как метаболический синдром является сочетанием факторов риска сердечно-сосудистых и обменных заболеваний, именно эти патологии и являются его осложнениями. Речь идёт, в первую очередь, о сахарном диабете, ишемической болезни сердца и их осложнениях: диабетическая ангио-, нейро- и нефропатия, острая коронарная недостаточность, сердечная недостаточность, нарушение сердечного ритма и проводимости, внезапная сердечная смерть, цереброваскулярные заболевания и болезни периферических артерий. [17] Прогрессирование артериальной гипертензии также приводит к поражению органов-мишеней и ассоциированным клиническим состояниям.
Диагностика метаболического синдрома
Для диагностики метаболического синдрома необходимо выявить у пациента основной признак — абдоминальное ожирение по измерению ОТ (>80 см у женщин и >94 см у мужчин) и хотя бы два дополнительных критерия, которые включают в себя:
- артериальную гипертензию (артериальное давление ≥140/90 мм рт.ст.);
- липидные показатели (ммоль/л) — повышение концентрации в крови триглицеридов ≥1,7; снижение ХС ЛПВП 3,0;
- углеводные показатели (ммоль/л) — гипергликемия натощак ≥6,1 и НТГ 7,8 – [8]
В клинических условиях нужно дифференцировать метаболический синдром от механического сочетания факторов риска, например артериальной гипертензии, избыточной массы тела без признаков абдоминального ожирения и повышения уровня ОХ крови, что встречается довольно часто (до 30%). В сомнительных случаях рекомендовано дополнительное определение инсулинорезистентности по следующим методикам:
- оценка базальной гиперинсулинемии в крови натощак (гиперинсулинемия — >18 мкед/мл);
- показатель HOMA-IR — произведение значения инсулина натощак (мкед/мл) на величину глюкозы (ммоль/л), разделить на 22,5 (значение большее, чем 2,27, считается инсулинорезистентностью);
- индекс Caro — соотношение тощаковой глюкозы (в ммоль/л) к инсулину (в мкед/мл) (инсулинорезистентность – значение [12]
Лечение метаболического синдрома
Лечение метаболического синдрома следует разделить на немедикаментозное и медикаментозное.
Немедикаментозное лечение синдрома Reaven — это ведение здорового образа жизни, отказ от курения и злоупотребления алкоголем, оптимальная двигательная активность [14] , рациональное питание, а также разумное использование природных и преформированных физических лечебных факторов (массаж, подводный душ-массаж, гипокситерапия и гиперкапния, водолечение, талассотерапия, бальнео- и термотерапия, внутренний прём минеральных вод, общие магнитотерапевтические воздействия) [15] , психотерапевтических методик и обучающих программ. [13]
Медикаментозное лечение метаболического синдрома, в зависимости от наличия тех или иных его компонентов, может включать гиполипидемические, антигипертензивные препараты, медикаменты для снижения инсулинорезистентности, постпрандиальной гипергликемии и веса.
Основными препаратами, которые используют при лечении артериальной гипертензии у больных синдромом Reaven и сахарным диабетом, являются ингибиторы ангиотензинпревращающего фермента, сартаны и агонисты имидазолиновых рецепторов. Однако для достижения целевого уровня артериального давления часто необходимо сочетание различных классов медикаментов, таких как пролонгированных блокаторов медленных кальциевых каналов, высокоселективных бета-адреноблокаторов и тиазидоподобных диуретиков (индапамид) в сочетании с медикаментами первой линии. [10]
Для коррекции нарушений липидного обмена при метаболическом синдроме первоначально используются статины, возможно их сочетание с эзетролом и фибратами. Основной механизм действия статинов — снижение внутриклеточного синтеза ОХ за счёт обратимого блокирования фермента 3-гидрокси-3-метилглютарил-кофермент А редуктазы. Оно ведёт к увеличению количества рецепторов к ХС-ЛПНП на поверхности гепатоцита и снижению концентрации ХС-ЛПНП в крови. Помимо этого, статины имеют плейотропные эффекты, такие как антитромбогенный, противовоспалительный, улучшение функции эндотелия, что приводит к стабилизации атеросклеротической бляшки. Современные статины способны вместе со снижением ХС-ЛПНП до 55% уменьшать триглицериды до 30% и повышать ХС-ЛПВП до 12%. В то же время, ключевое достоинство статинотерапии — снижение сердечно-сосудистых осложнений и общей смертности [1] . Эффективней всего использовать аторвастатин (10-80 мг/сут) или розувастатин (5-40 мг/сут). [11]
При неэффективности монотерапии статинами целесообразно присоединение эзетрола в дозе 10 мг/сут, который препятствует всасыванию ОХ в кишечнике и может усиливать снижение ХС-ЛПНП на 15-20%.
Фибраты — ещё один класс липидснижающих препаратов. Они расщепляют богатые триглицеридами жировые частицы, снижают синтез свободных жирных кислот и повышают ХС-ЛПВП путём увеличения распада ЛНП. Это приводит к значительному уменьшению триглицеридов (до 50%), ХС-ЛПНП (до 20%) и увеличению ХС-ЛПВП (до 30%). Фибраты также имеют плейотропные эффекты: снижают концентрацию мочевой кислоты, фибриногена и улучшают инсулиночувствительность, однако их положительное влияние на прогноз пациентов не доказано. Наиболее эффективный и безопасный препарат этой группы — фенофибрат 145 мг/сут.
Для снижения инсулинорезистентности препаратом выбора является метформин, который обладает доказанным положительным эффектом на тканевую инсулинорезистентность через усиление поглощения глюкозы тканями-мишенями. Метформин уменьшает скорость всасывания углеводов в тонкой кишке, оказывает периферическое анорексигенное действие, уменьшает продукцию глюкозы печенью, улучшает транспорт глюкозы внутри клеток. Положительное воздействие метформина (1500-3000 мг/сутки) на конечные точки обусловлено снижением инсулинорезистентности, системными метаболическими эффектами (снижение веса, липидных нарушений, факторов свёртываемости крови и т.д.). [9]
Для снижения постпрандиальной гипергликемии используют акарбозу, которая обратимо блокирует глюкоамилазы, сахарозы и мальтазы в верхнем отделе тонкой кишки. В итоге непереваренные углеводы достигают нижние отделы кишечника, и абсорбция углеводов пролонгируется. Вместе с тем, у акарбозы выявлены дополнительные эффекты. В исследовании STOP-NIDDM (2002 год) у больных метаболическим синдромом, принимающих акарбозу дозировкой 300 мг/сут, продемонстрировано снижение развития сахарного диабета на 36%, новых случаев артериальной гипертензии на 34% и суммарного показателя сердечно-сосудистых событий на 46% [6] .
При наличии у пациента с синдромом Reaven сахарного диабета второго типа могут применяться современные классы сахароснижающих препаратов, такие как аналог глюкагоноподобного пептида-1, ингибитор дипептидилпептидазы-4 и ингибитор натрийзависимого переносчика глюкозы второго типа. Представитель последнего класса эмпаглифлозин (Джардинс) в исследовании EMPA-REG OUTCOME (2016 год) снизил сердечно-сосудистую смертность у больных сахарным диабетом второго типа на 36%.
Медикаментозная коррекция морбидного ожирения показана, если немедикаментозное лечение не приводит к снижению массы тела более чем на 5% от исходного. Препараты для лечения ожирения делятся на аноретики центрального действия (сибутрамин), и средства, воздействующие на желудочно-кишечный тракт, например орлистат (Ксеникал).
Препарат для снижения аппетита сибутрамин в меньшей степени воздействует на дофаминовые и холинергические процессы, но уменьшает потребление жиров и углеводов, что приводит к похудению и улучшает жировой и углеводный метаболизм. Артериальное давление и частота сердечных сокращений при этом повышается только на 5%.
Орлистат является ингибитором желудочной и панкреатической липаз, вследствие чего треть пищевых триглицеридов не всасывается и снижается их концентрация в крови, что приводит к уменьшению калоража пищи и веса. Кроме того, снижается артериальное давление, уровень глюкозы и инсулинорезистентности.
В медицинской практике лечение метаболического синдрома зависит от наличия и выраженности его компонентов. В таблице ниже показана тактика подбора терапии при вариантах синдрома Reaven, которые встречаются наиболее часто.
В 1869 г. Langerhans описал особые скопления клеток в ткани поджелудочной железы, которые, как это было установлено в дальнейшем, обладают эндокринной функцией и выделяют в кровь гормон — инсулин.
Инсуломы развиваются чаще всего в возрасте 30— 55 лет, одинаково часто у мужчин и женщин. Наблюдается семейное предрасположение к инсуломам.
Этиология и патогенез. Инсуломы могут выявляться в семьях, в которых имеются больные сахарным диабетом. Чаще встречаются инсуломы доброкачественные, чем злокачественные.
Гипогликемические состояния наблюдаются при понижении функции передней доли гипофиза, когда снижается количество СТГ — гормона роста, способствующего снижению ипсулиновой активности. Уменьшение продукции СТГ наблюдается при болезни Симмондса и синдроме Шихена. Уровень сахара в крови у больных гипофизарным истощением низкий, возможны приступы гипогликемии.
Острая хроническая недостаточность коры надпочечников проявляется снижением глюкокортикоидов и снижением количества сахара в крови. У больных аддисоновой болезнью при введении нескольких единиц инсулина возникает гипогликемия. Гликемическая кривая дает низкие показатели количества сахара в крови. При некоторых формах вирильного синдрома, когда снижена продукция глюкокортикоидов, наблюдаются гипогликемические состояния. При микседеме количество сахара в крови натощак и гликемическая кривая низкие, что обусловлено недостатком тиреоидных гормонов, которые содействуют повышению уровня сахара в крови.
Низкий уровень сахара в крови наблюдается у людей при длительном голодании и истощении, нарушении всасывания углеводов в кишечнике, при хронических, острых энтероколитах и при резекции желудка. Токсические поражения печени ведут к снижению гликогенолиза и могут способствовать появлению гипогликемии. Гипогликемии наблюдаются при почечной глюкозурии. При высоком уровне сахара в моче количество сахара в крови снижено.

При анорексии невроза — нервном истощении — на почве длительного недоедания и отсутствия аппетита значительно снижен уровень сахара в крови и возможны гипогликемии. Функциональные гипогликемии описаны при поражении гипоталамуса, когда нарушается координирующая деятельность вегетативных центров дна III желудочка, регулирующих процессы углеводного обмена.
Функциональные гипогликемии могут возникать вследствие быстрого всасывания углеводов в кишечнике. Гипогликемические состояния иногда наблюдаются у больных с опухолью брюшной полости. Гистологически эти опухоли относятся к эпителиомам (гепатомы, карциномы надпочечников, псевдомиксомы) и к мезодер-мальным (фибросаркомы, мезентелиомы, фибромы и др.). По-видимому, эти опухоли выделяют инсулинопо-добное вещество или сами опухоли утилизируют большое количество глюкозы, что ведет к снижению количества сахара в крови. После экстирпации этих опухолей приступы гипогликемии проходят.
При синдроме Золлингер — Эллисон, когда возникают множественные язвы желудка и кишечника, при развитии опухоли из островков Лангерганса, содержащей наряду с другими клетками и инсулинопродуцирующие, также могут возникать гипогликемические состояния.
Снижение содержания сахара в крови до 50— 30 мг% и гипоксия тканей вызывают нарушения в центральной нервной системе. Нервные клетки головного мозга не получают глюкозу и на фоне недостатка в снабжении кислородом в них развиваются патологические изменения. Глубокие функциональные нарушения отмечаются в коре головного мозга, гипоталамусе и других отделах головного мозга при развитии глубокой гипогликемической комы.
Необходимо помнить, что при тяжелой форме гипогликемической комы могут возникать неврологические симптомы и психотические состояния вследствие локальных изменений в нервных клетках головного мозга и нарушения целостности его сосудов.

Гиперинсулинемическая гипогликемия представляет собой группу клинически, генетически и морфологически гетерогенных нарушений, характеризующихся неадекватно высокой секрецией инсулина β-клетками поджелудочной железы. Гиперинсулинемическая гипогликемия — наиболее частая причина стойкой гипогликемии у новорожденных и младенцев. Избыток инсулина приводит к понижению уровня глюкозы в плазме крови за счет ингибирования гликолиза и глюконеогенеза. Также он подавляет высвобождение жирных кислот и синтез кетоновых тел, которые являются основными альтернативными видами энергии для нейронов мозга при гипогликемии. Быстрая диагностика и незамедлительное лечение при гиперинсулинемической гипогликемии должны быть направлены на предотвращение потенциально возможных неврологических осложнений.
Клинические проявления гиперинсулинемической гипогликемии могут варьировать от мягких неспецифических (дефицит массы тела, сонливость и раздражительность) до более тяжелых симптомов гипогликемии (апноэ, судороги или даже кома). Заболевание может быть врожденным (первичным) или вторичным по отношению к определенным факторам риска, таким как гипоксия плода, внутриутробная задержка роста, сахарный диабет у матери, либо связанным с различными синдромами нарушения развития (синдром Беквит — Видемана), либо патологиями метаболизма, такими как синдром врожденного нарушения гликозилирования. К другим причинам относятся: резус-изоиммунизация, каналопатия, тирозинемия 1-го типа, синдромы Кабуки, Патау, центральной гиповентиляции, инсулинорезистентности, Шерешевского — Тернера (мозаичная форма), Сотоса, Ашера, Тимоти, Костелло — Дента, инсулиновый аутоиммунный, демпинговый, неинсуломный панкреатогенный гипогликемический синдром, мутации гена инсулинового рецептора, постпрандиальная и ложная гипергликемическая гипогликемия, инсулинома, неостровково-клеточная опухоль, последствия медикаментозного и хирургического (бариатрического) вмешательств. Большинству форм гиперинсулинемической гипогликемии присущ низкий уровень глюкозы натощак, но в некоторых случаях гипогликемию выявляют лишь в ходе провокационной пробы на белок/лейцин или физического нагрузочного теста.
На гистологическом уровне врожденные формы гиперинсулинемической гипогликемии подразделяются на три подгруппы: диффузные, фокальные и атипичные. Дифференциация гистологического подтипа тесно связана с выбором лечебной тактики и клиническим прогнозом. Недавно предложенный дополнительный диагностический инструмент, молекулярно-генетический анализ 18F-фтор-L-дигидроксифенилаланина PET/CT (18F-ДОПА — синтетический аналог предшественника норадреналина — фенилаланина — прим. ред.), коренным образом изменил клинический подход к пациентам с гиперинсулинемической гипогликемией. Молекулярная основа врожденной гиперинсулинемической гипогликемии обусловлена мутационными изменениями в ключевых генах (в данное время идентифицированы 9 последовательностей), ответственных за регуляцию секреции инсулина: ABCC8, KCNJ11, GLUD1, GCK, HADH, SLC16A1, UCP2, HNF4A и HNF1A. К вновь выявленным относятся аномалии генов, связанных с синтезом гексокиназы 1, фосфоглюкомтутазы 1 и фосфоманномутазы 2.
Гомеостаз глюкозы
Залогом поддержания нормального уровня глюкозы в плазме крови является баланс между ее производством (экзогенным и/или эндогенным) и последующим использованием. Гормональная система обеспечивает этот баланс путем интеграции, модуляции и мобилизации субстрата с дальнейшим взаимопревращением и утилизацией. У детей и младенцев в поддержании гомеостаза глюкозы важную роль также играют мобилизация и метаболизм липидов. Бета-окисление свободных жирных кислот приводит к образованию кетоновых тел, которые способны проходить через гематоэнцефалический барьер и таким образом обеспечивать основную альтернативную энергетическую поддержку нейронных структур головного мозга. При нехватке питания у детей наблюдается ускоренное снижение концентрации глюкозы в крови из-за относительно меньшего количества запасов гликогена и более быстрого роста концентрации кетоновых тел. Поэтому дети с гиперинсулинемической гипогликемией подвержены более высокому риску поражения головного мозга по сравнению со взрослыми пациентами.
Физиологические механизмы регуляции секреции инсулина
При гипергликемической гипогликемии существует несоответствие концентрации инсулина в сыворотке крови к С-пептиду (показателю синтеза инсулина и обмена углеводов — прим. ред.) для низкого уровня глюкозы в плазме крови. Метаболический эффект неадекватной секреции инсулина проявляется снижением уровня кетоновых тел и жирных кислот в сыворотке крови во время гипогликемического эпизода. Никакой корреляции между концентрацией инсулина в сыворотке крови и тяжестью гипогликемии не существует. В некоторых сложных случаях диагноз гипергликемической гипогликемии не может основываться исключительно на отношении концентрации инсулина к С-пептиду в сыворотке крови, а должен учитывать клинические проявления и биохимический профиль действия инсулина (низкая концентрации β-гидроксибутирата и жирных кислот).
Диагностические критерии гипергликемической гипогликемии
- уровень глюкозы в плазме крови 8 мг/кг/мин;
- положительный гликемический (>1,5 ммоль/л) ответ на внутримышечное/внутривенное введение глюкагона;
- положительный гликемический ответ на подкожное/внутривенное введение октреотида;
- низкий уровень связывающего инсулиноподобного фактора роста-1 в сыворотке крови (инсулин отрицательно регулирует экспрессию этого белка);
- снижение уровня разветвленноцепочечных аминокислот (лейцина, изолейцина и валина) в сыворотке крови;
- провокационные тесты (лейциновые или физические нагрузочные);
- сниженный/неопределяемый кетон в моче;
- нормальный уровень молочной кислоты;
- нормальный уровень гидроксибутирилкарнитина в сыворотке крови;
- нормальный уровень аммиака в крови;
- соответствующий антагонистический гормональный ответ для:
− кортизола >20 мкг/дл (500 нмоль/л);
− соматотропина >7 нг/мл;
Если в неонатальный период гипогликемия сохраняется >48 ч, требуется обследование.
Повышенная концентрация аммиака в сыворотке крови у пациентов с гипергликемической гипогликемией свидетельствует о синдроме гиперинсулинизма и гипераммониемии. Повышенный уровень гидроксибутирилкарнитина в плазме крови и 3-гидроксиглютарата в моче характерен при редком типе врожденного дефицита гидроксиацил-кофермента A дегидрогеназы. Некоторые типы гиперинсулинемической гипогликемии выявляются только после проведения провокационных тестов. Например, у пациентов с синдромом гиперинсулинизма и гипераммониемии (у которых наблюдается голодание, а также протеиновая гипогликемия) нагрузка белком/лейцином вызывает гипогликемию.
Лечение при гиперинсулинемической гипогликемии
Пациенты с гиперинсулинемической гипогликемией подвержены риску черепно-мозговой травмы, что приводит к кратковременным острым неврологическим симптомам и долгосрочным неврологическим последствиям (например эпилепсия, когнитивные расстройства, микроцефалия). Для предупреждения таких осложнений необходима экстренная диагностика и лечение. Лечение предусматривает медикаментозное, хирургическое, иногда комбинированное вмешательство. Долгосрочная терапия основана на ингибировании нежелательной секреции инсулина и/или обеспечения адекватного уровня глюкозы. Однако прежде всего — поддержание нормогликемии в безопасном диапазоне (>3,5 ммоль/л).
Контроль нормогликемии
Если уровень гипогликемии не изменяется при пероральном кормлении или пациент не может принимать пищу, мини-болюс (2 мл/кг массы тела) 10% глюкозы следует вводить внутривенно в течение 1 мин. Для достижения нормогликемии и поддержания уровня глюкозы в плазме крови в безопасном диапазоне немедленно следует вводить глюкозу в объеме 6–8 мг/кг/мин. Пациенты с гипергликемической гипогликемией требуют высокой скорости инфузии глюкозы, которая может быть скорригирована в соответствии с последовательными измерениями уровня глюкозы в плазме крови.
Применение глюкагона
Глюкагон вызывает гликогенолиз, глюконеогенез, кетогенез и липолиз, поэтому может быть применен в чрезвычайных ситуациях, когда пациенты не могут принимать пищу и/или невозможно проведение внутривенного вливания. Рекомендуемая разовая доза составляет 0,5–1 мг. Глюкагон в высоких дозах может вызвать ответную гипогликемию из-за парадоксального увеличения секреции инсулина. Глюкагон также возможно вводить непрерывно внутривенно/подкожно со скоростью 5–10 мкг/кг/ч для краткосрочной стабилизации уровня глюкозы в плазме крови, а в сочетании с октреотидом — в качестве долгосрочного консервативного лечения пациентов с врожденной гиперинсулинемической гипогликемией.
Частота питания
У младенцев частое употребление высококалорийной углеводной пищи может снизить частоту и тяжесть гипогликемических эпизодов. Поскольку у этих пациентов обычно наблюдается потеря аппетита, возможно применение чрескожной гастростомии. Употребление сырого кукурузного крахмала также может уменьшить частоту гипогликемических эпизодов, особенно при выработке толерантности к голоду в ночное время у детей в возрасте старше 1 года.
Применение диазоксида
Применение октреотида
Октреотид — препарат второй линии при лечении гиперинсулинемической гипогликемии, который ингибирует секрецию инсулина путем связывания с соматостатиновыми рецепторами sstr2 и sstr5. Активация sstr5 снижает активность промотора гена инсулина, ингибирует мобилизацию кальция и активность ацетилхолина. Соматостатин также ингибирует аденозинтрифосфатчувствительные калиевые каналы, что приводит к снижению секреции инсулина. Первоначальная доза инъекции октреотида составляет 5 мкг/кг/сут подкожно с интервалом в 6–8 ч. Рекомендуемая максимальная доза составляет 30–35 мкг/кг/сут. Долгосрочное непрерывное подкожное введение октреотида при установленной инсулиновой помпе было предложено в качестве возможной альтернативы хирургическому лечению для пациентов с моноаллельными мутациями генов аденозинтрифосфатчувствительных калиевых каналов. Начальным ответом на введение октреотида обычно является гипергликемия с последующим умеренным эффектом в течение 24–48 ч (тахифилаксия). Поэтому может потребоваться коррекция дозы для поддержания уровня глюкозы в плазме крови при нормогликемических уровнях. Тахифилаксия, некротизирующий энтероколит, анорексия, тошнота, боль в животе, диарея, нарушение функций желчного пузыря, повышение уровня трансаминаз печени, ингибирование гипофизарных гормонов, синдром удлинения интервала Q–T и остановка в линейном росте являются побочными эффектами применения октреотида. Однако в недавних исследованиях, оценивающих долгосрочные результаты терапии октреотидом у пациентов с врожденной гиперинсулинемической гипогликемией, действие препарата не выявило клинически значимого эффекта на линейный рост.
Аналоги соматостатина пролонгированного действия
Разработка синтетических октапептидов — октреотида пролонгированного действия (октреотид Лар) и ланреотида, состоящих из биоразлагаемых микросфер, позволяет применять эти препараты один раз в 28 дней. Октреотид Лар и ланреотид успешно назначают для детей с врожденной гиперинсулинемической гипогликемией. Применение пролонгированных форм не только улучшает соблюдение режима лечения, но и повышает качество жизни пациентов.
Применение нифедипина
Нифедипин ингибирует секрецию инсулина, инактивируя работу потенциалзависимых кальциевых каналов. Рекомендуемая доза составляет 0,25–2,5 мг/кг/сут, разделенная на 2–3 приема. Обычным побочным эффектом применения нифедипина является гипотония, особенно при дозах выше 0,5 мг/кг/сут. Несмотря на то что во многих случаях лечение нифедипином оказывает благоприятное влияние на течение гиперинсулинемической гипогликемии, в недавнем исследовании, посвященном исключительно изучению его применения при мутации в гене ABCC8, динамика гиперинсулинемической гипогликемии показала, что нифедипиновая терапия не была эффективной. Поэтому высказано предположение, что мутации в генах аденозинтрифосфатчувствительных калиевых каналов могут привести к неэффективности нифедипина по отношению к потенциалзависимым кальциевым каналам L-типа.
Новые и потенциально возможные методы лечения
Пациенты с диффузным и очаговым типом гиперинсулинемической гипогликемии нечувствительны к обычным медикаментозным средствам, таким как диазоксид и октреотид, поэтому хирургическое лечение оставалось единственным вариантом лечения. Тем не менее после операции отмечали рецидивы или даже осложнения, приводящие к развитию сахарного диабета или экзокринной недостаточности поджелудочной железы. Для улучшения краткосрочных и долгосрочных результатов лечения необходим поиск новых вариантов терапии.
В нескольких недавних исследованиях сообщалось об эффективном и безопасном применении ингибитора mTOR, сиролимуса, при тяжелой форме диффузной врожденной гиперинсулинемической гипогликемии без серьезных побочных эффектов. Оптимальная доза еще не установлена, поэтому рекомендуется придерживаться диапазонов, ранее определенных при назначении пациентам с трансплантацией почки (5–15 нг/мл). Наиболее частыми побочными эффектами сиролимуса являются стоматит, повышенный риск инфицирования, иммуносупрессия, почечная дисфункция, утомляемость, пневмония и повышенный уровень аминотрансферазы или липидов в сыворотке крови. Несмотря на ограниченный опыт применения ингибиторов mTOR при гиперинсулинемической гипогликемии многие клиницисты считают их хорошим выбором для отдельных пациентов, организм которых не реагируют на применение диазоксида или октреотида.
В качестве терапевтических мишеней при гиперинсулинемической гипогликемии рассматриваются рецепторы глюкагоноподобного пептида 1 (соответствующий ингибитор эксендин (9–39)) и белки шапероны (глибенкламид, карбамазепин). Обсуждается роль кетогенной диеты, которая может оказывать нейропротекторное воздействие, несмотря на сохранение нейрогликопении.
Долгосрочная терапия и прогноз при врожденной гиперинсулинемической гипогликемии
Лечение при гиперинсунемической гипогликемии является довольно сложным и требует мультидисциплинарного подхода. Раннее выявление и тщательное лечение этих пациентов жизненно важно для предотвращения неврологических осложнений. В исследованиях, посвященных долгосрочному прогнозу развития гиперинсулинемической гипогликемии, сообщалось о высокой частоте отставания в развитии нервной системы и различных неврологических расстройствах, включая эпилепсию и микроцефалию. Кроме того, частота развития аномальных нейродеструкций при транзиторных и хронических формах заболевания была схожей. Для оценки эффективности медикаментозной терапии, составления плана питания, соответствующего индивидуальной толерантности, и корригирования доз лекарственного средства могут потребоваться повторные тесты во время наблюдения. Кроме того, это позволит своевременно прекратить лечение.
Читайте также:

