Геномные библиотеки и их конструирование реферат
Обновлено: 30.06.2024
Виды вставок при конструировании рекомбинантных молекул ДНК, лигирование вектора со вставкой. Инфекция, трансфекция и клонирование. Скрининг клонированных популяций рекомбинантных молекул. Виды ДНК-библиотек, стратегии клонирования генов и кДНК.
| Рубрика | Биология и естествознание |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 27.07.2009 |
| Размер файла | 42,0 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Отдельные хромосомы дрожжей и некоторых простейших невозможно идентифицировать цитогенетическими методами, однако ДНК из них все же удается выделить. Для выделения применяют мягкие методы, чтобы избежать разрыва молекул. Затем ДНК подвергают электрофорезу в агарозном геле в условиях, позволяющих разделить молекулы длиной до 2000 т.п. н. Традиционные методы электрофореза не позволяют разделять дуплексные молекулы, размер которых значительно превышает 20 т.п. н. Скорость миграции столь больших молекул уже не зависит от их размера. Однако если вместо постоянного однонаправленного электрического поля, приложенного к обычному гелю, использовать поле, ориентация которого многократно меняется, то даже очень большие молекулы можно будет разделить по размерам. По-видимому, этот феномен объясняется механизмом прохождения молекул ДНК через поры агарозного геля. Предполагается, что молекулы вытягиваются в направлении поля, а затем при изменении этого направления переориентируются. Время переориентации зависит от длины цепи и угла между направлениями поля; они и определяют конечное расстояние, на которое перемещается молекула. В простейшем варианте импульсного электрофореза электрический ток подается импульсами, при этом направления поля примерно перпендикулярны друг другу, а само поле неоднородно. При более сложных распределениях используют однородные поля и оптимизируют угол между двумя направлениями, с тем чтобы повысить разрешение. Импульс обычно длится примерно минуту.
Библиотеки второго типа включают последовательности, составляющие всю мРНК, обнаруживаемую в определенных клетках. В этом случае популяцию мРНК превращают в популяцию молекул кДНК, которые затем клонируют. Геномные библиотеки представляют собой собрание генов и последовательностей ДНК; в библиотеках кДНК представлены продукты экспрессии этих генов в форме мРНК.
а. Геномные библиотеки
Геномные библиотеки обычно создают с помощью векторов, сконструированных на основе бактериофага X или космиды. Эти векторы содержат большие вставки, благодаря чему минимизируется число рекомбинантов, наобходимых для составления библиотеки. Например, если создается Х-библиотека генома млекопитающего, содержащего 3*10 9 п. н. при средней длине вставки 17 т.п. н., то весь геном будет представлен 3* 10 9 /1,7* 10 4 = 1,8* 10 5 рекомбинантами. На самом деле для создания библиотеки, вероятность обнаружения в которой определенного сегмента генома превышает 99%, нужно получить ~ 10 6 отдельных рекомбинантных молекул, поскольку лигирование отдельных фрагментов происходит случайно. Так, некоторые фрагменты могут быть включены более чем в одну векторную молекулу, а другие могут вообще не участвовать в лигировании и упаковке. Полная космидная библиотека содержит меньше рекомбинантных молекул, поскольку размер вставок может достигать 45 т.п. н.
Фрагменты суммарной геномной ДНК для конструирования библиотек можно получать несколькими способами. Наиболее удобный из них состоит в частичном расщеплении ДНК рестриктирующей эндонуклеазой, сайт узнавания которой содержит шесть оснований, а образующиеся липкие концы соответствуют липким концам выбранного вектора. В этом случае разрезание осуществляют лишь в ограниченном числе возможных сайтов. Поскольку выбор таких сайтов производится случайно и в используемом препарате геномной ДНК содержится много копий любого геномного сегмента, практически каждый сегмент ДНК должен быть представлен во фрагментах ДНК, пригодных по своему размеру для клонирования. При таком подходе, однако, может получиться неполная библиотека. Те части генома, в которых сайты узнавания рестриктирующих эндонуклеаз находятся слишком далеко друг от друга, не смогут включиться в жизнеспособный рекомбинантный фаг. С другой стороны, те области генома, в которых сайты узнавания тесно сгруппированы, будут разделены на очень короткие фрагменты, и не все из них будут представлены в библиотеке.
Вообще говоря, более репрезентативную библиотеку можно получить при частичной фрагментации геномной ДНК, осуществляемой более случайно, чем с помощью фермента с сайтом узнавания из шести пар оснований. Для этого можно использовать гидродинамические методы деградации ДНК или очень ограниченную обработку эндонуклеазами с сайтами узнавания из четырех пар оснований, например Alu I и Нае III.
б. Библиотеки кДНК
Для создания библиотек кДНК обычно используют плазмидные или фаговые векторы, сконструированные на основе бактериофага X. Принципы конструирования не отличаются от описанных, за исключением того, что в этих случаях чаще используют смесь разных мРНК, а не очищенную мРНК. Полученные с помощью специально сконструированных векторов или определенным образом отобранные библиотеки кДНК могут использоваться для клонирования последовательностей мРНК даже в тех случаях, когда аминокислотная последовательность белка и кодирующая нуклеотидная последовательность неизвестны и даже отсутствует гомологичный зонд. Соответствующие примеры мы рассмотрим ниже.
Библиотека экспрессирующихся кДНК. Очищенную кДНК или смесь разных кДНК можно лигировать с векторами, специально сконструированными для осуществления транскрипции и трансляции кодирующей области кДНК. Нужный клон идентифицируют с помощью иммунологического скрининга с применением антител, специфичных к полипептиду, кодируемому данной кДНк. Эта весьма удобная методика позволяет осуществить клонирование даже тогда, когда ничего не известно о структуре нужного нам гена или белка.
Одним из векторов, широко применяемых для изучения экспрессии, является производное фага X, получившее название Xgtll. Когда кДНК, содержащие EсоRI-линкеры, включаются в вектор Xgtll в его единственном сайте для эндонуклеазы EcoRI, вставки оказываются в области, кодирующей бактериальный ген в-галактозидазы. Примерно одна из шести кДНК-вставок включается в подходящей для транскрипции ориентации и в фазе с рамкой считывания в-галактозидазы. При индукции в-галактозидазного гена с помощью в-галактозида в lac-промоторе начинается транскрипция, которая распространяется на эукариотический сегмент. В результате трансляции соответствующей РНК образуется гибридный белок, у которого на N-конце находится в-галактозидазный полипептид, а на С-конце-эукариотический. Библиотека кДНК, созданная с помощью A. gt11, образует популяцию бляшек, отдельные члены которой содержат эти гибридные белки. Бляшку, содержащую интересующий нас белок, идентифицируют по ее способности связывать соответствующее антитело. На одной чашке можно выявить одну позитивную бляшку среди 10 4 и без труда провести скрининг 10 6 бляшек.
Библиотеки селективных кДНК. Развитие и дифференцировка сложных многоклеточных организмов из одной оплодотворенной яйцеклетки осуществляются с помощью высокоорганизованной системы дифференцированной экспрессии генов. Одни гены экспрессируются только в одном или строго ограниченном числе типов клеток, другие - в какой-то определенный период времени. В результате популяции цитоплазматических мРНК в различных тканях и клетках оказываются представленными разными молекулами. Такая дифференцированная экспрессия генов может использоваться для клонирования кДНК, соответствующих регулируемым генам, даже в тех случаях, когда о продуктах этих генов ничего не известно.
Например, при изучении процессов раннего развития Xenopus важно знать, какие гены экспрессируются при первых клеточных делениях. Для этого нужно идентифицировать те мРНК, которые присутствуют в гаструле, но не в яйцеклетках. Это можно сделать, создав геномную библиотеку и проведя раздельный скрининг с использованием препаратов РНК из яйцеклеток и гаструл. Затем можно идентифицировать и клонировать фаговые бляшки, которые дают положительный ответ при отжиге только с РНК гаструл. Однако данный метод имеет тот недостаток, что многие из 10 5 или более мРНК в двух указанных выше препаратах являются одинаковыми и приходится проводить скрининг громадного числа бляшек, чтобы обнаружить те немногие, которые проявляют специфичность. Более эффективным является создание библиотеки кДНК на основе гаструлярной РНК.
Библиотеку кДНК подвергают скринингу, выявляя те клоны, которые гибридизуются с обогащенным мРНК - зондом.
Некоторые стратегии клонирования генов и кДНК
Мы рассмотрели множество разных методов, используемых при конструировании, клонировании и отборе специфических рекомбинантных генов. На основе этих методов можно разработать множество стратегий для получения определенных клонированных генов или кДНК. При выборе эффективной и действенной стратегии важно учитывать природу гена и его продукта, а также происхождение вида. Чтобы представить себе все многообразие методов работы с рекомбинантными молекулами ДНК, лучше всего рассмотреть конкретные примеры клонирования различных генов и кДНК.
Конструирование геномных библиотек проводят, даже если сиквенс известен. На схеме представлены 2 альтернативных подхода к секвенированию генома.
Сначала может быть построена физическая карта, и клоны могут быть упорядочены относительно друг друга, потом их состыковывают.
Сначала пытаются состыковать клоны между собой, потом то, что не стыкуется, стыкуют друг с другом при помощи методик физического картирования.
Альтернативный подход – шотган всего генома, когда геном сразу полностью дробится на случайные куски, из которых пытаются собрать какую-то последовательность, а потом собранные кусочки располагают на геномной карте. Стадия финиширования при этом получается достаточно длинной.
1. Конструирование геномных библиотек.
Векторы, которые используются в геномных проектах. Используется большое количество плазмидных и фаговых векторов. У каждого носителя геномной ДНК есть свои плюсы и минусы. Поскольку библиотек всегда несколько, при их конструировании необходимо выбрать оптимальное сочетание векторов, которое обеспечит максимальную репрезентативность генома.
Плазмиды. рUC. 90% сиквенсов делается на этой плазмиде. В очень редких случаях берется какой-то другой вектор, но такого же типа – небольшая высококопийная бактериальная плазмида. Используется она, т.к. это высококопийная плазмида, присутствует в клетке до 1000 копий, ее легко выделить и концентрация ее в препарате высокая, поэтому легко очищать. Получается ДНК высокого качества,….. Технологически такой вектор обеспечивает наивысшее качество сиквенса, поэтому основная масса секвенирования делается на таких плазмидах. К тому же процесс с использованием высококопийной плазмиды легко роботизировать. Недостатки, связанные с высокой копийностью:
Некоторые фрагменты геномной ДНК в принципе невозможно клонировать в таких плазмидах, т.к. даже нормальный клеточный ген, если число его копий многократно возрастает, может оказаться токсичным для клетки. Эукариотические гены тоже могут быть токсичными для бактериальной клетки. 5-10% генома в таком векторе клонировать нельзя из-за проблемы токсичности.
В такие векторы нельзя клонировать протяженные фрагменты ДНК длиной больше нескольких т.н.п. Когда в pUC делаются вставки по 20-30 т.н.п., плазмиды становятся нестабильными, т.к. копийность у плазмиды та же самая, около 50% ДНК в клетке может оказаться плазмидной. Возникает мощное селективное давление, чтобы уменьшить количество ДНК. Постоянно идут процессы рекомбинации, достаточно легко может происходить реорганизация, в первую очередь делеции и инверсии. Любая перестройка плазмиды в сторону уменьшения будет подхвачена естественным отбором. Относительно стабильными оказываются вставки размером не более 1,5-2 т.н.п.
Фаговые векторы. У них всегда больше емкость: если инсерционный вектор, емкость около 10? т.н.п., если вектор замещения фага лямбда – 20? т.н.п. К тому же при размножении бактериофага не стоит вопрос токсичности, т.к. при размножении фага клетка погибает в любом случае, а фаг реплицировать и упаковать свою ДНК успеет. Это единственная причина, по которой фаговые векторы до сих пор используются в геномных проектах. За исключением очень экзотических ситуаций у клонированных в фаговом векторе генов не имеется шанса воспрепятствовать размножению фага, и если выбирать правильные штаммы фагов, то проблем с перестройками меньше. Считается, что фаговые векторы замещения достаточно стабильны, и их до сих пор используют в крупных геномных проектах, когда нужно закрыть пробелы, которые никак не клонируются в других библиотеках. Недостатки: ДНК фага выделять гораздо менее удобно (сложнее методика, гораздо более трудоемко, автоматизировать сложнее). Поэтому фаговые векторы обычно используются на стадии финиширования, когда нужно закрыть пробелы.
Следующий по емкости – космидный вектор. Это гибрид плазмиды и бактериофага. Картинка неправильная: должно быть 2 cos-сайта. До начала 90-х это были векторы с максимальной емкостью (увеличена по сравнению с бактериофагом в 2 раза). Размер космиды: 53 т.н.п. (максимум, который помещается в головку фага лямбда) минус размер самого вектора – это 45-51 т.н.п. емкости. Нормальная космида несет 2 cos-сайта, т.к. фаг нормально пакует в головку линейную ДНК между двумя cos-сайтами. Приготовление космидной библиотеки – гораздо более трудоемкая методика, но такие библиотеки считаются библиотеками хорошего качества, поскольку если получен высокий титр фаговых частиц, то ДНК не надо реамплифицировать, библиотека стабильна и долго хранится. В любой момент можно инфицировать такими космидами бактериальные клетки и получить соответствующие гены.
Дрожжевые искусственные хромосомы используются до сих пор, но с учетом этих вещей. Они используются для многих специализированных методов исследования генома, поскольку они все равно имеют свое значение. Если нужен крупный фрагмент ДНК, его особо никуда не клонируешь. Дрожжевые искусственные хромосомы – линейный фрагмент ДНК, который должен нести 3 составных части. Как правило, такая дрожжевая хромосома имеет точку инициации репликации плазмид, для того чтобы нарабатывать ДНК в бактериях. Препарат сначала амплифицируется в бактериях, получают большое количество плазмидной ДНК, а потом приготавливаются плечи искусственной хромосомы. В обязательном порядке в вектор должны входить 3 селективных маркера (обозначены буквами X, Y и Z). Два из них должны быть в одном плече хромосомы, еще один – в другом. Плазмида линеаризуется: обычно какой-то фрагмент ДНК вставлен между теломерными участками, он вырезается одной рестриктазой, и получается линейная хромосома. Мини-хромосома – несколько т.н.п., реально такая структура могла бы реплицироваться в дрожжевых клетках, но есть какой-то минимальный размер, меньше которого они оказываются нестабильны. YAC меньше 100 т.н.п. не поддерживаются. Затем такая маленькая линейная хромосома режется рестриктазой, сайт для которой располагается в пределах одного из маркеров, в данном случае – маркера Z. В результате мы получаем 2 плеча хромосомы. На одном плече – теломера и 1 селективный маркер, на втором плече – центромера, второй селективный маркер и теломера. Затем геномная ДНК режется той же рестриктазой, это частичная рестрикция, фрагменты отбираются по размеру и лигируются с плечами хромосомы.
Продукты лигирования вводятся в дрожжевые сферопласты, это достаточно сложная и не очень эффективная методика. Затем эти дрожжи регенерируют клеточную стенку и высеваются на селективную среду. Селективная среда должна отбирать хромосомы, которые несут 2 маркера и, как правило, содержит индикатор на отсутствие разрезанного маркера. Это достаточно эффективная методика. Получается библиотека, достаточно высокий выход этих клонов. Плечи могут лигироваться друг с другом, но такие хромосомы без вставки ДНК нестабильны. Методика достаточно простая, космидную библиотеку сделать сложнее. Когда выяснилось, что эти искусственные хромосомы нестабильны, разрабатывались альтернативные векторы, и сейчас 2 типа таких векторов широко используются, на них делаются все библиотеки для геномных проектов.
Секвенируются бактериальные искусственные хромосомы. Это достаточно громко звучит, но фактически это мини-производные от плазмиды Е. coli – F-фактора. От него остается точка инициации репликации и система распределения плазмиды по дочерним клеткам. F-плазмида нестабильна, число копий поддерживается в клетке на том же уровне, что и число копий бактериальных хромосом. В медленно растущих клетках будет всегда 1 копия F-плазмиды, в быстрорастущих – чуть больше. При такой низкой копийности должна быть система распределения по дочерним клеткам. Это относительно небольшая плазмида, векторов таких достаточно много, все они отличаются дополнительными сайтами, вставленными в плазмиду. Обычно сайт антибиотикорезистентности и обычно достаточно сложная система клонирования используется.
Должны быть сайты, в которые могут встраиваться интересующие фрагменты, и они стандартно находятся посреди lacZ-гена. BAC веткора стабильны со вставками до 300 т.н.п., а реально работа обычно идет со вставками 130-150 т.н.п. Не всегда имеет смысл до предела догонять емкость.
Еще один вектор такого же плана – это искусственные хромосомы на основе фага Р1. Это крупный фаг, более 100 т.н.п. В клетке он существует в виде плазмиды, не встраиваясь в хромосому. Может быть лизогенным. Это природная плазмида, рассчитанная на подержание достаточно крупного репликона.
На основе фага Р1 разработаны два типа векторов. Первый – эквивалент векторов на основе фага лямбда: есть векторы замещения, есть векторы типа космид, которые используют систему упаковки фага Р1. Объем этих векторов ограничен емкостью головки фага, порядка 125 т.н.п. Этот вектор сохраняет преимущества вектора на основе фага лямбда и имеет еще большую емкость. На основании этого фага разработан и второй вектор – Р1-искусственные хромосомы (PAC). Емкость такая же, как и у BAC, – стабильны со вставками до 300 т.н.п. Библиотеки, построенные на фаговых и бактериальных искусственных хромосомах, будут различаться по своим свойствам, поэтому в геномных проектах используют и те, и другие.

Т.е. это банк генов еще можно назвать набором клонированных фрагментов генома. Если геном какого-либо организма разрезать, вставить в плазмидные или вирусные вектора и ввести в клетку, то в таком виде его можно сохранить. При разрезании плазмидной или фаговой ДНК вероятность выпадения целых и неизмененных кусков генома довольно высока.
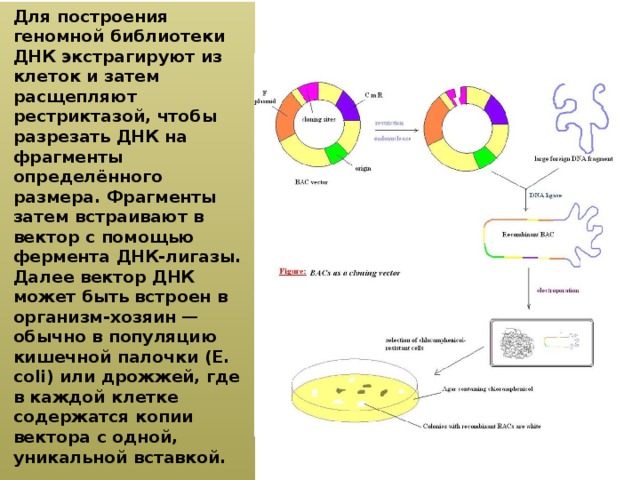
Для построения геномной библиотеки ДНК экстрагируют из клеток и затем расщепляют рестриктазой, чтобы разрезать ДНК на фрагменты определённого размера. Фрагменты затем встраивают в вектор с помощью фермента ДНК-лигазы. Далее вектор ДНК может быть встроен в организм-хозяин — обычно в популяцию кишечной палочки (E. coli) или дрожжей, где в каждой клетке содержатся копии вектора с одной, уникальной вставкой.

Схема блоттинга колоний геномной библиотеки с последующей гибридизацией ДНК колоний и меченых ДНК-зондов
Принципы создания плазмидных и вирусных векторов общие, поэтому рассмотрим их на примере плазмидных. Из вирусных ДНК лучше использовать ДНК фагов, так как они имеют большую емкость и позволяют вставлять более крупные куски генома.

Для создания банка генов необходимо
- выделение всей геномной ДНК
- фрагментация ДНК рестриктазами или ультразвуком
3) Очищенные кольцевые молекулы ДНК (векторы) обрабатывают той же рестриктазой, получая линейную ДНК. Клеточную ДНК добавляют к плазмидной в присутствии лигаз. Таким образом получают рекомбинантную плазмидную ДНК
4)рекДНК вводят в бактериальные или дрожжевые клетки, где плазмида реплицируется с образованием многих копий.
5)Клонирование бактерий: каждая возникшая колония клеток представляет собой клон или потомство одной клетки. Плазмиды одной колонии содержат клон геномной ДНК, а совокупность плазмид образует библиотеку геномной ДНК.
Презентация на тему: " ГЕНОМНЫЕ БИБЛИОТЕКИ И МЕТОДЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ИХ СОЗДАНИЯ." — Транскрипт:
1 ГЕНОМНЫЕ БИБЛИОТЕКИ И МЕТОДЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ИХ СОЗДАНИЯ
3 Геномная библиотека представляет собой набор ДНК всего генома одного организма. Эта ДНК хранится в популяции идентичных векторов, каждый из которых содержит различные вставки ДНК. Т.е. это банк генов еще можно назвать набором клонированных фрагментов генома. Если геном какого-либо организма разрезать, вставить в плазмидные или вирусные вектора и ввести в клетку, то в таком виде его можно сохранить. При разрезании плазмидной или фаговой ДНК вероятность выпадения целых и неизмененных кусков генома довольно высока. Первую геномную библиотеку создали Т. Маниатис с сотрудниками : ДНК из генома D. melanogaster клонировали в клетках E.coli
4 Для построения геномной библиотеки ДНК экстрагируют из клеток и затем расщепляют рестриктазой, чтобы разрезать ДНК на фрагменты определённого размера. Фрагменты затем встраивают в вектор с помощью фермента ДНК- лигазы. Далее вектор ДНК может быть встроен в организм- хозяин обычно в популяцию кишечной палочки (E. coli) или дрожжей, где в каждой клетке содержатся копии вектора с одной, уникальной вставкой.
5 Схема блоттинга колоний геномной библиотеки с последующей гибридизацией ДНК колоний и меченых ДНК-зондов
8 ДЛЯ СОЗДАНИЯ БАНКА ГЕНОВ НЕОБХОДИМО 1)выделение всей геномной ДНК 2)фрагментация ДНК рестриктазами или ультразвуком 3) Очищенные кольцевые молекулы ДНК (векторы) обрабатывают той же рестриктазой, получая линейную ДНК. Клеточную ДНК добавляют к плазмидной в присутствии лигаз. Таким образом получают рекомбинантную плазмидную ДНК 4)рекДНК вводят в бактериальные или дрожжевые клетки, где плазмида реплицируется с образованием многих копий. 5)Клонирование бактерий: каждая возникшая колония клеток представляет собой клон или потомство одной клетки. Плазмиды одной колонии содержат клон геномной ДНК, а совокупность плазмид образует библиотеку геномной ДНК.
10 ИСПОЛЬЗОВАНИЕ: -источник трансгенов -источник материала для изучения структуры, функции и регуляции индивидуальных генов, структуры и функции белков -сохранение генофонда исчезающих видов
Читайте также:

