Электронное строение атома углерода и виды гибридизации реферат
Обновлено: 07.07.2024
Углерод. Символ С, элемент IVA группы 2-го периода Периодической системы элементов ; атомный номер 6; атомная масса 12,01115.
Электронная конфигурация в основном состоянии 1s 2 2s 2 2p 2 .
Углерод – особый элемент. Ни один другой химический элемент не способен образовывать такое многообразие соединений. Причина этого многообразия в том, что атомы углерода способны:
1) соединяться друг с другом в цепи различного строения – открытые (неразветвленные, разветвленные), замкнутые.
2) образовывать не только простые (одинарные), но и кратные (двойные, тройные) связи:
3) образовывать прочные связи почти с любым другим элементом.
Эти уникальные свойства углерода объясняются сочетанием двух факторов:
- наличие на внешнем энергетическом уровне (2s и 2p) четырех электронов (поэтому атом углерода не склонен ни терять, ни приобретать свободные электроны с образованием ионов);
- малый размер атома (в сравнении с другими элементами IV группы).
Вследствие этого углерод образует главным образом ковалентные, а не ионные связи, и проявляет валентность, равную 4.
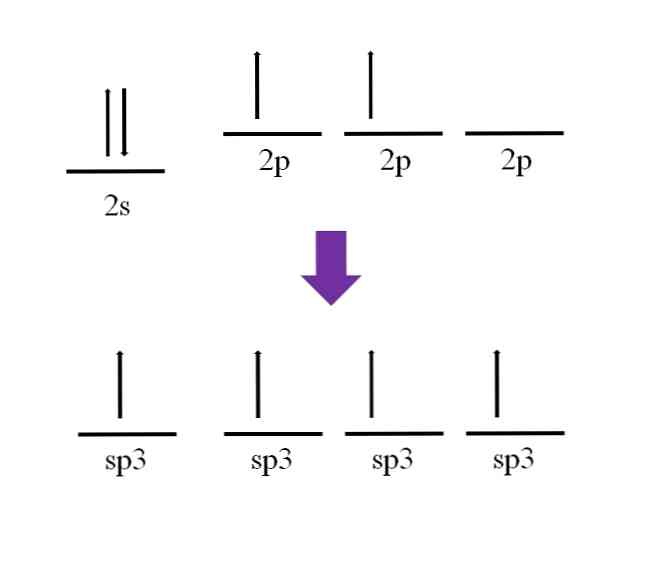
Гибридизация. Атом углерода в возбужденном состоянии обладает четырьмя неспаренными электронами: одним s-электроном и тремя p-электронами — 1s 2 2s 2 2p 3 .

Гибридизация электронных орбиталей – это процесс их взаимодействия, приводящий к выравниванию по форме и энергии. Гибридные орбитали отталкиваются и располагаются на максимальном расстоянии друг от друга. Объяснение этого факта впервые было дано американским химиком Л. Полингом. Ввиду относительной близости значений энергии 2s- и 2р-электронов, эти электроны могут взаимодействовать между собой в ходе образования химической связи с электронами другого атома, давая четыре новых равноценных гибридных электронных облака.
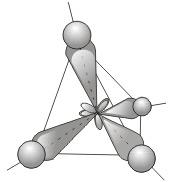
1) sp 3 – гибридизация. В процессе гибридизации принимает участие одна s и 3 p орбитали. Четыре совершенно одинаковые sp 3 -гибридные орбитали атома углерода расположены под углом 109,5° друг к другу и направлены к вершинам тетраэдра, в центре которого находится атом углерода .
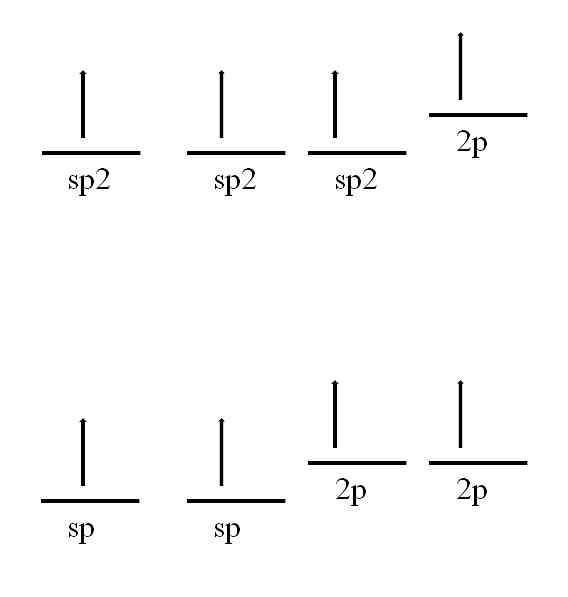
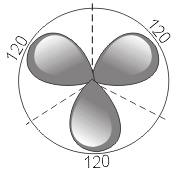
2) sp 2 – гибридизация. В этом случае при образовании соединений происходит гибридизация одной s- и двух р-орбиталей (sp 2 -гибридизация), при этом образуются три одинаковые sp 2 - гибридные орбитали, расположенные под углом 120° друг к другу
.
Посредством образования sp 2 -гибридных орбиталей как раз и объясняются структуры непредельных углеводородов с двойными связями. Например, для такой молекулы, как этилен,
схематично можно изобразить следующую структуру
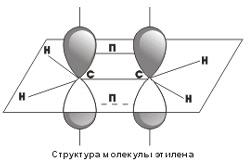
.
Как видно, у каждого атома углерода есть σ-связи, образованные sp 2 -гибридными облаками, кроме того, между атомами углерода образуется П-связь за счет перекрывания p-орбиталей. Таким образом, двойные углерод-углеродные связи состоят из одной σ- и одной П-связи.
3) sp – гибридизация. В этом случае при образовании соединений происходит гибридизация одной s- и одной р-орбитали. Эти две различные орбитали превращаются в две одинаковые гибридные орбитали (тип гибридизации - sp), направленные под углом 180° друг к другу, т.е. эти две связи имеют противоположное направление
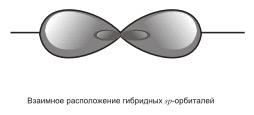
.
Остановимся подробнее на структуре молекулы ацетилена С2Н2. В молекуле ацетилена каждый атом углерода находится в sp-гибридном состоянии, образуя две гибридные связи, направленные под углом 180° друг к другу. Как в случае связей С-С, так и в случае связей С-Н возникает общее двухэлектронное облако, образующее σ-связи. σ-связью называют связь, возникающую при обобществлении электронных облаков двух атомов, если облака перекрываются по линии, соединяющей атомы.
Понятие и сущность sp3-гибридизации. Модель атома с sp3-гибридными орбиталями. Примеры соединений, для которых характерна sp3-гибридизация. Характеристика электронного строения атома углерода. Химические связи и гибридизация орбиталей атома углерода.
| Рубрика | Химия |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 19.05.2016 |
| Размер файла | 399,1 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
МИНОБРНАУКИ РОССИИ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«Санкт-Петербургский государственный технологический институт
УГС 240100 - Химическая и биотехнология
Направление подготовки 240100.62 - Химическая технология
Профиль Технология электрохимических производств
Факультет Химии веществ и материалов
Кафедра Технология электрохимических производств
Учебная дисциплина Физико-химические методы анализа
Работу выполнил студент Бундюк В.С.
Работу принял Юдина Н.С.
sp 3 -гибридизация
sp 3 -Гибридизация - гибридизация, в которой участвуют атомные орбитали одного s- и трех p-электронов (рис. 1).
Рис. 1. Образование sp 3 -гибридных орбиталей
Четыре sp 3 -гибридные орбитали симметрично ориентированны в пространстве под углом 109°28' (рис. 2).
Модель атома с sp 3 -гибридными орбиталями
Пространственная конфигурация молекулы, центральный атом которой образован sp 3 -гибридными орбиталями - тетраэдр
Тетраэдрическая пространственная конфигурация молекулы, центральный атом которой образован sp 3 -гибридными орбиталями
гибридизация атом орбиталь углерод
Примеры соединений, для которых характерна sp 3 -гибридизация: NH3, POCl3, SO2F2, SOBr2, NH 4+ , H3O + . Также, sp 3 -гибридизация наблюдается во всех предельных углеводородах (алканы, циклоалканы) и других органческих соединениях: CH4, C5H12, C6H14, C8H18 и др. Общая формула алканов: CnH2n+2. Общая формула циклоалканов: CnH2n. В предельных углеводородах все химические связи одинарные, поэтому между гибридными орбиталями этих соединений возможно только у-перекрывание.
Атомная орбиталь - это функция, которая описывает плотность электронного облака в каждой точке пространства вокруг ядра атома. Электронное облако - это область пространства, в которой с высокой вероятностью может быть обнаружен электрон.
Для согласования электронного строения атома углерода и валентности этого элемента пользуются представлениями о возбуждении атома углерода. В нормальном (невозбужденном) состоянии атом углерода имеет два неспаренных 2р 2 -электрона. В возбужденном состоянии (при поглощении энергии) один из 2s 2 -электронов может переходить на свободную р-орбиталь. Тогда в атоме углерода появляется четыре неспаренных электрона:
Напомним, что в электронной формуле атома (например, для углерода 6С - 1s 2 2s 2 2p 2 ) большие цифры перед буквами - 1, 2 - обозначают номер энергетического уровня. Буквы s и р указывают форму электронного облака (орбитали), а цифры справа над буквами говорят о числе электронов на данной орбитали. Все s-орбитали сферические
На втором энергетическом уровне кроме 2s-орбитали имеются три 2р-орбитали. Эти 2р-орбитали имеют эллипсоидную форму, похожую на гантели, и ориентированы в пространстве под углом 90° друг к другу. 2р-Орбитали обозначают 2рх, 2рy и 2рz в соответствии с осями, вдоль которых эти орбитали расположены.
Форма и ориентация р-электронных орбиталей
При образовании химических связей электронные орбитали приобретают одинаковую форму. Так, в предельных углеводородах смешиваются одна s-орбиталь и три р-орбитали атома углерода с образованием четырех одинаковых (гибридных) sр 3 -орбиталей:
Это - sр 3 -гибридизация.
Гибридизация - выравнивание (смешивание) атомных орбиталей (s и р) с образованием новых атомных орбиталей, называемых гибридными орбиталями.
Четыре sp 3 -гибридные орбитали атома углерода
Гибридные орбитали имеют асимметричную форму, вытянутую в сторону присоединяемого атома. Электронные облака взаимно отталкиваются и располагаются в пространстве максимально далеко друг от друга. При этом оси четырех sр3-гибридных орбиталей оказываются направленными к вершинам тетраэдра (правильной треугольной пирамиды).
Соответственно углы между этими орбиталями - тетраэдрические, равные 109°28'.
Вершины электронных орбиталей могут перекрываться с орбиталями других атомов. Если электронные облака перекрываются по линии, соединяющий центры атомов, то такую ковалентную связь называют сигма () - связью. Например, в молекуле этана С2Н6 химическая связь образуется между двумя атомами углерода перекрыванием двух гибридных орбиталей. Это -связь. Кроме того, каждый из атомов углерода своими тремя sр 3 -орбиталями перекрывается с s-орбиталями трех атомов водорода, образуя три -связи.
Схема перекрывания электронных облаков в молекуле этана
Всего для атома углерода возможны три валентных состояния с различным типом гибридизации. Кроме sр 3 -гибридизации существует sр 2 - и sр-гибридизация.
sр 2 -Гибридизация - смешивание одной s- и двух р-орбиталей. В результате образуются три гибридные sр 2 -орбитали. Эти sр 2 -орбитали расположены в одной плоскости (с осями х, у) и направлены к вершинам треугольника с углом между орбиталями 120°. Негибридизованная р-орбиталь перпендикулярна к плоскости трех гибридных sр 2 -орбиталей (ориентирована вдоль осиz). Верхняя половина р-орбитали находится над плоскостью, нижняя половина - под плоскостью.
Тип sр 2 -гибридизации углерода бывает у соединений с двойной связью: С=С, С=О, С=N. Причем только одна из связей между двумя атомами (например, С=С) может быть -связью. (Другие связывающие орбитали атома направлены в противоположные стороны.) Вторая связь образуется в результате перекрывания негибридных р-орбиталей по обе стороны от линии, соединяющей ядра атомов.
Орбитали (три sp 2 и одна р) атома углерода в sp 2 -гибридизации
Ковалентная связь, образующаяся путем бокового перекрывания р-орбиталей соседних углеродных атомов, называется пи()-связью.
Образование -связи
Из-за меньшего перекрывании орбиталей -связь менее прочная, чем -связь.
sр-Гибридизация - это смешивание (выравнивание по форме и энергии) одной s- и одной р-орбиталей с образованием двух гибридных sр-орбиталей. sр-Орбитали расположены на одной линии (под углом 180°) и направлены в противоположные стороны от ядра атома углерода. Две р-орбитали остаются негибридизованными. Они размещены взаимно перпендикулярно направлениям -связей. На рисунке sр-орбитали показаны вдоль оси y, а негибридизованные две р-орбитали- вдоль осей х и z.
Атомные орбитали (две sp и две р) углерода в состоянии sp-гибридизации
Тройная углерод-углеродная связь СС состоит из -связи, возникающей при перекрывании sp-гибридных орбиталей, и двух -связей.
Электронное строение атома углерода
Углерод, входящий в состав органических соединений проявляет постоянную валентность. На последнем энергетическом уровне атома углерода содержится 4 электрона, два из которых занимают 2s- орбиталь, имеющую сферическую форму, а два электрона занимают 2р-орбитали, имеющие гантелеподобную форму. При возбуждении один электрон из 2s-орбитали может переходить на одну из вакантных 2р-орбиталей. Этот переход требует некоторых энергетических затрат (403 кДж/моль). В результате возбужденный атом углерода имеет 4 неспаренных электрона и его электронная конфигурация выражается формулой 2s1 2p3 .
Атом углерода в возбужденном состоянии способен образовывать 4 ковалентных связи за счет 4 собственных неспаренных электронов и 4 электронов других атомов. Так, в случае углеводорода метана (СН4) атом углерода образует 4 связи с s-электронами атомов водорода. При этом должны были бы образовываться 1 связь типа s-s (между s-электроном атома углерода и s-электроном атома водорода) и 3 p-s-связи (между 3 р-электронами атома углерода и 3 s-электронами 3-х атомов водорода). Отсюда вытекает вывод о неравноценности четырех ковалентных связей, образуемых атомом углерода. Однако, практический опыт химии свидетельствует о том, что все 4 связи в молекуле метана абсолютно равноценны, а молекула метана имеет тетраэдрическое строение с валентными углами 109°, чего не могло бы быть при неравноценности связей. Ведь только орбитали р-электронов ориентированы в пространстве по взаимноперпендикулярным осям x, y, z, а орбиталь s-электрона имеет сферическую форму, поэтому направление образования связи с этим электроном было бы произвольным. Объяснить это противоречие смогла теория гибридизации. Л.Поллинг высказал предположение, что в любых молекулах не существует изолированных друг от друга связей. При образовании связей орбитали всех валентных электронов перекрываются. Известно несколько типов гибридизации электронных орбиталей. Предполагается, что в молекуле метана и других алканов в гибридизацию вступает 4 электрона.
Гибридизация орбиталей атома углерода
Гибридизация орбиталей - это изменение формы и энергии некоторых электронов при образовании ковалентной связи, приводящее к более эффективному перекрыванию орбиталей и повышению прочности связей. Гибридизация орбиталей происходит всегда, когда в образовании связей участвуют электроны, принадлежащие к различным типам орбиталей. 1. sp 3 -гибридизация (первое валентное состояние углерода). При sp3 -гибридизации 3 р- орбитали и одна s-орбиталь возбужденного атома углерода взаимодействуют таким образом, что получаются орбитали абсолютно одинаковые по энергии и симметрично расположенные в пространстве. Это преобразование можно записать так:
s + px+ py + pz = 4sp3
При гибридизации общее число орбиталей не изменяется, а изменяется только их энергия и форма. Показано, что sр3 -гибридизация орбитали напоминают объемную восьмерку, одна из лопастей которой значительно больше другой. Четыре гибридных орбитали вытянуты от центра к вершинам правильного тетраэдра под углами 109,50 . Связи образованные гибридными электронами (например связь s-sp 3 ) более прочные, чем связи, осуществляемые негибридизованными р-электронами (например, связь-s-p). поскольку гибридная sp3 -орбиталь обеспечивает большую площадь перекрывания электронных орбиталей, чем негибридизованная р-орбиталь. Молекулы, в которых осуществляется sp3 - гибридизация имеют тетраэдрическое строение. К ним, кроме метана, относятся гомологи метана, неорганические молекулы типа аммиака. На рисунках показана гибридизованная орбиталь и тетраэдрическая молекула метана. Химические связи, возникающие в метане между атомами углерода и водорода относятся к типу 2 у-связей (sp3 -s-связь). Вообще говоря любая сигма-связь характеризуется тем, что электронная плотность двух связанных между собой атомов, перекрывается по линии, соединяющей центры (ядра) атомов. у-Связи отвечают максимально возможной степени перекрывания атомных орбиталей, поэтому они достаточно прочны. 2. sp2 -гибридизация (второе валентное состояние углерода). Возникает в результате перекрывания одной 2s и двух 2р орбиталей. Образовавшиеся sp2 -гибридные орбитали располагаются в одной плоскости под углом 1200 друг к другу, а негибридизованная р-орбиталь перпендикулярно к ней. Общее число орбиталей не меняется - их четыре.
s + px + py + pz = 3sp2 + pz
Состояние sp2 -гибридизации встречается в молекулах алкенов, в карбонильной и карбоксильной группах, т.е. у соединений, имеющих в своем составе двойную связь. Так, в молекуле этилена гибридизованные электроны атома углерода образуют 3 у-связи (две связи типа sp 2 -s между атомом углерода и атомами водорода и одна связь типа sp 2 -sp 2 между атомами углерода). Оставшийся негибридизованным р-электрон одного атома углерода образует р-связь с негибридизованным р-электроном второго атома углерода. Характерной особенностью р-связи является то, что перекрывание орбиталей электронов идет вне линии, соединяющей два атома. Перекрывание орбиталей идет выше и ниже у-связи, соединющей оба атома углерода. Таким образом двойная связь является комбинацией у- и р-связей. На первых двух рисунках показано, что в молекуле этилена валентные углы между атомами, образующими молекулу этилена, составляют 1200 (соответственно ориентации с пространстве трех sp2 - гибридных орбиталей). На третьем и четвертом рисунках показано образование р-связи. этилен (образование у-связей) этилен (образование пи-связи) Поскольку площадь перекрывания негибридизованных р-орбиталей в р-связях меньше, чем площадь перекрывания орбиталей в у-связях, то р-связь менее прочна, чем у-связь и легче разрывается в химических реакциях. 3. sp-гибридизация (третье валентное состояние углерода). В состоянии sр-гибридизации атом углерода имеет две sр-гибридные орбитали, расположенные линейно под углом 1800 друг к другу и две негибридизованные р-орбитали расположенные в двух взаимно перпендикулярных плоскостях. sр- Гибридизация характерна для алкинов и нитрилов, т.е. для соединений, имеющих в своем составе тройную связь.
s + px + py + pz = 2sp + py + pz
Так, в молекуле ацетилена валентные углы между атомами составляют 1800 . Гибридизованные электроны атома углерода образуют 2 у-связи (одна связь sp-s между атомом углерода и атомом водорода и другая связь типа sp-sp между атомами углерода. Два негибридизованных р-электрона одного атома углерода образуют две р-связи с негибридизованными р-электронами второго атома углерода. Перекрывание орбиталей р-электронов идет не только выше и ниже у-связи, но и спереди и сзади, а суммарное облако р-электронов имеет цилиндрическую форму. Таким образом тройная связь является комбинацией одной у-связи и двух р-связей. Наличие в молекуле ацетилена менее прочных двух р- связей, обеспечивает способность этого вещества вступать в реакции присоединения с разрывом тройной связи.
Вывод: sp3-гибридизация характерна для соединений углерода. В результате гибридизации одной s-орбитали и трех р-орбиталей образуются четыре гибридные sp3-орбитали, направленные к вершинам тетраэдра с углом между орбиталями 109°.
Подобные документы
Развитие модельных представлений в квантовой химии. Метод валентных связей. Основные положения данного метода. Гибридизация атомных орбиталей и условия их образования. Правила выбора канонических форм. Гибридизация атома углерода и гибридных орбиталей.
презентация [284,1 K], добавлен 15.10.2013
Гибридизация – квантово-химический способ описания перестройки орбиталей атома в молекуле по сравнению со свободным атомом. Изменение формы и энергии орбиталей атома при образовании ковалентной связи и достижения более эффективного перекрывания орбиталей.
презентация [788,9 K], добавлен 22.11.2013
Представление о строении метана (молекулярная, электронная и структурная формулы). Физические свойства, нахождение в природе, тип химической связи и пространственное строение молекулы и атома углерода в трёх валентных состояниях, понятие гибридизации.
дипломная работа [21,6 K], добавлен 31.03.2009
Многообразие соединений углерода, их распространение в природе и применение. Аллотропные модификации. Физические свойства и строение атома свободного углерода. Химические свойства углерода. Карбонаты и гидрокарбонаты. Структура алмаза и графита.
реферат [209,8 K], добавлен 23.03.2009
Вращательные движения определяют важнейшие черты стационарных состояний электронных оболочек и ядер, aтомов и молекул. Гибридизация – смешение состояний с различными значениями момента импульса. Совместные измерения динамических переменных и коммутация.

Углерод (С) – шестой элемент периодической таблицы Менделеева с атомным весом 12. Элемент относится к неметаллам и имеет изотоп 14 С. Строение атома углерода лежит в основе всей органической химии, т. к. все органические вещества включают молекулы углерода.
Атом углерода
Положение углерода в периодической таблице Менделеева:
Опираясь на данные из таблицы, можно заключить, что строение атома элемента углерода включает две оболочки, на которых расположено шесть электронов. Валентность углерода, входящего в состав органических веществ, постоянна и равна IV. Это значит, что на внешнем электронном уровне находится четыре электрона, а на внутреннем – два.
Из четырёх электронов два занимают сферическую 2s-орбиталь, а оставшиеся два – 2p-орбиталь в виде гантели. В возбуждённом состоянии один электрон с 2s-орбитали переходит на одну из 2p-орбиталей. При переходе электрона с одной орбитали на другую затрачивается энергия.
Таким образом, возбуждённый атом углерода имеет четыре неспаренных электрона. Его конфигурацию можно выразить формулой 2s 1 2p 3 . Это даёт возможность образовывать четыре ковалентные связи с другими элементами. Например, в молекуле метана (СН4) углерод образует связи с четырьмя атомами водорода – одна связь между s-орбиталями водорода и углерода и три связи между p-орбиталями углерода и s-орбиталями водорода.
Схему строения атома углерода можно представить в виде записи +6C)2)4 или 1s 2 2s 2 2p 2 .
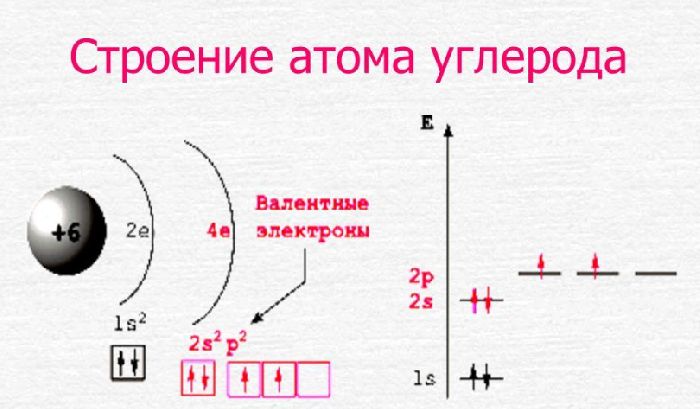
Рис. 2. Строение атома углерода.
Физические свойства
Углерод встречается в природе в виде горных пород. Известно несколько аллотропных модификаций углерода:
- графит;
- алмаз;
- карбин;
- уголь;
- сажа.
Все эти вещества отличаются строением кристаллической решётки. Наиболее твёрдое вещество – алмаз – имеет кубическую форму углерода. При высоких температурах алмаз превращается в графит с гексагональной структурой.
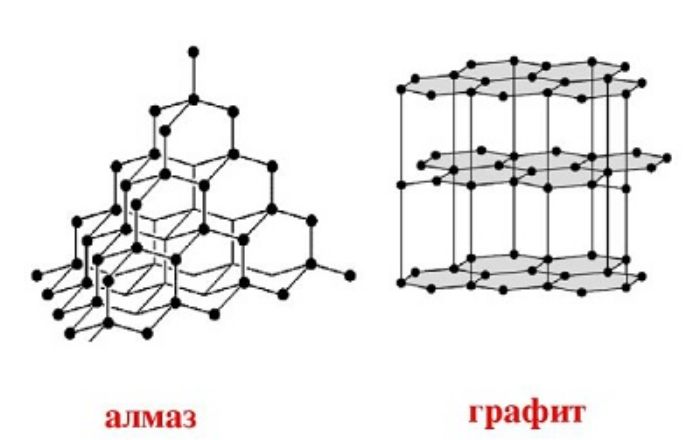
Рис. 3. Кристаллические решётки графита и алмаза.
Химические свойства
Атомное строение углерода и его способность присоединять четыре атома другого вещества определяют химические свойства элемента. Углерод реагирует с металлами, образуя карбиды:
- Са + 2С → СаС2;
- Cr + C → CrC;
- 3Fe + C → Fe3C.
Также реагирует с оксидами металлов:
- 2ZnO + C → 2Zn + CO2;
- PbO + C → Pb + CO;
- SnO2 + 2C → Sn + 2CO.
При высоких температурах углерод реагирует с неметаллами, в частности с водородом, образуя углеводороды:
С кислородом углерод образует углекислый газ и угарный газ:
Угарный газ также образуется при взаимодействии с водой:
Концентрированные кислоты окисляют углерод, образуя углекислый газ:
Активность углерода возрастает при нагревании. При низких температурах элемент относительно стабилен.
Что мы узнали?
Углерод – типичный неметалл с шестью электронами на s- и р-орбиталях. В активном состоянии приобретает валентность IV и способен присоединять четыре атома вещества. Углерод может быть представлен в виде угля, сажи, графита, алмаза. Элемент реагирует с металлами, неметаллами, кислотами, кислородом, оксидами.
Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Одна из характеристик химических связей — тип перекрывания орбиталей атомов в молекуле.
По характеру перекрывания различают σ-(сигма) и π‑(пи) связи.
| σ-Связь — это связь, в которой перекрывание орбиталей происходит вдоль оси, соединяющей ядра атомов. |
σ-Связь может быть образована любыми типами орбиталей (s, p, d, гибридизованными).
σ-Связь — это основная связь в молекуле, которая преимущественно образуется между атомами.
Между двумя атомами возможна только одна σ-связь.
 |  |
 |  |
 |  |
| π-Связь — это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи. |
π-Связь образуется при перекрывании только р- (или d) орбиталей, перпендикулярных линии связи и параллельных друг другу.
π-Связь является дополнительной к σ-связи, она менее прочная и легче разрывается при химических реакциях.
Электронная формула атома углерода в основном состоянии:
+6С 1s 2 2s 2 2p 2
+6С 1s 2s 2p
В возбужденном состоянии: один электрон переходит с 2s-подуровня на 2р-подуровень.
+6С * 1s 2 2s 1 2p 3
+6С * 1s 2 2s 1 2p 3
Таким образом, в возбужденном состоянии углерод содержит четыре неспаренных электрона, может образовать четыре химические связи и проявляет валентность IV в соединениях.
При образовании четырех химических связей атомом углерода происходит гибридизация атомных орбиталей.
| Гибридизация атомных орбиталей — это выравнивание электронной плотности атомных орбиталей разного типа с образованием новых, молекулярных орбиталей, форма и энергия которых одинаковы. |
В гибридизацию вступают атомные орбитали с небольшой разницей в энергии (как правило, орбитали одного энергетического уровня). В зависимости от числа и типа орбиталей, участвующих в гибридизации, для атома углерода возможны sp 3 , sp 2 и sp-гибридизация.
sp 3 -Гибридизация
В sp 3 -гибридизацию вступают одна s-орбиталь и три p-орбитали. При этом образуются четыре sp 3 -гибридные орбитали:


| Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным. |
Поэтому четыре гибридные орбитали углерода в состоянии sp 3 -гибридизации направлены в пространстве под углом 109 о 28’ друг к другу, что соответствует тетраэдрическому строению.

| Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода. Валентный угол Н–С–Н в метане равен 109 о 28’ |

Молекулам линейных алканов с большим числом атомов углерода соответствует зигзагообразное расположение атомов углерода.
| Например, пространственное строение н-бутана |

sp 2 -Гибридизация
В sp 2 -гибридизацию вступают одна s-орбиталь и две p-орбитали. Одна p-орбиталь не гибридизуется:

| Три sp 2 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным. |
Поэтому три sp 2 -гибридные орбитали атома углерода направлены в пространстве под углом 120 о друг к другу, что соответствует плоскому строению (треугольник).

При этом негибридная р-орбиталь располагается перпендикулярно плоскости, в которой расположены три гибридные sp 2 — орбитали.

| Например, молекула этилена C2H4 имеет плоское строение. Сигма-связь между атомами углерода образуется за счет перекрывания sp 2 -гибридных орбиталей. Пи-связь между атомами углерода образуется за счет перекрывания негибридных р-орбиталей. |

Модель молекулы этилена:

sp-Гибридизация
В sp-гибридизацию вступают одна s-орбиталь и одна p-орбиталь. Две p-орбитали не вступают в гибридизацию:

| Две sp-гибридные орбитали атома углерода направлены в пространстве под углом 180 о друг к другу, что соответствует линейному строению. |

При этом две р-орбитали располагаются перпендикулярно друг другу и перпендикулярно линии, на которой расположены гибридные орбитали.
атом углерода Это, пожалуй, самый важный и символический из всех элементов, потому что благодаря этому возможно существование жизни. Он включает в себя не только несколько электронов или ядро с протонами и нейтронами, но и звездную пыль, которая в конечном итоге включается и образует живые существа.
Кроме того, атомы углерода находятся в земной коре, хотя их количество не сопоставимо с такими металлическими элементами, как железо, карбонаты, диоксид углерода, нефть, алмазы, углеводы и т. Д., Которые являются частью его физические и химические проявления.
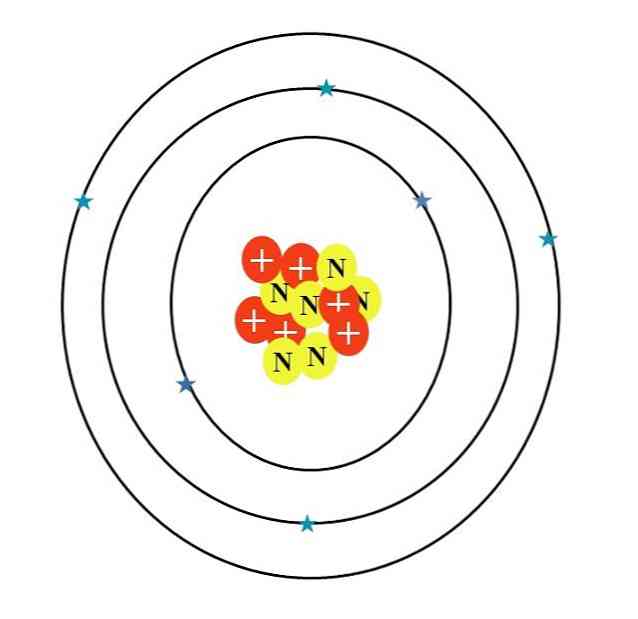
Но как атом углерода? Первым неточным эскизом является тот, который наблюдается на изображении выше, характеристики которого описаны в следующем разделе..
Атомы углерода путешествуют через атмосферу, моря, недра, растения и любые виды животных. Его большое химическое разнообразие обусловлено высокой стабильностью его связей и тем, как они упорядочены в пространстве. Таким образом, он имеет с одной стороны гладкий и смазывающий графит; а с другой стороны, алмаз, твердость которого превосходит твердость многих материалов.
Если бы атом углерода не обладал качествами, которые его характеризуют, органическая химия не существовала бы полностью. Некоторые провидцы видят в нем новые материалы будущего через конструирование и функционализацию его аллотропных структур (углеродные нанотрубки, графен, фуллерены и т. Д.).
- 1 Характеристика атома углерода
- 2 Структура
- 3 Гибридизация
- 3.1 sp3
- 3.2 sp2 и sp
- 4.1 Первичный
- 4.2 Вторичный
- 4.3 третичный
- 4.4 Четвертичный
- 5.1 Атомная единица массы
- 5.2 Углеродный цикл и жизнь
- 5.3 13C ЯМР спектроскопия
Характеристики атома углерода
Сумма масс их атомных частиц дает среднее значение 12.0107 ед. Однако атом на изображении соответствует 12-изотопу углерода ( 12 В), который состоит из д. Другие изотопы, такие как 13 С и 14 С, менее обильные, изменяются только по числу нейтронов.
Итак, если вы рисуете эти изотопы на 13 C будет иметь дополнительный желтый круг, а 14 С, еще два. Это логически означает, что они являются более тяжелыми атомами углерода.
В дополнение к этому, какие еще характеристики могут быть упомянуты в этом отношении? Он четырехвалентен, то есть может образовывать четыре ковалентные связи. Он расположен в группе 14 (НДС) периодической таблицы, более конкретно в блоке p.
Это также очень универсальный атом, способный связывать практически все элементы периодической таблицы; особенно с самим собой, образуя макромолекулы и линейные, разветвленные и пластинчатые полимеры.
структура
Какова структура атома углерода? Чтобы ответить на этот вопрос, сначала вы должны перейти к вашей электронной конфигурации: 1с 2 2s 2 2р 2 или [Он] 2с 2 2р 2 .
Таким образом, есть три орбитали: 1 2 , 2s 2 и 2р 2 , каждый с двумя электронами. Это также можно увидеть на изображении выше: три кольца с двумя электронами (голубые звезды) каждое (не путайте кольца с орбитами: они орбитальные).
Обратите внимание, однако, что две звезды имеют более темный оттенок синего цвета, чем остальные четыре. Почему? Потому что первые два соответствуют внутреннему слою 1с 2 или [He], который не участвует непосредственно в образовании химических связей; в то время как электроны во внешнем слое, 2s и 2p, делают.
S и p орбитали не имеют одинаковую форму, поэтому проиллюстрированный атом не соответствует действительности; в дополнение к большой диспропорции расстояния между электронами и ядром, которое должно быть в сотни раз больше.
гибридизация
Ранее упоминалось, что атом углерода является четырехвалентным. В соответствии с его электронной конфигурацией его 2s-электроны спарены, а 2p-электроны спарены:
![]()
Остается свободная орбиталь, которая пуста и заполнена дополнительным электроном в атоме азота (2р 3 ).
Согласно определению ковалентной связи, необходимо, чтобы каждый атом вносил электрон для своего образования; Тем не менее, можно заметить, что в базальное состояние атома углерода, он едва имеет два неспаренных электрона (по одному в каждой 2p-орбитали). Это означает, что в этом состоянии это двухвалентный атом, и, следовательно, он образует только две связи (-C-).
Итак, как это возможно, что атом углерода образует четыре связи? Для этого вы должны продвинуть электрон с орбитали 2s на орбиту с более высокой энергией 2p. Это сделано, четыре получающиеся орбитали вырождаться; другими словами, они имеют одинаковую энергию или стабильность (обратите внимание, что они выровнены).
Этот процесс известен как гибридизация, и благодаря этому теперь атом углерода имеет четыре орбитальных sp 3 с одним электроном каждый, чтобы сформировать четыре связи. Это связано с тем, что он является четырехвалентным.
зр 3
Когда атом углерода обладает sp-гибридизацией 3 , Ориентируйте его четыре гибридные орбитали к вершинам тетраэдра, который является его электронной геометрией.
Таким образом, вы можете определить углеродный сп 3 потому что он образует только четыре простые связи, как в молекуле метана (СН4). И вокруг этого можно наблюдать тетраэдрическую среду.
Перекрытие sp орбиталей 3 она настолько эффективна и стабильна, что простая связь C-C имеет энтальпию 345,6 кДж / моль. Это объясняет, почему существуют бесконечные углеродистые структуры и неизмеримое количество органических соединений. В дополнение к этому, атомы углерода могут образовывать другие типы связей.
зр 2 и зр
![]()
Атом углерода также способен принимать другие гибридизации, которые позволят ему образовывать двойную или даже тройную связь.
В sp гибридизации 2 , Как видно на изображении, есть три sp-орбитали 2 вырождается и 2p орбиталь остается неизменной или "чистой". С тремя орбитали 2 отделенный на 120º, углерод образует три ковалентные связи, рисуя электронную геометрию в треугольной плоскости; в то время как с 2p-орбиталью, перпендикулярной остальным трем, она образует связь π: -C = C-.
Для случая sp-гибридизации есть две sp-орбитали, разделенные на 180º, так что они рисуют линейную электронную геометрию. На этот раз они имеют две чистые 2p-орбитали, перпендикулярные друг другу, которые позволяют углероду образовывать тройные связи или две двойные связи: -C≡C- или . C = C = C . (центральный углерод имеет sp-гибридизацию) ).
Обратите внимание, что всегда (обычно), если вы добавите ссылки вокруг углерода, вы обнаружите, что число равно четырем. Эта информация важна при рисовании структур Льюиса или молекулярных структур. Атом углерода, образующий пять связей (= C≡C), теоретически и экспериментально недопустим.
классификация
Как классифицируются атомы углерода? Больше, чем классификация по внутренним характеристикам, в действительности это зависит от молекулярной среды. То есть, что внутри молекулы ее атомы углерода могут быть классифицированы в соответствии со следующим.
первичный
Первичный углерод - это тот, который связан только с другим углеродом. Например, молекула этана, СН3-СН3 состоит из двух связанных первичных углеродов. Это сигнализирует о конце или начале углеродной цепи.
вторичный
Это тот, который связан с двумя атомами углерода. Итак, для молекулы пропана, СН3-СН2-СН3, атом углерода среды является вторичным (метиленовая группа, -CH2-).
третичный
Третичные атомы углерода отличаются от остальных тем, что из них возникают ветви основной цепи. Например, 2-метилбутан (также называемый изопентан), СН3-СН(СН3) -CH2-СН3 Третичный углерод выделен жирным шрифтом.
четвертичный
И, наконец, четвертичные атомы углерода, как следует из названия, связаны с четырьмя другими атомами углерода. Молекула неопентана, С(СН3)4 имеет четвертичный атом углерода.
приложений
Атомная единица массы
Средняя атомная масса 12 C используется в качестве стандартной меры для расчета массы других элементов. Таким образом, водород весит двенадцатую часть этого изотопа углерода, который используется для определения того, что известно как атомная единица массы u.
Таким образом, другие атомные массы можно сравнить с 12 С а 1 H. Например, магний ( 24 Mg) весит примерно вдвое больше, чем атом углерода, и в 24 раза больше, чем атом водорода.
Углеродный цикл и жизнь
Растения поглощают СО2 в процессе фотосинтеза выделяют кислород в атмосферу и действуют как легкие растений. Когда они умирают, они становятся древесным углем, который после сжигания выделяет СО2. Одна часть возвращается к растениям, а другая попадает в морское дно, питая многие микроорганизмы.
Когда микроорганизмы умирают, оставшиеся твердые в его осадок биологического разложения, и через миллионы лет, он превращается в то, что известно как нефть.
Когда человечество использует это масло в качестве альтернативного источника энергии для сжигания угля, оно способствует выделению большего количества СО2 (и другие нежелательные газы).
С другой стороны, жизнь использует атомы углерода из самых глубоких ее основ. Это происходит из-за стабильности его связей, что позволяет ему формировать цепочки и молекулярные структуры, которые составляют макромолекулы, столь же важные, как ДНК.
ЯМР спектроскопия 13 С
13 С, даже если он в гораздо меньшей пропорции, чем 12 С его обилие достаточно, чтобы выяснить молекулярные структуры с помощью ядерной магнитно-резонансной спектроскопии углерода-13.
Благодаря этой методике анализа можно определить, какие атомы окружают 13 С и к каким функциональным группам они относятся. Таким образом, углеродный скелет любого органического соединения может быть определен.
Читайте также: