Диффузия и осмос реферат
Обновлено: 04.07.2024
Диффузия и осмос — это два типа пассивного процесса переноса, посредством которого вещество переносится из области более высокой концентрации в область более низкой концентрации. Оба эти процесса не требуют внешней энергии для транспортировки. Поскольку осмос и диффузия воздействуют на очень похожие явления, их можно различить по материалу, который они переносят, и их зависимости. Другими словами, можно также сказать, что осмос — это один из видов диффузии. В процессе диффузии любое вещество в жидком, твердом или газообразном состоянии перемещается из области более высокой концентрации в область более низкой концентрации. С другой стороны, в процессе осмоса вода или любой другой растворитель перемещается из области более высокой концентрации в область более низкой концентрации через полупроницаемую мембрану.
Сравнительная таблица
| Диффузия | Осмос | |
| Определение | В процессе диффузии любое вещество в жидком, твердом или газообразном состоянии перемещается из области более высокой концентрации в область более низкой концентрации. | В процессе осмоса вода или любой другой растворитель перемещается из области более высокой концентрации в область более низкой концентрации через полупроницаемую мембрану. |
| Полупроницаемая мембрана | Не проходит через полупроницаемую мембрану | Проходит через полупроницаемую мембрану |
| Состояния вещества | Процесс диффузии может происходить во всех трех состояниях вещества (твердое, жидкое и газообразное). | Процесс осмоса только для жидкостей. |
| Потенциал растворенного вещества | Потенциал растворенного вещества не влияет на скорость диффузии. | Потенциал растворенного вещества влияет на скорость осмоса. |
Что такое диффузия?
Это процесс пассивного переноса, при котором любой тип материала, будь то твердое, жидкое или газовое, перемещается из области более высокой концентрации в область более низкой концентрации независимо от полупроницаемой мембраны. Процесс диффузии не зависит ни от наличия полупроницаемой мембраны, ни от потенциала растворенного вещества в смеси. Поскольку диффузия может происходить во всех состояниях материи, она зависит от присутствия других частиц и имеет тенденцию выравнивать площадь, заполняя пустые пространства. Например, когда мы открываем флакон духов или любого другого аромата, через какое-то время аромат распространяется по всей комнате, то есть из-за процесса распространения. В живых организмах диффузия также играет ключевую роль в различных жизненных процессах.
Что такое осмос?
Это процесс пассивного переноса, при котором вода или любой другой растворитель в смеси перемещается из области более высокой концентрации в область более низкой концентрации через полупроницаемую мембрану. Процесс предназначен исключительно для жидкостей, хотя, когда мы говорим об осмосе в жидкостях, в первую очередь речь идет о воде, хотя, когда мы изучаем процесс осмоса с точки зрения химии, транспортировка может осуществляться другими растворителями в смесях или растворах. Процесс осмоса происходит через полупроницаемую мембрану и также зависит от потенциала растворенного вещества в растворе, поскольку вода движется к раствору, имеющему высокую концентрацию растворенного вещества и низкую концентрацию растворителя. В жизни процесс осмоса происходит, когда молекулы воды перемещаются из одной клетки в другую. Как правило, у животных процесс осмоса принимает участие в распределении питательных веществ и выпуске продуктов метаболизма. У растений проникновение воды через почву и корни растений происходит через процесс осмоса.
Описание процесса осмоса через полупроницаемую мембрану. Понятие обратной диффузии растворителя. Уравнение Вант-Гоффа, зависимость осмотического давления от концентрации растворов. Механизм прямого осмоса в биологических системах, структура мембраны.
| Рубрика | Физика и энергетика |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 14.12.2016 |
| Размер файла | 770,8 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Сущность процесса осмоса и его роль в биологических системах
1.1 Сущность процесса
1.2 Осмотическое давление
2. Механизм прямого осмоса в биологических системах
2.1 Структура биологической мембраны
2.2 Механизм прямого осмоса
3. Обратный осмос
Введение
Явление осмоса лежит в основе обмена веществ всех живых организмов. Благодаря ему в каждую живую клетку поступают питательные вещества и, наоборот, выводятся шлаки. Явление осмоса наблюдается, когда два соляных раствора с разными концентрациями разделены полупроницаемой мембраной.
В настоящее время мембранная технология является одной из самых динамично развивающихся областей технологии. Она получила широкое распространение, как на промышленном, так и на бытовом уровне.
Основной областью применения мембранной технологии является водоочистка и водоподготовка, однако ее применение не ограничивается этим.
В химической и нефтехимической промышленности мембранные методы разделения используются для разделения углеводородов, смесей высокомолекулярных и низкомолекулярных соединений, азеотропных смесей, смещения равновесия химических реакций путем удаления через мембрану одного из ее продуктов, концентрирование растворов, выделения гелия и водорода из природных газов, кислорода из воздуха и т.п.
В микробиологии и медицинской промышленности широкое применение мембранные методы находят в процессах выделения и очистки биологически активных веществ, вакцин, ферментов, гормонов, вирусов, очистки крови и решение других технологических задач.
Цель исследования - изучить сущность процесса осмоса и его роль в биологических системах.
1. Прямой осмос
1.1 Сущность процесса
Явление осмоса наблюдается в тех средах, где подвижность растворителя больше подвижности растворённых веществ
Важным частным случаем осмоса является осмос через полупроницаемую мембрану.
Полупроницаемыми называют мембраны, которые имеют достаточно высокую проницаемость не для всех, а лишь для некоторых веществ, в частности, для растворителя.
(Подвижность растворённых веществ в мембране стремится к нулю).
Как правило, это связано с размерами и подвижностью молекул, например, молекула воды меньше большинства молекул растворённых веществ.
Если такая мембрана разделяет раствор и чистый растворитель, то концентрация растворителя в растворе оказывается менее высокой, поскольку там часть его молекул замещена на молекулы растворённого вещества (Рис. 1).
Рисунок 1. Прямой осмос
Вследствие этого, переходы частиц растворителя из отдела, содержащего чистый растворитель, в раствор будут происходить чаще, чем в противоположном направлении.
Соответственно, объём раствора будет увеличиваться (а концентрация вещества уменьшаться), тогда, как объём растворителя будет соответственно уменьшаться.
Например, к яичной скорлупе с внутренней стороны прилегает полупроницаемая мембрана: она пропускает молекулы воды и задерживает молекулы сахара. Если такой мембраной разделить растворы сахара с концентрацией 5 и 10 % соответственно, то через нее в обоих направлениях будут проходить только молекулы воды.
В результате в более разбавленном растворе концентрация сахара повысится, а в более концентрированном, наоборот, понизится. Когда концентрация сахара в обоих растворах станет одинаковой, наступит равновесие. Растворы, достигшие равновесия, называются изотоническими. Если принять меры, чтобы концентрации не менялись, осмотическое давление достигнет постоянной величины, когда обратный поток молекул воды сравняется с прямым.
Осмос, направленный внутрь ограниченного объёма жидкости, называется эндосмосом, наружу -- экзосмосом. Перенос растворителя через мембрану обусловлен осмотическим давлением.
Это осмотическое давление возникает соответственно Принципу Ле-Шателье из-за того, что система пытается выровнять концентрацию раствора в обеих средах, разделенных мембраной, и описывается вторым законом термодинамики.
Оно равно избыточному внешнему давлению, которое следует приложить со стороны раствора, чтобы прекратить процесс, то есть создать условия осмотического равновесия. Превышение избыточного давления над осмотическим может привести к обращению осмоса -- обратной диффузии растворителя.
В случаях, когда мембрана проницаема не только для растворителя, но и для некоторых растворённых веществ, перенос последних из раствора в растворитель позволяет осуществить диализ, применяемый как способ очистки полимеров и коллоидных систем от низкомолекулярных примесей,
1.2 Осмотическое давление
Осмос можно объяснить тем, что концентрация молекул воды в единице объема в одном сосуде больше, чем в другом, или тем, что молекулы воды в растворе частично связываются молекулами сахара, гидратируя их. В разбавленных растворах осмос не зависит в явной форме от вида растворенного вещества и растворителя.
Решающее значение имеет концентрация раствора, точнее - число частиц растворенного вещества в единице объема.
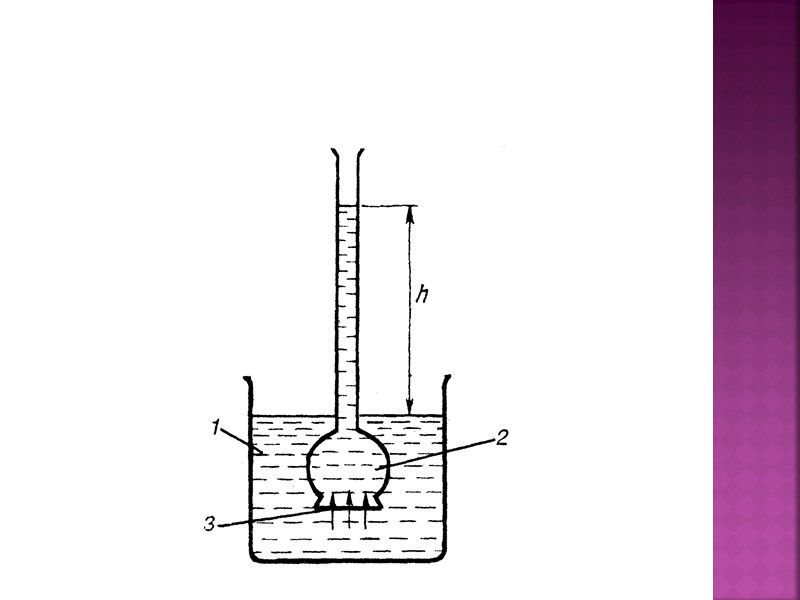
Для исследования осмоса применяют специальный прибор (рис.2), состоящий из двух сосудов: внешнего и внутреннего.
Рисунок 2. Схематическое изображение прибора для исследования осмоса
Дно внутреннего сосуда изготавливают из полупроницаемой перегородки (пропускает растворитель, но не пропускает растворенное вещество, например целлофан).
В наружном сосуде - вода. Во внутреннем - раствор в воде. Из наружного сосуда вода будет переходить во внутренний. Во внутреннем сосуде ее уровень будет повышаться.
В результате повышается гидростатическое давление, под которым находится раствор во внутреннем сосуде. Вследствие этого скорость перехода воды из внутреннего сосуда во внешний возрастает. Наконец, при некоторой высоте столба раствора скорости прохождения воды из наружного сосуда во внутренний, и из внутреннего - в наружный сравняются, и подъем жидкости в трубке прекратится.
Давление, которое отвечает такому равновесию, может служить количественной характеристикой осмоса. Оно называется осмотическим давлением.
Осмотическим давлением называют давление, которое нужно приложить к раствору, чтобы привести его в равновесие с чистым растворителем, отделенным от него полупроницаемой перегородкой.
Анализируя результаты изучения осмотического давления, Я. Вант Гофф пришел к выводу, что растворенное вещество в очень разбавленных растворах ведет себя подобно тому, как если бы оно находилось в газообразном состоянии.
Отсюда возникла идея применения к ним законов идеальных газов. Тогда для раствора можно записать:
Заменяя n/V = с, получаем уравнение, названное законом Вант-Гоффа.
В этих уравнениях под п понимается осмотическое давление.
Линейная зависимость осмотического давления от концентрации для большинства растворов неэлектролитов сохраняется до концентраций порядка 10-2 моль/л.
Получим уравнение Вант-Гоффа исходя из термодинамических представлений. Растворитель будет проникать через полупроницаемую перегородку до тех пор, пока не установиться равновесие.
Уравнение Вант-Гоффа показывает, что осмотическое давление равно тому давлению, которое производило бы растворенное вещество, если бы оно в виде идеального газа занимало тот же объем, что и в растворе при той же температуре.
Осмотическое давление имеет очень большое значение в процессах жизнедеятельности различных организмов, определяя распределение растворенных веществ и воды в тканях. Осмотическое давление крови у человека составляет примерно 8.1 105 Па (8 атм.).
При уменьшении в организме содержания воды возникает чувство жажды, утоление которой восстанавливает водно-солевое равновесие и осмотическое давление крови.
От осмотического давления зависит, так называемая, сосущая сила клетки, достигая у семян при 6% влажности величины в 4.04 107 (400 атм.), что обеспечивает необходимое для прорастания поглощение воды даже из сравнительно сухой почвы.
Из (3) видно, что величина осмотического давления определяется лишь концентрацией растворенного вещества, и не зависит от природы раствора, что и позволяет отнести этот эффект к коллигативным свойствам.
Рассмотрим еще два свойства подобного рода: понижение точки замерзания (затвердевания) вещества и повышение температуры кипения.
Разность температур замерзания растворителя и раствора называют понижением точки замерзания.
Разность температур кипения раствора и растворителя называют повышением температуры кипения раствора Ткип.
Оба этих свойства находятся в полном согласии с принципом Ле-Шателье. Чтобы продемонстрировать сказанное, рассмотрим равновесную систему, состоящую из двух фаз: твердое вещество А и жидкий раствор вещества В, в котором А является растворителем.
Увеличим концентрацию раствора, т.е. содержание компонента В в жидкой фазе. Согласно принципу Ле-Шателье, в системе должны усилится процессы стремящиеся ослабить произведенное воздействие. В данном случае, это означает, что в системе должны усилится процессы, которые смогут уменьшить концентрацию раствора.
Для рассматриваемой системы, такое возможно лишь за счет перехода части растворителя из твердого состояния в жидкое. Однако, если при данной температуре происходит переход вещества из твердого состояния в жидкое, то эта температура выше точки замерзания. Следовательно, точка замерзания раствора при увеличении концентрации раствора понизилась.
Аналогично, исходя из принципа Ле-Шателье, можно обосновать повышение температуры кипения раствора нелетучего вещества.
Для этого рассмотрим двухфазную систему пар - жидкий раствор. Пусть система находится в равновесии; и пусть одна фаза представляет собой пар вещества А, а другая - жидкий раствор вещества В в А.
Увеличим концентрацию раствора (концентрацию В в А). Согласно принципу Ле-Шателье, это должно инициировать процессы, позволяющие нивелировать, произведенное увеличение концентрации.
Здесь к таким процессам относится конденсация растворителя из паровой фазы. Нетрудно понять, что конденсация приведет к понижению давления пара.
Понижение давления насыщенного пара повышает температуру кипения. Кипение жидкости наступает тогда, когда давление насыщенного пара над жидкостью сравнивается с внешним давлением.
Над раствором давление насыщенного пара понижается. Это означает, что для достижения указанного равенства давлений раствор необходимо дополнительно нагреть. Отсюда утверждение о повышении температуры кипения раствора в сравнении с чистым веществом.
Эффект повышения температуры кипения можно объяснить и иначе (рис.3).
Рисунок 3. Повышение температуры кипения
Действительно, в тех случаях, когда растворенное вещество имеет пренебрежимо малое давление пара, давление пара раствора равно давлению пара растворителя. Для идеальных растворов давление пара растворителя определяется законом Рауля:
Из (4) следует, что при возрастании хв давление насыщенного пара уменьшается, а значит, температура кипения возрастает.
Все сказанное демонстрирует рисунок, отражающий зависимость давления насыщенного пара над веществом от температуры.
Кипение наступает при равенстве давления насыщенного пара над жидкостью давлению внешнему (атмосферному).
Чтобы найти температуры кипения чистого растворителя и растворов, достаточно найти точки пересечения изобары при р = 1,013 10-5 Па с кривыми диаграммы состояния в координатах р - Т (см. рис.1). Из рисунка можно видеть, что раствор кипит при более высокой температуре, чем чистый растворитель.
осмос биологический мембрана диффузия
2. Механизм прямого осмоса в биологических системах
Дрожжевая клетка, локализованная в дрожжевой суспензии, представляет собой систему, состоящую из двух фаз, разграниченных клеточной стенкой дрожжевой клетки - полупроницаемой мембраной.
Формы связи влаги в этой системе играют существенную роль в формировании механизма прямого осмоса и фактически обусловливают полупроницаемость клеточной мембраны.
Классификацию форм связи влаги подобной двухфазной системы, разделённой биологической мембраной, рассмотрим с точки зрения классификации форм связи влаги, предложенной П.А. Ребиндером, которая позволяет учитывать как природу образования различных форм связи, так и энергию связи их с материалами.
В соответствии с точкой зрения этой классификации влагу, локализованную внутри дрожжевой клетки, необходимо рассматривать как осмотически удерживаемую влагу, обусловленную избирательной диффузией воды из окружающей среды. Осмотически удерживаемая влага характеризуется энергией связи слабой интенсивности, по своим свойствам не отличается от обычной воды и обладает способностью свободно диффундировать через клеточные мембраны под воздействием разности концентраций внутри и вне клеток.
К категории внутриклеточной влаги можно отнести и влагу, иммобилизованную в капиллярах клеточной стенки дрожжевой клетки - капиллярную влагу, которая играет существенную роль в механизме перераспределения влаги и фактически обусловливает полупроницаемость биомембраны.
Так, из анализа научной литературы известно, что влага, локализованная в капиллярах диаметром более 10-7 м (влага макрокапилляров), не имеет связи с материалом и может свободно перемещаться в процессе диффузии.
В свою очередь влага, локализованная в капиллярах диаметром менее 10-7 м (влага микрокапилляров) и обусловленная адсорбционной связью полимолекулярного слоя вблизи стенок капилляра, и не является свободной. Такая влага не участвует в диффузионных процессах ввиду особых свойств характерных для связанной влаги.
Как правило, адсорбционно-связанная влага, иммобилизованная на поверхности биомембраны в виде поверхностного мономолекулярного слоя адсорбированной воды (гидратной оболочки), также не участвует в процессах перераспределения влаги ввиду высоких значений энергии связи молекул воды с поверхностью биомембраны. Последующие слои адсорбционно-связанной жидкости (полимолекулярная адсорбция) удерживаются менее прочно и могут вовлекаться в диффузионные процессы.
Химически связанная влага не играет существенной роли в формировании механизма перераспределения влаги, поскольку количество её незначительно, а связи ионной и молекулярной природы очень прочны.
Таким образом, в формировании механизма прямого осмоса - перераспределения влаги через биомембрану дрожжевой клетки - участвуют осмотически удерживаемая влага, влага макрокапилляров, а также свободная избыточная внеклеточная влага, локализованная в межклеточном пространстве дрожжевой биомассы (рис. 4).
Рисунок 4. Формы связи влаги в дрожжевой клетке, локализованной в дрожжевой суспензии: 0 - химически связанная влага; 1 - осмотически удерживаемая влага (свободная внутриклеточная влага); 2 - свободная влага капилляров (влага макрокапилляров); 3 - связанная влага капилляров (влага микрокапилляров); 4 - адсорбционно-связанная влага; 5 - свободная внеклеточная влага (избыточная межклеточная влага)
2.1 Структура биологической мембраны
Структура полупроницаемой клеточной мембраны дрожжевой клетки, представляющей собой капиллярно-пористое тело, играет ключевую роль в формировании механизма прямого осмоса - осмотически обусловленного самопроизвольного процесса перераспределения влаги из внутриклеточной среды дрожжевой клетки в межклеточное пространство при внесении в дрожжевую суспензию осмоиндуцирующего компонента (как правило, электролита).
Так, существенную роль в формировании механизма перераспределения играет система пор (капилляров) клеточной стенки биологической мембраны, которая является полупроницаемой, то есть низкоселективной для молекул воды и высокоселективной для гидратированных ионов осмоиндуцирующего компонента.
Исходя из представлений о строении растворов и результатов экспериментов, можно утверждать, что на селективность и проницаемость мембран влияет гидратирующая способность ионов.
Явление гидратации заключается в том, что ионы, растворного вещества окружены растворителем и движутся с некоторой его частью, вступающей с ним во взаимодействие.
При этом может наблюдаться как первичная, так и вторичная гидратация. Первичная гидратация заключается в прочном связывании ионов молекулы воды, вплоть до образования донорно-акцепторных связей. Вторичная - представляет собой электростатическое взаимодействие молекул воды с первично гидратированными ионами.
Молекулы воды, расположенные в непосредственной близости от ионов растворённых веществ, образуют гидратную оболочку, число молекул в которой характеризует координационное число гидратации.
Электростатическое взаимодействие не является единственной причиной гидратации - последняя может быть обусловлена и химическими силами.
Учитывая сказанное выше и основываясь на современных представлениях о связанной жидкости, процесс селективной проницаемости мембраны дрожжевой клетки по отношению к водным растворам электролитов можно представить следующим образом.
На поверхности и внутри пор (капилляров) клеточной мембраны дрожжевой клетки, локализованной в дрожжевой суспензии, возникает слой связанной воды. Вода на границе раздела фаз мембрана-раствор по своим свойствам отличается от воды в свободном состоянии. Например, связанная вода в значительной мере теряет растворяющую способность, поэтому наличие связанной воды в порах клеточной мембраны дрожжевой клетк одна из основных причин непроходимости для тех молекул растворённых веществ, для которых связанная вода практически не является растворителем. Если диаметр d пор мембраны d
Диффузия – это самопроизвольный процесс выравнивания концентрации растворённого вещества в объёме.
Она обусловлена 2 факторами: 1) наличием рыхлой структуры и пустот в растворителе (например, в 1 л воды её молекулами занято только примерно 370 мл), 2) тепловым движением частиц раствора.
Диффузия прекращается, если концентрация во всех частях раствора становится одинаковой. Скорость диффузии зависит от:
1) абсолютной температуры;
2) градиента концентрации;
3) вязкости растворителя;
4) размера диффундирующих частиц.
Скорость диффузии возрастает при повышении температуры и градиента концентрации и уменьшается при увеличении вязкости растворителя, размера и массы диффундирующих частиц. Поэтому растворы высокомолекулярных соединений (ВМС - белков, полисахаридов и др.) имеют очень низкий коэффициент диффузии.
Диффузия может быть выражена количественно. Её описывает закон Фика: количество растворенного вещества m, проходящее за время t через площадь поперечного сечения сосуда S, которая разделяет растворы с разными концентрациями C1 и C2 определяется уравнением:
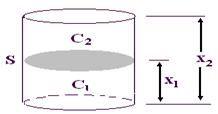 |
где: m/t – скорость диффузии, D – коэффициент диффузии, равный количеству вещества, диффундирующего через 1 см 2 поверхности раздела за время t при градиенте концентраций, равном 1; S – площадь поперечного сечения сосуда; (C2–C1) – градиент концентраций; (x2–x1) – расстояние, пройденное диффундирующей частицей от дна сосуда из раствора с концентрацией C1 в раствор с концентрацией C2 (рис. 6).
Рис. 6.Закон Фика
Для биологических мембран это уравнение имеет следующий вид:
где: р – коэффициент проницаемости мембраны, C1 и C2 – концентрации по обе стороны мембраны.
Диффузия играет важную роль в биологических системах. Благодаря диффузии осуществляется транспорт метаболитов внутри клеток и через мембрану. Так, например, в организме человека ежеминутно путём диффузии через стенки капилляров перемещается 1500 л жидкости.
Осмос – это односторонняя диффузия растворителя через полупроницаемую мембрану в сторону раствора с большей концентрацией растворённого вещества.
Осмос вызывается осмотическим давлением– силой, отнесённой к единице поверхности мембраны. Осмотическое давление имеется у любого раствора. Оно обусловлено стремлением частиц растворителя путём диффузии распределиться в максимально большем объёме.
Осмотическое давление растворов неэлектролитов пропорционально молярной концентрации (при постоянной температуре) и абсолютной температуре (при постоянной концентрации) раствора:
Росм = RCT,
где: R – универсальная газовая постоянная равная 8,31 Дж/(моль•К), C – молярная концентрация раствора, T – его абсолютная температура.
Закон Вант-Гоффа:учитывая, что С = n/V, получаем: РосмV = nRT. Для растворов электролитов вводится поправочный коэффициент i, показывающий во сколько раз истинная концентрация растворённых частиц, осмотическое давление, понижение температуры замерзания, повышение температуры кипения, понижение давления насыщенного пара растворителя больше, чем в эквивалентном растворе неэлектролита:
Математичекое выражение закона Вант-Гоффа для водных растворов электролитов имеет вид:
РосмV = inRT
Осмолярность и осмоляльность представляют собой общую концентрацию растворенных частиц в 1 л раствора (осмолярность) или в 1 кг воды (осмоляльность). Осмоляльность крови в значительной степени зависит от концентрации ионов натрия и хлора, в меньшей степени глюкозы и мочевины. В норме осмоляльность сыворотки крови 275-296 мосмоль/кг Н20, осмоляльность мочи обусловлена мочевиной, ионами натрия, калия, аммония. Осмоляльность мочи колеблется значительно: от 50 до 1400 мосмоль/кг Н20. При суточном диурезе около 1,5 л осмоляльность мочи здорового человека составляет 600-800 мосмоль/кг Н20.
При патологических состояниях осмоляльность крови может как снижаться, так и повышаться. Гипоосмоляльность характеризует снижение концентрации натрия в крови при передозировке диуретиков, избыточной продукции антидиуретического гормона, при хронической сердечной недостаточности, циррозе печени с асцитом, глюкокортикоидной недостаточности. Гиперосмоляльностьсвязана с гипернатриемией и наблюдается при сахарном диабете, недостаточности калия, гиперкальциемии, при декомпенсированном сахарном диабете (гипергликемической коме), при гиперальдостеронизме, избыточном введении кортикостероидов, при хронической почечной недостаточности наблюдается увеличение концентрации мочевины (каждые 5 ммоль/л мочевины увеличивают осмоляльность крови на 5 мосмоль/кг Н20), параллельно происходит снижение концентрации натрия в крови, поэтому осмоляльность крови значительно не меняется.
Явление осмоса играет важную роль во многих химических и биологических системах. Благодаря осмосу регулируется поступление воды в клетки и межклеточные структуры. Упругость клеток (тургор), обеспечивающая эластичность тканей и сохранение определенной формы органов, обусловлена осмотическим давлением. Животные и растительные клетки имеют оболочки или поверхностный слой протоплазмы, обладающие свойствами полупроницаемых мембран. При помещении этих клеток в растворы с различной концентрацией наблюдается осмос.
Все биологические жидкости (лимфа, сыворотка и плазма крови) – растворы, поэтому они обладают коллигативными свойствами. Осмотическое давление в биологических жидкостях зависит как от растворённых в них минеральных веществ, так и от ВМС (белков, нуклеиновых кислот, полисахаридов). Осмотическое давление крови человека постоянно и при 37°С составляет 7,4-7,8 атм. (0,74-0,78 МПа). Учитывая это, в медицинской практике во избежание осмотических конфликтов широко используют различные изотонические растворы.
Изотонический раствор–раствор какого-либо вещества в воде, осмотическое давление которого равно осмотическому давлению крови. Например, 0,85% раствор NaCl, 5% раствор глюкозы. В изотонических растворах эритроциты не изменяют свою форму, т.к. Росм изотонического раствора равно Росм эритроцита, поэтому потоки Н2О в эритроцит и из него уравновешены. Изотонические растворы используют в качестве кровезаменителей при небольших потерях крови или для внутривенного введения растворённых в них лекарственных веществ.
Существуют и неизотонические растворы: гипотонические и гипертонические. Раствор, осмотическое давление которого ниже изотонического, называется гипотоническим. Раствор, осмотическое давление которого выше изотонического, называется гипертоническим.
Введение в организм значительных объёмов неизотонических растворов может привести к осмотическим конфликтам. Росм гипертонического раствора больше Росм эритроцитов. В результате ток воды направлен из эритроцитов в окружающую среду (в сторону раствора с большей концентрацией). Наступает обезвоживание эритроцитов и, как следствие, их сморщивание (плазмолиз).
Росм гипотонического раствора меньше Росм эритроцита. В результате ток воды направлен в эритроцит из окружающей среды (в сторону раствора с большей концентрацией). Наступает набухание эритроцита и, как следствие, его разрыв (гемолиз). Тем не менее, неизотонические растворы применяют в медицине.
2) повязки с гипертоническим раствором NaCl (10% водный раствор) используют для лечения гнойных ран – ток раневой жидкости направляется по марле наружу, что способствует постоянному очищению раны от гноя, микроорганизмов и продуктов распада;
3) гипертонические растворы MgSO4 и Na2SO4 используют в качестве слабительных средств, эти соли плохо всасываются в ЖКТ, что вызывает переход Н2О из слизистой в просвет кишечника; в результате, увеличивается объём кишечного содержимого, раздражаются рецепторы слизистой, усиливается перистальтика, и ускоряется эвакуация кишечного содержимого;
4) введение гипотонических растворов входят в программу лечения гиперосмолярной комы – тяжёлого осложнения сахарного диабета.
Часть осмотического давления, которое обусловлено только растворёнными белками, называется онкотическим давлением. Оно составляет примерно 0,5% от общего осмотического давления и равно 0,04 атм или 30-40 см водного столба.
Биологическое значение онкотического давлениясостоит в том, что оно поддерживает равновесие между кровью и внеклеточной жидкостью для постоянного обмена питательными веществами и конечными продуктами обмена.
Согласно гипотезе Старлинга, в крови, в артериальной и венозной частях капилляров, соотношение между гидростатическим давлением, обусловленным работой сердца (45 и 15 см водного столба соответственно), и онкотическим давлением (30 см водного столба) различно. Разница давлений одинакова и составляет 15 см водн. ст., но в артериальной области преобладает Ргидр, а в венозной области – Ронк.

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.


Диффузия и осмос
Диффузия- это самопроизвольный процесс выравнивания концентрации, идущий из раствора с большей концентрации растворённых веществ в раствор с меньшей их концентрацией. Это явление обусловлено хаотическим тепловым движением молекул и ионов, находящихся в растворе. Диффузия-самопроизвольный процесс, в результате которого: энтропия повышается; величина химического потенциала понижается. Диффузия прекращается тогда, когда происходит полное выравнивание концентрации по всему объёму раствора.

Энштейн и независимо от него М.Смолуховский вывели следующее уравнение для коэффициента диффузии:
Скорость диффузии зависит от различных Скорость диффузии вещества пропорциональна площади поверхности, через которую переносится вещество, и градиенту концентрации этого вещества:

Из приведённых уравнений следует, что скорость диффузии возрастает с повышением температуры; увеличение градиента концентрации; понижением вязкости растворителя; уменьшением размера диффундирующих частиц; увеличением площади соприкосновения растворов.

Биологическая роль диффузии Явление диффузии широко представлено в окружающем нас мире, например: перемещение питательных веществ и продуктов обмена в тканевых жидкостях; насыщение крови кислородом в лёгких.(Площадь поверхности альвеол составляет около 80 кв.м., кислород активно растворяется в плазме и переходит в эритроциты. При этом концентрация кислорода в венозной крови приближается к нулю, градиент концентрации кислорода между атмосферой и кровью очень большой,что приводит к активному поглощению кислорода (закон Фика).

Коллигативные свойства растворов.Осмос Многие свойства растворов зависят не только от концентрации растворённого в нём вещества, но и от природы этого вещества(например, плотность раствора). Однако, некоторые физические свойства растворов зависят только от концентрации частиц растворённого вещества и не зависят от индивидуальных свойств этого вещества. Эти свойства называются коллигативными. К ним относится осмотическое давление, понижение давление пара, повышение температуры кипения, понижение температуры замерзания.


Осмос. Закон Вант - гоффа Если на пути диффундирующих частиц поставить полупроницаемую мембрану, начнётся односторонняя диффузия, в результате которой будет происходить самопроизвольный процесс перехода молекул воды из раствора с меньшей концентрацией растворённых частиц в раствор с большей их концентрацией. Осмос- преимущественно одностороннее проникновение молекул растворителя через полупроницаемую мембрану из растворителя в раствор или из раствора с меньшей концентрацией в раствор с большей концентрацией растворённых частиц.


Виды полупронмцаемых мембран Естественные: животного происхождения(мембраны клеток, кожа, пергамент); растительного происхождения(мембраны растительных клеток). Искусственные(целлофан, коллодий, некоторые химические вещества).

осмотическое давление. Закон Вант-Гоффа С точки зрения термодинамики движущей силой осмоса является стремление системы к выравниванию концентрации, т.к. при этом происходит увеличение энтропии и уменьшение энергии Гиббса, поэтому осмос - самопроизвольный процесс. Давление,которое необходимо создать, чтобы остановить осмос,называется осмотическим давлением. Осмотическое давление является мерой стремления растворённого вещества перейти в процесс диффузии из раствора в чистый растворитель и равномерно распределиться по всему объёму системы.

Осмос


Закон Вант-Гоффа (1887 г.) Осмотическое давление раствора равно тому давлению, которое производило бы растворённое вещество, если бы оно находилось в газообразном состоянии при той же температуре и занимала бы тот же объём. Используя закон Менделеева-Клайперона pV=nRT или n/V=C(молярная концентрация) Р(осм.)= СRT

Если полупроницаемой мембраной разделены два раствора с одинаковым осмотическим давлением, проникновение растворителя через полупроницаемую мембрану не происходит. Растворы с одинаковым осмотическим давлением называются изотоническими. Раствор, обладающий меньшим осмотическим давлением, чем другой, сравниваемый с ним раствор, называется гипотоническим. Если осмотическое давление одного раствора больше осмотического давления другого раствора, взятого за стандарт,то такой раствор называется гипертоническим.

Закон Вант-Гоффа для растворов электролитов Исходя из закона Вант-Гоффа можно предположить,что растворы самых разнообразных веществ с одинаковой молярной концентрацией должны быть изотоничны. Однако оказалось, что величина осмотического давления для электролитов и неэлектролитов одинаковой концентрации, неодинакова. Эта величина всегда больше для электролитов.

Данный факт можно объяснить тем, что растворы электролитов содержат большее число частиц(ионы и недиссоциированные молекулы). Поэтому, чтобы использовать законы идеальных растворов для количественного описания коллигативных свойств растворов, Вант-Гофф ввёл в уравнение поправочный коэффициент, который был назван изотоническим коэффициентом(i): i= Δ T(зам.эл) = Δ T(кип.эл) = Р(осм.эл) = N(эл) Δ Т(зам.неэл) Δ Т(к.неэл) Р(ос.неэл) N(неэл)

Закон Вант-Гоффа для растворов электролитов Р(осм)эл.= iCRT Количественной характеристикой диссоциации является степень диссоциации,поэтому она должна быть связана с изотоническим коэффициентом. Если допустить,что общее число частиц в растворе =N, тогда n-число продиссоциированных молекул, а (N-n)-число непродиссоциированных молекул.

Если за m обозначить число ионов, образующихся при диссоциации 1 моль электролита, тогда mn- общее число ионов в растворе электролита. Следовательно,общее число частиц в растворе электролита, можно определить как сумму (N-n)+mn,тогда: i= N(эл) = (N-n)+mn =N+n(m-1)= N(неэл) N N i=1+ (m- 1)

Биологическая роль осмоса Осмос играет огромную роль в биологических процессах,происходящих в организме животных и растений. Живая(растительная и животная) клетка окружена полупроницаемой мембраной,поэтому при соприкосновении растительной клетки с почвенным раствором,происходит осмос и проникающая в клетку вода создаёт в ней давление, которое придаёт клетке упругость и определяет напряжение(тургор).что позволяет растениям сохранять вертикальное положение.

Биологическая роль осмоса Если клетки отмирают, то осмос прекращается, давление в клетках падает и растение увядает. Если клетку(растительную или животную) поместить в дист.воду или менее концентрированный раствор, то вода устремится в клетку, клетка набухнет, что может привести к разрыву оболочки клетки.Такое разрушение клетки называется лизисом. В случае эритроцитов этот процесс называется гемолизом.

Биологическая роль осмоса При помещении клетки в гипертонический раствор вода из клетки переходит в более концентрированный раствор, клетка сморщивается. Это явление называется плазмолизом. Биологические жидкости(кровь,лимфа,тканевые жидкости) представляют собой водные растворы,содержащие как НМС(NaCl,KCl,CaCl2 и др),так и ВМс(белки,полисахариды,форменные элементы). Их суммарным действием определяется осмотическое давление биологических жидкостей.

Плазмолиз растительной клетки

Биологическая роль осмоса Осмотическое давление крови(t=37)составляет 7,7атм. Такое же давление создаёт 0,9% раствор NaCl(0,15 моль/л и 4,5-5,0% раствор глюкозы.ЭТИ РАСТВОРЫ ИЗОТОНИЧНЫ КРОВИ ЧЕЛОВЕКА и называются физиологическими. Осмотическое давление высокоорганизованных животных и человека поддерживается на постоянном уровне(изоосмия).Явление изоосмии обусловлено работой органов выделения(почки, кожа) и органов,которыеспособны депонировать воду(печень,подкожная жировая клетчатка).

Биологическая роль осмоса Из общего осмотического давления крови(7,7атм) выделяют онкотическое давление,которое обусловлено присутствием в крови ВМС(0,02атм). Онкотическое давление: Определяет постоянство объёма плазмы, меж- и внутриклеточной жидкости; От его величины зависит перемещение жидкости на уровне капилляр-ткань-межклеточная жидкость-клетка и обратно. Способствует образованию лимфы.

Осмотическому давлению крови человека отвечает осмомолярная концентрация растворённых в плазме неорганических и органических веществ и составляет 0,303моль/л. Явление осмоса широко используется в медицинской практике: Физиологические растворы используют в качестве кровезаменителей; во время операций( органы помещают в физ.раствор для предохранения их от высыхания); В хирургии используют гипертонические растворы((гипертонические повязки).

В медицинской практике часто используют слабительные средства-МgSO4*7H2O(горькая соль), Na2SO4*10H2O(глауберова соль), тиосульфат натрия. Применение основано на плохом всасывании в желудочно-кишечном тракте, в результате чего в просвет кишечника поступает большое количество воды. Гипертонические растворы в небольших количествах используются при глаукоме(вводят в/в, чтобы уменьшить избыточное количество влаги в передней камере глаза и тем самым уменьшить глазное давление).
Давление пара над раствором. Законы рауля ……………….. Пар ……………….. Жидкость В результате естественного процесса испарения над жидкостью образуется пар, давление которого можно определить с помощью манометра. Эндотермический процесс испарения обратим: одновременно с ним протекает экзотермический процесс конденсации. При определённых условиях устанавливается равновесие.

Равновесное состояние системы жидкость- пар при данной температуре характеризуется давлением насыщенного пара. Эта величина для чистого растворителя есть величина постоянная и является термодинамической характеристикой растворителя. Если в равновесную систему жидкость- пар введено нелетучее вещество, то его переход в паровую фазу исключён. В результате этого концентрация растворителя уменьшается, его мольная доля становится меньше 1, а это вызовет нарушение равновесия жидкость- пар. В соответствие с принципом Ле- Шателье начнёт протекать процесс, стремящийся ослабить влияние воздействия,т.е. конденсация пара. А это означает снижение давления пара.
Читайте также:

