Дефект межжелудочковой перегородки реферат
Обновлено: 05.07.2024
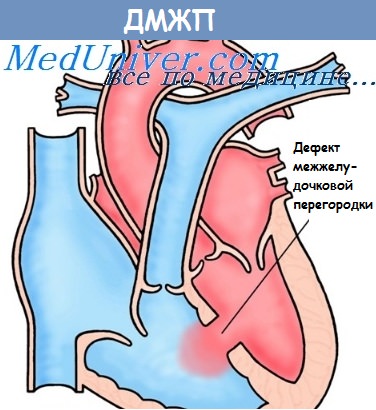
Дефект межжелудочковой перегородки составляет примерно 17—30% врожденных пороков сердца. Располагаются дефекты либо в мембранозной, либо з мышечной части межжелудочковой перегородки. В некоторых случаях возможно полное отсутствие перегородки (так называемый единый желудочек).
Патогенез. Нарушение гемодинамики при дефекте межжелудочковой перегородки имеет следующий характер. В связи с тем что давление в левом желудочке выше, чем в правом, при наличии дефекта межжелудочковой перегородки происходит сброс части крови из левого желудочка в правый. Соответственно в систему легочной артерии попадаег больший, чем в норме, объем крови, что приводит к развитию легочной гиперволемии. С этим связано повышение давления в системе легочной артерии н в полости правого желудочка.
Уровень легочной гипертензии и ее прогрессировать зависят прежде всего от величины дефекта. В свою очередь показания к коррекции порока обусловливаются степенью легочной гипертензии. Практика показала, что в случаях, когда давление в легочной артерии превышает 60— 80 мм рт. ст., оперативное закрытие дефекта невозможно. Сразу после закрытия дефекта правый желудочек одни (без левого) должен создать напряжение, достаточное для преодоления сопротивления малого круга. У таких бальных он не справляется с этой задачей: уже во время операции происходят дилатация правого желудочка и остановка сердца. Таким образом, со временем этот порок становится неоперабельным. Мы наблюдали детей, у которых высокая легочная гипертензия возникала довольно быстро, уже к 6—7 годам. При этом субъективные ощущения и жалобы были минимальными. Педиатрам и терапевтам нужно помнить патогенез врожденных пороков сердца, знать возможности кардиохирургии и направлять детей к хирургам, не дожидаясь развития необратимых изменений в малом круге кровообращения.
Клиника изолированных дефектов меж желудочковой перегородки разнообразна и зависит от размера и локализации дефектов, возраста ребенка и степени легочной гипертензии. Дети жалуются в основном на одышку при физической нагрузке, сердцебиение и повышенную утомляемость. В некоторых случаях дети ни на что не жалуются. Иногда отмечается отставание в развитии ребенка. Цианоз появляется я терминальной стадии развития заболевания.
Аускультатнвно определяется, как правило, грубый систолический шум с максимумом звучания в третьем — четвертом межреберье слева от грудины. При легочной гипертензнн выражен акцент второго тона во втором межреберье слева от грудины. ЭКГ указывает на комбинированную гипертензию желудочков с преобладанием потенциалов левого. При рентгенологическом исследовании органов грудной клетки отмечаются увеличение сердца я поперечнике, выбухание дуги легочной артерии, увеличение желудочков (преимущественно правого). Эти признаки не совсем патогномоничны для дефекта межжелудочковой перегородки, поэтому обычно возникает необходимость в зондировании правых отделов сердца. Зондирование позволяет установить также величину давления в легочной артерии.
Лечение. Возможен только хирургический способ лечения. Производят продольную стернотомию. Вскрывают перикард. Через стенку и полость правого предсердия в верхнюю и нижнюю полые вены вводят катетеры, по которым из вен кровь отсасывается в аппарат искусственного кровообращения. Из аппарата оксигенированная кровь попадает в канюлю, введенную в аорту. Вскрывают стенку желудочка над выходным отделом. В зависимости от величины дефекта межжелудочковой перегородки либо ушивают его непрерывным швом, либо нашивают на него заплату из войлочного тефлона. Ушивание дефекта можно выполнить и без искусственного кровообращения в условиях церебральной гипотермии. Однако применение этого метода сопряжено со спешкой, требует блестящей операционной техники и абсолютной ясности анатомических взаимоотношений, поскольку гипотермия позволяет выключить сердце из кровообращения на срок не более 3 мин.
Дефект межпредсердной перегородки
Клиника и диагностика зависят от величины и локализации дефекта. При аускультацни определяется нежный систолический шум с максимумом звучания во втором — третьем межреберьс слева от грудины. Он возникает вследствие относительного стеноза легочной артерии, из-за повышенного кровотока по ней. Второй тон над легочной артерией усилен и расщеплен. Расщепление его происходит в силу неодновременного захлопывания клапанов легочной артерии и аорты, из-за удлинения систолы правого желудочка, вследствие повышенного кровенаполнения его. На ЭКГ регистрируются отклонение электрической оси вправо, признаки гипертрофии правого предсердии и правого желудочка (при вторичном дефекте) или левого желудочка (при первичном дефекте). Часто встречается полная или неполная атриовентрикулярная блокада.
При рентгенологическом исследовании обнаруживаются увеличение сердца в поперечнике, выбухание конуса легочной артерии, застойный легочный рисунок, увеличение правого предсердия и правого желудочка, усиленная пульсация легочной артерии и корней легких. При зондировании отмечается повышение давления в правом предсердии, праиом желудочке и легочной артерии. Насыщение крови кислородом повышено, начиная с правого предсердия или правого желудочка сразу у трех створчатого клапана. Попадание зонда из правого предсердия в левое возможно и при незаращении овального окна. В данном случае большое значение имеет величина сброса крови через дефект.
- Вернуться в оглавление раздела "Неотложная хирургия."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Патологическая анатомия и классификация ДМПП
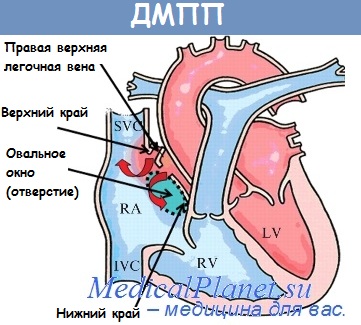
При нарушении нормального развития первичной и вторичной межпредсердной перегородок могут образовываться разнообразной формы дефекты межпредсердной перегородки. Если происходит закрытие отверстия первичной межпредсердной п регородки — образуется первичный дефект (10%). При нарушении развития вторичной межпредсердной перегородки формируется вторичный дефект.
Первичный ДМПП располагается в нижнем отделе межпредсердной перегородки непосредственно над предсердножелудочковыми отверстиями (верхним краем межжелудочковой перегородки). Первичный ДМПП может быть изолированным (крайне редко), чаще сочетанным с расщеплением септальной створки митрального (редко трикуспидального) клапана. Сочетанныи первичный ДМПП рассматривают как неполную форму атриовентрикулярной коммуникации (АВК). При редко встречающейся полной АВК межпредсердный дефект распространяется на межжелудочковую перегородку, причем сочетается с расщеплением септальных створок как митрального, так и трикуспидального клапанов. При этом все четыре камеры сердца сообщаются между собой.
Вторичные ДМПП (90%) всегда имеют нижний край межпредсердной перегородки, отделяющий дефект от уровня предсердно-желудочковых клапанов.
По локализации вторичные ДМПП делятся на:
—верхние, или дефекты верхнего венозного синуса (5%), расположенные под устьем верхней полой вены (ВПВ) и, как правило, сочетающиеся с частичным аномальным впадением правых легочных вен в ВПВ или правое предсердие;
—нижние, или дефекты нижнего венозного синуса (1%), расположенные в устье нижней полой вены (НПВ);
—общее предсердие или трехкамерное сердце (1%) — полное отсутствие межпредсердной перегородки.
Сброс артериальной крови из левого предсердия в правое предсердие (градиент 2-3 мм рт. ст.) приводит к гиперволемии малого круга кровообращения, перегрузке правого желудочка объемом. Это вызывает гипертрофию миокарда правого желудочка. Позднее развитие легочной гипертензии при ДМПП (после 16-20 лет) связано с рядом факторов: отсутствием непосредственного воздействия высокого давления (ЛЖ при ДМЖП) на сосуды легких, передачей нормального или слегка повышенного Давления из ПЖ в ЛА, значительной растяжимостью правых отделов сердца, высокой резервной емкостью легочных сосудов и их низким сопротивлением.
Легочная гипертензия при ДМПП развивается медленно по органическому типу, однако имеет плохой прогноз. Декомпенсация правого желудочка также развивается в относительно поздние сроки.
При первичном ДМПП артериовенозный сброс крови происходит на уровне предсердий и, одновременно, через расщепленную створку митрального клапана из ЛЖ в ЛП, следовательно, имеет место объемная перегрузка обоих желудочков. Это приводит к гипертрофии миокарда обоих желудочков. Левое предсердие может быть дилатировано за счет регургитации на митральном клапане.
Клиника и диагностика ДМПП
В раннем детстве большинство детей с ДМПП ведут нормальный образ жизни. С возрастом (во второй половине детства, юношеском и даже взрослом возрасте) появляются жалобы на повышенную утомляемость, одышку и сердцебиение при физической нагрузке по сравнению со сверстниками. Почти у 2 /3 больных в анамнезе отмечаются повторные бронхиты и пневмонии в связи с гиперволемией малого круга кровообращения. При первичном ДМПП клинические проявления заболевания появляются раньше.
На ЭКГ регистрируются признаки гипертрофии правого желудочка и частичной блокады правой ножки пучка Гиса. Могут определяться также признаки гипертрофии левого желудочка, перегрузки левого предсердия, блокады передневерхнего разветвления левой ножки пучка Гиса при первичном ДМПП.
ЭхоКГ. При одномерном изображении косвенными признаками ДМПП являются увеличение правых отделов сердца, парадоксальное движение межжелудочковой перегородки. При двухмерной ЭхоКГ (В-режим) непосредственно визуализируется межпредсердная перегородка из парастернальной позиции по короткой оси сканирования, а также в проекции 4 камер с верхушки сердца. По короткой оси ЛЖ на уровне клапана определяется расщепление передней митральной створки при первичном ДМПП. Допплер-КГ исследование позволяет оценить регургитацию на митральном и трикуспидалыюм клапане, рассчитать давление в легочной артерии.
Рентгенологически определяется увеличение правых отделов сердца, ствола легочной артерии, усиление сосудистого легочного рисунка вследствие гиперволемии. При первичном ДМПП может определяться увеличение обоих желудочков и предсердий.
Катетеризация сердца и ангиокардиография применяются при сочетанных пороках или в неясных случаях. Признаками ДМПП являются:
· некоторое повышение давления в ПЖ и ЛА (может определяться небольшой градиент между ПЖ и ЛА в 15-20 мм рт. ст.);
· повышенное содержание кислорода в пробах крови из ппа вого предсердия (ПП) по сравнению с пробами из полых вен;
· прохождение катетера из ПП в левое предсердие (ЛЩ через ДМПП и сброс контраста в обратном направлении (через овальное окно сброс отсутствует);
Течение заболевания и его осложнения. Вторичный ДМПП имеет благоприятное естественное течение в первые две-три декады жизни. Средняя продолжительность жизни составляет 36-40 лет; имеются наблюдения за больными, прожившими 70 и более лет. Однако большинство из них становятся тяжелыми инвалидами в возрасте старше 50 лет. Основными осложнениями являются легочная гипертензия и сердечная недостаточность.
Больные с неполной АВК без операции умирают до 20~30-летнего возраста от сердечной недостаточности, легочной гипертензии, бактериального эндокардита, нарушений ритма сердца.
Оперативное лечение показано практически всем больным с ДМПП. В раннем детском возрасте операция показана при тяжелом клиническом течении с явлениями сердечной недостаточности. Чаще всего операция выполняется в дошкольном или младшем школьном возрасте.
Закрытие вторичных ДМПП выполняется в условиях экстракорпорального кровообращения (ЭКЮ путем ушивания или (при больших дефектах) пластики заплатой из аутоперикардиальной (ксеноперикардиальной) или синтетической ткани. Реже устраняют вторичный ДМПП по закрытой методике на работающем сердце или эндоваскулярным методом.
Первичный ДМПП устраняют в условиях ЭКК и фармакохолодовой кардиоплегии. Производят ушивание расщепленной створки и пластику дефекта заплатой.
Результаты оперативного лечения. Летальность после оп рации закрытия вторичных ДМПП не превышает 1-2%. Гемодинамически малозначимая реканализация дефектов наблюдается в 5% случаев. Хорошие отдаленные результаты отмечены у больных, оперированных до развития легочной гипертензии.
Госпитальная летальность при первичном ДМПП колеблется от 3 до 7%. Среди осложнений, ведущих к летальному исходу, следует отметить сердечную недостаточность, возникающую из-за неадекватной коррекции митрального клапана или сужения субаортального тракта, полную АВ-блокаду, нарушения сердечного ритма. Отдаленные результаты у большинства больных хорошие. Лишь 5% больных нуждаются в повторной операции на митральном клапане.
Дефект межжелудочковой перегородки (ДМЖП)
Aнатомия межжелудочковой перегородки. Межжелудочковая перегородка условно делится на мембранозную и мышечную части. Последняя состоит из приточной, трабекулярной и отточной частей.
Патанатомия и классификация
Размеры дефектов бывают от 1-2 мм до 20-25 мм в диаметре. Выделяют большие дефекты (величина их сходна с диаметром аорты), средние (10-15 мм), малые (до 5-6 мм).
Нередко ДМЖП сочетается с ДМПП, ОАП, коарктацией аорты, аортальным стенозом и др. Особое место занимает ДМЖП с аортальной недостаточностью, расположенный, как правило, субаортально. Мембранозно-перимембранозная часть межжелудочковой перегородки выполняет роль опоры для синусов Вальсальвы, поэтому ее отсутствие способствует провисанию аортальных створок и развитию недостаточности аортального клапана.
Классификация ДМЖП по локализации.
—перимембранозный дефект (самый частый) — приточный, трабекулярный, инфундибулярный;
—отточный дефект (инфундибулярный, надгребешковый) 1 субартериальный, мышечный;
—мышечный дефект (редко) — приточный, трабекулярный.
Патофизиология. Артериальная кровь из Л Ж фактически сбрасывается в ЛА вместе с венозной кровью правого желудочка, откуда по малому кругу кровообращения возвращается в левые отделы сердца, что приводит, прежде всего, к объемной перегрузке левого желудочка и гипертрофии его миокарда.
Сразу после рождения отмечается перекрестный или небольшой левоправый (артериовенозный) сброс крови через ДМЖП в силу почти одинакового давления в обоих желудочках. Постепенно давление в легочной артерии падает (физиологическая инволюция строения легочных сосудов), градиент давления между желудочками повышается, и сброс крови также увеличивается. Компенсаторно возникающий спазм легочных сосудов препятствует переполнению их кровью. Так развивается функциональная фаза легочной гипертензии, обусловливающая развитие гипертрофии миокарда ПЖ. При длительном существовании порока развивается органическая фаза легочной гипертензии, в результате чего возникает перекрестный, а затем и праволевый сброс крови (синдром Эйзенменгера). При этом систолический шум становится короче и постепенно может исчезнуть, а появляется диастолический шум пульмональной недостаточности (Грехема-Стила) и цианоз.
Клиника и диагностика ДМЖП
Диагноз ДМЖП обычно устанавливается рано, в родильном доме, по данным выраженной аускультативной симптоматики. Время проявления первых признаков порока определяется размерами дефекта и объемом сброса крови.
При больших и средних перимембранозных дефектах у младенца рано появляются одышка и быстрая утомляемость при кормлении, в результате чего ребенок остается голодным, становится беспокойным и отстает в физическом развитии. У таких Детей отмечаются повышенная потливость (результат гиперсимпатикотонии), бледность и небольшой периферический цианоз кожных покровов. Нередко возникает кашель, усиливающийся при перемене положения тела, развиваются повторные, трудно поддающиеся лечению пневмонии. При осмотре может выявляться сердечный горб. Верхушечный толчок усилен, смещен влево вниз. Существенно усилен эпигастральный толчок. Границы сердца расширены. Определяется систолическое дрожание в третьем-четвертом межреберье слева от грудины (струя крови, проходя через дефект и правый желудочек, направлена на его стенку, прилежащую к грудной стенке). Аускулътативно определяется связанный с первым тоном грубый систолический шум с эпицентром в третьем-четвертом межреберье слева от грудины Редко эпицентр этого шума выслушивается во втором-третьем межреберье (при надгребешковом ДМЖП). Определяется также акцент и расщепление II тона над легочной артерией. У большинства детей этой группы в первые месяцы жизни выявляются признаки выраженной сердечной недостаточности — увеличение печени и селезенки, отечный синдром, застойные влажные хрипы в легких, особенно с левой стороны (сдавление нижней доли увеличенным сердцем).
С возрастом состояние и самочувствие многих этих детей улучшается в связи с уменьшением отношения размеров ДМЖП к общему объему сердца. Проявления недостаточности кровообращения существенно уменьшаются или исчезают. Однако основные признаки заболевания сохраняются.
При малых перимембранозных дефектах жалоб, как правило, нет. Основным проявлением порока является систолический шум в третьем-четвертом межреберье слева от грудины. Со временем могут появиться жалобы на повышенную утомляемость, признаки увеличения левого и затем правого желудочка, признаки умеренной легочной гипертензии.
При малых мышечных дефектах (болезнь Толочинова-Роже) жалоб и клинических проявлений порока нет, за исключением скребущего систолического шума средней интенсивности в четвертом-пятом межреберье слева от грудины. С возрастом интенсивность шума уменьшается, и он может исчезнуть (спонтанное закрытие дефекта).
При малых дефектах регистрируется нормальная ЭКГ либо ЭКГ с признаками повышенной активности Л Ж или умеренной гипертрофии его миокарда. По мере повышения давления в ЛА присоединяются признаки перегрузки, а затем и гипертрофии миокарда ПЖ. При больших и средних дефектах аналогичные признаки появляются рано.
ЭхоКГ. Одномерная эхокардиография позволяет определить только косвенные признаки порока — увеличение полости ЛЖ и дилатацию ПЖ при развитии легочной гипертензии. При двухмерной ЭхоКГ производят прямое определение размеров и расположения дефекта. Для лоцирования дефекта в мембранозной части перегородки используют проекцию 4 камер.
Рентгенологически при малых дефектах патологических изменений со стороны сердца и легких может не быть. При средних и больших дефектах легочный рисунок усилен по артериальному типу, ствол и ветви легочной артерии расширены, чаще преобладает увеличение Л Ж. При легочной гипертензии, может определяться дилатация обоих желудочков.
Катетеризация сердца и ангиокардиография показаны больным с ДМЖП при необходимости уточнения степени легочной гипертензии и подозрении на сопутствующие ВПС. Признаками ДМЖП являются повышенная оксигенация венозной крови в ПЖ, сброс контрастного вещества из ЛЖ в правый и его поступление в ЛА.
Течение заболевания и его осложнения. Средняя продолжительность жизни больных при естественном течении ДМЖП составляет 23-27 лет, при малых размерах дефекта — около 60 лет. Основными осложнениями ДМЖП являются легочная гипертензия и синдром Эйзенменгера, сердечная недостаточность, пневмония, инфекционный эндокардит. Наибольшая летальность при больших ДМЖП приходится на ранний детский возраст — более 50% детей умирают в возрасте до года.
Медикаментозное. При сердечной недостаточности у детей раннего детского возраста до операции и в послеоперационном периоде назначают дигоксин, мочегонные препараты, витаминотерапию.
Хирургическое. В раннем детском возрасте оперативное лечение обычно показано при больших дефектах и развитии осложнений — легочной гипертензии, рефрактерной сердечной недостаточности, рецидивирующих пневмониях, гипотрофии II-III степени. Операция может выполняться даже в первые дни или недели жизни ребенка.
При малых дефектах, отсутствии жалоб и нарушений общей и внутрисердечной гемодинамики операция не показана. Больные подлежат динамическому наблюдению. При тенденции к повышению давления в Л А (даже при отсутствии жалоб) операция показана.
При давлении в Л А, приближающемся к 60-75% от системного АД, прогноз операции сомнительный. Уравновешенное давление в желудочках или праволевый сброс (синдром Эйзенменгера) являются противопоказанием к операции.
Методы оперативного лечения. Все операции осуществляются в условиях искусственного кровообращения и фармакохолодовой кардиоплегии из трансстернального доступа. Малые дефекты устраняются путем правосторонней атриотомии и ушивания дефекта П-образными швами. При больших и средних дефектах производят пластику ДМЖП заплатой из синтетической, ксеноперикардиальной или стабилизированной (глутаровым альдегидом) аутоперикардиальной ткани. При ДМЖП с выраженной аортальной недостаточностью помимо пластики дефекта выполняют пластическую операцию на створках аортального клапана или (редко) его протезирование.
В настоящее время разрабатывается эндоваскулярное транскатетерное закрытие малых ДМЖП.
Результаты оперативного лечения. При своевременно выполненных операциях госпитальная летальность не превышает 1-5%. При значительной легочной гипертензии летальность увеличивается до 10%. Отдаленные результаты в большинстве случаев (около 80%) хорошие.
1. Сердечно-сосудистая хирургия./ под ред. Буравского В.И., Бокерия Л.А., М: Медицина, 2002г.
Дефект межжелудочковой перегородки (ДМЖП) - наиболее распространенный изолированный врожденный порок, обнаруживаемый при рождении. Довольно часто ДМЖП диагностируется и во взрослом возрасте.
При наличии показаний, проводят лечение порока в детстве. Нередко наблюдается спонтанное закрытие дефекта.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
Выделяют четыре возможные локализации дефекта межжелудочковой перегородки (ДМЖП):
1. Мембранозный, перимембранозный, коновентрикулярный - наиболее частая локализация дефекта, встречается в приблизительно 80 % всех ДМЖП. Дефект обнаруживается в мембранозной части межжелудочковой перегородки с возможным распространением на входной, септальный и выходной отдел перегородки; под аортальным клапаном и септальной створкой трикуспидального клапана; часто развиваются аневризмы Аневризма - расширение просвета кровеносного сосуда или полости сердца вследствие патологических изменений их стенок или аномалии развития
мембранозного отдела перегородки, в результате которых происходит частичное или полное закрытие дефекта.
2. Мышечный, трабекулярный - до 15-20 % случаев всех ДМЖП. Полностью окружен мышцей, может быть локализован в различных участках мышечного отдела межжелудочковой перегородки. Дефектов может быть несколько. Особенно часто наблюдается спонтанное закрытие.
3. Надгребневые, подартериальные, подлегочные, инфундибулярные дефекты выносящего тракта - встречаются приблизительно в 5 % случаев. Дефект локализуется под полулунными клапанами конусовидного или выходного отдела перегородки. Часто сочетается с прогрессирующей аортальной недостаточностью из-за пролапса Пролапс - смещение вниз какого-либо органа или ткани от его нормального положения; причиной такого смещения обычно бывает ослабление окружающих и поддерживающих его тканей.
створок аортального клапана (наиболее часто - правой).
4. Дефекты приносящего тракта (атриовентрикулярного канала) - входной отдел межжелудочковой перегородки непосредственно под местом прикрепления колец атриовентрикулярных клапанов; часто наблюдается при синдроме Дауна.
Чаще встречаются одиночные дефекты перегородки, но бывают и случаи множественных дефектов. ДМЖП также наблюдается при комбинированных пороках сердца, например, тетраде Фалло Тетрада Фалло - врожденный порок сердца: сочетание стеноза устья легочного ствола, дефекта межжелудочковой перегородки, смещения аорты вправо и вторично развивающейся гипертрофии правых отделов сердца
Подробно , корригированной транспозиции магистральных сосудов.
Этиология и патогенез
Формирование сердца с камерами и крупными сосудами происходит к концу первого триместра. Основные пороки развития сердца и крупных сосудов связаны с нарушением органогенеза на 3-8 неделе развития плода.
Внутриутробная гемодинамика при ДМЖП. Внутриутробно малый круг кровообращения (МКК) не функционирует. Вся проходящая через легкие кровь относится к большому кругу кровообращения (БКК). Поэтому внутриутробная гемодинамика плода не страдает. Дефект возможно определить только при ультразвуковом исследовании плода.
Гемодинамика новорожденного при ДМЖП. При рождении сосуды МКК имеют толстую стенку с хорошо выраженным мышечным слоем, за счет чего создается высокое сопротивление крови, проходящей через МКК. В связи с этим отмечается высокое давление в МКК (75-80 мм.рт.ст.), практически соответствующее давлению в левом желудочке и аорте, то есть в БКК. Градиент давления между правым и левым желудочком незначительный, почти отсутствует сброс крови в какую-либо сторону и соответственно отсутствует и шум. Шум и незначительный цианоз (в основном периоральный) могут возникать при крике, кашле, натуживании, сосании, когда может появляться право-левый сброс. Дефекты малого размера могут сами оказывать сопротивление току крови, уменьшая разницу в градиенте между правым и левым желудочком.
Приблизительно ко второму месяцу жизни ребенка снижаются толщина мышечной стенки, сосудистое сопротивление и давление в МКК (до 20-30 мм.рт.ст.). Давление в правом желудочке становится меньше, чем в левом, что приводит к сбросу крови слева направо, а значит и шуму.
Высокое давление в МКК быстро приводит к гипертрофии и дилaтации правого желудочка - развивается правожелудочковая недостаточность. По мере повышения давления в правом желудочке, оно сначала становится таким же, как в левом (шум уменьшается), а затем появляется право-левый сброс (шум возникает вновь).
Таким образом протекают ДМЖП среднего и крупного размера в отсутствие лечения. Средняя продолжительность жизни при этом не превышает 25 лет, большая часть детей гибнет в возрасте до 1 года.
Эпидемиология
Дефект межжелудочковой перегородки является самым распространенным врожденным пороком сердца, обнаруживаемым у 32% пациентов как изолированно, так и в сочетании с другими пороками аномалиями.
Перимембранозные дефекты составляют 61,4-80% всех случаев ДМЖП, мышечные дефекты - 5-20%.
Факторы и группы риска
Факторы риска, влияющие на формирование врожденных пороков сердца у плода
Семейные факторы риска:
- наличие детей с врожденными пороками сердца (ВПС);
- наличие ВПС у отца или ближайших родственников;
- наследственные заболевания в семье.
Клиническая картина
Клинические критерии диагностики
Синдром кардиомегалии, Синдром легочной гипертензии, систолический шум, парастернальный сердечный горб, одышка по типу тахипноэ, симптомы сердечной недостаточности
Cимптомы, течение
Дефект межжелудочковой перегородки у плода
Изолированный ДМЖП у плода клинически делится на 2 формы в зависимости от его размеров, величины сброса крови:
1. Небольшие ДМЖП (болезнь Толочинова-Роже) - расположенны в основном в мышечной перегородке и не сопровождаются выраженными гемодинамическими нарушениями.
2. ДМЖП достаточно больших размеров - расположены в мембранозной части перегородки и приводят к выраженным нарушениям гемодинамики.
Клиника болезни Толочинова-Роже. Первое (иногда единственное) проявление порока - систолический шум в области сердца, появляющийся в основном с первых дней жизни ребенка. Жалобы отсутствуют, дети растут хорошо, границы сердца - в пределах возрастной нормы.
В III-IV межреберье слева от грудины у большинства больных выслушивается систолическое дрожание. Характерный симптом порока - грубый, очень громкий систолический шум. Шум занимает, как правило, всю систолу, нередко сливается со вторым тоном. Максимум звучания отмечается в III-IV межреберье от грудины. Шум хорошо проводится по всей области сердца, вправо за грудиной, выслушивается на спине в межлопаточном пространстве, хорошо проводится по костям, передается по воздуху и прослушивается, даже если поднять стетоскоп над сердцем (дистанционный шум).
У некоторых детей выслушивается очень нежный систолический шум, который лучше определяется в положении лежа. При физической нагрузке шум значительно уменьшается или даже полностью исчезает. Это объясняется тем, что благодаря мощному сокращению мышц сердца при нагрузке, отверстие в межжелудочковой перегородке у детей полностью закрывается и поток крови через него завершается. Признаков сердечной недостаточности при болезни Толочинова-Роже нет.
ДМЖП у детей старше года. Дефект переходит в стадию затухания клинических признаков за счет интенсивного роста и анатомического развития организма ребенка. В возрасте 1-2 лет наступает фаза относительной компенсации - одышка и тахикардия Тахикардия - повышенная частота сердечных сокращений (более 100 в 1 мин.)
отсутствуют. Дети становятся более активными, лучше прибавляют в весе и растут, реже болеют сопутствующими заболеваниями, многие из них по своему развитию догоняют сверстников.
Объективное обследование выявляет у 2/3 детей центрально расположенный сердечный горб, систолическое дрожание в III-IV межреберье слева от грудины. Границы сердца незначительно расширены в поперечнике и вверх. Верхушечный толчок - средней силы и усиленный.
При аускультации Аускультация - метод физикальной диагностики в медицине, заключающийся в выслушивании звуков, образующихся в процессе функционирования органов.
отмечается расщепление II тона во II межреберье слева у грудины, может наблюдается его акцентуация. Вдоль левого края грудины выслушивается грубый систолический шум с максимумом звучания в III межреберье слева и большой зоной распространения.
У части детей выслушиваются и диастолические шумы относительной недостаточности клапана легочной артерии:
- шум Грэхема - Стилла - появляется в результате усиления легочного кровообращения в легочной артерии и при нарастании легочной гипертензии; выслушивается в 2-3 межреберье слева от грудины и хорошо проводится вверх на основание сердца;
В зависимости от степени нарушения гемодинамики наблюдается очень большая вариабельность клинического течения ДМЖП у детей, которая требует различного терапевтического и хирургического подхода к таким детям.
Диагностика
1. Эхокардиография - является основным исследованием, позволяющим поставить диагноз. Проводится для оценки тяжести заболевания, определения локализации дефекта, количества и размера дефектов, степени перегрузки левого желудочка объемом. При исследовании необходимо проверить наличие недостаточности аортального клапана, возникающей как результат пролапса правой или некоронарной створки (в особенности при дефектах выносящего тракта и высоко локализованных мембранозных дефектах). Также очень важно исключить двухкамерный правый желудочек.
3. Катетеризация сердца проводится при высоком легочном артериальном давлении (по результатам ЭхоКГ) для определения легочного сосудистого сопротивления.
Дифференциальный диагноз
- открытый общий АВ-канал;
- общий артериальный ствол;
- отхождение магистральных сосудов от правого желудочка;
- изолированный стеноз легочной артерии;
- дефект аортолегочной перегородки;
- врожденная митральная недостаточность;
- стеноз аорты .
Осложнения
При высоко расположенных дефектах рано прогрессирующая легочная гипертензия приводит к развитию симптомокомплекса Эйзенменгера, для которого характерны уменьшение интенсивности шума и усиление акцента II тона, появление постоянной одышки и цианоза в результате право-левого сброса крови. Возможно развитие таких осложнений, как затяжной септический эндокардит, рецидивные инфекции дыхательных путей, застойная сердечная недостаточность, стеноз Стеноз - сужение трубчатого органа или его наружного отверстия.
легочной артерии.
Лечение
Тактика лечения дефектов межжелудочковой перегородки (ДМЖП) определяется гемодинамической значимостью дефекта и известным для него прогнозом. Поскольку существует высокая вероятность спонтанного закрытия дефектов (40% - на первом году жизни) или их уменьшения в размерах, у пациентов с сердечной недостаточностью целесообразно сначала прибегнуть к терапии диуретиками и дигоксином. Возможно применение ингибиторов синтеза АПФ, которые облегчают антеградный кровоток из левого желудочка и тем самым уменьшают сброс через ДМЖП.
Следует также обеспечить лечение сопутствующих заболеваний (анемия, инфекционные процессы), энергетически адекватное питание больных.
Для детей, поддающихся терапии, возможна отложенная операция. Хирургическое лечение, как правило, не показано детям с маленькими ДМЖП, достигшим шести месяцев без признаков сердечной недостаточности, легочной гипертензии или задержки развития. Коррекция порока обычно не показана при соотношении легочного и системного кровотоков (Qp/Qs) менее чем 1,5:1,0.
Показания к хирургическому вмешательству - сердечная недостаточность и задержка физического развития у детей, не поддающихся терапии. К операции прибегают, начиная с первого полугодия жизни. У детей старше одного года хирургическое вмешательство показано при Qp/Qs - более чем 2:1. При соотношении сопротивлений легочного и системного русла равном 0,5 или при наличии обратного сброса крови, возможность операции ставится под сомнение и необходим углубленный анализ причин данного состояния.
Оперативные вмешательства
1. Паллиативные - заключаются в сужении легочной артерии для ограничения легочного кровотока. В настоящее время применяют только при наличии сопутствующих пороков и аномалий, затрудняющих первичную коррекцию ДМЖП.
2. Радикальные - заключаются в полном хирургическом закрытии дефекта. Операция выбора - закрытие дефекта в условиях искусственного кровообращения. Госпитальная летальность составляет 2-5%. Риск операции повышается у детей в возрасте до 3 месяцев, при наличии множественных ДМЖП или сопутствующих серьезных аномалий развития (поражения центральной нервной системы, легких, почек, генетические заболевания, недоношенность).
Прогноз
Во внутриутробном периоде дефект межжелудочковой перегородки не влияет на гемодинамику и развитие плода поскольку давление в желудочках равное и большого сброса крови не возникает.
Раннее ухудшение состояния ребенка после рождения маловероятно, поэтому родоразрешение в специализированном учреждении не является обязательным. Порок относится ко 2-й категории тяжести.
Спонтанное закрытие ДМЖП встречается в 45-78% случаев, однако точная вероятность данного события неизвестна. Например, большие дефекты в сочетании с синдромом Дауна или со значительной сердечной недостаточностью редко закрываются самостоятельно. Более часто спонтанно исчезают маленькие и мышечные ДМЖП . Более 40% отверстий закрываются на первом году жизни, но данный процесс может продолжаться и до 10 лет.
Профилактика
Профилактика возникновения врожденных пороков сердца (ВПС) очень сложна и в большинстве случаев сводится к медико-генетическому консультированию и разъяснительной работе среди людей, относящихся к группе повышенного риска заболевания. К примеру, в случае, когда 3 человека, состоящие в прямом родстве, имеют ВПС, вероятность появления следующего случая составляет 65-100% и беременность не рекомендуется. Нежелателен брак между двумя людьми с ВПС. Помимо этого необходимо тщательное наблюдение и исследование женщин, имевших контакт с вирусом краснухи или имеющих сопутствующую патологию, которая может привести к развитию ВПС.
Профилактика неблагоприятного развития ВПС:
- своевременное выявление порока;
- обеспечение надлежащего ухода за ребенком с ВПС;
- определение оптимального метода коррекции порока (чаще всего, это хирургическая коррекция).
Обеспечение необходимого ухода является важной составляющей в лечении ВПС и профилактике неблагоприятного развития, так как около половины случаев смерти детей до 1-го года во многом обуславливаются недостаточно адекватным и грамотным уходом за больным ребенком.
Специальное лечение ВПС, (в том числе, кардиохирургическое) должно проводиться в наиболее оптимальные сроки, а не немедленно по выявлению порока, и не в самые ранние сроки. Исключение составляют только критические случаи угрозы жизни ребенка. Оптимальные сроки зависят от естественного развития соответствующего порока и от возможностей кардиохирургического отделения.
Профилактика осложнений ВПС определяется характером осложнений.
Грозным осложнением ВПС является инфекционный эндокардит Инфекционный эндокардит - это инфекционное полипозно-язвенное воспаление эндокарда, сопровождающееся образованием вегетаций на клапанах или подклапанных структурах, их деструкцией, нарушением функции и формированием недостаточности клапана
Подробно , который может осложнить любой вид порока и может появиться уже в дошкольном возрасте.
Рекомендуется ограничить назначение антибиотикопрофилактики инфекционного эндокардита группам пациентов с наибольшей вероятностью развития инфекционного эндокардита:
1. Пациенты после протезирования клапана сердца.
2. Инфекционный эндoкардит в анамнезе.
3. Пациенты со следующими врожденными пороками:
- "синие" пороки, без предшествующей хирургической коррекции или с остаточными дефектами, паллиативными шунтами или кондуитами;
- пороки после хирургической коррекции с применением искусственных материалов до 6 месяцев (до тех пор, пока не произошла эндотелизация);
- если после операции на сердце или чрескожной коррекции есть остаточный дефект в месте имплантации искусственного материала или устройства.
МКБ-10
Общие сведения
Дефект межжелудочковой перегородки (ДМЖП) – отверстие в перегородке, разделяющей полости левого и правого желудочка, наличие которого приводит к патологическому шунтированию крови. В кардиологии дефект межжелудочковой перегородки – наиболее часто встречающийся врожденный порок сердца (9–25% от всех ВПС). Частота критических состояний при дефекте межжелудочковой перегородки составляет около 21%. С одинаковой частотой порок обнаруживается у новорожденных мальчиков и девочек.
Дефект межжелудочковой перегородки может быть единственной внутрисердечной аномалией (изолированный ДМЖП) или входить в структуру сложных пороков (тетрады Фалло, общего артериального ствола, транспозиции магистральных сосудов, атрезии трехстворчатого клапана и др.). В ряде случаев межжелудочковая перегородка может отсутствовать полностью - такое состояние характеризуется как единственный желудочек сердца.

Причины дефекта межжелудочковой перегородки
Чаще всего дефект межжелудочковой перегородки является следствием нарушения эмбрионального развития и формируется у плода при нарушениях закладки органов. Поэтому дефекту межжелудочковой перегородки часто сопутствуют другие сердечные пороки: открытый артериальный проток (20%), дефект межпредсердной перегородки (20%), коарктация аорты (12%), стеноз устья аорты (5%), аортальная недостаточность (2,5—4,5%), недостаточность митрального клапана (2%), реже - аномальный дренаж легочных вен, стеноз легочной артерии и др.
В 25-50% случаев дефект межжелудочковой перегородки сочетается с пороками развития внесердечной локализации - болезнью Дауна, аномалиями развития почек, расщелиной твердого неба и заячьей губой.
Непосредственными факторами, вызывающими нарушение эмбриогенеза, выступают вредные воздействия на плод в I триместре гестации: заболевания беременной (вирусные инфекции, эндокринные нарушения), алкогольная и лекарственная интоксикации, ионизирующая радиация, патологическое течение беременности (выраженные токсикозы, угроза самопроизвольного прерывания беременности и пр.). Имеются данные о наследственной этиологии дефекта межжелудочковой перегородки. Приобретенные дефекты межжелудочковой перегородки могут являться осложнением инфаркта миокарда.
Особенности гемодинамики при дефекте межжелудочковой перегородки
Межжелудочковая перегородка образует внутренние стенки обоих желудочков и составляет примерно 1/3 площади каждого из них. Межжелудочковая перегородка представлена мембранозным и мышечным компонентами. В свою очередь, мышечный отдел состоит из 3-х частей - приточной, трабекулярной и отточной (инфундибулярной).
После рождения и установления кровотока в большом и малом кругах кровообращения из-за дефекта межжелудочковой перегородки возникает лево-правый сброс крови, объем которого зависит от размеров отверстия. При небольшом объеме шунтируемой крови давление в правом желудочке и легочных артериях остается нормальным либо незначительно повышается. Однако при большом поступлении крови через дефект в малый круг кровообращения и ее возврате в левые отделы сердца, развивается объемная и систолическая перегрузка желудочков.
Значительное повышение давления в малом круге кровообращения при больших дефектах межжелудочковой перегородки способствует возникновению легочной гипертензии. Повышение легочно-сосудистого сопротивления взывает развитие сброса крови из правого желудочка в левый (обратного или перекрестного шунтирования), что приводит к артериальной гипоксемии (синдром Эйзенменгера).
Многолетняя практика кардиохиругов показывает, что наилучших результатов закрытия дефекта межжелудочковой перегородки можно добиться при сбросе крови слева направо. Поэтому при планировании операции тщательно учитываются гемодинамические параметры (давление, сопротивление и объем сброса).
Классификация дефекта межжелудочковой перегородки
Размер дефекта межжелудочковой перегородки оценивается, исходя из его абсолютной величины и сопоставления с диаметром аортального отверстия: маленький дефект составляет 1-3 мм (болезнь Толочинова–Роже), средний – равен примерно 1/2 диаметра аортального отверстия, большой – равен или превышает его диаметр.
С учетом анатомического расположения дефекта выделяют:
- перимембранозные дефекты межжелудочковой перегородки - 75% (приточные, трабекулярные, инфундибулярные) расположены в верхней части перегородки под аортальным клапаном, могут закрываться самопроизвольно;
- мышечные дефекты межжелудочковой перегородки – 10% (приточные, трабекулярные) - расположены в мышечном отделе перегородки, на значительном удалении от клапанной и проводящей систем;
- надгребневые дефекты межжелудочковой перегородки - 5% - расположены выше наджелудочкового гребня (мышечного пучка, отделяющего полость правого желудочка от его выносящего тракта), самопроизвольно не закрываются.
Симптомы дефекта межжелудочковой перегородки
Большие дефекты межжелудочковой перегородки, имеющие размеры более 1/2 диаметра устья аорты или более 1 см, проявляются симптоматически уже в первые 3 месяца жизни новорожденных, приводя в 25-30% случаев к развитию критического состояния. При больших дефектах межжелудочковой перегородки отмечается гипотрофия, одышка при физической нагрузке или в покое, повышенная утомляемость. Характерны затруднения при кормлении: прерывистое сосание, частые отрывы от груди, одышка и бледность, потливость, пероральный цианоз. В анамнезе у большинства детей с дефектом межжелудочковой перегородки - частые респираторные инфекции, затяжные и рецидивирующие бронхиты и пневмонии.
Диагностика дефекта межжелудочковой перегородки
К методам инструментальной диагностики дефекта межжелудочковой перегородки относятся ЭКГ, ФКГ, рентгенография грудной клетки, ЭхоКС, катетеризация камер сердца, ангиокардиография, вентрикулография.
Электрокардиограмма при дефекте межжелудочковой перегородки отражает перегрузку желудочков, наличие и степень выраженности легочной гипертензии. У взрослых больных могут регистрироваться аритмии (экстрасистолия, мерцание предсердий), нарушения проводимости (блокада правой ножки пучка Гиса, синдром WPW). Фонокардиография фиксирует высокочастотный систолический шум с максимумом в III-IV межреберье слева от грудины.
Эхокардиография позволяет выявить дефект межжелудочковой перегородки или заподозрить его по характерным нарушениям гемодинамики. Рентгенография органов грудной клетки при больших дефектах межжелудочковой перегородки обнаруживает усиление легочного рисунка, усиленную пульсацию корней легких, увеличение размеров сердца. Зондирование правых полостей сердца выявляет повышение давления в легочной артерии и правом желудочке, возможность проведения катетера в аорту, повышенную оксигенацию венозной крови в правом желудочке. Аортография проводится для исключения сопутствующих ВПС.
Дифференциальная диагностика дефекта межжелудочковой перегородки проводится с открытым атриовентрикулярным каналом, общим артериальным стволом, дефектом аортолегочной перегородки, изолированным стенозом легочной артерии, стенозом аорты, врожденной митральной недостаточностью, тромбоэмболией.
Лечение дефекта межжелудочковой перегородки
Асимптомное течение дефекта межелудочковой перегородки при его небольших размерах позволяет воздержаться от хирургического вмешательства и осуществлять динамическое наблюдение за ребенком. В ряде случаев возможно спонтанное закрытие дефекта межжелудочковой перегородки к 1-4 годам жизни или в более позднем возрасте. В остальных случаях показано хирургическое закрытие дефекта межжелудочковой перегородки, как правило, после достижения ребенком 3-х лет.
При развитии сердечной недостаточности и легочной гипертензии проводится консервативное лечение с помощью сердечных гликозидов, мочегонных препаратов, ингибиторов ангиотензинпревращающего фермента, кардиотрофиков, антиоксидантов.
Кардиохирургическое лечение дефекта межжелудочковой перегородки может быть радикальным и паллиативным. К радикальным операциям относятся ушивание малых дефектов межжелудочковой перегородки П-образными швами; пластика больших дефектов синтетической (тефлон, дакрон и др.) заплатой или биологической (консервированный ксеноперикард, аутоперикард) тканью; рентгенэндоваскулярная окклюзия дефекта межжелудочковой перегородки.
У грудных детей с выраженной гипотрофией, большим лево-правым шунтированием крови и множественными дефектами предпочтение отдается паллиативной операции, направленной на создание искусственного стеноза легочной артерии с помощью манжетки. Данный этап позволяет подготовить ребенка к радикальной операции по устранению дефекта межжелудочковой перегородки в более старшем возрасте.
Течение беременности при дефекте межжелудочковой перегородки
Женщины с небольшим дефектом межжелудочковой перегородки, как правило, в состоянии нормально выносить и родить ребенка. Однако, при больших размерах дефекта, аритмии, сердечной недостаточности или легочной гипертензии риск осложнений во время беременности значительно повышается. Наличие синдрома Эйзенменгера является показанием для искусственного прерывания беременности. У женщин с дефектом межжелудочковой перегородки имеется повышенная вероятность рождения ребенка с аналогичным или другим врожденным пороком сердца.
Перед планированием беременности пациентке с пороком сердца (оперированным или нет) необходимо проконсультироваться с акушером-гинекологом, кардиологом, генетиком. Ведение беременности у категории женщин с дефектом межжелудочковой перегородки требует повышенного внимания.
Прогноз при дефекте межжелудочковой перегородки
Естественное течение дефекта межжелудочковой перегородки в целом не позволяет надеяться на благоприятный прогноз. Продолжительность жизни при данном пороке зависит от величины дефекта и составляет в среднем около 25 лет. При больших и средних дефектах 50-80% детей умирают в возрасте до 6 мес. или 1 года от сердечной недостаточности, застойной пневмонии, бактериального эндокардита, нарушений ритма сердца, тромбоэмболических осложнений.
В редких случаях ДМЖП не оказывает существенного влияния на продолжительность и качество жизни. Спонтанное закрытие дефекта межжелудочковой перегородки наблюдается в 25-40% случаев, преимущественно при его малом размере. Однако даже в этом случае больные должны находиться под наблюдением кардиолога в связи с возможными осложнениями со стороны проводящей системы сердца и высоким риском возникновения инфекционного эндокардита.
Этиология • Врождённые пороки (изолированный ДМЖП, составная часть комбинированного ВПС, например тетрада Фалло, транспозиция магистральных сосудов, общий артериальный ствол, атрезия трёхстворчатого клапана и др.) • Существуют данные об аутосомно-доминантном и рецессивном типах наследования. В 3,3% случаев у прямых родственников больных с ДМЖП также обнаруживают этот порок • Разрыв межжелудочковой перегородки при травмах и ИМ.
Статистические данные • ДМЖП составляет 9–25% всех ВПС • Выявляют у 15,7% живорождённых детей с ВПС • Как осложнение трансмурального ИМ — 1–3% • 6% всех ДМЖП и 25% ДМЖП у грудных детей сопровождаются открытым артериальным протоком, 5% всех ДМЖП — коарктацией аорты, 2% врождённых ДМЖП — стенозом клапана аорты • В 1,7% случаев межжелудочковая перегородка отсутствует, и такое состояние характеризуют как единственный желудочек сердца • Соотношение мужского и женского пола — 1:1.
Патогенез. Степень функциональных нарушений зависит от величины сброса крови и общего лёгочного сосудистого сопротивления (ОЛСС). При сбросе слева направо и отношении лёгочного минутного объёма кровотока к системному (Qp/Qs) менее 1,5:1 лёгочный кровоток возрастает незначительно, и повышения ОЛСС не происходит. При больших ДМЖП (Qp/Qs более 2:1) значительно увеличиваются лёгочный кровоток и ОЛСС, и давления в правом и левом желудочках выравниваются. По мере увеличения ОЛСС возможно изменение направления сброса крови — он начинает происходить справа налево. Без лечения развиваются правожелудочковая и левожелудочковая недостаточность и необратимые изменения лёгочных сосудов (синдром Айзенменгера).
Варианты ДМЖП • Мембранозные ДМЖП (75%) располагаются в верхней части межжелудочковой перегородки, под клапаном аорты и септальной створкой трёхстворчатого клапана, часто закрываются самопроизвольно • Мышечные ДМЖП (10%) располагаются в мышечной части межжелудочковой перегородки, на значительном расстоянии от клапанов и проводящей системы, бывают множественными, фенестрированными и часто закрываются самопроизвольно • Надгребневые (ДМЖП выносящего тракта правого желудочка, 5%) располагаются выше наджелудочкового гребня, часто сопровождаются аортальной недостаточностью аортального клапана, самопроизвольно не закрываются • Открытый АВ-канал (10%) обнаруживают в задней части межжелудочковой перегородки, около места прикрепления колец митрального и трёхстворчатого клапанов, часто встречается при синдроме Дауна, сочетается с ДМПП типа ostium primum и пороками развития створок и хорд митрального и трёхстворчатого клапанов, самопроизвольно не закрывается • В зависимости от размера ДМЖП выделяют малые (болезнь Толочинова–Роже) и большие (более 1 см или половина диаметра устья аорты) дефекты.
Клиническая картина
• Жалобы: см. Дефект межпредсердной перегородки.
• Объективно • Бледность кожных покровов • Борозды Харрисона • Усиление верхушечного толчка, дрожание в области левого нижнего края грудины • Патологическое расщепление II тона в результате удлинения периода изгнания правого желудочка • Грубый пансистолический шум у левого нижнего края грудины • При надгребневых ДМЖП — диастолический шум аортальной недостаточности.
Инструментальная диагностика
• ЭКГ: признаки гипертрофии и перегрузки левых отделов, а при лёгочной гипертензии — и правых.
• Яремная флебография: высокоамплитудные волны A (сокращение предсердия при ригидном правом желудочке) и, иногда, волна V (трикуспидальная регургитация).
• ЭхоКГ •• Гипертрофия и дилатация левых отделов, а при лёгочной гипертензии — и правых •• Визуализация ДМЖП в допплеровском и В-режиме •• Диагностика сопутствующих аномалий (клапанных пороков, коарктация аорты и др.) •• Определяют систолическое давление в правом желудочке, степень сброса крови и Qp/Qs •• Взрослым проводят чреспищеводную ЭхоКГ.
• Рентгенография органов грудной клетки •• При небольших ДМЖП — нормальная рентгенологическая картина •• Выбухание дуги левого желудочка, усиление лёгочного сосудистого рисунка •• При лёгочной гипертензии — выбухание дуги лёгочной артерии, расширение и неструктурность корней лёгких с резким сужением дистальных ветвей и обеднением лёгочного сосудистого рисунка.
• Радионуклидная вентрикулография: см. Дефект межпредсердной перегородки.
• Катетеризация камер сердца •• Показана при подозрении на лёгочную гипертензию, перед операцией на открытом сердце и при противоречивых клинических данных •• Вычисляют Qp/Qs •• Проводят пробы с аминофиллином и ингаляцией кислорода для определения прогноза в отношении обратимости лёгочной гипертензии.
• Левая вентрикулография, коронарная ангиография: визуализация и количественная оценка сброса, диагностика ИБС при наличии симптомов или перед операцией.
Медикаментозное лечение. При бессимптомном течении и нормальном давлении в лёгочной артерии (даже при больших дефектах) возможно консервативное лечение до 3–5 лет жизни. При застое в малом круге кровообращения — периферические вазодилататоры (гидралазин или нитропруссид натрия), уменьшающие сброс слева направо. При правожелудочковой недостаточности — диуретики. До и в течение 6 мес после неосложнённой хирургической коррекции ДМЖП — профилактика инфекционного эндокардита.
Хирургическое лечение
Показания • При бессимптомном течении — если к 3–5 годам жизни не происходит самопроизвольного закрытия дефекта, хотя лучших результатов достигают при оперативном лечении в возрасте до 1 года • Сердечная недостаточность или лёгочная гипертензия у детей младшего возраста • У взрослых отношение Qp/Qs составляет 1,5 и более.
Противопоказания: см. Дефект межпредсердной перегородки.
Методы оперативного лечения. Паллиативное вмешательство — сужение лёгочного ствола манжетой, проводят при необходимости экстренной операции детям с массой тела менее 3 кг, при сопутствующих пороках сердца и малом опыте клиники по радикальной коррекции порока в раннем возрасте. При травматическом дефекте в области мембранозной части межпредсердной перегородки возможно ушивание дефекта. В остальных случаях проводят пластику дефекта заплатой из аутоперикарда или синтетических материалов. При постинфарктном ДМЖП проводят пластику дефекта с одномоментным коронарным шунтированием.
Специфические послеоперационные осложнения: инфекционный эндокардит, АВ-блокада, желудочковые аритмии, реканализация ДМЖП, недостаточность трёхстворчатого клапана.
Прогноз. У 80% пациентов с большими ДМЖП происходит спонтанное закрытие дефекта в течение 1 мес, у 90% — в возрасте до 8 лет, известны единичные случаи спонтанного закрытия ДМЖП в возрасте между 21 и 31 годами. При небольших дефектах продолжительность жизни существенно не меняется, но увеличивается риск инфекционного эндокардита (4%). При ДМЖП средних размеров сердечная недостаточность обычно развивается в детском возрасте, тяжёлую лёгочную гипертензию встречают редко. Большие ДМЖП без градиента давления между желудочками в 10% случаев приводят к развитию синдрома Айзенменгера, большинство таких больных умирают в детском или подростковом возрасте. Неотложное хирургическое вмешательство необходимо 35% детей в течение 3 мес после рождения, 45% — в течение 1 года. Материнская смертность во время беременности и родов при синдроме Айзенменгера превышает 50%. При постинфарктном ДМЖП через 1 год при отсутствии хирургического лечения выживают 7% больных. Госпитальная летальность после сужения лёгочной артерии — 7–9%, 5-летняя выживаемость — 80,7%, 10-летняя — 70,6%. Летальность при хирургическом лечении постинфарктных ДМЖП — 15–50%. Госпитальная летальность при закрытии изолированных врождённых ДМЖП с низким ОЛСС — 2,5%, с высоким ОЛСС — менее 5,6%.
Сокращения. Qp/Qs — отношение лёгочного минутного объёма кровотока к системному. ОЛСС — общее лёгочное сосудистое сопротивление.
МКБ-10 • Q21.0 ДМЖП
Код вставки на сайт
Этиология • Врождённые пороки (изолированный ДМЖП, составная часть комбинированного ВПС, например тетрада Фалло, транспозиция магистральных сосудов, общий артериальный ствол, атрезия трёхстворчатого клапана и др.) • Существуют данные об аутосомно-доминантном и рецессивном типах наследования. В 3,3% случаев у прямых родственников больных с ДМЖП также обнаруживают этот порок • Разрыв межжелудочковой перегородки при травмах и ИМ.
Статистические данные • ДМЖП составляет 9–25% всех ВПС • Выявляют у 15,7% живорождённых детей с ВПС • Как осложнение трансмурального ИМ — 1–3% • 6% всех ДМЖП и 25% ДМЖП у грудных детей сопровождаются открытым артериальным протоком, 5% всех ДМЖП — коарктацией аорты, 2% врождённых ДМЖП — стенозом клапана аорты • В 1,7% случаев межжелудочковая перегородка отсутствует, и такое состояние характеризуют как единственный желудочек сердца • Соотношение мужского и женского пола — 1:1.
Патогенез. Степень функциональных нарушений зависит от величины сброса крови и общего лёгочного сосудистого сопротивления (ОЛСС). При сбросе слева направо и отношении лёгочного минутного объёма кровотока к системному (Qp/Qs) менее 1,5:1 лёгочный кровоток возрастает незначительно, и повышения ОЛСС не происходит. При больших ДМЖП (Qp/Qs более 2:1) значительно увеличиваются лёгочный кровоток и ОЛСС, и давления в правом и левом желудочках выравниваются. По мере увеличения ОЛСС возможно изменение направления сброса крови — он начинает происходить справа налево. Без лечения развиваются правожелудочковая и левожелудочковая недостаточность и необратимые изменения лёгочных сосудов (синдром Айзенменгера).
Варианты ДМЖП • Мембранозные ДМЖП (75%) располагаются в верхней части межжелудочковой перегородки, под клапаном аорты и септальной створкой трёхстворчатого клапана, часто закрываются самопроизвольно • Мышечные ДМЖП (10%) располагаются в мышечной части межжелудочковой перегородки, на значительном расстоянии от клапанов и проводящей системы, бывают множественными, фенестрированными и часто закрываются самопроизвольно • Надгребневые (ДМЖП выносящего тракта правого желудочка, 5%) располагаются выше наджелудочкового гребня, часто сопровождаются аортальной недостаточностью аортального клапана, самопроизвольно не закрываются • Открытый АВ-канал (10%) обнаруживают в задней части межжелудочковой перегородки, около места прикрепления колец митрального и трёхстворчатого клапанов, часто встречается при синдроме Дауна, сочетается с ДМПП типа ostium primum и пороками развития створок и хорд митрального и трёхстворчатого клапанов, самопроизвольно не закрывается • В зависимости от размера ДМЖП выделяют малые (болезнь Толочинова–Роже) и большие (более 1 см или половина диаметра устья аорты) дефекты.
Клиническая картина
• Жалобы: см. Дефект межпредсердной перегородки.
• Объективно • Бледность кожных покровов • Борозды Харрисона • Усиление верхушечного толчка, дрожание в области левого нижнего края грудины • Патологическое расщепление II тона в результате удлинения периода изгнания правого желудочка • Грубый пансистолический шум у левого нижнего края грудины • При надгребневых ДМЖП — диастолический шум аортальной недостаточности.
Инструментальная диагностика
• ЭКГ: признаки гипертрофии и перегрузки левых отделов, а при лёгочной гипертензии — и правых.
• Яремная флебография: высокоамплитудные волны A (сокращение предсердия при ригидном правом желудочке) и, иногда, волна V (трикуспидальная регургитация).
• ЭхоКГ •• Гипертрофия и дилатация левых отделов, а при лёгочной гипертензии — и правых •• Визуализация ДМЖП в допплеровском и В-режиме •• Диагностика сопутствующих аномалий (клапанных пороков, коарктация аорты и др.) •• Определяют систолическое давление в правом желудочке, степень сброса крови и Qp/Qs •• Взрослым проводят чреспищеводную ЭхоКГ.
• Рентгенография органов грудной клетки •• При небольших ДМЖП — нормальная рентгенологическая картина •• Выбухание дуги левого желудочка, усиление лёгочного сосудистого рисунка •• При лёгочной гипертензии — выбухание дуги лёгочной артерии, расширение и неструктурность корней лёгких с резким сужением дистальных ветвей и обеднением лёгочного сосудистого рисунка.
• Радионуклидная вентрикулография: см. Дефект межпредсердной перегородки.
• Катетеризация камер сердца •• Показана при подозрении на лёгочную гипертензию, перед операцией на открытом сердце и при противоречивых клинических данных •• Вычисляют Qp/Qs •• Проводят пробы с аминофиллином и ингаляцией кислорода для определения прогноза в отношении обратимости лёгочной гипертензии.
• Левая вентрикулография, коронарная ангиография: визуализация и количественная оценка сброса, диагностика ИБС при наличии симптомов или перед операцией.
Медикаментозное лечение. При бессимптомном течении и нормальном давлении в лёгочной артерии (даже при больших дефектах) возможно консервативное лечение до 3–5 лет жизни. При застое в малом круге кровообращения — периферические вазодилататоры (гидралазин или нитропруссид натрия), уменьшающие сброс слева направо. При правожелудочковой недостаточности — диуретики. До и в течение 6 мес после неосложнённой хирургической коррекции ДМЖП — профилактика инфекционного эндокардита.
Хирургическое лечение
Показания • При бессимптомном течении — если к 3–5 годам жизни не происходит самопроизвольного закрытия дефекта, хотя лучших результатов достигают при оперативном лечении в возрасте до 1 года • Сердечная недостаточность или лёгочная гипертензия у детей младшего возраста • У взрослых отношение Qp/Qs составляет 1,5 и более.
Противопоказания: см. Дефект межпредсердной перегородки.
Методы оперативного лечения. Паллиативное вмешательство — сужение лёгочного ствола манжетой, проводят при необходимости экстренной операции детям с массой тела менее 3 кг, при сопутствующих пороках сердца и малом опыте клиники по радикальной коррекции порока в раннем возрасте. При травматическом дефекте в области мембранозной части межпредсердной перегородки возможно ушивание дефекта. В остальных случаях проводят пластику дефекта заплатой из аутоперикарда или синтетических материалов. При постинфарктном ДМЖП проводят пластику дефекта с одномоментным коронарным шунтированием.
Специфические послеоперационные осложнения: инфекционный эндокардит, АВ-блокада, желудочковые аритмии, реканализация ДМЖП, недостаточность трёхстворчатого клапана.
Прогноз. У 80% пациентов с большими ДМЖП происходит спонтанное закрытие дефекта в течение 1 мес, у 90% — в возрасте до 8 лет, известны единичные случаи спонтанного закрытия ДМЖП в возрасте между 21 и 31 годами. При небольших дефектах продолжительность жизни существенно не меняется, но увеличивается риск инфекционного эндокардита (4%). При ДМЖП средних размеров сердечная недостаточность обычно развивается в детском возрасте, тяжёлую лёгочную гипертензию встречают редко. Большие ДМЖП без градиента давления между желудочками в 10% случаев приводят к развитию синдрома Айзенменгера, большинство таких больных умирают в детском или подростковом возрасте. Неотложное хирургическое вмешательство необходимо 35% детей в течение 3 мес после рождения, 45% — в течение 1 года. Материнская смертность во время беременности и родов при синдроме Айзенменгера превышает 50%. При постинфарктном ДМЖП через 1 год при отсутствии хирургического лечения выживают 7% больных. Госпитальная летальность после сужения лёгочной артерии — 7–9%, 5-летняя выживаемость — 80,7%, 10-летняя — 70,6%. Летальность при хирургическом лечении постинфарктных ДМЖП — 15–50%. Госпитальная летальность при закрытии изолированных врождённых ДМЖП с низким ОЛСС — 2,5%, с высоким ОЛСС — менее 5,6%.
Сокращения. Qp/Qs — отношение лёгочного минутного объёма кровотока к системному. ОЛСС — общее лёгочное сосудистое сопротивление.
Читайте также:

