Давление насыщенных паров реферат
Обновлено: 05.07.2024
Нефть и нефтепродукты характеризуются определенным давлением насыщенных паров, или упругостью нефтяных паров. Давление насыщенных паров является нормируемым показателем для авиационных и автомобильных бензинов, косвенно характеризующим испаряемость топлива, его пусковые качества, склонность к образованию паровых пробок в системе питания двигателя.
Для жидкостей неоднородного состава, таких, как бензины, давление насыщенных паров при данной температуре является сложной функцией состава бензина и зависит от объема пространства, в котором находится паровая фаза. Поэтому для получения сравнимых результатов практические определения необходимо проводить при стандартной температуре и постоянном соотношении паровой и жидкой фаз. С учетом изложенного выше топлив называют давление паровой фазы топлива, находящейся в динамическом равновесии с жидкой фазой, измеренное при стандартной температуре и определенном соотношении объемов паровой и жидкой фаз. Температура, при которой давление насыщенных паров становится равным давлению в системе, называется температурой кипения вещества. Давление насыщенных паров резко увеличивается с повышением температуры. При одной и той же температуре большим давлением насыщенных паров характеризуются более легкие нефтепродукты.
В настоящее время существует несколько способов определения ДНП веществ, которые можно разделить на следующие группы:
- Статический метод.
- Динамический метод.
- Метод насыщения движущегося газа.
- Метод изучения изотерм.
- Метод эффузии Кнудсена.
- Хроматографический метод.
Статический метод
На основе прямого статического метода создан ряд эксперименальных установок для исследования ДНП нефтепродуктов.

В нефтепереработке вследствие своей простоты широкое применение получил стандартный метод с использованием бомбы Рейда (ГОСТ 1756-2000). Бомба состоит из двух камер: топливной 1 и воздушной 2 с соотношением объемов соответственно 1:4, соединенных с помощью резьбы. Давление, создаваемое парами испытуемого топлива, фиксируется манометром 3, прикрепленным к верхней части воздушной камеры. Испытание проводят при температуре 38,8°С и давлении 0,1 МПа, обеспечиваемой специальной термостатированной баней.
Давление насыщенных паров испытуемой жидкости определяют по формуле:

Определение давления паров в бомбе Рейда дает приближенные результаты, служащие только для сравнительной оценки качества моторных топлив.
К достоинствам прибора относится простота конструкции и экспериментирования, к недостаткам - постоянное соотношение жидкой и паровой фаз и грубость метода (погрешность определения ДНП бензинов достигает 15-20%).
Расхождения между дайными, полученными с помощью бомбы Рейда и методом НАТИ, составляют 10-20 %.
Динамический метод
Метод насыщения движущегося газа
Метод изучения изотерм
Метод изучения изотерм даёт наиболее точные, по сравнению с другими способами, результаты, особенно при высоких температурах. Этот способ заключается в исследовании зависимости между давлением и объёмом насыщенного пара при постоянной температуре. В точке насыщения изотерма должна иметь излом, превращаясь в прямую. Считается, что этот метод пригоден для измерения ДНП чистых веществ и непригоден для многокомпонентных, у которых температура кипения - величина неопределённая. Поэтому он не получил распространения при измерении ДНП нефтепродуктов.
Метод эффузии Кнудсена
Метод эффузии Кнудсена применим в основном для измерения очень низких давлений (до 100 Па). Этот метод даёт возможность находить скорость эффузии пара по количеству конденсата при условии полной конденсации эффундирующего вещества. Установки, основанные на этом методе, имеют следующие недостатки: они являются установками однократного измерения и требуют разгерметизации после каждого измерения, что при наличии легкоокисляющихся и нестойких веществ нередко приводит к химическому превращению исследуемого вещества и искажению результатов измерений. Создана экспериментальная установка, лишенная указанных недостатков, но сложность конструкции позволяет применить её только в специально оснащенных лабораториях. Этот метод применяется в основном для измерения ДНП твёрдых веществ.
Метод эффузии Кнудсена
Однако, при анализе таких сложных смесей углеводородов, как нефтепродукты, возникают трудности не только при разделении углеводородов, относящихся к различным классам, но и при идентификации отдельных компонентов этих смесей.
Пересчет давления насыщенных паров
В технологических расчетах часто приходится производить пересчет температур с одного давления на другое или давления при изменении температуры. Для этого имеется множество формул. Наибольшее применение получила формула Ашворта:

Уточненная В. П. Антонченковым формула Ашворта имеет вид:

Для пересчета температуры и давления удобно также пользоваться графическими методами.
Оказалось, что для алканов нормального строения графики, построенные по этим координатам, представляют собой прямые линии, которые все сходятся в одной точке (полюсе). В дальнейшем достаточно взять любую точку с координатами температура - давление насыщенных паров углеводорода и соединить с полюсом, чтобы получить зависимость давления насыщенных паров от температуры для этого углеводорода.
Несмотря на то что график построен для индивидуальных алканов нормального строения, им широко пользуются в технологических расчетах применительно к узким нефтяным фракциям, откладывая на оси ординат среднюю температуру кипения этой фракции.
Кроме графика Кокса для пересчета давления насыщенных паров углеводородов и их смесей в зависимости от температуры используется также график Максвелла.
Для пересчета температур кипения нефтепродуктов с глубокого вакуума на атмосферное давление используется номограмма UOP, по которой, соединив две известные величины на соответствующих шкалах графика прямой линией, получают на пересечении с третьей шкалой искомую величину Р или t. Номограммой UOP в основном пользуются в лабораторной практике.
Давление насыщенных паров смесей и растворов в отличие от индивидуальных углеводородов зависит не только от температуры, но и от состава жидкой и паровой фаз. Для растворов и смесей, подчиняющихся законам Рауля и Дальтона, общее давление насыщенных паров смеси может быть вычислено по формулам:

В области высоких давлений, как известно, реальные газы не подчиняются законам Рауля и Дальтона. В таких случаях найденное расчетными или графическими методами давление насыщенных паров уточняется с помощью критических параметров, фактора сжимаемости и фугитивности.
В этой работе описываются методы расчета и корреляции давления паров чистых жидкостей, а также энтальпий парообразования, поскольку их определение основывается на Р-Т данных.
Общие сведения по давлению паров
Согласно правилу фаз, давление паров чистой жидкости является однозначной функцией температуры насыщения, поэтому почти все данные о давлении паров представляют в виде зависимости

.(7.1)

Давление насыщенного пара может быть связано с любым другим интенсивным свойством насыщенной жидкости (или пара), однако температура насыщения в этом случае наиболее удобна. Если паровая фаза находится в равновесии с жидкой фазой, то условие равенства химических потенциалов, температуры и давления обеих фаз приводит к уравнению Клаузиуса-Клапейрона:

(7.2)

.(7.3)

Большинство уравнений для расчета и корреляции давления паров получаются путем интегрирования уравнения (7.3). После интегрирования должна быть выбрана форма зависимости группы от температуры, а константа интегрирования определяется по одной точке “давление паров -температура”.
S-образный вид зависимости от обусловлен изменением отношения с температурой. Для нормальных жидкостей это отношение сравнительно нечувствительно к изменению температуры в диапазоне между нормальной температурой кипения вещества и его критической температурой. Объясняется это тем, что уменьшение теплоты парообразования компенсируется в некоторой степени уменьшением величины . Ниже нормальной точки кипения (при = 0,6-0,7) значение очень близко к единице и изменение отношения происходит исключительно вследствие изменения энтальпии.
Аппроксимация Р-Т данных
Для аппроксимации экспериментальных P-T данных применяются уравнения различной сложности и теоретической аргументации. Одни из них хорошо работают при температурах ниже нормальной точки кипения, другие - при более высоких температурах. Корреляции, учитывающие S -образный вид зависимости от , имеют, как правило, весьма сложную алгебраическую форму. Универсальных подходов для описания ее пока не найдено.
Выбор типа уравнения во многом зависит от объема и качества экспериментальных данных, а также от приверженности автора тем или иным подходам. Все корреляции, предложенные в настоящее время для описания P-T данных, могут быть объединены в несколько групп с весьма близкими возможностями их в каждой группе. Ниже рассмотрены методы, наиболее часто применяющиеся при массовых расчетах.
Большинство уравнений для расчета давлений паров получены интегрированием уравнения Клаузиуса-Клапейрона (7.3). Число вариантов интегрирования ограниченно. Тем не менее результаты, опубликованные в литературе, отличаются достаточно большим разнообразием. Объясняется это тем, что для достижения большей точности каждый автор обычно вводит свои поправочные коэффициенты.
В уравнении (7.3) как , так и являются функциями температуры. Величина представляет собой изменение коэффициента сжимаемости при переходе вещества из состояния насыщенной жидкости в состояние насыщенного пара.

Для прогнозирования в настоящее время довольно широко применяется уравнение Хаггенмахера

,(7.4)

где при условии, что жидкость находится под давлением, равным давлению насыщенных паров.
Уравнение Хаггенмахера дает хорошие результаты при температурах, близких к нормальной точке кипения, или при более низких, чем , температурах. При уравнение Хаггенмахера следует использовать с осторожностью.

При интегрировании уравнения Клаузиуса-Клапейрона в самом простом случае предполагается, что группа имеет постоянное значение, которое не зависит от температуры.
Обозначив постоянную величину интегрирования через “A”, получим

,(7.5)

где .
Соотношение (7.5) иногда называют уравнением Клапейрона. Графически приведенная зависимость выражается прямой линией. Часто уравнение (7.5) оказывается неплохой аппроксимацией, но в общем случае оно дает существенные ошибки по причине того, что зависимость от имеет S -образный вид. Уравнение (7.5) неприменимо для температур ниже нормальной точки кипения даже для неполярных и не склонных к образованию ассоциатов веществ. Для последних линейная форма P-T зависимости может применяться для аппроксимации P-T данных только в узком температурном интервале даже в области температур, превышающих нормальную точку кипения.
Антуан предложил широко используемую простую модификацию уравнения (7.5):

.(7.6)
При C=0 уравнение (7.6) превращается в уравнение Клапейрона (7.5). Константы “A”, “B” и “C” в уравнении Антуана получают путем аппроксимации экспериментальных P-T данных. Для многих веществ значения этих констант приводятся в справочной литературе [5, 6, 16]. Применимость констант уравнения Антуана ограничена теми диапазонами по температуре или давлению, для которых они рекомендованы авторами указанных справочников. Использовать уравнение Антуана вне рекомендованных интервалов нельзя.

Кокс предложил графическую корреляцию давления паров. На графике по оси ординат откладывается логарифм и проводится прямая линия (с положительным наклоном), ординаты которой отвечают значениям давления паров воды (или какого-либо другого эталонного вещества). Так как зависимость давления паров воды от температуры хорошо известна, то абсцисса соответственно размечается в единицах температуры. На подготовленном таким образом поле координат давления паров других веществ будут также изображаться прямыми линиями. Однако такие графики несколько неудобны для практического использования вследствие того, что интерполяция по температуре при этом оказывается весьма неточной.

Калингерт и Дэвис показали, что температурная шкала, полученная таким образом, почти эквивалентна функции ;здесь “С” примерно равно 43 K для большинства веществ, кипящих при температурах от 0 до 100 С. Эти же авторы построили указанным способом зависимости давлений паров для ряда веществ и получили почти прямые линии. Их уравнение

,(7.7)
весьма похожее на уравнение Антуана, часто именно так и называют, а его графическое изображение считают диаграммой Кокса.
В литературе можно встретить указания на то, что существуют довольно простые правила, связывающие константу “С” с нормальной температурой кипения вещества. Несмотря на то, что эти правила недостаточно надежны, ниже приводятся некоторые из них в порядке ознакомления с подходами.
Правила Томпсона:

· для одноатомных и всех веществ с нормальной температурой кипения K

;
· для других соединений

;
· для веществ, нормальная температура кипения которых выше 250 K, рекомендуется принимать C = 43 K;
· для низкокипящих газов C ® 0.
Другая, более употребительная форма корреляции Кокса-Антуана получена дифференцированием уравнения (7.7) по 1/T и сочетанием полученной зависимости с уравнением Клаузиуса-Клапейрона (7.3). Для нормальной точки кипения константы “A” и “B” выразятся в этом случае следующим образом:

;

(7.8)

при ,
где Pvp выражено в физических атмосферах.
Для использования уравнений (7.8) необходимо знать только при Tb и Tb. . В соответствии с рекомендацией Миллера [5] для большинства веществ в области низких давлений может быть принято ~ 1,05.
Уравнение Ренкина, которое также иногда называют уравнением Кирхгофа, получено интегрированием уравнения Клаузиуса-Клапейрона в приближении =const и :

.(7.9)
Уравнение Ренкина используется для аппроксимации экспериментальных данных, которые не отличаются высокой точностью, вследствие чего прочие дополнительные члены P-T зависимости оказываются незначимыми.
Ридель предложил корреляцию давления паров, основанную на модификации уравнения (7.9):

.(7.10)

Член T 6 намеренно включен в корреляцию для учета того, что значение v Z не равно единице при высоких температурах и также не является линейной функцией в этой области. Показатель степени “6” при T не играет существенной роли - могут использоваться и другие числа без особого влияния на точность расчета. В отечественной практике используется уравнение

.(7.11)
Теоретическая аргументация применения этого уравнения дана А.Н.Корниловым.
Корреляции, основанные на использовании принципа соответственных состояний
В группе трехпараметрических корреляций для прогнозирования P-T данных довольно широкое применение нашло разложение Питцера

(7.12)
с аналитическим представлением функций и , выполненным Ли и Кеслером:

;(7.13)

,(7.14)
где - приведенное давление насыщенного пара, равное давлению насыщенного пара, деленному на критическое давление , а - ацентрический фактор. Величину ацентрического фактора при использовании корреляции Ли-Кеслера целесообразно также вычислять по уравнению Ли-Кеслера (5.7).
Преимущества корреляции Ли-Кеслера очевидны. Однако необходимо помнить, что универсальных подходов к описанию P-T данных в настоящее время не выработано, поэтому результаты прогнозирования для одних соединений могут быть очень хорошими, для других - только удовлетворительными. То же можно сказать и для различных температурных диапазонов применительно к одному и тому же соединению. В связи с этим ниже рассмотрены еще несколько наиболее часто применяющихся корреляций.
Выше было приведено уравнение Риделя для давления паров (7.10). По аналогии с этим уравнением им же рекомендована корреляция с использованием приведенных параметров:

,(7.15)

где ;

;

;

;

;

;

,(7.16)
c - коэффициент Риделя в критической точке. При вычислении коэффициента Риделя с использованием приведенной выше корреляции необходимо иметь в виду, что критическое давление должно быть выражено в физических атмосферах.
Итак, зная критические параметры Tc , Pc и c ,можно рассчитать давление насыщенного пара при любой из интересующих температур. Для определения величины c можно использовать либо значение нормальной температуры кипения, либо известное давление насыщенного пара при какой-либо другой температуре. С аналогичным подходом мы уже встречались при определении величины ацентрического фактора.
Фрост и Колкуорф интегрировали уравнение Клаузиуса-Клапейрона в приближении , но они не считали величиной постоянной, а находили по уравнению Ван-дер-Ваальса. Результирующее уравнение лишь немного отличается от уравнения Риделя:

,(7.17)
однако величина D связана с константой Ван-дер-Ваальса “a” и критическими температурой и давлением:

.(7.18)
Тодос и его сотрудники детально исследовали уравнение (7.17) и предложили для константы “C” зависимость

.(7.19)
Используя уравнения для приведенных параметров, получена зависимость:

.(7.20)
Константу “B” можно определить, если известно давление насыщенного пара вещества при какой-либо температуре. Так, для нормальной точки кипения имеем

.(7.21)
Из приведенного материала видно, что значения констант “B” и “C” в уравнении являются зависимыми от природы рассматриваемого вещества. Это должно приводить к лучшему предсказанию прогнозируемого свойства, чем при использовании корреляций “жесткого” типа, где константы имеют постоянное значение. К последним можно отнести, в частности, корреляцию Ли-Кеслера. Тем не менее корреляция Фроста-Колкуорфа-Тодоса используется в практических расчетах нечасто. Причиной тому служит определенное неудобство в ее применении, вызванное отсутствием P-T зависимости в явном виде. Конечно же, в настоящее время эти проблемы легко решаются, но существует некоторая инерция в отношении к применяемым подходам. Для облегчения вычислительных процедур Гарлахер и Браун на основе большого массива надежных экспериментальных данных рассчитали значения констант “B” и “C” для 242 веществ, которые приведены в [5]. Они также предложили приближенную корреляцию этих констант с парахором и фактором ацентричности.
В заключение следует сказать, что предпринималось множество других попыток улучшения подходов к интегрированию уравнения Клаузиуса-Клапейрона с целью обеспечения более тесной связи вида применяемых корреляций и природы соединений, для которых прогнозируются свойства. Обычно увеличение точности прогноза сопряжено с необходимостью привлечения дополнительной экспериментальной информации. Причем ее качество существенно влияет на качество прогноза. Так, например, метод Тека и Стила рекомендован для прогнозирования упругостей паров веществ, в том числе и сильно полярных или имеющих группы, участвующие в образовании ассоциатов. Для использования этого метода необходимо располагать сведениями по энтальпии испарения вещества при нормальной точке кипения, кроме критических параметров и Tb . Совершенно очевидно, что такой набор информации отсутствует для множества веществ. Кроме того, выполненная нами проверка метода на большом массиве соединений показала, что этим методом можно пользоваться только при наличии весьма точных данных. В противном случае предсказание дает большую ошибку, чем при использовании таких методов, как Ли-Кеслера, или эквивалентных ему. Применение методов, широко используемых при прогнозировании давлений насыщенного пара органических веществ, иллюстрируется примером 7.1.

Оказывается, у насыщенного пара и бизнес-центра много общего, а чтобы вскипятить чайник при температуре меньше 100°C, нужно забраться на Эльбрус.
О чем эта статья:
Фазовые переходы: изменение агрегатных состояний вещества
Прежде чем говорить о насыщенном паре, нужно освежить знания об агрегатных состояниях и фазовых переходах между ними. Если вы забыли, какие бывают агрегатные состояния, то можете сбегать в нашу статью про них.
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Вот какие бывают фазовые переходы:
Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
На схеме — названия всех фазовых переходов:
Фазовые переходы — важная штука. Все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы в металлургии и микроэлектронике.
Парообразование
Итак, парообразование — это переход из жидкого состояния в газообразное.
При парообразовании всегда происходит поглощение энергии: к веществу необходимо подводить теплоту, чтобы оно испарялось. Из-за этого внутренняя энергия вещества увеличивается.
У процесса парообразования есть две разновидности: испарение и кипение.
Испарение — это превращение или переход жидкости в газ (пар) со свободной поверхности жидкости. Если поверхность жидкости открыта и с нее начинается переход вещества из жидкого состояния в газообразное, это будет называться испарением.
Кипение — процесс интенсивного парообразования, который происходит в жидкости при определенной температуре.
Например, мы заварили себе горячий чай. Над чашкой мы увидим пар, так как вода только что поучаствовала в процессе кипения.
Подождите-ка, мы ведь только что сказали, что кипение и испарение — разные вещи. 🤔 Это действительно так, но при этом оба процесса могут происходить параллельно.
Испарение может происходить и без кипения, просто тогда оно не будет для нас заметно. Например, вода в озере испаряется, хотя мы этого и не замечаем. Кипение по сути своей — это интенсивное испарение, которое вызвали внешними условиями — доведя вещество до температуры кипения.
Физика объясняет испарение тем, что жидкость обычно несколько холоднее окружающего воздуха, и из-за разницы температур происходит испарение.
Если нет каких-то внешних воздействий, испарение жидкостей происходит крайне медленно. Молекулы покидают жидкость из-за явления диффузии.
Направление тепловых потоков при испарении может идти в разной последовательности и комбинациях:
из глубины жидкости к поверхности, а затем в воздух;
только из жидкости к поверхности;
к поверхности из воды и газовой среды одновременно;
к площади поверхности только от воздуха.
Подытожим, чтобы не запутаться, в чем главная разница между испарением и кипением:
при любой температуре
с поверхности жидкости
при определенной температуре
с поверхности жидкости
Температура кипения
При температуре кипения давление насыщенного пара становится равным внешнему давлению на жидкость — чаще всего это атмосферное давление. Значит, чем больше внешнее давление, тем при более высокой температуре начнется кипение.
При нормальном атмосферном давлении, которое приблизительно равно 100 кПа, температура кипения воды равна 100°C. Поэтому можно сразу сказать, что давление насыщенного водяного пара при температуре 100 градусов по Цельсию равно 100 кПа. Это значение пригодится при решении задач.
Чем выше мы поднимаемся, тем меньше становится атмосферное давление, потому что масса атмосферы над нами уменьшается. Так, например, на вершине Эльбруса атмосферное давление составляет 5 × 104 Па — в два раза меньше, чем нормальное атмосферное давление. Поэтому и температура кипения на вершине Эльбруса будет ниже, чем на уровне моря. Вода там закипит при температуре 82°C.
Температура кипения при нормальном атмосферном давлении — это строго определенная величина для каждой жидкости.
Испарение и конденсация
Молекулы в жидкости непрерывно и хаотично движутся. Это значит, что направление движения отдельно взятых молекул — это случайные направления. При этом жидкость сохраняет свой объем. Также молекулы силами притяжения притягиваются друг к другу, из-за чего не могут покинуть Омск жидкость.
Значения скоростей молекул случайны. Из-за этого среди всех молекул обязательно есть те, что движутся очень быстро. Если такая молекула окажется вблизи поверхности раздела жидкости и окружающей среды, то ее кинетическая энергия может достигнуть большого значения, и молекула покинет жидкость.
Собственно, именно так происходит процесс испарения (мы говорили о нем выше, когда речь шла о фазовых переходах). Когда испарившихся молекул становится много, образуется пар.
Обратный процесс тоже возможен: вырвавшиеся за пределы жидкости молекулы вернутся в жидкость. Это конденсация, о ней мы тоже говорили.
Если открыть сосуд с жидкостью, то испарившиеся молекулы будут покидать пространство над жидкостью и не возвращаться обратно. Количество жидкости таким образом будет уменьшаться. То есть жидкость испаряется, а пар обратно не конденсируется (потому что молекулы этого пара удаляются от жидкости) — так происходит высыхание.
Испарение может происходить с разной скоростью. Чем больше силы притяжения молекул друг к другу, тем меньшее число молекул в единицу времени окажется в состоянии преодолеть эти силы притяжения и вылететь наружу, и тем меньше скорость испарения.
Быстро испаряются такие жидкости, как эфир, ацетон, спирт. Из-за этого свойства их иногда называют летучими жидкостями. Медленнее — вода. Намного медленнее воды испаряются масло и ртуть.
Курсы подготовки к ОГЭ по физике помогут снять стресс перед экзаменом и получить высокий балл.
Определение насыщенного пара
Оставим стакан воды на столе и будем замерять уровень воды в нем каждый день. Если записать эти измерения и сравнить их, станет очевидно: уровень воды стал меньше, то есть вода испарилась.
Теперь давайте накроем стакан сверху. Молекулы пара уже не смогут покидать пространство над жидкостью, по мере испарения их количество начнет расти, а значит, будет расти и количество молекул, которые конденсируются в единицу времени.
Сначала количество конденсирующихся молекул за единицу времени будет меньше количества испаряющихся молекул. Но по мере роста концентрации пара (то есть увеличении количества молекул в единице объема пара) поток конденсирующихся молекул вырастет. Это приведет к состоянию, которое называется динамическим равновесием.
Пар, находящейся в динамическом равновесии, называют насыщенным.
Представьте себе огромный бизнес-центр с не менее огромными дверями. У сотрудников бизнес-центра разный график работы, поэтому люди одновременно заходят в здание и выходят из него в произвольном количестве. Допустим, в 6 часов вечера 100 человек заходят в здание, чтобы попасть на деловую встречу, а другие 100 человек уже закончили работать и идут домой. Количество заходящих в бизнес-центр и выходящих из него будет одинаковым — это и есть состояние насыщения.
Значение давления насыщенного пара и его плотности являются максимальными при заданном значении температуры. Если это не так, то пар ненасыщенный.
Свойства насыщенного пара
При постоянной температуре плотность насыщенного пара не зависит от его объема.
Представьте, что объем сосуда с насыщенным паром уменьшили, не изменив температуры.
Количество молекул, переходящих от пара к жидкости, превысит количество испаряющихся молекул, но при этом часть пара сконденсируется, а оставшийся пар снова придет в динамическое равновесие. В итоге плотность этого пара будет равна начальной плотности.
Давление насыщенного пара не зависит от его объема.
Это связано с тем, что давление и плотность связаны через уравнение Менделеева-Клапейрона, и следует из первого свойства насыщенного пара.
Кстати, уравнение Менделеева-Клапейрона справедливо для насыщенного пара. При этом нужно быть внимательным с частными случаями. Так, например, закон Бойля-Мариотта для насыщенного пара не выполняется.
pV = νRT
p — давление газа [Па]
V — объем [м3]
ν — количество вещества [моль]
T — температура [К]
R — универсальная газовая постоянная
R = 8,31 м 2 × кг × с -2 × К -1 × моль -1
При неизменном объеме плотность насыщенного пара растет с повышением температуры и уменьшается с понижением температуры.
В начальный момент испарения динамическое равновесие будет нарушено (некоторая часть жидкости испарится дополнительно). Плотность пара будет расти, пока динамическое равновесие не восстановится.
Давление и температура насыщенного пара растут быстрее, чем по линейному закону, который справедлив для идеального газа.
В случае идеального газа рост давления обусловлен только ростом температуры, а в случае с насыщенном паром имеют значение два фактора: температура и масса пара.
В случае нагревания насыщенного пара молекулы начинают ударяться чаще, так как их в целом стало больше, потому что пара стало больше.
Главное отличие насыщенного пара от идеального газа: пар сам по себе не является замкнутой системой, а находится в постоянном контакте с жидкостью.
Применим свойства насыщенного пара при решении задач.
Задачка раз
В цилиндрическом сосуде под поршнем длительное время находятся вода и ее пар. Поршень начинают вдвигать в сосуд. При этом температура воды и пара остается неизменной. Как будет меняться при этом масса жидкости в сосуде? Ответ поясните.
Решение
Так как пар и вода находятся в контакте длительное время, пар является насыщенным. При уменьшении объема сосуда давление насыщенного пара не меняется. Из уравнения Менделеева-Клапейрона следует, что для того, чтобы давление пара не менялось, его количество вещества (а значит и масса) должно уменьшаться.
В этом процессе происходит конденсация, часть молекул пара переходят в жидкость, поэтому масса жидкости увеличивается.
Ответ
Масса жидкости увеличивается.
Задачка два
Какова плотность насыщенного пара при температуре 100°С?
Решение
При нормальном давлении (p = 105 Па) 100°С — это температура кипения воды. Значит, давление насыщенного пара при этой температуре равно атмосферному давлению.
Найдем связь между давлением и плотностью через уравнение Менделеева-Клапейрона.
Подставим значение давления в уравнение состояния идеального газа, предварительно переведя температуру в Кельвины: T = 100 + 273 = 373 K
Стремись не к тому, чтобы добиться успеха, а к тому, чтобы твоя жизнь имела смысл.
Альберт Эйнштейн
Вопросы к экзамену
Для всех групп технического профиля
Учу детей тому, как надо учиться
Часто сталкиваюсь с тем, что дети не верят в то, что могут учиться и научиться, считают, что учиться очень трудно.
Урок 18. Лекция 18. Свойства паров
Насыщенные и ненасыщенные пары.
Рассмотрим процессы, происходящие в закрытом сосуде:
- процесс испарения, скорость которого постепенно уменьшается
- конденсации, скорость которого постепенно возрастает
С течением времени в сосуде закрытом крышкой между жидкостью и её паром устанавливается состояние динамического (подвижного) равновесия, когда число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, то есть когда скорости процессов испарения и конденсации одинаковы. Такую систему называютдвухфазной.
Пар, находящийся в динамическом равновесии со своей жидкостью, называютнасыщенным.
Ненасыщенный пар – это пар, не достигший динамического равновесия со своей жидкостью. При данной температуре давление ненасыщенного пара всегда меньше давления насыщенного пара. При наличии над поверхностью жидкости ненасыщенного пара процесс парообразования преобладает над процессом конденсации, и потому жидкости в сосуде с течением времени становится все меньше и меньше.
Рассмотрим некоторые свойства насыщенного пара:
1. Концентрация молекул насыщенного пара не зависит от его объёма при постоянной температуре. Если уменьшить объем насыщенного пара, то сначала концентрация его молекул увеличится и из газа в жидкость начнет переходить больше молекул до тех пор, пока опять на установится динамическое равновесие.
2. Давление насыщенного пара при постоянной температуре не зависит от его объёма.
p = n*k*T, т.к. n не зависит от V , то и р не зависит от V.
Независимое от объёма давление пара, при котором жидкость находится в равновесии со своим паром, называется давлением насыщенного пара. Это наибольшее давление, которое может иметь пар при данной температуре.
3. Давление насыщенного пара зависит от температуры. Чем выше будет температура жидкости, тем больше молекул будет испаряться, динамическое равновесие нарушится, но концентрация молекул пара будет расти до тех пор, пока равновесие не установится опять, а значит, больше станет и давление насыщенного пара. С увеличением температуры давление насыщенных паров возрастает.
В атмосферном воздухе всегда присутствуют пары воды, которая испаряется с поверхности морей, рек, океанов и т.п.
Воздух, содержащий водяной пар, называют влажным.
Влажность воздуха оказывает огромное влияние на многие процессы на Земле: на развитие флоры и фауны, на урожай сельхоз. культур, на продуктивность животноводства и т.д. Влажность воздуха имеет большое значение для здоровья людей, т.к. от неё зависит теплообмен организма человека с окружающей средой. При низкой влажности происходит быстрое испарение с поверхности и высыхание слизистой оболочки носа, гортани, что приводит к ухудшению состояния.
Значит, влажность воздуха надо уметь измерять. Для количественной оценки влажности воздуха используют понятия абсолютной и относительной влажности.
Абсолютная влажность – величина, показывающая, какая масса паров воды находится в 1 м³ воздуха. Она равна парциальному давлению пара при данной температуре.
Парциальное давление пара – это давление, которое оказывал бы водяной пар, находящийся в воздух , если бы все остальные газы отсутствовали.
Относительная влажность воздуха – это величина, показывающая, как далек пар от насыщения. Это отношение парциального давления p водяного пара, содержащегося в воздухе при данной температуре, к давлению насыщенного пара p0 при той же температуре, выраженное в процентах:
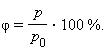
Если воздух не содержит паров воды, то его абсолютная и относительная влажность равны 0.
Если влажный воздух охлаждать, то находящийся в нем пар можно довести до насыщения, и далее он будет конденсироваться.
выпадение росы под утро,

запотевание холодного стекла, если на него подышать,

образование капли воды на холодной водопроводной трубе,

сырость в подвалах домов.

Точка росы – это температура, при которой водяной пар, содержащийся в воздухе, становится насыщенным.
Читайте также:

