Барометрическая формула распределение больцмана реферат
Обновлено: 06.07.2024
Если на молекулы газа не действуют никакие внешние силы, то вследствие теплового движения они равномерно распределяются по всему объему сосуда, так что в каждой единице объема содержится в среднем одинаковое число молекул. При одинаковой во всех частях объема температуре в газе устанавливается всюду одинаковое давление Р = nkT = const (в соответствии с законом Паскаля).
Иначе обстоит дело, когда газ находится в некотором силовом поле, в котором на каждую частицу газа действует внешняя сила, толкающая ее в определенном направлении. Под действием такой силы молекулы будут собираться преимущественно в тех областях пространства, куда их заталкивают внешние силы, и там концентрация частиц, а значит, и давление газа будут возрастать. Т.е. действие внешних сил на молекулы газа противоположно тому действию, которое оказывает на них беспорядочное тепловое движение.
В результате одновременного действия внешних сил и теплового движения молекул в газе при заданной температуре устанавливается некоторое неравномерное распределение молекул в пространстве, не изменяемое во времени. Это значит, что при действии внешних сил плотность идеального газа, находящегося в равновесных условиях, будет различной в различных местах пространства, т.е. она будет некоторой функцией координат
Примером внешних сил является поле силы тяжести, а примером газа в таком силовом поле является земная атмосфера. Молекулы газов, составляющие атмосферный воздух, под влиянием теплового движения рассеялись бы в мировом пространстве, если бы отсутствовала сила тяжести. Напротив, если бы отсутствовало тепловое движение молекул, то под действием силы тяжести все молекулы воздуха упали бы на землю, и весь воздух собрался бы тончайшим слоем у поверхности Земли. Таким образом, само существование атмосферы является результатом одновременного действия силы притяжения молекул к Земле и их теплового движения. При этом в атмосфере устанавливается некоторое неравномерное распределение молекул воздуха по высоте. Соответственно этому распределению молекул устанавливается и определенный закон изменения давления с высотой.
Если бы земная атмосфера находилась в состоянии теплового равновесия, т.е. температура атмосферы была бы одинаковой на всех высотах, то в ней бы установилось так называемое барометрическое распределение плотности и давления с высотой.
Для определения барометрического закона изменения давления и плотности идеального газа с высотой рассмотрим вертикальный столб газа с площадью поперечного сечения S = 1, находящийся при постоянной температуре, рис.1.

Z

dZ P-dP

Z P

Х
Обозначим давление газа на некотором нулевом уровне Z = 0 (уровне моря, поверхности земли, дне сосуда и т.д.) через Р0, а давление на высоте Z над нулувым уровнем через Р. При увеличении высоты на dZ давление газа уменьшится на некоторую величину dР. Это уменьшение давления равно весу столба газа высотой dZ с площадью основания S = 1
где - r - плотность газа. На основании уравнения состояния идеального газа, его плотность r равна
Интегрируя это выражение, находим
ò dP/P = - m/R ò g dZ/Т
ln P/P0 = - m/R ò g dZ/Т (3)
На небольших высотах над поверхностью земли ускорение силы тяжести g можно считать постоянным, не зависящим от высоты Z, и вынести его за знак интеграла ò. Кроме тего, если газ находится в тепловом равновесии при постоянной, не зависящей от высоты Z температуре Т, то и Т можно вынести за знак интеграла. В этом случае получим
Р/Р0 = е - m gZ/ RT
Р = Р0 е - m gZ/ RT . (4)

Формула (4) характеризует изменение давления газа с высотой и называется барометрической формулой. Она показывает, что давление газа с высотой убывает по экспоненциальному закону. Характер этого убывания графически можно представить следующим образом, рис.2. Р
 |

Z
Прибор для определения высоты над земной поверхностью называется высотомером(или альтиметром). Принцип его действия основан на использовании формулы (4). Из этой формулы следует, что давление с высотой убывает тем быстрее, чем тяжелее газ.
Принимая во внимание, что m = mNA и R = k NA , мы можем переписать барометрическую формулу в виде
Р = Р0 е - mgZ/ kT .
Так как P = nkT, то эта барометрическая формула выражает также закон убывания плотности газа с высотой
n = n0 е - mgZ/ kT (5)
где n и n0 – числа молекул в единице объема газа в точках, разность высот между которыми равна Z. Ввиду чрезвычайно малой массы газовых молекул убывание плотности газа и его давления заметно только при значительных изменениях высоты. В случае небольшого изменения высоты изменение давления и плотности газа оказываются весьма малыми. Поэтому в случае газа, заключенного в сосуд небольшой высоты, действием силы тяжести на молекулы газа можно пренебречь. Поскольку температура атмосферы Земли не постоянна и изменяется с высотой, то для более точного описания изменений ее давления и плотности с высотой в формулы (4) и (5) необходимо вводить соответствующие поправки на изменение температуры.
Поскольку входящая в формулу (5) величина mgZ представляет собой потенциальную энергию молекул в поле тяготения, то эту формулу можно переписать в виде
n = n0 е – U(Z) /kT (6)
т.е. она выражает закон распределения молекул идеального газа по величине их потенциальной энергии в поле тяготения. Причем величина n0 имеет смысл числа частиц с потенциальной энергией равной нулю (n = n0 при U = 0).
В середине 19 века Больцман показал, что для идеального газа, находящегося в любом силовом поле, число частиц, обладающих заданной потенциальной энергией U, определяется формулой, имеющей тот же вид, что и формула (6). Поскольку, в произвольном силовом поле потенциальная энергия частицы может зависеть от всех трех координат, характеризующих ее положение в пространстве, а не только от одной, как это имело место в частном случае поля тяготения, т.е. n = n(X,Y,Z) и соответственно этому U = U(X,Y,Z). Таким образом, в любом силовом поле распределение частиц в пространстве выражается законом
n(X,Y,Z) = n0 е – U(X,Y,Z) / kT -закон Больцмана (7)
где U(X,Y,Z) – потенциальная энергия частиц во внешнем силовом поле, зависящая от координат той точки, в которой находится частица; n(X,Y,Z) – концентрация частиц в точке с координатами X,Y,Z; n0 – число частиц в единице объема (концентрация) в том месте пространства, где их потенциальная энергия равна 0.
Больцман показал, что при постоянной Т концентрация частиц убывает с ростом U и возрастает с убыванием U, т.е. частицы концентрируются преимущественно в местах с меньшей потенциальной энергией.
Закон Больцмана (8) является весьма общим законом, применимым не только к идеальному газу, но и ко многим другим системам невзаимодействующих частиц.
ДИФФУЗИЯ.
Беспорядочное тепловое движение молекул в газе приводит к тому, что молекулы переносятся с одного места в другое и при столкновении передают друг другу кинетическую энергию и количество движения. Этот перенос молекул и столкновения между ними обуславливают несколько процессов, которые получили название явлений переноса, в результате которых происходит пространственный перенос энергии, массы, импульса. К явлениям переноса относятся диффузия(обусловлена переносом массы), теплопроводность(обусловлена переносом энергии) ивнутреннее трение (обусловлено переносом импульса силы или количества движения).
Если два различных газа привести в соприкосновение друг с другом, то тепловое движение молекул будет перемешивать их до тех пор, пока не образуется однородная смесь молекул, в которой парциальная плотность каждого газа будет одинакова во всем объеме.
Этот процесс постепенного перемешивания 2-х или большего числа газов называется диффузией. Явление диффузии наблюдается также в жидкостях и даже твердых телах. Процесс диффузии заключается в том, что каждая из компонент смеси переходит из тех частей объема, где ее порциальная плотность больше, туда, где она меньше, т.е. в направлении падения парциальной плотности.
Явление диффузии подчиняется закону Фика,который справедлив не только для газов, но и для жидкостей и твердых тел:
где Jm – плотность потока массы – величина, определяемая массой вещества, диффундирующего в единицу времени через единичную площадку, перпендикулярную направлению переноса (оси OX); D – диффузия(коэффициент диффузии); dr/dx – градиент плотности (величина векторная), равный скорости изменения плотности на единицу длины Х в направлении нормали к этой площадке. Знак минус показывает, что перенос массы происходит в направлении убывания плотности (поэтому знаки Jm и dr/dx противоположны).
Диффузия D численно равна плотности потока массы при градиенте плотности, равном единице.
Возникающий при наличии разности концентраций (или парциальных плотностей) диффузионный поток Jm приводит к выравниванию концентраций, т.е. к уменьшению той разности концентраций, которая вызвала этот поток. Такой процесс диффузии, в результате которого происходит выравнивание концентраций компонентов, является нестационарным процессом: при этом как градиент концентрации, так и диффузионный поток изменяются со временем.
Для того, чтобы процесс диффузии был стационарным, необходимо тем или иным путем поддерживать разность концентраций компонент смеси неизменной во времени. Для этого, например, в одной части сосуда необходимо непрерывно добавлять данный компонент, а из другой его части отбирать его в таком же количестве. При стационарной диффузии градиент концентрации остается неизменным во времени. Остается поэтому постоянным и диффузионный поток.
Рассматривая явление диффузии с точки зрения молекулярно-кинетической теории газов, можно получить выражение для коэффициента диффузии
где - средняя скорость теплового движения молекул, - средняя длина свободного пробега молекул газа.
ТЕПЛОПРОВОДНОСТЬ.
Если в одной области газа средняя кинетическая энергия молекул больше, чем в другой, то с течением времени вследствие постоянных столкновений молекул происходит выравнивание средних кинетических энергий молекул, т.е. иными словами, выравнивание температур.
С макроскопической точки зрения явление теплопроводности заключается в переносе некоторого количества тепла от более нагретой части вещества к более холодной. Существование градиента температуры dT/dX является необходимым условием для возникновения теплопроводности.
Перенос энергии при теплопроводности подчиняется закону Фурье:
где JE –плотность теплового потока – величина, определяемая энергией, переносимой в форме теплоты в единицу времени через единичную площадку, перпендикулярную направлению переноса (оси ОХ); c - теплопроводность, dT/dX – градиент температуры (величина векторная), равный скорости изменения температуры на единицу длины Х в направлении нормали к этой площадке. Знак минус показывает, что при теплопроводности энергия переносится в направлении убывания температуры (поэтому знаки JE и dT/dX противоположны).
Теплопроводность c численно равна плотности теплового потока при градиенте температуры, равном единице.
В стационарных условиях, когда за счет какого-либо внешнего источника энергии градиент температуры dT/dX поддерживается постоянным, тепловой поток также не изменяется со временем. В тех же случаях, когда газ (или другое тело), в котором существует градиент температуры, предоставлен самому себе, т.е. к нему извне не подводится энергия, теплопроводность приводит к выравниванию температуры. Такой процесс будет, конечно, нестационарным.
При рассмотрении явления теплопроводности газов с точки зрения молекулярно-кинетической теории можно показать, что
где CV – удельная теплоемкость газа при постоянном объеме (количество теплоты, необходимое для нагревания 1 кг газа на 1 К при постоянном объеме), r - плотность газа, - средняя скорость теплового движения молекул, - средняя длина свободного пробега молекул газа, m – масса одной молекулы, n – число молекул газа в единице объема.
Формула (2) позволяет выяснить характер зависимости коэффициента теплопроводности газа от его температуры и давления.
Л. Больцман как австрийский физик-теоретик, основатель статистической механики и молекулярно-кинетической теории. Общая характеристика закона Больцмана распределения частиц, анализ особенностей. Знакомство с линейными функциями распределения Максвелла.
| Рубрика | Физика и энергетика |
| Вид | контрольная работа |
| Язык | русский |
| Дата добавления | 29.11.2013 |
| Размер файла | 212,5 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
"Барометрическая формула. Закон Больцмана распределения частиц"
1.Барометрическая формула
Зависимость давления или плотности газа от высоты в поле силы тяжести.
Для идеального газа, имеющего постоянную температуру и находящегося в однородном поле тяжести (во всех точках его объёма ускорение свободного падения одинаково), барометрическая формула имеет следующий вид:
где -- давление газа в слое, расположенном на высоте , -- давление на нулевом уровне (), -- молярная масса газа, -- универсальная газовая постоянная, -- абсолютная температура. Из барометрической формулы следует, что концентрация молекул (или плотность газа) убывает с высотой по тому же закону:
где -- масса молекулы газа, -- постоянная Больцмана.
Барометрическая формула может быть получена из закона распределения молекул идеального газа по скоростям и координатам в потенциальном силовом поле (см. Статистика Максвелла -- Больцмана). При этом должны выполняться два условия: постоянство температуры газа и однородность силового поля. Аналогичные условия могут выполняться и для мельчайших твёрдых частичек, взвешенных в жидкости или газе. Основываясь на этом, французский физик Ж.Перрен в 1908 году применил барометрическую формулу к распределению по высоте частичек эмульсии, что позволило ему непосредственно определить значение постоянной Больцмана.
Барометрическая формула показывает, что плотность газа уменьшается с высотой по экспоненциальному закону. Величина , определяющая быстроту спада плотности, представляет собой отношение потенциальной энергии частиц к их средней кинетической энергии, пропорциональной . Чем выше температура , тем медленнее убывает плотность с высотой. С другой стороны, возрастание силы тяжести (при неизменной температуре) приводит к значительно большему уплотнению нижних слоев и увеличению перепада (градиента) плотности. Действующая на частицы сила тяжести может изменяться за счёт двух величин: ускорения и массы частиц .
Следовательно, в смеси газов, находящейся в поле тяжести, молекулы различной массы по-разному распределяются по высоте.
Реальное распределение давления и плотности воздуха в земной атмосфере не следует барометрической формуле, так как в пределах атмосферы температура и ускорение свободного падения меняются с высотой и географической широтой. Кроме того, атмосферное давление увеличивается с концентрацией в атмосфере паров воды.
Барометрическая формула лежит в основе барометрического нивелирования -- метода определения разности высот между двумя точками по измеряемому в этих точках давлению ( и ). Поскольку атмосферное давление зависит от погоды, интервал времени между измерениями должен быть возможно меньшим, а пункты измерения располагаться не слишком далеко друг от друга. Барометрическая формула записывается в этом случае в виде: (в м), где -- средняя температура слоя воздуха между точками измерения, -- температурный коэффициент объёмного расширения воздуха. Погрешность при расчётах по этой формуле не превышает 0,1--0,5 % от измеряемой высоты.
Разность давления на высотах h и h+dh мы можем определить как вес молекул воздуха заключённого в объёме с площадью основания равного 1 и высотой dh.
плотность на высоте h, и так как , то = const.
Из уравнения Менделеева-Клапейрона.
С изменением высоты от h1 до h2 давление изменяется от p1 до p2
Пропотенцируем данное выражение (
Барометрическая формула, показывает, как меняется давление с высотой
n концентрация молекул на высоте h,
n0 концентрация молекул на высоте h =0.
потенциальная энергия молекул в поле тяготения
распределение Больцмана во внешнем потенциальном поле. Из него следует, что при T = const плотность газа больше там, где меньше потенциальная энергия молекул.
2.Распределение Больцмана
Людвиг Больцман - австрийский физик-теоретик, основатель статистической механики и молекулярно-кинетической теории. Одним из первых его достижений было получение в 1866 формулы для равновесного распределения по импульсам и координатам молекул идеального газа, находящегося во внешнем потенциальном поле, в дальнейшем именуемое Распределение Больцмана.
Под распределением Больцмана понимают зависимость концентрации частиц газа от их потенциальной энергии во внешнем поле. Закон распределения молекул газа по скоростям, теоретически установленный Максвеллом, определяет, какое число молекул газа из общего числа его молекул в единице объема имеет при данной температуре скорости, заключенные в интервале от u до u+du. Максвелловское распределение устанавливается в результате парных столкновений хаотически движущихся молекул газа. При этом распределение молекул по объему сосуда определяется законом Больцмана.
Основное уравнение МКТ и максвелские распределения молекул по скорости были получены предположением, что молекулы равномерно распределены по объему и все направления движения молекул равномерно распределены по объему и все направления движения молекул равновероятны. Такие условия могут быть реализованы только в том случае, если на молекулы не действуют никакие внешние силовые поля. Однако молекулы любого газа в земных условиях находятся в потенциальном гравитационном поле Земли, что приводит к нарушению равномерного распределения молекул по объему.
Распределение Больцмана описывает распределение частиц по высоте в гравитационном поле, а не только в гравитационном поле Земли. Это распределение приемлемо к частицам, находящимся в состоянии хаотического теплового движения.
До сих пор рассматривалось поведение идеального газа, не подверженного воздействию внешних силовых полей. Из опыта хорошо известно, что при действии внешних сил равномерное распространение частиц в пространстве может нарушиться. Так под действием силы тяжести молекулы стремятся опуститься на дно сосуда. Интенсивное тепловое движение препятствует осаждению, и молекулы распространяются так, что их концентрация постепенно уменьшается по мере увеличения высоты.
Согласно распределению, число частиц ni с полной энергией Ei равно:
где щi - статистический вес (число возможных состояний частицы с энергией ei). Постоянная А находится из условия, что сумма ni по всем возможным значениям i равна заданному полному числу частиц N в системе (условие нормировки):
В случае, когда движение частиц подчиняется классической механике, энергию Ei можно считать состоящей из кинетической энергии Eiкинчастицы (молекулы или атома), её внутренней энергии Eiвн (напр., энергии возбуждения электронов) и потенциальной энергии Ei,пот во внешнем поле, зависящей от положения частицы в пространстве:
Распределение частиц по скоростям является частным случаем распределения Больцмана. Оно имеет место, когда можно пренебречь внутренней энергией возбуждения
Ei,вн и влиянием внешних полей Ei,пот. В соответствии с (2) формулу (1) можно представить в виде произведения трёх экспонент, каждая из которых даёт распределение частиц по одному виду энергии.
В постоянном поле тяжести, создающем ускорение g, для частиц атмосферных газов вблизи поверхности Земли (или др. планет) потенциальная энергия пропорциональна их массе m и высоте H над поверхностью, т.е. Ei, пот = mgH. После подстановки этого значения в распределение Больцмана и суммирования по всевозможным значениям кинетической и внутренней энергий частиц получается барометрическая формула, выражающая закон уменьшения плотности атмосферы с высотой.
В астрофизике, особенно в теории звёздных спектров, распределение Больцмана часто используется для определения относительной заселённости электронами различных уровней энергии атомов. Если обозначить индексами 1 и 2 два энергетических состояния атома, то из распределения следует:
Разность энергий E2-E1 для двух нижних уровней энергии атома водорода >10 эВ, а значение kT, характеризующее энергию теплового движения частиц для атмосфер звёзд типа Солнца, составляет всего лишь 0,3-1 эВ. Поэтому водород в таких звёздных атмосферах находится в невозбуждённом состоянии. Так, в атмосферах звёзд, имеющих эффективную температуру Тэ > 5700 К (Солнце и др. звёзды), отношение чисел атомов водорода во втором и основном состояниях равно 4,2*10 -9 .
Распределение Больцмана было получено в рамках классической статистики. В 1924-26 гг. была создана квантовая статистика. Она привела к открытию распределений Бозе - Эйнштейна (для частиц с целым спином) и Ферми - Дирака (для частиц с полуцелым спином). Оба эти распределения переходят в распределение, когда среднее число доступных для системы квантовых состояний значительно превышает число частиц в системе, таким образом, когда на одну частицу приходится много квантовых состояний или, другими словами, когда степень заполнения квантовых состояний мала. Условие применимости распределении Больцмана можно записать в виде неравенства:
где N - число частиц, V - объём системы.
Это неравенство выполняется при высокой темп-ре и малом числе частиц в ед. объёма (N/V). Из этого следует, что чем больше масса частиц, тем для более широкого интервала изменений Т и N/V справедливо распределение Больцмана.
Подтверждением больцмановского распределения частиц служит опыт Ж. Перрена (французкий ученый),который в 1909 г. исследовал поведение броуновских частиц в эмульсии гуммигута (сок деревьев) с размерами осматривались с помощью микроскопа, который имел глубину поля - 1мкм. Перемещая микроскоп в вертикальном направлении можно было исследовать распределение броуновских частиц по высоте.
Применив к ним распределение Больцмана можно записать
n= - где m-масса частицы
m - масса вытесненной жидкости:
Если n1 и n2 концентрация частиц на уровнях h1 и h2, а k=R/NA, то
Значение хорошо согласуется со справочным значением , что подтверждает больцмановское распределение частиц.
3.Вывод распределения Больцмана в МКТ
Покажем, что в состоянии термодинамического равновесия влияние силового поля сказывается только на изменении средней концентрации молекул газа от точки к точке. Скорости молекул в каждой точке пространства Распределены по закону Максвелла с температурой Т, общей для всего газа.
Рассмотрим молекулу. Скорость которой направлена от поверхности земли вверх. Вертикальная составляющая начальной скорости равна. Изменение этой составляющей с высотой можно определить с помощью закона сохранения энергии.
Фактически молекула наверняка столкнется на этом пути с другими молекулами и изменит направление движения. Однако среди огромного множества молекул, который будут достигать высоты h, всегда найдется какая-то молекула, обладающая скоростью и направлением движения согласно вышеупомянутой формуле, если бы она достигала высоты h без столкновения c другими молекулами.
Максимальная высота, которую достигают молекулы с начальной вертикальной компонентой скорости равна.
Средняя концентрация молекул на поверхности земли, имеющих скорости в интервале от до равна
Где -функция распределения молекул по z-составляющей скорости, которая может отличаться в соответствующей функции распределения Максвелла.
Среднее число молекул в единице объема, покидающих нулевой уровень и достигающих рассматриваемой поверхности в единицу времени равно
В соответствии с законом сохранения энергии, полагая что vz =0
Найдем, что в среднем разность между количеством молекул, которые в единицу времени приходят снизу в слой dh уходят из него наверх, равна
С другой стороны, эту же разность Z0, можно вычислить с помощью барометрической формулы, продифференцировав ее, и полученный результат умножить на среднее арифметическое значение z-компоненты скорости молекулы, которая равна. В итоге получим
Эта функция тождественная линейной функции распределения Максвелла. Таким образом, распределение молекул по скоростям не изменится в однородном поле силы тяжести. Этот вывод остается верным и в общем случае.
Следовательно, среднее число молекул в единице объема на высоте h от поверхности со скоростью определяется следующим выражением
статистический механика кинетический
Подобные документы
Критерий применимости классического приближения. Каноническое распределение и статистические интегралы. Распределения Максвелла и Максвелла – Больцмана для идеального классического газа. Статистический интеграл.
лекция [109,3 K], добавлен 26.07.2007
Равновесное состояние идеального газа. Краткая характеристика главных особенностей распределения Максвелла. Барометрическая формула, распределение Больцмана. Микро- и нанозагрязнения. Понятие о термодинамическом равновесии. Внутренняя энергия системы.
презентация [106,8 K], добавлен 29.09.2013
Скорости газовых молекул. Обзор опыта Штерна. Вероятность события. Понятие о распределении молекул газа по скоростям. Закон распределения Максвелла-Больцмана. Исследование зависимости функции распределения Максвелла от массы молекул и температуры газа.
презентация [1,2 M], добавлен 27.10.2013
Рассмотрение способов определения коэффициентов амбиполярной диффузии. Общая характеристика уравнения непрерывности. Анализ пространственного распределения частиц. Знакомство с особенностями транспортировки нейтральных частиц из объема к поверхности.
презентация [706,1 K], добавлен 02.10.2013
Уравнения Больцмана, которое описывает статистическое распределение частиц в газе или жидкости. Принципиальные свойства уравнения Лиувилля. Безразмерная форма уравнений Боголюбова. Факторизация и корреляционные функции. Свободно-молекулярное течение.
Барометрическая формула — зависимость давления или плотности газа от высоты в поле силы тяжести.
Для идеального газа, имеющего постоянную температуру и находящегося в однородном поле тяжести (во всех точках его объёма ускорение свободного падения одинаково), барометрическая формула имеет следующий вид:

где — давление газа в слое, расположенном на высоте , — давление на нулевом уровне ( ), — молярная масса газа, — универсальная газовая постоянная, — абсолютная температура. Из барометрической формулы следует, что концентрация молекул (или плотность газа) убывает с высотой по тому же закону:

где — масса молекулы газа, — постоянная Больцмана.
Барометрическая формула может быть получена из закона распределения молекул идеального газа по скоростям и координатам в потенциальном силовом поле (см. Статистика Максвелла — Больцмана). При этом должны выполняться два условия: постоянство температуры газа и однородность силового поля. Аналогичные условия могут выполняться и для мельчайших твёрдых частичек, взвешенных в жидкости или газе. Основываясь на этом, французский физик Ж. Перрен в 1908 году применил барометрическую формулу к распределению по высоте частичек эмульсии, что позволило ему непосредственно определить значение постоянной Больцмана.
Барометрическая формула показывает, что плотность газа уменьшается с высотой по экспоненциальному закону. Величина , определяющая быстроту спада плотности, представляет собой отношение потенциальной энергии частиц к их средней кинетической энергии, пропорциональной . Чем выше температура , тем медленнее убывает плотность с высотой. С другой стороны, возрастание силы тяжести (при неизменной температуре) приводит к значительно большему уплотнению нижних слоев и увеличению перепада (градиента) плотности. Действующая на частицы сила тяжести может изменяться за счёт двух величин: ускорения и массы частиц .
Следовательно, в смеси газов, находящейся в поле тяжести, молекулы различной массы по-разному распределяются по высоте.
Реальное распределение давления и плотности воздуха в земной атмосфере не следует барометрической формуле, так как в пределах атмосферы температура и ускорение свободного падения меняются с высотой и географической широтой. Кроме того, атмосферное давление увеличивается с концентрацией в атмосфере паров воды.
Барометрическая формула лежит в основе барометрического нивелирования — метода определения разности высот между двумя точками по измеряемому в этих точках давлению ( и ). Поскольку атмосферное давление зависит от погоды, интервал времени между измерениями должен быть возможно меньшим, а пункты измерения располагаться не слишком далеко друг от друга. Барометрическая формула записывается в этом случае в виде: (в м), где — средняя температура слоя воздуха между точками измерения, — температурный коэффициент объёмного расширения воздуха. Погрешность при расчётах по этой формуле не превышает 0,1—0,5 % от измеряемой высоты. Более точна формула Лапласа, учитывающая влияние влажности воздуха и изменение ускорения свободного падения.
| Распределение Больцмана |
В присутствии гравитационного поля (или, в общем случае, любого потенциального поля) на молекулы газа действует сила тяжести. В результате, концентрация молекул газа оказывается зависящей от высоты в соответствии с законом распределения Больцмана:
n = n0exp( -mgh / kT )
где n - концентрация молекул на высоте h, n0 - концентрация молекул на начальном уровне h = 0, m - масса частиц, g - ускорение свободного падения, k - постоянная Больцмана, T - температура.
Распределением Больцмана называют распределение вероятностей разных энергетических состояний идеальной термической системы, включая идеальный газ атомов или молекул, при термодинамическом равновесии.
Данная закономерность объясняет принцип деления частиц, которые находятся под воздействием силового поля, при условии теплового равновесия. Принцип описан Л. Больцманом в 1868 – 1871 гг.
Австрийский физик-теоретик Больцман Людвиг является одним из основоположников классической статистической физики. Основные утверждения ученого связаны с кинетической теорией газов, термодинамикой и теорией излучения. Больцман представил кинетическую формулу газов, которая легла в основу физической кинетики, а также первым использовал и применил к излучению термодинамические закономерности.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Исходя из распределения Больцмана, можно рассчитать количество частиц с полной энергией \(E_\) в среднем:
где \(N_\) является переменной кратностью состояния частицы с энергией \(E_\) или числом возможных состояний частицы с энергией \(E_\) .
Постоянная Z рассчитывается с условием, что сумма \(n_\) со всеми возможными значениями i составляет заданное полное количество частиц n в системе, что является условием применения для нормировки:
При условии, что частицы перемещаются, согласно пояснению принципов классической механики, энергия \(E_\) состоит из следующих компонентов:
- Кинетическая энергия \(E^_=E_\) (кин) частицы в виде молекулы или атома.
- Внутренняя энергия \(E^_=E_\) (вн), к примеру, энергия возбуждения электронов.
- Потенциальная энергия \(E^_=E_\) (пот), характерная для внешнего поля, которая определяется положением частицы в пространстве.
Распределение Больцмана в поле сил тяжести
Можно рассмотреть нахождение идеального газа в поле, в котором действуют консервативные силы, с тепловым равновесием. В зависимости от точек с разными значениями потенциальной энергии определяется концентрация газа, что позволяет соблюсти условия механического равновесия. Количество молекул на единицу объема n уменьшается во время удаления от поверхности Земли, и величина давления убывает, исходя из уравнения:
Когда определено количество молекул в единице объема, можно найти и величину давления. Справедлив и обратный принцип выполнения расчета числа молекул в определенном объеме при известном давлении. Плотность среды и параметры давления находятся в пропорциональной зависимости друг от друга, в условиях стабильных температурных показателей. Рост величины давления с уменьшением высоты объясняется тем, что на нижний слой оказывается нагрузка в виде веса всех атомов, которые находятся выше этого уровня.
Согласно основному уравнению молекулярно-кинетической теории можно P заменить на n для барометрической формулы и получить, таким образом, распределение Больцмана для молярной массы газа:
Где n является количеством молекул в единице объема на высоте h = 0 и h.
распределение Больцмана имеет следующий вид:
Количество молекул на высоте, не равной нулю, уменьшается при понижении температуры. Если Т = 0, нельзя наблюдать тепловое движение. В этом случае все молекулы были бы распределены на поверхности Земли. Высокая температура, наоборот, способствуют практически равномерному распределению молекул по высоте. При этом показатели плотности молекул медленно уменьшаются с высотой. Исходя из уравнения потенциальной энергии:
в зависимости от высоты U будет отличаться. Таким образом, равенство:
является характеристикой распределения частиц, согласно величине потенциальной энергии:
Данное уравнение является законом распределения частиц, согласно потенциальным энергиям, или распределением Больцмана. В этом случае \(n_\) представляет собой количество молекул на единицу объема там, где U = 0.
Наглядно продемонстрировать зависимость концентрации разных газообразных веществ от высоты можно с помощью графика. Таким образом, количество более тяжелых молекул во время увеличения высоты уменьшается быстрее, чем легких.
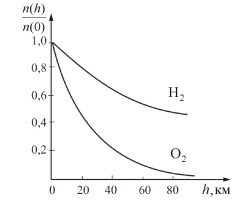
Исходя из выведенной формулы, отношение концентраций молекул в точках с \(U_\) и \(i>U_\) будет записано в таком виде:
Больцманом было доказано, что данная формула справедлива и для потенциального поля с силами гравитации, и для любого потенциального поля с совокупностью каких-либо одинаковых частиц, которые совершают хаотичное тепловое движение.
Барометрическая формула Больцмана, вывод
На какой-то высоте h можно наблюдать атмосферное давление, наличие которого объясняется весом слоев газа, находящихся выше этого уровня. Можно представить, что Р является давлением на высоте h, а P + dP характерно для h + dh.
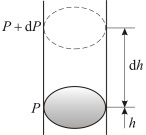
Следует отметить, что dh > 0, а dP \(P=\rho gh\)
где \(\rho =\frac
\(P-\left(P+dP \right)=\rho gdh\)
Исходя из этого равенства, можно записать барометрическое уравнение, которое будет иметь следующий вид:
где \(P_\) является величиной давления на высоте h = 0.
Правила построения графика
Согласно выведенной закономерности, можно заметить, что скорость убывания Р тем больше, чем выше масса газа или больше μ и чем ниже показатели температуры. В качестве практического примера можно рассмотреть концентрацию легких газообразных веществ таких, как Не и Н2, которая на большой высоте существенно больше, чем у земной поверхности.
Графически закономерность можно изобразить с помощью двух кривых, которые трактуются, либо как соответствующие разным μ (при одинаковой Т), либо как отвечающие разным Т, при одинаковых μ. На графике видно, чем тяжелее газ (больше μ) и чем ниже температура, тем быстрее убывает давление.
по термодинамике на тему: Барометрическая формула. Распределение Максвелла—Больцмана и распределение Больцмана в однородном поле сил. Выполнила: студентка IV курса физфака Андрианова Лилия. Барометрическая формула. Распределение Максвелла—Больцмана и распределение Больцмана в однородном поле сил. На практике часто приходится иметь дело с газом, находящимся в однородном внешнем поле сил. Наиболее важным примером такого поля является поле тяжести. До сих пор мы отвлекались от действия поля тяжести на поведение газа. Мы рассмотрим теперь идеальный газ, помещенный в однородное силовое поле. В таком поле каждая молекула обладает полной энергией где —кинетическая энергия ее поступательного движения, а u — потенциальная энергия во внешнем поле, зависящая от положения частицы. Подставляя это выражение' для энергии в распределение Гиббса для одной молекулы PAGE 3 , имеем (1) где интеграл состояний равен, очевидно, (2) Интегрирование ведется по всем возможным значениям переменных. Замечая, что интеграл состояний можно записать в виде , (3) мы находим, что нормированное на единицу распределение Гиббса для молекулы идеального газа при наличии внешнего поля имеет вид (4) Полученное распределение вероятностей, характеризующее вероятность того, что молекула имеет данный импульс и находится в данном элементе объема, носит название распределения Максвелла — Больцмана. Первый из множителей в (4)—хорошо знакомое нам распределение Максвелла. Оно характеризует распределение вероятностей по компонентам импульса. Второй множитель зависит только от координат молекулы и определяется видом ее потенциальной энергии u (х, у, z) во внешнем поле сил. Он выражает вероятность нахождения молекулы в данном объеме dV. В частном случае, когда внешнее поле сил отсутствует, распределение молекул по всему объему сосуда является равновероятным и последний множитель сводится к величине . На основании теоремы умножения вероятностей распределение Максвелла — Больцмана можно рассматривать как произведение вероятностей двух независимых событий — вероятности данного значения импульса и данного положения молекулы. Первая вероятность представляет распределение Максвелла; вторая вероятность — распределение Больцмана. Каждое из распределений нормировано на единицу. То обстоятельство, что оба эти распределения являются независимыми, выражает важное и заранее совершенно неочевидное физическое положение: вероятность данного значения импульса совершенно не зависит от положения молекулы, и, наоборот, вероятность положения молекулы не зависит от ее импульса. Рассмотрим теперь более подробно распределение Больцмана для частного случая, когда газ находится в поле земного тяготения. Направим ось z вертикально вверх. Тогда потенциальная энергия газовой молекулы может быть написана в виде . Поскольку потенциальная энергия зависит только от высоты, в плоскости z = const молекулы распределяются равномерно. Поэтому представляет интерес лишь зависимость распределения вероятностей от координаты z. Она имеет вид (5) где интеграл берется по всем возможным значениям z. Вводя вместо распределения вероятностей среднее число частиц в 1 см3 на данной высоте, можно переписать (5) в виде (6) где n0 — число частиц в 1 см3 на условном уровне отсчета координаты z в плоскости z = 0. PAGE 3
Читайте также:

