Азотсодержащие органические соединения реферат
Обновлено: 02.07.2024
Нитросоединения. Нитросоединениями называются органические вещества, в молекулах которых содержится нитрогруппа — NO 2 при атоме углерода.
Их можно рассматривать как производные углеводородов, получающиеся путем замещения атома водорода на нитрогруппу. По числу нитрогрупп различают моно-, ди- и полинитросоединения.
Названия нитросоединемий производят от названий исходных углеводородов с добавлением приставки нитро-:
Общая формула этих соединений R—NO 2 .
Введение в органическое вещество нитрогруппы называется нитрованием. Его можно проводить разными способами. Нитрование ароматических соединений легко осуществимо при действии смесью концентрированных азотной и серной кислот (первая — нитрующий агент, вторая — водоотнимающий):
Тринитротолуол хорошо известен как взрывчатое вещество. Взрывается только от детонации. Горит коптящим пламенем без взрыва.
Нитрование предельных углеводородов проводится при действии на углеводороды разбавленной азотной кислотой при нагревании и повышенном давлении (реакция М.И. Коновалова):
Нитросоединения часто также получают взаимодействием алкил-галогенидов с нитритом серебра:
При восстановлении нитросоединений образуются амины.
Азотсодержащие гетероциклические соединения. Гетероциклические соединения — это органические соединения, содержащие в своих молекулах кольца (циклы), в образовании которых кроме атома углерода принимают участие и атомы других элементов.
Атомы других элементов, входящие в состав гетероцикла, называются гетероатомами. Наиболее часто встречаются в составе гетероциклов гетероатомы азота, кислорода, серы, хотя могут существовать гетероциклические соединения с самыми различными элементами, имеющими валентность не менее двух.
Гетероциклические соединения могут иметь в цикле 3, 4, 5, 6 и более атомов. Однако наибольшее значение имеют пяти- и шестичленные гетероциклы . Эти циклы, как и в ряду карбоциклических соединений, образуются наиболее легко и отличаются наибольшей прочностью. В гетероцикле может содержаться один, два и более гетероатомов.
Во многих гетероциклических соединениях электронное строение связей в кольце такое же, как и в ароматических соединениях. Поэтому типичные гетероциклические соединения условно обозначают не только формулами, содержащими чередующиеся двойные и одинарные связи, но и формулами, в которых сопряжение p -электронов обозначается кружком, вписанным в формулу.
Для гетероциклов обычно пользуются эмпирическими названиями.
Большое значение имеют гетероциклы, конденсированные с бензольным кольцом или с другим гетероциклом, например пурин:
Шестичленные гетероциклы. Пиридин C 5 H 5 N — простейший шестичленный ароматический гетероцикл с одним атомом азота. Его можно рассматривать как аналог бензола, в котором одна группа СН заменена на атом азота:
Пиридин представляет собой бесцветную жидкость, немного легче воды, с характерным неприятным запахом; с водой смешивается в любых отношениях. Пиридин и его гомологи выделяют из каменноугольной смолы. В лабораторных условиях пиридин можно синтезировать из синильной кислоты и ацетилена:
Химические свойства пиридина определяются наличием ароматической системы, содержащей шесть p -электронов, и атома азота с неподеленной электронной парой.
1. Основные свойства. Пиридин — более слабое основание, чем алифатические амины. Его водный раствор окрашивает лакмус в синий цвет:
При взаимодействии пиридина с сильными кислотами образуются соли пиридиния:
2. Ароматические свойства. Подобно бензолу, пиридин вступает в реакции электрофильного замещения, однако, его активность в этих реакциях ниже, чем бензола, из-за большой электроотрицательности атома азота. Пиридин нитруется при 300 ° С с низким выходом:
Атом азота в реакциях электрофильного замещения ведет себя как заместитель 2-го рода, поэтому электрофильное замещение происходит в мета- положение.
В отличие от бензола пиридин способен вступать в реакции нуклеофильного замещения, поскольку атом азота оттягивает на себя электронную плотность из ароматической системы и орто-пара- положения по отношению к атому азота обеднены электронами. Так, пиридин может реагировать с амидом натрия, образуя смесь орто- и пара- аминопиридинов (реакция Чичибабина):
При гидрировании пиридина ароматическая система разрушается и образуется пиперидин, который представляет собой циклический вторичный амин и является гораздо более сильным основанием, чем пиридин:
Пиримидин C 4 H 4 N 2 — шестичленный гетероцикл с двумя атомами азота. Его можно рассматривать как аналог бензола, в котором две группы СН заменены на атомы азота:
Благодаря наличию в кольце двух электроотрицательных атомов азота пиримидин еще менее активен в реакциях электрофильного замещения, чем пиридин. Его основные свойства также выражены слабее, чем у пиридина.
Основное значение пиримидина состоит в том, что он является родоначальником класса пиримидиновых оснований.
Пиримидиновые основания — производные пиримидина, остатки которых входят в состав нуклеиновых кислот: урацил, тимин, цитозин.
Каждое из этих оснований может существовать в двух формах. В свободном состоянии основания существуют в ароматической форме, а в состав нуклеиновых кислот они входят в NH-форме.
Соединения с пятичленным циклом. Пиррол C 4 H 4 NH - пятичленныи гетероцикл с одним атомом азота.
Ароматическая система содержит шесть p -электронов (по одному от четырех атомов углерода и пара электронов атома азота). В отличие от пиридина электронная пара атома азота в пирроле входит в состав ароматической системы, поэтому пиррол практически лишен основных свойств.
Пиррол — бесцветная жидкость с запахом, напоминающим запах хлороформа. Пиррол слабо растворим в воде (
Пиррол получают конденсацией ацетилена с аммиаком:
или аммонолизом пятичленных циклов с другими гетероатомами (реакция Юрьева):
Сильные минеральные кислоты могут вытягивать электронную пару атома азота из ароматической системы, при этом ароматичность нарушается и пиррол превращается в неустойчивое соединение, которое сразу полимеризуется. Неустойчивость пиррола в кислой среде называется ацидофобностью .
Пиррол проявляет свойства очень слабой кислоты. Он реагирует с калием, образуя пиррол-калий:
Пиррол, как ароматическое соединение, склонен к реакциям электрофильного замещения, которые протекают преимущественно у a -атома углерода (соседнего с атомом азота).
При гидрировании пиррола образуется пирролидин — циклический вторичный амин, проявляющий основные свойства:
Пурин — гетероцикл, включающий два сочлененных цикла: пиридиновый и имидазольный:
Ароматическая система пурина включает десять p -электронов (восемь электронов двойных связей и два электрона пиррольного атома азота). Пурин — амфотерное соединение. Слабые основные свойства пурина связаны с атомами азота шестичленного цикла, а слабые кислотные свойства — с группой NH пятичленного цикла.
Основное значение пурина состоит в том, что он является родоначальником класса пуриновых оснований.
Пуриновые основания — производные пурина, остатки которых входят в состав нуклеиновых кислот: аденин, гуанин.
Нуклеиновые кислоты. Нуклеиновые кислоты — это природные высокомолекулярные соединения (полинуклеотиды), которые играют огромную роль в хранении и передаче наследственной информации в живых организмах. Молекулярная масса нуклеиновых кислот может меняться от сотен тысяч до десятков миллиардов. Они были открыты и выделены из клеточных ядер еще в XIX в., однако их биологическая роль была выяснена только во второй половине XX в.
Строение нуклеиновых кислот можно установить, анализируя продукты их гидролиза. При полном гидролизе нуклеиновых кислот образуется смесь пиримидиновых и пуриновых оснований, моносахарид ( b -рибоза или b -дезоксирибоза) и фосфорная кислота. Это означает, что нуклеиновые кислоты построены из фрагментов этих веществ.
При частичном гидролизе нуклеиновых кислот образуется смесь нуклеотидов, молекулы которых построены из остатков фосфорной кислоты, моносахарида (рибозы или дезоксирибозы) и азотистого основания (пуринового или пиримидинового). Остаток фосфорной кислоты связан с 3-м или 5-м атомом углерода моносахарида, а остаток основания — с первым атомом углерода моносахарида. Общие формулы нуклеотидов:
где Х=ОН для рибонуклеотидов, построенных на основе рибозы, и Х==Н для дезоксирибонуклеотидов, построенных на основе дезоксирибозы. В зависимости от типа азотистого основания различают пуриновые и пиримидиновые нуклеотиды.
Нуклеотид — основная структурная единица нуклеиновых кислот, их мономерное звено. Нуклеиновые кислоты, состоящие из рибонуклеотидов, называют рибонуклеиновыми кислотами (РНК). Нуклеиновые кислоты, состоящие из дезоксирибонуклеотидов, называют дезоксирибонуклеиновыми кислотами (ДНК). В состав молекул РНК входят нуклеотиды, содержащие основания аденин, гуанин, цитозин и урацил. В состав молекул ДНК входят нуклеотиды, содержащие аденин, гуанин, цитозин и тимин. Для обозначения оснований используют однобуквенные сокращения: аденин — А, гуанин — G, тимин — Т, цитозин — С, урацил — U.
Свойства ДНК и РНК определяются последовательностью оснований в полинуклеотидной цепи и пространственным строением цепи. Последовательность оснований содержит генетическую информацию, а остатки моносахаридов и фосфорной кислоты играют структурную роль (носители, оснований).
При частичном гидролизе нуклеотидов отщепляется остаток фосфорной кислоты и образуются нуклеозиды, молекулы которых состоят из остатка пуринового или пиримидинового основания, связанного с остатком моносахарида — рибозы или дезоксирибозы. Структурные формулы основных пуриновых и пиримидиновых нуклеозидов:
В молекулах ДНК и РНК отдельные нуклеотиды связаны в единую полимерную цепь за счет образования сложноэфирных связей между остатками фосфорной кислоты и гидроксильными группами при 3-м и 5-м атомах углерода моносахарида:
Пространственная структура полинуклеотидных цепей ДНК и РНК была определена методом рентгено-структурного анализа. Одним из самых крупных открытий биохимии XX в. оказалась модель двухспиральной структуры ДНК, которую предложили в 1953 г. Дж. Уотсон и Ф. Крик. Согласно этой модели, молекула ДНК представляет собой двойную спираль и состоит из двух полинуклеотидных цепей, закрученных в противоположные стороны вокруг общей оси. Пуриновые и пиримидиновые основания расположены внутри спирали, а остатки фосфата и дезоксирибозы — снаружи. Две спирали удерживаются вместе водородными связями между парами оснований. Важнейшее свойство ДНК — избирательность в образовании связей (комплементарность). Размеры оснований и двойной спирали подобраны в природе таким образом, что тимин (Т) образует водородные связи только с аденином (А), а цитозин (С) — только с гуанином (G).
Таким образом, две спирали в молекуле ДНК комплементарны друг другу. Последовательность нуклеотидов в одной из спиралей однозначно определяет последовательность нуклеотидов в другой спирали.
В каждой паре оснований, связанных водородными связями, одно из оснований — пуриновое, а другое — пиримидиновое. Отсюда следует, что общее число остатков пуриновых оснований в молекуле ДНК равно числу остатков пиримидиновых оснований.
Длина полинуклеотидных цепей ДНК практически неограниченна. Число пар оснований в двойной спирали может меняться от нескольких тысяч у простейших вирусов до сотен миллионов у человека.
В отличие от ДНК молекулы РНК состоят из одной полинуклеотидной цепи. Число нуклеотидов в цепи колеблется от 75 до нескольких тысяч, а молекулярная масса РНК может изменяться в пределах от 2500 до нескольких миллионов. Полинуклеотидная цепь РНК не имеет строго определенной структуры.
Биологическая роль нуклеиновых кислот. ДНК— главная молекула в живом организме. Она хранит генетическую информацию, которую передает от одного поколения к другому. В молекулах ДНК в закодированном виде записан состав всех белков организма. Каждой аминокислоте, входящей в состав белков, соответствует свой код в ДНК, т. е. некоторая последовательность азотистых оснований.
ДНК содержит всю генетическую информацию, но непосредственно в синтезе белков не участвует. Роль посредника между ДНК и местом синтеза белка выполняет РНК. Процесс синтеза белка на основе генетической информации схематично можно разбить на две основные стадии: считывание информации (транскрипция) и синтез белка (трансляция).
Клетки содержат три типа РНК, которые выполняют различные функции.
1. Информационная, или матричная. РНК (ее обозначают мРНК) считывает и переносит генетическую информацию от ДНК, содержащейся в хромосомах, к рибосо-мам, где происходит синтез белка со строго определенной последовательностью аминокислот.
2. Транспортная РНК (тРНК) переносит аминокислоты к рибосомам, где они соединяются пептидной связью в определенной последовательности, которую задает мРНК.
3. Рибосомная РНК (рРНК) непосредственно участвует в синтезе белков в рибосомах. Рибосомы — это сложные надмолекулярные структуры, которые состоят из четырех рРНК и нескольких десятков белков . Фактически рибосомы — это фабрики по производству белков.
Все виды РНК синтезируются на двойной спирали ДНК.
Последовательность оснований в мРНК — это генетический код, управляющий последовательностью аминокислот в белках. Он был расшифрован в 1961—1966 гг. Замечательная особенность генетического кода состоит в том, что он универсален для всех живых организмов. Одинаковым основаниям в разных РНК (будь то РНК человека или вируса) соответствуют одинаковые аминокислоты. Каждой аминокислоте соответствует своя последовательность из трех оснований, называемая кодоном. Некоторые аминокислоты кодируются несколькими кодонами. Так, лейцину, серину и аргинину соответствует по шесть кодонов, пяти аминокислотам — по четыре кодона, изолейцину — три кодона, девяти аминокислотам — по два кодона, а метионину и триптофану — по одному. Три кодона являются сигналами для прекращения синтеза полипептидной цепи и называются кодонами-терминаторами.
Амины. Амины — органические соединения, которые можно рассматривать как производные аммиака, в котором атомы водорода (один или несколько) замещены на углеводородные радикалы.
В зависимости от природы радикала амины могут быть алифатическими (предельными и непредельными), алициклическими, ароматическими, гетероциклическими. Они подразделяются на первичные, вторичные, третичные в зависимости от того, сколько атомов водорода замещено на радикал.
Четвертичные аммониевые соли типа [R 4 N] + Cl - — это органические аналоги неорганических аммониевых солей.
Названия первичных аминов обычно производят от названий соответствующих углеводородов, добавляя к ним приставку амино- или окончание -амин . Названия вторичных и третичных аминов чаще всего образуют по принципам рациональной номенклатуры, перечисляя имеющиеся в соединении радикалы:
первичные R—NH 2 : СН 3 —NH 2 — метиламин; С 6 Н 5 —NH 2 — фениламин;
вторичные R—NH—R': (CH 2 )NH — диметиламин; С 6 Н 5 —NH—СН 3 —метилфениламин;
третичные R—N(R')—R": (СН 3 ) 3 Н — триметиламин ; (C 6 H 5 ) 3 N — трифениламин.
Получение. 1. Нагревание алкилгалогенидов с аммиаком под давлением приводит к последовательному алкилированию аммиака, при этом образуется смесь солей первичных, вторичных и третичных аминов, которые дегидрогалогенируются при действии оснований:
2. Ароматические амины получают восстановлением нитросоединений:
Для восстановления можно использовать цинк или железо в кислой среде или алюминий в щелочной среде.
3. Низшие амины получают, пропуская смесь спирта и аммиака над поверхностью катализатора:
Физические свойства. Простейшие алифатические амины при нормальных условиях представляют собой газы или жидкости с низкой температурой кипения, обладающие резким запахом. Все амины являются полярными соединениями, что приводит к образованию водородных связей в жидких аминах, и следовательно, температуры их кипения превышают температуры кипения соответствующих алканов. Первые представители ряда аминов растворяются в воде, по мере роста углеродного скелета их растворимость в воде уменьшается. Амины растворимы также в органических растворителях.
Химические свойства. 1. Основные свойства. Будучи производными аммиака, все амины обладают основными свойствами, причем алифатические амины являются более сильными основаниями, чем аммиак, а ароматические — более слабыми. Это объясняется тем, что радикалы СН 3 —, С 2 Н 5 — и др. проявляют положительный индуктивный (+I) эффект и увеличивают электронную плотность на атоме азота:
что приводит к усилению основных свойств. Напротив, фенильный радикал C 6 H 5 — проявляет отрицательный мезомерный (-М) эффект и уменьшает электронную плотность на атоме азота:
Щелочная реакция растворов аминов объясняется образованием гидроксильных ионов при взаимодействии аминов с водой:
Амины в чистом виде или в растворах взаимодействуют с кислотами, образуя соли:
Обычно соли аминов — твердые вещества без запаха, хорошо растворимые в воде. В то время как амины хорошо растворимы в органических растворителях, соли аминов в них не растворяются. При действии щелочей на соли аминов выделяются свободные амины:
2. Горение. Амины сгорают в кислороде, образуя азот, углекислый газ и воду:
3. Реакции с азотистой кислотой. а) Первичные алифатические амины при действии азотистой кислоты превращаются в спирты:
б) Первичные ароматические амины при действии HNO 2 превращаются в соли диазония:
в) Вторичные амины (алифатические и ароматические) дают нитрозосоединения — вещества с характерным запахом:
Важнейшие представители аминов. Простейшие алифатические амины — метиламин, диметиламин, диэтиламин — находят применение при синтезе лекарственных веществ и других продуктов органического синтеза. Гексаметилендиамин NH 2 —(СН 2 ) 2 —NH 6 является одним из исходных веществ для получения важного полимерного материала нейлона.
Анилин C 6 H 5 NH 2 — важнейший из ароматических аминов. Он представляет собой бесцветную маслянистую жидкость, мало растворимую в воде. Для качественного обнаружения анилина используют его реакцию с бромной водой, в результате которой выпадает белый осадок 2,4,6-триброманилина:
Анилин применяется для получения красителей, лекарственных препаратов, пластмасс и т. д.
Аминокислоты. Аминокислоты — это органические бифункциональные соединения, в состав которых входят карбоксильная группа —СООН и аминогруппа —NH 2 . В зависимости от взаимного расположения обеих функциональных групп различают a -, b -, g -аминокислоты и т. д.:
Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы. Обычно рассматривают только a -аминокислоты, поскольку другие аминокислоты в природе не встречаются.
Классификация, свойства и характеристики высокомолекулярных соединений. Необходимое условие кристаллизации. Химический состав, строение, конформация, взаимное расположение макромолекул. Скорость взаимодействия макромолекул с низкомолекулярными веществами.
| Рубрика | Химия |
| Вид | статья |
| Язык | русский |
| Дата добавления | 19.10.2013 |
| Размер файла | 21,3 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Азотсодержащие органические соединения -- один из важнейших типов органических соединений. В их состав входит азот. Они содержат в молекуле связь углерод-водород и азот-углерод.
В нефти содержится азотсодержащий гетероцикл-пиридин. Азот входит в состав белков, нуклеиновых кислот и некоторых липидов
Название класса соединений
Высокомолекулярные соединения (полимеры), характеризуются молекулярной массой от нескольких тысяч до нескольких (иногда многих) миллионов. В состав молекул высокомолекулярных соединений (макромолекул) входят тысячи атомов, соединенных химическими связями. Любые атом или группа атомов, входящие в состав цепи полимера или олигомера, называются составным звеном. Наименьшее составное звено, повторением которого может быть описано строение регулярного (см. ниже) полимера, называется составным повторяющимся звеном. Составное звено, которое образуется из одной молекулы мономера при полимеризации, называется мономерным звеном (ранее иногда называлось элементарным звеном). Например, в полиэтилене [--СН2СН2--]n повторяющееся составное звено - СН2, мономерное -СН2СН2.
Название линейного полимера образуют прибавлением приставки "поли" (в случае неорганических полимеров - "катенан-поли"): а) к названию составного повторяющегося звена, заключенному в скобки (систематические названия); б) к названию мономера, из которого получен полимер (полусистематические названия, которые ИЮПАК рекомендует использовать для обозначения наиболее часто применяемых полимеров). Название составного повторяющегося звена образуют по правилам номенклатуры химической, например (первыми указаны полусистематические названия):
Классификация высокомолекулярных соединений
По происхождению высокомолекулярные соединения делят на природные, или биополимеры (например, белки, нуклеиновые кислоты, полисахариды), и синтетические (например, полиэтилен, полистирол, феноло-альдегидные смолы). В зависимости от расположения в макромолекуле атомов и атомных групп различают: 1) линейные высокомолекулярные соединения, макромолекулы которых представляют собой открытую, линейную, цепь (например, каучук натуральный) или вытянутую в линию последовательность циклов (например, целлюлоза; 2) разветвленные высокомолекулярные соединения, макромолекулы которых имеют форму линейной цепи с ответвлениями (например, амилопектин); 3) сетчатые высокомолекулярные соединения - трехмерные сетки, образованные отрезками высокомолекулярных соединений цепного строения (например, отвержденные феноло-альдегидные смолы, вулканизовованный каучук).
Макромолекулы одного и того же химического состава могут быть построены из различных стереоизомеров звена. Высокомолекулярные соединения, молекулы которых состоят из одинаковых стереоизомеров или из различных стереоизомеров, чередующихся в цепи с определенной периодичностью, называются стереорегулярными. Высокомолекулярные соединения, в которых каждый или некоторые стереоизомеры звена образуют достаточно длинные непрерывные последовательности, сменяющие друг друга в пределах одной макромолекулы, называются стереоблоксополимерами. В нестереорегулярных, или атактических, высокомолекулярных соединениях звенья различной пространственной конфигурации чередуются в цепи произвольно.
По химическому составу макромолекулы различают гомополимеры (полимер образован из одного мономера, например полиэтилен) и сополимеры (полимер образован по меньшей мере из двух различных мономеров, например бутадиен-стирольный каучук). Высокомолекулярные соединения, состоящие из одинаковых мономерных звеньев, но различающиеся по молекулярной массе, называются полимергомологами.
Сополимеры в зависимости от характера распределения различных звеньев в макромолекуле делят на регулярные и нерегулярные. В регулярных макромолекулах наблюдается определенная периодичность распределения звеньев. Простейшие примеры - чередующиеся сополимеры стирола с малеиновым ангидридом или некоторых олефинов с акриловыми мономерами, построенные по типу . АВАВАВАВ. где А и В - мономерные звенья (см. Сополимеризация, Радикальная полимеризация). Более сложные регулярные последовательности чередования звеньев реализованы, например, в полипептидах - сополимерах б-аминокислот. Для нерегулярных сополимеров характерно случайное, или статистическое (т.е. подчиняющееся определенной статистике, но не регулярное), распределение звеньев; оно наблюдается у многих синтетических сополимеров. В белках нерегулярные последовательности звеньев задаются генетическим кодом и определяют биохимическую и биологическую специфичность этих соединений. Сополимеры, в которых достаточно длинные непрерывные последовательности, образованные каждым из звеньев, сменяют друг друга в пределах макромолекулы, называются блоксополимерами (см. Блоксополимеры). Последние называются регулярными, если длины блоков и их чередование подчиняются определенной периодичности. При уменьшении длины блоков различие между блоксополимерами и статистическими сополимерами постепенно утрачивается. К внутренним (неконцевым) звеньям макромолекулярной цепи одного химического состава или строения могут быть присоединены одна или несколько цепей другого состава или строения; такие сополимеры называются привитыми.
В зависимости от состава основной (главной) цепи макромолекулы все высокомолекулярные соединения делят на два больших класса: гомоцепные, основные цепи которых построены из одинаковых атомов, и гетероцепные, в основной цепи которых содержатся атомы разных элементов, чаще всего С, N, Si, P. Среди гомоцепных высокомолекулярных соединений наиболее распространены карбоцепные (главные цепи состоят только из атомов углерода), например полиэтилен, полиметилметакрилат, политетрафторэтилен (см. Фторопласты), гуттаперча. Примеры гетероцепных высокомолекулярных соединений - полиэфиры (например, полиэтиленоксид, полиэтилентерефталат, поликарбонаты), полиамиды, кремнийорганические полимеры, мочевино-формальдегидные смолы, белки, целлюлоза. Высокомолекулярные соединения, в макромолекулы которых наряду с углеводородными группами входят атомы неорганогенных элементов, называются элементоорганическими. В полимерах, содержащих атомы металла (напр., Zn, Mg, Сu), обычные ковалентные связи могут сочетаться с координационными (см. Координационные полимеры). Отдельная группа высокомолекулярных соединений - неорганические полимеры (например, полифосфазены), макромолекулы которых построены из неорганических главных цепей и не содержат органических боковых радикалов (обрамляющих групп).
Свойства и основные характеристики высокомолекулярных соединений
Высокомолекулярные соединения обладают специфическим комплексом физико-химических и механических свойств. Важнейшие из них: 1) способность образовывать высокопрочные анизотропные волокна и пленки (см. Ориентированное состояние, Пленки полимерные); 2) способность к большим обратимым, так называемым высокоэластическим, деформациям (см. Высокоэластическое состояние); 3) способность набухать перед растворением и образовывать высоковязкие растворы (см. Растворы полимеров). Эти свойства обусловлены высокой молекулярной массой высокомолекулярных соединений, цепным строением макромолекул, их гибкостью и наиболее полно выражены у линейных высокомолекулярных соединений. По мере перехода от линейных цепей к разветвленным, редким трехмерным сеткам и, наконец, к частым сетчатым структурам комплекс характерных свойств высокомолекулярных соединений становится все менее выраженным. Трехмерные высокомолекулярные соединения с очень большой частотой сетки нерастворимы, неплавки и неспособны к высокоэластичным деформациям.
По фазовому состоянию высокомолекулярные соединения могут быть кристаллическими или аморфными. Необходимое условие кристаллизации - регулярность достаточно длинных участков молекулярной цепи. В таких высокомолекулярных соединениях возможно образование разнообразных кристаллических форм (фибрилл, сферолитов, монокристаллов и других, тип которых во многом определяет свойства полимерного материала. Аморфные высокомолекулярные соединения помимо высокоэластического могут находиться в двух других физических состояниях: стеклообразном состоянии и вязкотекучем состоянии. Высокомолекулярные соединения, которые переходят из высокоэластичного состояния в стеклообразное при температурах ниже комнатной, относят к эластомерам, при более высокой температуре - к пластикам. Кристаллические высокомолекулярные соединения обычно являются пластиками.
Свойства отдельных высокомолекулярных соединений определяются химическим составом, строением, конформацией и взаимным расположением макромолекул (надмолекулярной структурой). В зависимости от этих факторов свойства высокомолекулярных соединений могут изменяться в широких пределах. Так, цис-1,4-полибутадиен, построенный из гибких углеводородных цепей, при температурах около 20°С представляет собой эластичный материал, который ниже -90°С переходит в стеклообразное состояние, тогда как полиметилметакрилат, построенный из более жестких цепей, при температурах около 20°С - твердый стеклообразный продукт, переходящий в высокоэластичное состояние лишь выше 100°С. Целлюлоза - полимер с очень жесткими цепями, соединенными межмолекулярными водородными связями, - вообще не может существовать в высокоэластичном состоянии до температуры ее разложения. Большие различия в свойствах высокомолекулярных соединений могут наблюдаться даже в том случае, когда различия в строении макромолекул на первый взгляд и невелики. Так, изотактический полипропилен - кристаллическое вещество, плавящееся около 175°С, а атактический полипропилен вообще не способен кристаллизоваться и размягчается около --40°С. В данном случае различия в микроструктуре макромолекулярной цепи определяют качественные различия и в характере надмолекулярной структуры.
Bысокомолекулярные соединения могут вступать в следующие реакции: 1) соединение макромолекул поперечными химическими связями (так называемое сшивание), происходящее, например, при вулканизации каучуков, отверждении реактопластов, дублении кож; 2) распад молекулярных цепей на более короткие фрагменты; 3) реакции макромолекул с низкомолекулярными соединениями, при которых изменяется природа боковых функциональных групп, но сохраняются длина и строение скелета основной цепи (так называемые полимераналогичные превращения), например, омыление поливинилацетата с образованием поливинилового спирта; высокомолекулярные соединения, образующиеся в результате таких реакций, называются полимераналогами; 4) внутримолекулярные реакции между функциональными группами одной макромолекулы, например внутримолекулярная циклизация. Гетероцепные высокомолекулярные соединения в отличие от карбоцепных обычно относительно легко гидролизуются. Скорость реакций высокомолекулярных соединений, особенно сетчатых, с низкомолекулярными веществами часто лимитируется скоростью диффузии низкомолярного вещества в фазу высокомолекулярного соединения. В кинетической области (например, в разбавленном растворе) скорость взаимодействия макромолекул с низкомолекулярными веществами часто существенно зависит от природы и расположения соседних звеньев относительно реагирующего звена. Это же относится и к внутримолекулярным реакциям между функциональными группами, принадлежащими одной цепи.
Некоторые свойства высокомолекулярных соединений, например растворимость, способность к вязкому течению, стабильность, существенно зависят от небольших количеств примесей или добавок, реагирующих с макромолекулами. Так, чтобы превратить линейный полимер из расторимого в полностью нерастворимый, достаточно одной-двух поперечных связей на одну макромолекулу.
Важнейшие характеристики высокомолекулярных соединений - химический состав, молекулярная масса, ММР, стереохимическое строение, степень разветвленности и гибкость макромолекулярных цепей, распределение по типам функциональности (см. Функциональность полимеров).
Применение азотсодержащих органических соединений в синтезе линейных и гетероциклических продуктов.
Реакции циклообразования с участием сопряженных азоалкенов.
Синтез карбофункциональных кремнийорганических соединений
Использование кремнийорганических соединений в синтезе линейных и гетероциклических продуктов.
Выдержка из текста
Азотосодержащие органические соединения.
Список использованной литературы
"1.Пожарский А. Ф. Теоретические основы химии гетероциклов. М., Химия, 1965.
2.И. И. Грандберг. Органическая химия. М., Дрофа, 2002
3.Т. Джилкрист. Химия гетероциклических соединений. Под.ред. Юровкой М. А. Москва, ""Мир"" 1996
4.А. А. Петров, Х. В. Бальян, А. Т. Трощенко. Органическая химия. Санкт- Петербург. Изд.""Иван Федоров"". 2003. С. 222
5.С. С. Наметкин, А. С. Забродина. Докл. АН СССР, 75, № 5, 701, (1950)
6.С. С. Наметкин. ЖРХО, 47, 1596, (1915)
7.П. П. Шорыгин, А. В. Топчиев. ЖОХ. № 5, 549, (1935); № 7, 193 (1937)
8.Герм. Патент 211198
9.I. M. Hunsberger. J. Am. Chem. Soc., 71, 2635, (1949)
10. D. I. Legge. J. Am. Chem. Soc., 69, 2079, (1947)
11.E. Macciotta. C., I, 3054, (1932)
12.Fr. M. Lang. Compt. Rend., 226, 1381, (1948)
13.И. Губен. Методы органической химии, т. IV, кн 2. М., Госхимиздат, 1949, С. 1094
14.И. С. Иоффе, А. С. Эфрос. ЖОХ. 16, 111, 1946
15.P. Brunner, O. Witt. Ber., 20, 1023, (1887)
16.H. C. Brown, W. H. Bonner. J. Am. Chem. Soc., 76, 605, 1954
17.A. W. Crossley, N. Renouff. J. Chem. Soc., 95, 215, 1909
18.H. Lecorche, P. Aubertein C. A., 919a (1952)
19.Ю. С. Шабаров Органическая химия часть 2. М., Химия. 1994
20.Дж. Марч Органическая химия. М., Мир.1987.
21.F. Nerdel, W. Kieeberg, G. Schonewald. Chem. Ber., 87, 276, (1954)
22.H. E. Smith, V. Rajevsky, J. Heterocycl. Chem., 5, 715, (1968)
23.P. E. Iversen, H. Lund, Acta Chem. Scand., 20, 2649, (1966)
24.T. Urbanski, B. Skowronska-Serafinowa, H. Dabrowska, Roczniki Chem., 29, 450, (1955); [C. A., 50, 5548 (1956)]
25.И. И. Грандберг, Т. И. Зуянова, Н. И. Афонина, Т. А. Иванова. Авт. Свид. СССР № 192818 [Бюлл. изобр. № 6 (1967)]
26.А. J. Ewins. J. Chem. Soc., 270, (1911)
28.Nielsen A., Archibald T. // Tetrahedron. 1969. Vol. 25. № 11. P. 2393
29.Кобзарева В. Н., Васильева О. С., Зобачева М. М., Берестовицкая В. М. //ЖОрХ. 1997. т. 33, № 10, С.1598
30.Берестовицкая В. М., Васильева О. С., Александрова С. М. //ЖОрХ. 2001. т. 37, № 10, С.1574.
31.Берестовицкая В. М., Остроглядов Е. С., Литвинов И. А., Васильева О. С., Криволапов Д. Б. //ЖОХ. 2004. т. 74, № 9, С.1504-1509
32.O. A. Attanasi, L. Caglioti Conjugated azoalkenes: attractive products and versatile intermediates// Org.Proc.Prep.Int./-1986. – V. 18, № 5-6. –P.299-327.
33.J. G. Schantl 1-Azo- 1-alkene in Metoden der organischen Chemie, Houben-Weil.- Georg Thieme Verlag, Stuttgart – New York, 1993.-Bd. E 15, Tl 1. – S. 909-1100.
35.J. G. Schantl Synthetic, structural, reactive and biological aspects of novel tetraazabicyclooctanes// I1 Farmaco. – 1995. –V. 50, № 6. –P. 379-394
36.H. Simon, S. Brodka Zur Kenntnis von 1-Benzolazoalkenen// Tetrahedron Lett.… — 1969. –P. 4991-4994.
38.F. Palacios, D. Aparico, J. M. de los Santos An efficient strategy for the regioselective synthesis of 3-phosphorylated-1-aminopyrroles from ?-hydrazono phosphine oxidesand phosphonates// Tetrahedron. – 1999. –V. 55. – P. 13767-13778.
41.К. Н. Зеленин, В. А. Никитин, Н. М. Анодина 1-Изопропил-3-трет-бутил-1,2-диазабутадиен-1,3 в реакциях [4 2]-циклоприсоединения//ХГС. 1973. С.124-128
42.К. Н. Зеленин, З. М. Матвеева, Л. Ю. Ермолаева Алкилвинилдиимиды и их реакции с метилвинилкетоном //ЖОрХ. 1970. т.6, № 6, С.723-727
43.В. А. Никитин, В. Н. Вербов, К. Н. Зеленин Строение тетрагидропиридизинов, образующихся из 1-изопропил-3,4-диметил-1,2-диазабутадиена-1,3 и метилвинилкетона// ХГС. 1978. № 12, С.1684-1686
44.К. Н. Зеленин, З. М. Матвеева Диеновый синтез алкилизопропенилдиимидов с метилвинилкетоном//ЖОрХ. 1970. т.6, № 4, С.717-719
45.S. Sommer Inverse Diels-Alder-Reaktionen von Azo-alkenen mit alkenen// Tetrahedron Lett.. 1977. № 1. P. 117-120
46.S. Sommer [4 2]-Cycloadditionen von azoalkenen an elektronenreiche alkene// Chem. Lett.. 1977. P. 583-586
47.T. L. Gilchrist, J. A. Stevens, B. Parton Addition and cycloaddition reactions of ?-chloroazoolefins// J. Chem. Soc. Perkin Trans. 1. 1985. № 6. P. 1741-1745
48.S. Brodka, H. Simon Darstellung neuer Azo-alkene und derivate, insbesondere Additions –produkte CH-acider Verbindungen // Justus Liebigs Ann. Chem. 1971. V. 745. P. 193-203
49.S. Sommer [3 2]- Cycloadditions of azoalkenes to enamines-criss-cross cycloadditions to azoalkenes// Angew. Chem. 1979. V. 18, № 9. P. 695-696
50.S. Sommer, U. Schubert //Andew. Chem. 1979. V. 18, № 9. Р. 696-697
51.G. Abbiati, A. Arcadi, O. A. Attanasi, L. De Crescentint, E. Rossi //Tetrahedron. 2001. V. 57, № 10. P. 2031-2038
52.L. Birkofer, H. Dickop, Chem. Ber., 101, 3579, 1968
53.В. Д. Шелудяков, Н. И. Кирилина, М. Г. Кузнецова, А. В. Кисин, А. Д. Кирилин. Журнал общей химии. 1981, т.51, N8, c.1824-1828
54.А. Д. Кирилин, Дисс., ИНЭОС АН СССР, М.,1978
55.Шелудяков В. Д, Кирилина Н. И., Котрикадзе Э. Л., Кирилин А. Д., Чернышев Е. А. Журнал общей химии. 1982, т.52, с.2646
56.В. Д. Шелудяков, Э. Л. Котрикадзе, А. Д. Кирилин. Журнал общей химии. 1984, т.54, N5, с.1134-1137
57.Родионов Е. С. Авторефер. дис…канд.хим. наук. М., 1973.с.25
58.Шелудяков В. Д., Родионов Е. С., Миронов В. Ф. // ЖОХ.1974. т.44, N7, C.1496
59.Кирилин А.Д., Докучаев А. А., Менчайкина И. Н., Чернышев Е. А. //Изв. РАН. Сер. хим. 1996. № 10, С.2407.
60.А. Д. Кирилин, Л. О. Белова, В. Г. Лахтин, А. В. Лега, М. Ю. Петров, Е. А. Чернышев. Журнал общей химии. 2005, т.75, № 9, С.1474-1478
61. Донской А. А., Баритко Н. В., Евсеева В. А., Зайцев Е. И., Кирилин А. Д., Белова Л. О., Чернышев Е. А., Шапатин А.С., Требукова Е. А. Пат. 218841 (2002).
Россия // Б. И. 2002. № 10.
62.Кирилин А. Д., Докучаев А. А., Сокова Н. Б., Пацкевич А. В., Чернышев Е. А. // ЖОХ. 2000, т.70, № 1, С.51
63.Кирилин А. Д., Докучаев А. А., Сокова Н. Б., Чернышев Е. А. // Изв. РАН. Сер. хим. 1999, № 1, С.169
64.Лахтин В. Г., Шелудяков В. Д., Носова В. М., Кисин А. В., Чернышев Е. А. // ЖОХ. 2001, т.71, № 10, С.1641
65.Кирилин А. Д., Белова Л. О., Лахтин В. Г., Чернышев Е. А. // ЖОХ. 2002, т.72, № 12, С.2025
66.Кирилин А. Д., Сокова Н. Б., Чернышев Е. А. // Изв. РАН. Сер. хим. 1994, № 10, С.1798
67.В. Д. Шелудяков, Н. И. Кирилина, А. Д. Кирилин.// ЖОХ. 1982, т. 53, № 2, С.469
68.В. Д. Шелудяков, Э. Л. Котрикадзе, Л. М. Хананашвили, М. Г. Кузнецова, А. Б. Кисин, А. Д. Кирилин. //ЖОХ. 1981, т. 52, С.2481
69.В. Д. Шелудяков, А. Д. Кирилин, В. Ф. Миронов. //ЖОХ. 1977, т. 47, № 7, С.1515
70.В. Д. Шелудяков, академик АН БССР Я. М. Паушкин, Н. И. Кирилина, А. Д. Кирилин.// Доклады АН СССР. 1979. Т.246. № 5. С.1152-1155
71.А. Д. Кирилин, В. Д. Шелудяков, Е. Г. Горлов, В. Ф. Миронов. Прикладное использование кремнийорганических уретанов. НИИТЭХим., М., 2, 1979.
72.Миронов В.Ф., Шелудяков В. Д., Кирилин А.Д. //ЖОХ. 1976, т. 46, № 10, С.2396
73.А. Д. Кирилин, Л. О. Белова, А. В. Лега, А. С. Максимов, С. В. Петров, Е. А. Чернышев. //ЖОХ. 2005, т. 75, № 7, С.1227
74.Шелудяков В. Д., Кирилин А. Д., Гусев А. И., Шарапов В. А., Миронов В. Ф. //ЖОХ.1976, т. 46, № 12, С.2712.
75.Шелудяков В. Д., Родионов Е, С., Кирилин А. Д., Миронов В. Ф. //ЖОХ. 1976, т. 46, № 10, С.2265
76.Белова Л. О. Автореф. Дис…канд. хим. наук. М., 2003. 24с
77.Музовская Е. В., Козюков В. П., Миронов В. Ф. Органосилилпсевдогалогениды и их использование в органическом синтезе. М.: НИИТЭХим, 1985. 28с.
78.Музовская Е. В. Автореф. Дис…канд. хим. наук. М., 1988.24с
79.А. Д. Кирилин, Л. О. Белова, С.П. Князев, А. В. Лега, М. Ю. Петров, Е. А. Чернышев. //ЖОХ. 2005, т. 75, № 12, С.2021-2025
80.Бауков Ю. И., Крамарова Е. П., Шипов А. Г., Оленева Г. И., Артамкина О. Б., Албанов А. И., Воронков М. Г., Пестунович В. А. // ЖОХ. 1989. т. 59, № 1, С.127
81.Белоусова Л. И., Гостевский Б. А., Калихман И. Д., Вязанкина О. А., Банникова О. Б., Вязанкин Н. С., Пестунович В. А. // ЖОХ. 1988. т. 58, № 2, С.407
82.Воронков М. Г., Пестунович В. А., Бауков Ю. И. // Металлоорг. хим. 1991. т.4, № 6, С.1210
83.Погожих С. А., Овчинников Ю. Е., Крамарова Е. П., Негребецкий В. В., Шипов А. Г., Албанов А. И., Воронков М. Г., Пестунович В. А., Бауков Ю. И. //ЖОХ. 2004. т. 74, № 10, С. 1617-1624
84.В. Д. Шелудяков, Н. И. Кирилина, Э. Л. Котрикадзе, Л. М. Хананашвили, А. Д. Кирилин. //ЖОХ. 1981, т. 51, № 2, С.489
85.A. Pinner. Die Imidoether und ihre Derivate, Oppenheim, Berlin (1892).
86.Г. С. Гольдин, В. Г. Поддубный, А. А. Симонова, А. Б. Каменский, Г. С. Шор. ЖОХ. 1970. т. 40, № 6, С. 1288

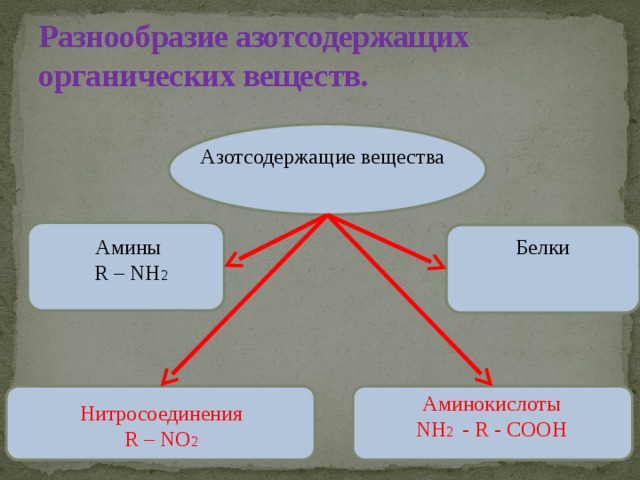
Как видно из названия, азотсодержащие соединения содержат хотя бы один атом азота в молекуле. К таким соединениям относятся, в частности, амины, аминокислоты и белки.
Амины
Амины — это производные аммиака, в молекуле которого один или более атомов водорода замещены на радикал:


Амины с небольшим числом атомов углерода в молекуле очень похожи на аммиак. Поэтому, описывая свойства аминов, полезно вспоминать аналогичные свойства аммиака (см. урок 14.2) Так, метиламин, как и аммиак — ядовитый газ с резким запахом, хорошо растворимый в воде.
Вопрос. Какую реакцию среды имеет раствор аммиака в воде?
Сравним взаимодействие аммиака с водой и амина с водой:

Вопрос. Какие свойства: основные или кислотные — проявляют растворы аммиака и аминов?
Совет. Составляя уравнения реакций первичного амина с водой (см. выше) или с кислотами (см. ниже), нужно прибегать к работе по аналогии. Посмотрите, чем отличается молекула первичного амина от молекулы аммиака? Одним радикалом. Поэтому замените и в молекуле амина, и в продуктах реакции один атом водорода в аммиаке на радикал. И всё получится. Так же поступайте и с более сложными аминами.
Поскольку амины, как и аммиак, проявляют свойства оснований, — они реагируют с кислотами:

Отметьте, как изменился состав аминогруппы.
Обратите внимание: в этих реакциях атом водорода кислоты добавляется к NH2-группе.
Амины могут вступать в реакцию и за счёт углеводородного радикала. Так, анилин вступает в реакцию замещения с бромом (аналогично реакции фенола или толуола с бромом):

Анилин необходим для синтеза многих красителей. Поэтому его в больших количествах получают восстановлением нитробензола при помощи реакции Зинина*:

* Зинин Николай Николаевич (25.08.1812–18.02.1880) — русский химик-органик, открыл (1842) реакцию восстановления ароматических нитросоединений, получив таким способом анилин (1842). В числе его учеников были А. М. Бутлеров, Н. Н. Бекетов и А. П. Бородин (по совместительству композитор).
Водород, необходимый для восстановления, получают при помощи реакции металла с кислотой:


Аминокислоты
Как видно из названия, молекулы аминокислот содержат две функциональные группы:

Простейшей аминокислотой является глицин:



Эти α-аминокислоты входят в состав белков. Всего в состав белков входит постоянно 20 аминокислот. Все они имеют особые названия, и все они α-аминокислоты.
Аминокислоты — это кристаллические вещества, хорошо растворимые в воде.
Вопрос. Какую реакцию среды имеет такой раствор?
Аминокислоты диссоциируют в растворе:

Ион водорода H + тут же вступает в реакцию с анионом:

В результате в растворе нет избытка ни ионов водорода, ни ионов гидроксила, т. е. среда нейтральная (рН = 7).
Вопрос. Какие свойства проявляет аминогруппа? карбоксильная группа?
Вопрос. Будет ли аминокислота реагировать с кислотой? с основанием?
Поскольку в состав аминокислоты входит оснОвная группа –NH2 и кислотная –СООН, аминокислоты могут реагировать и с кислотами:

и с основаниями:

Вопрос. Как называются вещества, реагирующие и с кислотами и с основаниями, если в результате образуется соль?
Таким образом, аминокислоты — амфотерные соединения, именно поэтому они могут реагировать друг с другом.
Вопрос. Какие вещества получаются при взаимодействии кислоты и основания?
В результате этой реакции отщепляется молекула воды. Для того чтобы составить уравнение такой реакции, записывайте формулы аминокислот так, чтобы СООН-группа одной молекулы находилась рядом с NH2-группой другой молекулы:

В эту реакцию может вступать и большее число молекул аминокислот. В результате образуется полипептид — основа любого белка.
Аминокислоты в живых организмах образуются при гидролизе белков или синтетическим путем из других соединений, например, их можно получить из галогенпроизводных кислот:

Задание 27.1. Назовите полученную аминокислоту.

Белки
Белки — это природные полимеры (высокомолекулярные вещества), состоящие из остатков α-аминокислот.
Эти остатки соединены в длинную цепь за счёт пептидных связей:

Атомы С–N образуют пептидную связь, которая соединяет остатки аминокислот в молекулах всех белков.
Эта полипептидная цепь определяет первичную структуру белка. Любое изменение первичной структуры белка влечёт за собой изменение всех свойств белка, так как формируется уже другой белок.
Длинная полипептидная цепь скручивается за счёт водородных связей в спираль:



Денатурация белка является причиной гибели микроорганизмов при стерилизации медицинских инструментов, консервов. Она же является причиной тяжёлых отравлений солями меди, ртути, свинца и другими ядами. Денатурация происходит и при варке мяса, яиц.
Более глубокие изменения, затрагивающие первичную структуру белка (полипептидную цепь) происходят при гидролизе белка: белок + Н2О → смесь аминокислот.
Белок входит в состав всех живых организмов и, значит, в состав многих пищевых продуктов: мясо, молоко, яйца, хлеб, картофель и т. д.
Обнаружить белок в растворе можно при помощи биуретовой реакции: раствор белка + CuSO4 + NaOH → фиолетовая окраска.
Большинство белков дают и ксантопротеиовую реакцию: так, если при неосторожном обращении с концентрированной азотной кислотой, капля её попадёт на кожу — появится несмываемое жёлтое пятно.
Биуретовая и ксантопротеиновая реакции — качественные реакции на белки.
Кроме того, реактивом на белок являются растворимые соли свинца, которые в щелочной среде образуют чёрный осадок.
И наконец, признаком присутствия белка в каком-либо материале может служить также появление характерного запаха при сжигании — запах палёного волоса, рога. Этот запах появляется, если поджечь волос, шерстяную нитку или кусочек натурального меха.

Выводы
Белки — это природные высокомолекулярные соединения, состоящие из остатков α-аминокислот. Аминокислоты содержат две функциональные группы, противоположные по свойствам, поэтому они могут реагировать друг с другом, образуя полипептиды. Аминокислоты образуются при гидролизе белков пищи (мясо, молоко, яйца, рыба), а затем из них образуются белки нашего организма (белки входят в состав всех органов и тканей нашего организма).

Азотсодержащие органические соединения — один из важнейших типов органических соединений. В их состав входит азот . Они содержат в молекуле связь углерод - водород и азот - углерод .
Амины и Анилин
Разнообразие азотсодержащих органических веществ.

Амины – органические производные аммиака , в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы:
RNH 2 , R 2 NH, R 3 N.
Группа – NH 2 называется аминогруппой.

История изучения аминов.
Первооткрывателями аминов считаются Ш.А. Вюрц и
А. В.Гофман (середина 19 века). Ученые получили первичные, вторичные и третичные амины.
Шарль Адольф Вюрц
Август Вильгельм Гофман

История изучения аминов.
Русский химик – органик. Открыл метод получения ароматических аминов восстановлением ароматических нитросоединений (реакция Зинина). Синтезировал анилин, заложил основы анилинокрасочной промышленности.
Николай Николаевич Зинин
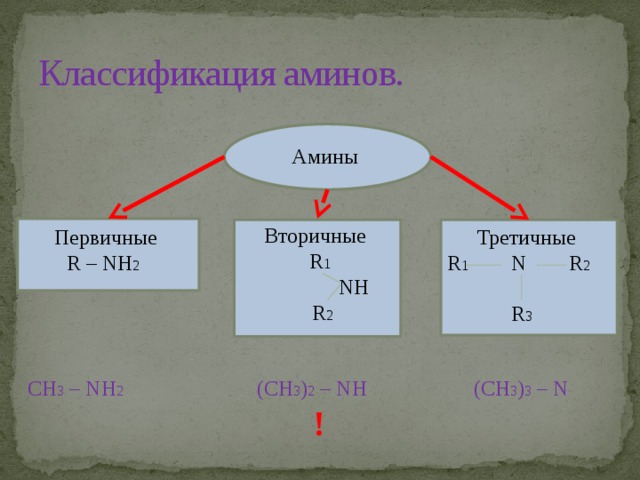
CH 3 – NH 2 (CH 3 ) 2 – NH (CH 3 ) 3 – N
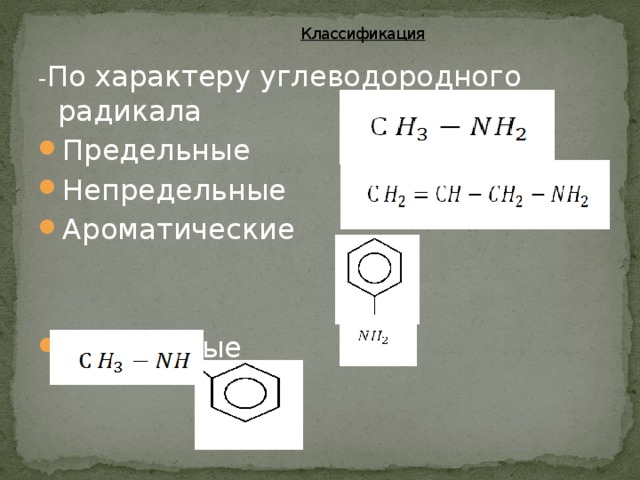
- По характеру углеводородного радикала
Номенклатура аминов
- В большинстве случаев названия аминов образуют из названий углеводородных радикалов и суффиксаамин.
CH 3 -NH 2 Метиламин CH 3 -CH 2 -NH 2 Этиламин
- Различные радикалы перечисляются в алфавитном порядке.
CH 3 -CH 2 -NH-CH 3 Метилэтиламин

Номенклатура аминов
- Первичные амины часто называют как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2.
бутан ди амин-1,3

Изомерия аминов
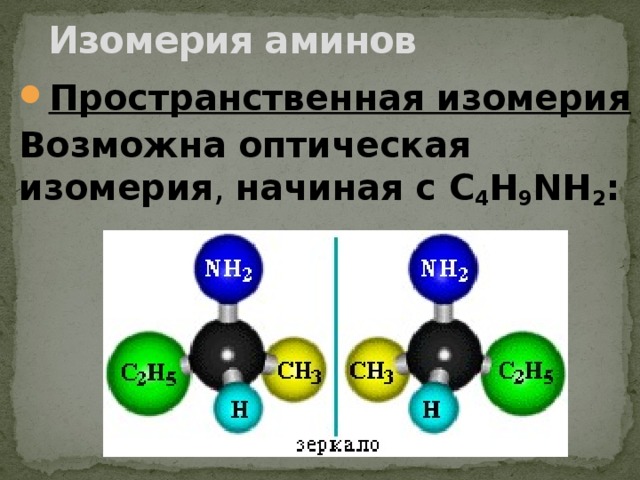
Изомерия аминов
Возможна оптическая изомерия , начиная с С 4 H 9 NH 2 :
Получение аминов.

Получение аминов.
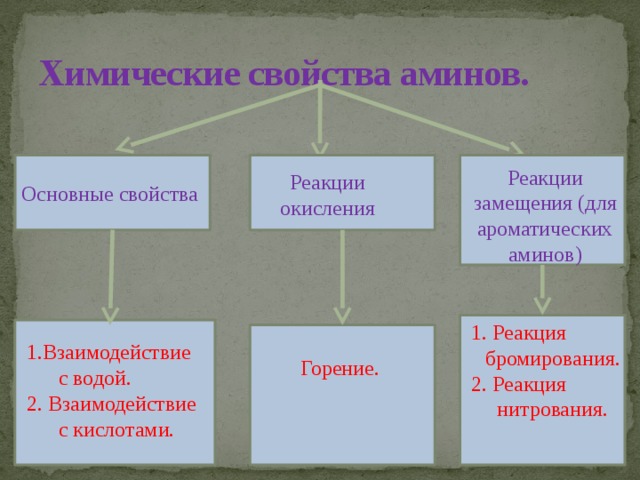
Химические свойства аминов.
Реакции замещения (для ароматических аминов)
1.Взаимодействие с водой.
2. Взаимодействие с кислотами.
![Химические свойства аминов. Взаимодействие с водой ( изменяют цвет индикаторов, проявляя основные свойства): CH 3 – NH 2 + H 2 O = [CH 3 NH 3 ] + + OH ˉ метиламмония 2. Взаимодействие с минеральными кислотами: CH 3 – NH 2 + HCl = [CH 3 NH 3 ] + Clˉ метиламмония хлорид 3. Реакция горения: 4CH 3 NH 2 + 9O 2 = 4CO 2 + 2N 2 + 10H 2 O Взаимодействие с бромной водой: C 6 H 5 NH 2 + 3Br 2 = C 6 H 2 Br 3 NH 2 ↓ + 3HBr 2,4,6-трибромамнилин (белый осадок)](https://fsd.multiurok.ru/html/2018/11/04/s_5bdf3e3589d06/img15.jpg)
Химические свойства аминов.
- Взаимодействие с водой ( изменяют цвет индикаторов, проявляя основные свойства):
CH 3 – NH 2 + H 2 O = [CH 3 NH 3 ] + + OH ˉ
2. Взаимодействие с минеральными кислотами:
CH 3 – NH 2 + HCl = [CH 3 NH 3 ] + Clˉ
3. Реакция горения:
4CH 3 NH 2 + 9O 2 = 4CO 2 + 2N 2 + 10H 2 O
C 6 H 5 NH 2 + 3Br 2 = C 6 H 2 Br 3 NH 2 ↓ + 3HBr
Применение аминов.

Представитель аминов ароматических – анилин .
Ароматические амины являются более слабыми основаниями, чем аммиак (влияние бензольного кольца).
Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот. Поэтому анилин взаимодействует лишь с сильными кислотами, а его водный раствор не окрашивает лакмус в синий цвет.
Таким образом, основные свойства изменяются в ряду:
C 6 H 5 NH 2 3 2 2 NH 3 N

История создания
Строение
C 6 H 5 NH 2 - анилин

Физические свойства
- Анилин - бесцветная маслянистая жидкость.
- Немного тяжелее воды, малорастворим в ней.
- Хорошо растворяется в этаноле и бензоле.
- При окислении на воздухе становится светло-коричневого цвета.
- Температура кипения – 174 С.
- Проявляет слабые основные свойства.
- Ядовит.

Получение
В промышленности анилин получают в две стадии. На первой стадии бензол нитруется смесью концентрированной азотной и серной кислот при температуре 50 - 60°C в результате образуется нитробензол. На втором этапе нитробензол гидрируют при температуре 200-300°C в присутствии катализаторов.
C 6 H 5 NO 2 + 3Н 2 → C 6 H 5 NH 2 + 2Н 2 О.

Другим способом получение анилина является восстановление нитро соединений-
Реакция Зинина :
C 6 H 5 NO 2 + 3(NH 4 ) 2 S → C 6 H 5 NH 2 +
6NH 3 + 3S + 2H 2 O

Применение
- В настоящий момент в мире основная часть (85%) производимого анилина используется для производства метилдиизоционатов (MDI), используемых затем для производства полиуретанов. Анилин также используется при производстве искусственных каучуков (9%), гербицидов (2%) и красителей (2%).
- В России он в основном применяется в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты).

2.6. Контрольные вопросы
1. Вещество CH 3 -NH-CH(CH 3 ) 2 относится к ряду …
2. Вещество, формула которого имеет вид C 6 H 5 -N(CH 3 ) 2 , называется …

2.6. Контрольные вопросы
3. Какую реакцию на индикатор показывают амины жирного ряда?
не действуют на индикатор
4. Характерной химической реакцией аминов, обусловленной наличием в их молекулах аминогруппы, является …
взаимодействие с кисло-тами с образованием солей

2.6. Контрольные вопросы
5. Какие реакции характерны для анилина?
а) C 6 H 5 NH 2 + Br 2 б) C 6 H 5 NH 2 + NaOH
в) C 6 H 5 NH 2 + HCl г) C 6 H 5 NH 2 + C 6 H 6
6. Определите массу хлорида фениламмония, если к анилину массой 13,95 г добавили хлороводород, выделившийся на первой стадии хлорирования метана объемом 5 л (при н.у.).
Читайте также:

