Анализ и оценка эффективности фармакотерапии реферат
Обновлено: 05.07.2024
С.А. Гридина, С.В. Поветкин
Курский государственный медицинский университет, Курск
Представлены результаты исследования фармакоэкономической эффективности применения свободных и фиксированных комбинаций антигипертензивных средств, применяемых у больных артериальной гипертензией высокого и очень высокого риска. Результаты проведенного исследования показали, что наибольшей экономической эффективностью по различным критериям гипотензивного действия обладала схема лечения с использованием фиксированной комбинации Экватор.
Артериальная гипертензия (АГ) является одной из наиболее значимых медико-социальных проблем Российской Федерации (РФ). АГ лидирует не только по распространенности, но и по затратам на ее лечение. В РФ ежегодный экономический ущерб, обусловленный временной или стойкой утратой трудоспособности, связанной с АГ или ее осложнениями, а также затраты на лечение и реабилитацию указанной категории больных превышают 30 млрд руб. и постоянно возрастают [11, 13].
Немалая доля расходов приходится на лекарственные препараты. За 10 лет стоимость терапии АГ увеличилась в 4 раза, что обусловлено повышением цен на современные антигипертензивные средства, несвоевременным обращением пациента за медицинской помощью, нерациональным выбором стартовой терапии, поражением органов-мишеней. В связи с этим выбор оптимальных с точки зрения не только клинической, но и фармакоэкономической эффективности препаратов – одна из важнейших медицинских и социальных задач [3, 9, 12, 14].
Целью работы стала фармакоэкономическая оценка эффективности свободных и фиксированных комбинаций (ФК) антигипертензивных средств, применяемых больными АГ высокого и очень высокого риска.
Материал и методы
В исследование были включены 120 больных АГ 2–3-й степеней, имеющих критерии высокого и очень высокого риска развития сердечно-сосудистых осложнений [4].
Критериями исключения из исследования были: наличие порока сердца, инфаркта миокарда, инсульта, стабильной стенокардии напряжения III–IV функциональных классов в период обследования или в анамнезе; наличие хронической сердечной недостаточности III–IV функциональных классов; нарушение ритма и проводимости сердца, требующие антиаритмической терапии; симптоматическая АГ; наличие хронической бронхолегочной патологии, сахарного диабета; сопутствующая патология, требующая постоянной медикаментозной терапии.
Пациентам, удовлетворяющим критериям включения в основную группу, в течение трехдневного плацебо-периода проведены клинические, лабораторные и инструментальные методы исследования, после чего пациенты были рандомизированы (стратификационным методом) в три группы, отличавшиеся стартовыми схемами фармакотерапии – фиксированная и свободные комбинации ингибитора ангиотензинпревращающего фермента и дигидропиридинового блокатора кальциевых каналов. В скрининговом периоде при необходимости пациенты могли использовать каптоприл. До скринингового периода от всех пациентов было получено информированное согласие на участие в исследовании.
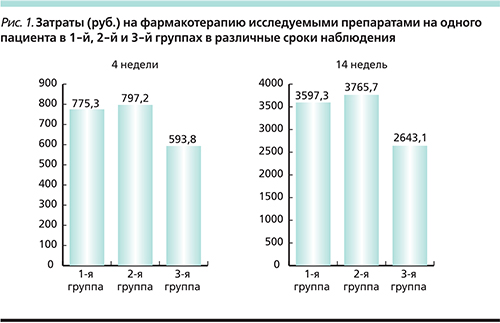
В каждой из трех групп проведено титрование доз препаратов, критерием увеличения которых было отсутствие достижения целевого артериального давления (АД) – менее 140/90 мм рт.ст. – оцениваемого при очередном визите пациента каждые 2 недели. Продолжительность фармакотерапии на второй и третьей ступенях лечения составила по 4 недели, на четвертой ступени – 6 недель. Общая длительность наблюдения – 14 недель.
В качестве критериев эффективности проводимого лечения, необходимых для проведения клинико-экономического анализа, использованы:
- степень (мм рт.ст.) снижения систолического, диастолического АД (САД и ДАД соответственно) у больных 1-й, 2-й и 3-й групп в конце 4-недельной фармакотерапии (вторая ступень лечения);
- степень (мм рт.ст.) снижения САД и ДАД у больных 1-й, 2-й и 3-й групп в конце 14-недельной фармакотерапии;
- частота достижения целевого АД у больных 1-й, 2-й и 3-й групп в конце 4- и 14-недельной фармакотерапии.
Статистическая обработка данных проведена с помощью программы Statistica v. 8.0 [1].
Результаты исследования
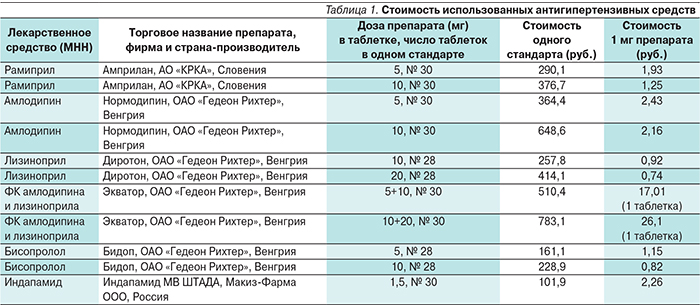
Данные о стоимости использованных в работе лекарственных препаратов представлены в табл. 1.
В конце 4-й недели фармакотерапии абсолютное большинство больных всех групп получали максимальные дозы препаратов второй ступени (в 1-й и 2-й группах по 38 человек, в 3-й группе –37 человек; р>0,05). В конце 14-недельного наблюдения вторая ступень терапии использована в отношении 52,5% больных 3-й группы, что значительно (р
Об авторах / Для корреспонденции
С.А. Гридина – Курский государственный медицинский университет, Курск
С.В. Поветкин – Курский государственный медицинский университет, Курск
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
АНАЛИЗ И ОЦЕНКА ЭФФЕКТИВНОСТИ ФАРМАКОТЕРАПИИ
Кожабекова Зауреш Хакимбековна
Ахметжанова Альбина Сериковна
Эффективная фармакотерапия опирается с одной стороны на точное представление о диагнозе и знание патогенетических основ заболевания, а с другой стороны на данные клинической фармакологии.
Теперь рассмотрим методы оценки эффективности и безопасности применения. К ним относиться: ретроспективный и проспективный анализ качества - контроль за использованием лекарственных средств , соблюдением совместимости; проведение фармакоэконмического анализа лекарственных средств с целью выбора наиболее эффетивных и наименее затратных наименовании; мониторинг нежелательных лекарственных реакций (НЛР).
Оценка названных критериев при длительном применении лекарственных средств должна осуществляться до, в начале и во время лечения. При изменении режима дозирования и при использовании лекарственных средств с малой широтой терапевтического действия, проведения такого контроля крайне необходимо.
В итоге, полноценный выбор лекарственных средств для проведения рациональной фармакотерапии может быть основан только на знании клинико – фармакологической характеристики (фармакодинамики, фармакокинетики, взаимодействия и нежелательных эффектов) лекарственных средств. Переходя от одного параметра характеристики к другому, врач находит правильное решение в клинической ситуации.
Существуют и проблемы фармакотерапии. Назовем их: неблагоприятные побочные реакций ; осложения , связанные с применением лекарственных средств; медицинские ошибки; неэффективность лекарственных средств; фальсификация лекарственных средств; влияние лекарственных средств на экологию; биологически - активные добавки – неконтролируемые по следствия.
Фармакотерапия должна быть эффективно и безопасной. С этой целью врач должен овладеть алгоритмом выбора лекарственных средств , его дозирование, знать методы оценки эффективности и безопасности лекарственных средств.
Значение медицинской сестры в лечебном процессе неоценимо. Медицинская сестра является связующим звеном между врачом и пациентом. Поэтому ориентируясь в арсенале лекарственных средств, зная механизм действия, показания к применению, побочные эффекты лекарственных средств, медицинская сестра может разъяснять больному, как и когда, принимать, то или иное лекарственное средство, успокоить и оказать необходимую помощь, при проявлении какого-либо побочного действия.
Список литературы
1.Рациональная фармакотерапия : справочник терапевта : рук. для практ. врачей / ред.-сост. Л. И. Дворецкий. - Москва : Литтерра, 2007. - (Рациональная фармакотерапия. Серия руководств для практикующих врачей. Т. 18). - Библиогр. в конце глав. Настоящее руководство для практикующих врачей-терапевтов не имеет аналогов
2. Востокова, Н. В. Система фармаконадзора в медорганизации [Текст] / Н. В. Востокова, Ю. А. Трахтенберг // Заместитель главного врача: лечебная работа и медицинская экспертиза. - 2017. - № 2. - С. 80-85.
3. Гуров, А. Н. Формирование перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи. Законодательные аспекты [Текст] / А. Н. Гуров, А. С. Бакланов, Н. А. Катунцева // Экономист лечебного учреждения. - 2016. - № 5. - С. 52-58. 35. Дьяков, И. Н.
4. Плавинский, С. Л. Фармакоэкономический анализ влияния на бюджетные расходы включения дексмедетомидина (дексдор) в список жизненно необходимых и важнейших лекарственных препаратов [Текст] / С. Л. Плавинский, П. И. Шабалкин, А. Е. Карелов // Вестник анестезиологии и реаниматологии. - 2015. - № 6. - С. 32-39
Для увеличения прибыли фармацевтическими компаниями предпринимаются самые разнообразные попытки воздействовать на медицинское сообщество и пациентов. Фармакокомпании активно работают с медицинскими ассоциациями, оказывают постоянное информационное давление на интернов, курсантов различных форм последипломного обучения, преподавателей медицинских и фармацевтических вузов — фармацевтическим компаниям экономически выгоднее работать с целыми группами лиц, определяющих медицинскую практику будущего [1,2,4-8].
При оценке достоверности информации можно полагаться на мнения экспертов, авторитетные руководства и справочники, однако это не всегда надежно из-за так называемого эффекта запаздывания — перспективные терапевтические методы внедряются в практику спустя значительное время после получения доказательств их эффективности/ С другой стороны, информация в учебниках, руководствах и справочниках зачастую устаревает еще до их публикации, а возраст проводящего лечение опытного врача отрицательно коррелирует с эффективностью лечения (Sackett D.L. et al., 1991). Известно, что в настоящее время в мире ежегодно публикуется около 2 млн. статей, не считая книг и материалов многочисленных конференций. Необходимость синтеза информации, представленной в виде обзора литературы по той или иной проблеме, очевидно. В этой ситуации чисто описательный подход к синтезу информации, имеющей место в несистематических или качественных обзорах литературы, не всегда оправдан. В таких исследованиях возникает большая вероятность β-ошибки (ложное утверждение об отсутствии значимого различия между эффективностью сравниваемых методов лечения, когда на самом деле они различаются. Классическим примером расхождения результатов описательного обзора литературы и ее систематического анализа (количественного анализа, или мета-анализа) является публикация вывода лауреата Нобелевской премии профессора Л.Полинга о снижении простудных заболеваний в результате применения аскорбиновой кислоты. Впоследствии этот вывод не был подтвержден результатами соответствующего мета-анализа.
Для оценки результатов проводимых исследований в настоящее время используется мета-анализ (используются статистические методы для объединения и обобщения результатов нескольких оригинальных исследований). Однако необходимо помнить, что неправильно проведенный мета-анализ может привести и к ошибочным результатам. Кроме мета-анализа в оценке медицинской информации используются систематические обзоры [8,9].
Клинические испытания лекарственных средств
Вероятно, именно ошибки в планировании исследований и анализе их результатов, а порой фальсификации последних стали причиной ряда гуманитарных катастроф, связанных с выпуском токсических препаратов, например раствора сульфаниламида в этиленгликоле (1937), а также талидомида (1961), который назначали в качестве седативного средства на ранних сроках беременности. В1962 г. талидомид был запрещён для медицинского применения. Спустя десятилетия в1998 г. талидомид получил одобрение американской FDA (Федеральная Комиссия по пищевым продуктам и лекарственным препаратам, Food and Drug Administration) для использования при лечении лепры, в настоящее время проводят его клинические испытания для терапии множественной рефрактерной миеломы и глиомы[4]/
При токсикологических доклинических исследованиях устанавливают характер и выраженность возможного повреждающего воздействия препаратов на экспериментальных животных. В токсикологических исследованиях выделяют три этапа: изучение острой токсичности вещества при однократном введении; определение хронической токсичности соединения, которое включает в себя повторные введения препарата на протяжении 1 года, а иногда и более; установление специфической токсичности препарата — онкогенности, мутагенности, эмбриотоксичности, включая тератогенное действие, аллергизирующих свойств, а также способности вызывать лекарственную зависимость [5,7].
Изучение повреждающего действия исследуемого препарата на организм экспериментальных животных позволяет определить, какие органы и ткани наиболее чувствительны к данному веществу и на что следует обратить особое внимание при клинических испытаниях. Однако нельзя забывать, что данные экспериментального исследования на животных не гарантируют полностью безопасность препарата для человека. Каждое лекарственное средство проходит IV фазы (этапа) клинических исследований.
Фаза I. Первый опыт применения нового активного вещества у человека. Чаще всего исследования начинаются у добровольцев (взрослые здоровые мужчины). Главная цель исследований – решить, стоит ли продолжать работу над новым препаратом, и, если удастся установить дозы, которые будут использоваться у пациентов во время II фазы клинических исследований. В ходе этой фазы исследователи получают предварительные данные о безопасности нового препарата и впервые описывают его фармакокинетику и фармакодинамику у человека. Иногда невозможно провести исследования I фазы у здоровых добровольцев из-за токсичности данного препарата (лечение онкологических заболеваний, СПИДа). В этом случае проводятся нетерапевтические исследования с участием пациентов с этой патологией в специализированных учреждениях.
Фаза II. Обычно это первый опыт применения у пациентов с заболеванием, для лечения которого предполагается использовать препарат. Вторая фаза делится на IIa и IIb. Фаза IIa – это терапевтические пилотные исследования (pilot studies), т.к. полученные в них результаты обеспечивают оптимальное планирование последующих исследований. Фаза IIb – это более обширные исследования у пациентов с заболеванием, которое является основным показанием к назначению нового лекарственного средства. Главная цепь – доказать эффективность и безопасность препарата. Результаты этих исследований (pivotal trial) служат основой для планирования исследований III фазы.
Фаза III. Многоцентровые испытания с участием больших (и, по возможности, разнообразных) групп пациентов (в среднем, 1000-3000 человек). Основная цель – получение дополнительных данных о безопасности и эффективности различных форм препарата, о характере наиболее частых нежелательных реакций и т.п. Чаще всего клинические исследования этой фазы – двойные слепые контролируемые, рандомизированные, а условия исследований максимально приближены к обычной реальной рутинной медицинской практике. Данные, полученные в клинических исследованиях III фазы, являются основой для создания инструкций по применению препарата и для решения об его регистрации Фармакологическим комитетом. Рекомендация к клиническому применению в медицинской практике считается обоснованной, если новый препарат
-более эффективен, чем известные препараты аналогичного действия;
-обладает лучшей переносимостью, чем известные препараты (при одинаковой эффективности)
-эффективен в тех случаях, когда лечение известными препаратами безуспешно;
-более выгоден экономически, имеет более простую методику лечения или более удобную лекарственную форму.
-при комбинированной терапии повышает эффективность уже существующих лекарственных средств, не увеличивая их токсичности.
Значение впечатления, которое производит на пациента врач и проводимые им манипуляции, хорошо известно из истории, по опыту Г.А. Захарьина (1829-1897). Этот выдающийся врач использовал следующую обстановку во время консультаций состоятельных пациентов. После осмотра профессор в одиночестве в специальной затемненной комнате обдумывал диагноз и лечение. В это время в доме должны были соблюдать полную тишину. От такой консультации впечатление, произведенное на больного и его близких, благоприятно отражалось на результатах лечения и позволяло врачу добиваться поразительных успехов.
Рандомизированные контролируемые испытания служат стандартом качества научных исследований эффективности лечения. Для исследования сначала отбираются пациенты из большого числа людей с изучаемым состоянием. Затем этих пациентов разделяют случайным образом на две группы, сопоставляемые по основным прогностическим признакам. Группы формируются случайным образом (рандомизация) путем использования таблиц случайных чисел, в которых каждая цифра или каждая комбинация цифр имеет равную вероятность отбора. Это означает, что пациенты одной группы будут в среднем обладать теми же характеристиками, что и пациенты другой. Кроме того, до проведения рандомизации следует убедиться в том, что характеристики заболевания, о которых известно, что они сильно влияют на исход, встречаются в экспериментальных и контрольных группах с одинаковой частотой. Для этого надо сначала распределить пациентов по подгруппам с одинаковым прогнозом и только затем рандомизировать их отдельно в каждой подгруппе — стратифицированная рандомизация. Экспериментальная группа (группа лечения) — подвергается вмешательству, которое, как ожидается, будет полезным. Контрольная группа (группа сравнения) – находится в точно таких же условиях, как и первая, за исключением того, что её пациенты не подвергаются изучаемому вмешательству 3.
В окончательных клинических испытаниях в качестве основного критерия оценки должен использовать истинный клинический исход – клиническое проявление, которое имеет существенное для больного значение и которого он хотел бы избежать. Например: cмерть, а также потеря зрения, необходимость применения искусственной вентиляции легких и иные явления, существенно снижающие качество жизни. Исследования, в которых изучаются такого рода клинические исходы, требуют значительных материальных и временных затрат.
С.А.Бабанов
Цель работы: изучить структуру ошибок фармакотерапии при реализации программы дополнительного лекарственного обеспечения в Приморском крае в 2006г., и рекомендации, даваемые врачами клиническим фармакологами по результатам экспертизы
Материал и методы: В течение 2006 года в ГУ ТФОМС ПК организована экспертиза качества оказываемой лекарственной помощи с привлечением внештатных экспертов, врачей клинических фармакологов.
Результаты:
При проведении экспертиз проанализировано 938 амбулаторных карт, в которых выявлено 1138 дефекта. Основными дефектами фармакотерапии были:
- назначение лекарственных средств (ЛС) без дополнительных методов обследования, предусмотренных стандартом медицинской помощи (110);
- назначение ЛС к заболеванию, не указанному в клиническом диагнозе (110);
- полипрагмазия (104);
- необоснованное назначение ЛС (65);
- назначение ЛС без указания способа приемадозы (87);
- нерациональное комбинирование ЛС (59);
- недостаточная оценка эффективности действия препарата (56);
- одновременное назначение 5 и более ЛС или более 10 ЛС за 1 месяц (47);
- политерапия (44);
- отсутствие возрастной корректировки доз у лиц пожилого или старческого возраста, а так же у больных с нарушением функции печени или почек (35);
- назначение ЛС без учета противопоказаний (34);
- назначение ЛС с неустановленной эффективностью (34); выписка лекарственных средств во время планового пребывания больного в стационаре (26);
- превышение курсовой дозы ЛС (25);
- необоснованное парентеральное применение ЛС в амбулаторных условиях (24);
- назначение ЛС без консультации узких специалистов (22);
- назначение ЛС, не входящих в стандарты лечения, без заключения ВК ЛПУ (3) и.т.д.
Наиболее часто клинические фармакологи давали рекомендации по усилению контроля за назначением ЛС льготной категории граждан, рациональным комбинированием ЛС (28).
В семи случаях экспертизы клинические фармакологи рекомендовали избегать полипрагмазии. Далее следуют рекомендации проводить мониторинг безопасности терапии (6), усиление контроля за соблюдением инструкции по использованию ЛС (6), усиление контроля за адекватным дозированием/режимом приема препарата (4). Три раза эксперты указывали на необходимость избегать назначения препаратов с недоказанной эффективностью, а так же рекомендации принять в штат ЛПУ врача клинического фармаколога для усиления контроля за рациональным назначением ЛС. По одному разу эксперты указывали на необходимость ограничения применения ЛС парентерально в амбулаторных условиях, оформления осмотра врача перед выпиской ЛС, необходимость проведения терапии жизненно важными препаратами там, где они необходимы, в полном объеме.
ИБС, стабильная стенокардия напряжения ІІІ ст. кардиосклероз атеросклеротический ІІІ ст., гипертоническая болезнь ІІ ст. остеохондроз п/к отдела позвоночника.
Жалобы больного при поступлении
Предъявляет жалобы на сжимающие боли в области сердца, головные боли, головокружение, снижение зрения, общую слабость, сонливость, мелькание мушек перед глазами, ощущение распирания. Также больной предъявляет жалобы на боли в коленных и голеностопных суставах.
Жалобы больного на момент осмотра
Предъявляет жалобы на головные боли, головокружение, снижение зрения, общую слабость.
История настоящего заболевания
Считает себя больным в течении 15 лет, когда начало повышаться АД, появились приступы стенокардии, за этот период неоднократно лечился по месту жительства. Поступил в связи с ухудшением состояния по направлению ЦРБ. В 2001 году оперировался по поводу ДГПЖ.
Ранение – контузия головного мозга средней степени тяжести.
Объективное состояние
Общее состояние – средней степени тяжести. Положение в постели – активное. Выражение лица – осмысленное. Поведение – обычное. Отношение к болезни – адекватное.
Сознание – ясное. Питание – нормальное. Конституция – астеническая.
Кожные покровы сухие, тургор несколько снижен.
Слизистые розовые влажные.
Периферические лимфатические узлы не увеличены, при пальпации безболезненны.
Выраженная деформация коленных и голеностопных суставов.
Органы дыхания
Нос прямой, дыхание через нос затруднено, наблюдается скудное слизисто-гнойное отделяемое. Гортань – деформаций нет, характер голоса нормальный. В акте дыхания обе половины грудной клетки участвуют равномерно и одинаково. Тип дыхания грудной. Вспомогательная мускулатура в акте дыхания не участвует. ЧДД – 16 дыхательных движений в мин. Грудная клетка при пальпации безболезненна, эластична. Голосовое дрожание одинаково с обеих сторон. Дыхание везикулярное, хрипов нет.
Сердечно – сосудистая система
Пульсаций и выбуханий шейных вен не наблюдается, "сердечный горб" отсутствует. Прекардиальная область при пальпации безболезненна.
Верхушечный толчок находится в V межреберье слева по передней подмышечной линии, разлитой.
Тоны сердца приглушенные, ритмичные, слабый систолический шум во всех точках. Пульс 68 в минуту. АД 150/90 мм рт. ст.
Органы пищеварения
Полость рта розовой окраски, без повреждений, суховатая. Язык розовый, влажный. Десны, мягкое и твердое небо розового цвета, влажные, без налетов, трещин, язв. Живот округлой формы, не увеличен, участвует в акте дыхания. Перистальтики желудка и кишечника не видно, венозные коллатерали на передней брюшной стенке отсутствуют. При поверхностной пальпации живот безболезненный, мягкий, напряжения мышц передней брюшной стенки не отмечается; опухолей, грыж, расхождений прямых мышц живота нет.
Выделительная система
Припухлостей, красноты в области проекции почек нет. Мочеиспускание частое (никтурия 6-7 раз). Почки пальпаторно не определяются. Симптом Пастернацкого отрицательный с обеих сторон.
Проводимая фармакотерапия
Цинаризин 1 таб. 3 раза в день
Нифедипин 1 таб. 3 раза в день
Диклофенак 1 таб. 3 раза в день
Sol. Pyracetamy 5,0
Sol. Vit. B12 200 мг в/м
заключение
Фармакологическое действие
Блокатор кальциевых каналов IV класса с преимущественным влиянием на сосуды головного мозга, производное пиперазина. Улучшает мозговое, а также коронарное и периферическое кровообращение. Нарушает поступление ионов кальция в гладкомышечные клетки сосудов. Снижает тонус гладкой мускулатуры артериол, уменьшает реакции на биогенные сосудосуживающие вещества (адреналин, норадреналин, брадикинин). Уменьшает возбудимость вестибулярного аппарата. У пациентов с нарушением периферического кровообращения улучшает кровоснабжение и потенцирует постишемическую гиперемию. Повышает устойчивость тканей к гипоксии.
Фармакокинетика
После приема внутрь циннаризин абсорбируется из ЖКТ, максимальная концентрация в плазме достигается через 1-4 ч. Связывание с белками плазмы составляет 91%. Подвергается метаболизму. Период полувыведения составляет 3-6 ч. Выводится через кишечник главным образом в неизмененном виде, с мочой - преимущественно в виде метаболитов.
Показания
Нарушения мозгового кровообращения (в т.ч. при остаточных явлениях после инсульта). Лабиринтные расстройства (в т.ч. для поддерживающей терапии при головокружении, шуме в ушах, нистагме, тошноте и рвоте лабиринтного происхождения). Болезнь движения (как профилактическое средство). Профилактика приступов мигрени. Болезнь Меньера. Профилактика и лечение нарушений периферического кровообращения - облитерирующий атеросклероз, облитерирующий тромбангиит, болезнь Рейно, диабетическая ангиопатия, акроцианоз.
Режим дозирования
Индивидуальный. Принимают внутрь по 25-50-75 мг 3 раза/сут после еды. При необходимости лечение можно начинать с 1/2 дозы, постепенно ее увеличивая. Для достижения оптимального терапевтического эффекта применяют непрерывно в течение нескольких месяцев.
Диклофенак
Фармакологическое действие
НПВС, производное фенилуксусной кислоты. Оказывает выраженное противовоспалительное, анальгезирующее и умеренное жаропонижающее действие. Механизм действия связан с угнетением активности ЦОГ - основного фермента метаболизма арахидоновой кислоты, являющейся предшественником простагландинов, которые играют главную роль в патогенезе воспаления, боли и лихорадки. Анальгезирующее действие обусловлено двумя механизмами: периферическим (опосредованно, через подавление синтеза простагландинов) и центральным (за счет ингибирования синтеза простагландинов в центральной и периферической нервной системе). При ревматических заболеваниях уменьшает боли в суставах в покое и при движении, а также утреннюю скованность и припухлость суставов, способствует увеличению объема движений. При травматических и послеоперационных болях препарат уменьшает болевые ощущения в покое и при движении, а также воспалительный отек. Подавляет агрегацию тромбоцитов. При длительном применении оказывает десенсибилизирующее действие. По активности превосходит напроксен. При местном применении в офтальмологии уменьшает отек и боль при воспалительных процессах неинфекционной этиологии.
Фармакокинетика
После приема внутрь всасывается из ЖКТ. Прием пищи замедляет скорость всасывания, степень абсорбции при этом не меняется. Около 50% активного вещества метаболизируется при "первом прохождении" через печень. При ректальном введении абсорбция происходит медленнее. Время достижения максимальной концентрации в плазме после приема внутрь составляет 2-4 ч в зависимости от применяемой лекарственной формы, после ректального введения - 1 ч, в/м введения - 20 мин. Концентрация активного вещества в плазме находится в линейной зависимости от величины применяемой дозы. Не кумулирует. Связывание с белками плазмы составляет 99.7% (преимущественно с альбумином). Проникает в синовиальную жидкость, максимальная концентрация достигается на 2-4 ч позже, чем в плазме. В значительной степени метаболизируется с образованием нескольких метаболитов, среди которых два фармакологически активны, но в меньшей степени, чем диклофенак. Системный клиренс активного вещества составляет примерно 263 мл/мин. Период полувыведения из плазмы составляет 1-2 ч, из синовиальной жидкости - 3-6 ч. Приблизительно 60% дозы выводится в виде метаболитов почками, менее 1% экскретируется с мочой в неизмененном виде, остальная часть выводится в виде метаболитов с желчью.
Показания
Суставной синдром (ревматоидный артрит, остеоартрит, анкилозирующий спондилит, подагра), дегенеративные и хронические воспалительные заболевания опорно-двигательного аппарата (остеохондроз, остеоартроз, периартропатии), посттравматическое воспаление мягких тканей и опорно-двигательного аппарата (растяжения, ушибы). Боли в позвоночнике, невралгии, миалгии, артралгии, болевой синдром и воспаление после операций и травм, болевой синдром при подагре, головная боль при мигрени, альгодисменорея, болевой синдром при аднексите, проктите, колики (желчная и почечная), болевой синдром при инфекционно-воспалительных заболеваниях ЛОР-органов. Для местного применения: ингибирование миоза во время операции по поводу катаракты, профилактика цистоидного макулярного отека, связанного с удалением и имплантацией хрусталика, воспалительные процессы глаза неинфекционной природы, посттравматический воспалительный процесс при проникающих и непроникающих ранениях глазного яблока.
Режим дозирования
Для приема внутрь для взрослых разовая доза составляет 25-50 мг 2-3 раза/сут. Частота приема зависит от применяемой лекарственной формы, тяжести течения заболевания и составляет 1-3 раза/сут, ректально - 1 раз/сут. Для лечения острых состояний или купирования обострения хронического процесса применяют в/м в дозе 75 мг. Для детей старше 6 лет и подростков суточная доза составляет 2 мг/кг. Наружно применяют в дозе 2-4 г (в зависимости от площади болезненного участка) на пораженное место 3-4 раза/сут. При применении в офтальмологии частота и длительность введения определяются индивидуально. Максимальные дозы: при приеме внутрь для взрослых - 150 мг/сут.
Нифедипин
Фармакологическое действие
Селективный блокатор кальциевых каналов II класса, производное дигидропиридина. Тормозит поступление кальция в кардиомиоциты и клетки гладкой мускулатуры сосудов. Оказывает антиангинальное и гипотензивное действие. Снижает тонус гладкой мускулатуры сосудов. Расширяет коронарные и периферические артерии, снижает ОПСС, АД и незначительно - сократимость миокарда, уменьшает постнагрузку и потребность миокарда в кислороде. Улучшает коронарный кровоток. Практически не обладает антиаритмической активностью. Не угнетает проводимость миокарда.
Фармакокинетика
При приеме внутрь быстро всасывается из ЖКТ. Подвергается метаболизму при "первом прохождении" через печень. Связывание с белками составляет 92-98%. Метаболизируется в печени с образованием неактивных метаболитов. Период полувыведения - около 2 ч. Выводится преимущественно почками в виде метаболитов и в следовых количествах в неизмененном виде; 20% выводится через кишечник в виде метаболитов.
Показания
Профилактика приступов стенокардии (в т.ч. вазоспастической стенокардии), в отдельных случаях - купирование приступов стенокардии; артериальная гипертензия, гипертонические кризы; болезнь Рейно.
Режим дозирования
Индивидуальный. Для приема внутрь начальная доза - по 10 мг 3-4 раза/сут. При необходимости дозу постепенно увеличивают до 20 мг 3-4 раза/сут. В особых случаях (вариантная стенокардия, тяжелая артериальная гипертензия) на короткое время дозу можно увеличить до 30 мг 3-4 раза/сут. Для купирования гипертонического криза, а также приступа стенокардии можно применять сублингвально по 10-20 мг (редко 30 мг). В/в для купирования приступа стенокардии или гипертонического криза - по 5 мг в течение 4-8 ч. Внутрикоронарно для купирования острых спазмов коронарных артерий вводят болюсом 100-200 мкг. При стенозах крупных коронарных сосудов начальная доза составляет 50-100 мкг. Максимальные дозы: при приеме внутрь - 120 мг/сут, при в/в введении - 30 мг/сут.
Витамин Е
Фармакологическое действие
Витамин E. Оказывает антиоксидантное действие, участвует в биосинтезе гема и белков, пролиферации клеток, тканевом дыхании, других важнейших процессах тканевого метаболизма, предупреждает гемолиз эритроцитов, препятствует повышенной проницаемости и ломкости капилляров.
Показания
Гиповитаминоз, состояния реконвалесценции после заболеваний, протекавших с лихорадочным синдромом, высокие физические нагрузки, пожилой возраст, заболевания связочного аппарата и мышц. Климактерические вегетативные нарушения. Неврастения при переутомлении, астенический неврастенический синдром, первичная мышечная дистрофия, посттравматическая, постинфекционная вторичная миопатия. Дегенеративные и пролиферативные изменения суставов и связочного аппарата позвоночника и крупных суставов.
Режим дозирования
Обычно назначают по 100-300 мг/сут. При необходимости дозу можно увеличить до 1 г/сут.
Эффективность проведенной фармакотерапии
За время пребывания больного в стационаре его состояние значительно улучшилось, снизились цифры АД, уменьшилась частота возникновения болей в области сердца, исчезли головные боли, головокружение, сонливость, улучшилось общее самочувствие. Также больной отмечает некоторое улучшение зрения, снижение болезненности суставов.
Это свидетельствует об адекватности применяемой фармакотерапии.
безопасность проводимой фармакотерапии
Возможные побочные эффекты применяемых препаратов.
Со стороны пищеварительной системы: возможны диспептические явления, сухость во рту; редко - холестатическая желтуха. Со стороны ЦНС: головные боли, сонливость; у пациентов старческого возраста при длительном применении возможны экстрапирамидные симптомы, депрессия. Аллергические реакции: редко - кожная сыпь. Прочие: увеличение массы тела, усиление потоотделения; в единичных случаях - волчаночноподобный синдром, красный плоский лишай.
Со стороны пищеварительной системы: возможны тошнота, рвота, анорексия, боли и неприятные ощущения в эпигастральной области, метеоризм, запор, диарея; в отдельных случаях - эрозивно-язвенные поражения, кровотечения и перфорации ЖКТ; редко - нарушение функции печени. При ректальном введении в единичных случаях отмечались воспаление толстой кишки с кровотечением, обострение язвенного колита. Со стороны ЦНС и периферической нервной системы: возможны головокружение, головная боль, возбуждение, бессонница, раздражительность, чувство усталости; редко - парестезии, нарушения зрения (расплывчатость, диплопия), шум в ушах, расстройства сна, судороги, раздражительность, тремор, психические нарушения, депрессия. Со стороны системы кроветворения: редко - анемия, лейкопения, тромбоцитопения, агранулоцитоз. Со стороны мочевыделительной системы: редко - нарушение функции почек; у предрасположенных пациентов возможны отеки. Дерматологические реакции: редко - выпадение волос. Аллергические реакции: возможны кожная сыпь, зуд; при применении в форме глазных капель - зуд, покраснение, фотосенсибилизация. Местные реакции: в месте в/м введения возможно жжение, в отдельных случаях - образование инфильтрата, абсцесса, некроз жировой ткани; при ректальном введении возможны местное раздражение, появление слизистых выделений с примесью крови, болезненная дефекация; при наружном применении в редких случаях - зуд, покраснение, сыпь, жжение местного характера; при местном применении в офтальмологии возможны преходящее чувство жжения и/или временная нечеткость зрения сразу после закапывания. При длительном наружном применении и/или нанесении на обширные поверхности тела возможны системные побочные эффекты вследствие резорбтивного действия диклофенака.
Со стороны сердечно-сосудистой системы: возможны гиперемия кожных покровов, ощущение тепла, тахикардия, артериальная гипотензия, периферические отеки; редко - брадикардия, желудочковая тахикардия, асистолия, усиление приступов стенокардии. Со стороны пищеварительной системы: тошнота, изжога, диарея; редко - ухудшение функции печени; в единичных случаях - гиперплазия десен. При длительном приеме в высоких дозах возможны диспептические симптомы, повышение активности печеночных трансаминаз, внутрипеченочный холестаз. Со стороны ЦНС и периферической нервной системы: головная боль. При длительном приеме в высоких дозах возможны парестезии, боли в мышцах, тремор, легкие расстройства зрения, нарушения сна. Со стороны системы кроветворения: в единичных случаях - лейкопения, тромбоцитопения. Со стороны мочевыделительной системы: увеличение суточного диуреза. При длительном приеме в высоких дозах возможны нарушения функции почек. Со стороны эндокринной системы: в единичных случаях - гинекомастия. Аллергические реакции: возможна кожная сыпь. Местные реакции: при в/в введении возможно жжение в месте инъекции. В течение 1 мин после внутрикоронарного введения возможно проявление отрицательного инотропного действия нифедипина, увеличение ЧСС, артериальная гипотензия; эти симптомы постепенно исчезают через 5-15 мин.
Аллергические реакции. При приеме в высоких дозах - диарея, боли в эпигастрии.
Читайте также:

