Альтернативный сплайсинг его значение реферат
Обновлено: 05.07.2024
Многие гены состоят из экзонов - кодирующие участки и интронов – некодирующие участки. При транскрипции с гена считывается РНК несущая как экзоны, так и интроны. В процессе сплайсинга интроны вырезаются, а экзоны сшиваясь образуют зрелую РНК.
Характеристика экзонов и интронов некоторых генов.
Сплайсосомы
У эукариот в большинстве кодирующих белки РНК интроны вырезаются в сплайсосомах - комплексах, состоящих из пяти малых ядерных нуклеопротеинов (snRNP, или SNURPs - снурпс). Интроны содержат последовательности, необходимые для вырезания - 3'-сайт (акцепторный), 5'-сайт (донорный) и бранч-сайт (см. рис.2). РНК в snRNA взаимодействует с этими сайтами, способствуя вырезанию интронов.
рис.2 Консервативные последовательности в экзонах и интронах необходимые для сплайсинга.
Обнаружено два типа сплайсосом - большие и малые, состоящие из разных snRNP.
Большие сплайсосомы состоят из U1, U2, U4, U5 и U6 snRNP; транскрипция U1-U5 РНК осуществляется РНК-полимеразой II, а U6 - РНК полимеразой III. Вырезают интроны имеющие GU на 5'-сайте и AG на 3'-сайте. U1 связываются с 5'-сайтом, U2 связываются с бранч-сайтом и U6. U4 ингибирует U6, инактивируя сплайсосому. U5 связывает U1 и U2 при образовании 'лассо'. При активации U6, U1 перемещается и связывает U2. U2-U6 формируют активный католитический комплекс (см. рис.3).
рис.3 Сплайсосома и взаимодействие ее компонентов с экзонами и интронами РНК.
Малые сплайсосомы. Сплайсируют РНК, содержащие AU 3'- и AC 5'-концы интронов. Cостоят из U11, U12, U4atac, U6atac и U5 - одинакового для больших и малых сплайсосом.
рис.4 Механизм удаления интронов.
Малые РНК. sРНК 103-105 копий на клетку, обогащены урацилом U1, U2. 100-300н, кодируются в ядре, но работают как в ядре (small nuclear - SN), так и в цитоплазме (small cytoplasmic - SC)
SNURPS - РНП (рибонуклеопротеидные комплексы) в ядре. snРНК входят в состав РНП, участвующих в полиаденилированиии и сплайсинге | SCURPS - РНП в цитоплазме, входят в состав информосом | U4 в комплексах, участвующих в полиаденилировании (при красной волчанке (аутоимунном заболевании) вырабатываются антитела к белкам комплекса с U4 нет полиаденилирования и сплайсинга) | Гистоновая mРНК не полиаденилируется т.к sРНКU7, комплементарная 3'-концу гистоновой mРНК, защищает ее от полиаденилирования.
Сплайсинг может иметь позитивную и негативную регуляцию. При позитивной регуляции из первичного транскрипта вырезается интрон при действии белка активатора. При негативной первичный транскрипт не подвергается сплайсингу при действии
белка репрессора.
Транс-сплайсинг
Транс-сплайсинг - форма
сплайсинга, при которой соединяются РНК разных транскриптов.
Альтернативный сплайсинг
mРНК кальцитонинового гена у млекопитающих (крыса)
Во всех клетках есть кальцитониновый ген, но в клетках щитовидной железы он экспрессируется в виде гормона кальцитонина, а в клетках гипофиза - нейропептида CGRP (пептида, имеющего отношение к гену кальцитонина). Ген один, а белки получаются разные в результате сплайсинга mРНК и процессинга полипептидов. В клетках других тканей этот ген не экспрессируется.
Сплайсинг осуществляется белковыми комплексами – сплайсосомами-ферменты, вырезающие и сшивающие участки про-mРНК, белки, придающие про-mРНК нужную конформацию, sPНК. Сплайсосома связана с ферментами полиаденилирования.
рис. Схема образования различных мРНК из
одного тропомиозинового гена в различных клетках.
Автосплайсинг
Автосплайсинг - вид сплайсинга, когда интроны кодируют рибозимы - РНК с каталитической активностью, выполняющие роль сплайсосомы. Имеются три группы интронов кодирующих рибозимы Group I, II и III. Group II и III выполняют роль сплайсосомы без привлечения
других белков.
Автосплайсинг открыт Томасом Чеком (США) в 1982 году. Он работал с инфузорией
Tetrаchymenа thermophyla
. У этой инфузории образуется 35S про-rРНК длиной 6400 нуклеотидов. Без участия дополнительных соединений белковой природы из этой про-rРНК вырезается внутренний участок длиной в 414 нуклеотида. Два экзона сшиваются с образованием 26S rРНК. Единственное требование - определенная концентрация ионов магния. Про-rРНК имеет третичную структуру и обладает каталитичекой активностью. Впервые было показано, что каталитической активностью
обладают не только белки.
Small nuclear RNAs (snRNAs), ranging in size from about 80 to 350 nucleotides, are ubiquitous components of eukaryotic cells. The U (uridine-rich) family of snRNAs are thought to be important for RNA splicing and have been highly conserved in evolution. They are associated with specific polypeptides, forming small nuclear ribonucleoprotein complexes (snRNPs). These are often targets of the autoimmune disorder systemic lupus erythematosus. The polypeptide associated with U1 snRNA appears to be unique (Wooley et al., 1983). Multigene families for human U1, U2, U3, U4 and U6 snRNAs have been demonstrated. Transcription of U1-U5 RNAs is accomplished by RNA polymerase II, whereas U6 snRNA is thought to be transcribed by RNA polymerase III. Kunkel and Pederson (1988) studied the upstream regulatory elements for the human U6 RNA gene and found a marked similarity to the proximal control elements of U1 and U2 snRNA genes, despite the transcription by different polymerases. Most of the human genes complementary to these snRNAs are pseudogenes, which are dispersed in the genome. Although most of the U1 genes are on chromosome 1, they probably are separated by intergenic spacer regions larger than 15 kb, because none of the recombinant phages isolated to date contains more than one U1 gene. By way of contrast, U2 snRNA genes are organized as a nearly perfect tandem array of 10 to 20 copies per haploid genome (Van Arsdell and Weiner, 1984). Bostock et al. (1984) concluded that the genes for human U1 snRNA are clustered on the short arm of chromosome 1. By somatic cell hybrid studies, Naylor et al. (1984) found that RNU1 segregated with PEPC (170000) and AK2 (103020), chromosome 1 markers. By in situ hybridization, they showed that most of the grains were concentrated in band 1p36.3. By in situ hybridization, Lindgren et al. (1985) found that the U1 snRNA pseudogenes (called class I) are coded in a cluster in 1q12-q22, separate from the true genes (in about 30 copies) in 1p36. Bernstein et al. (1985) presented evidence in support of the idea that the true U1 genes were derived by gene amplification and transposition from a more ancient family of U1 genes (represented now by class I U1 pseudogenes). The clustering of both U1 true genes and pseudogenes and the conservation of at least 44 kb of DNA flanking the U1 coding region in a large fraction of the 30 true U1 genes
are explained by gene amplification.
Pseudogenes for U1 snRNA outnumber the true genes by 15- to 30-fold. Some of the pseudogenes have no flanking homology to the true genes, but others, the class I pseudogenes, share several kilobases of flanking homology. Lindgren et al. (1985) noted that the site of the U1 pseudogenes corresponds to a site of chromosomal modification by adenovirus-12. They postulated that class I U2 pseudogenes may be affected by the virus because they retain flanking regulatory sequences.
Сплайсинг(от англ. splice-соединять, сращивать) - удаление из молекулы РНК нитронов (участков РНК, которые практически не несут генетической информации) и соединение оставшихся участков, несущих генетическую информацию (экзонов), в одну молекулу. Катализируется сплайсосомой – комплексом белков и РНК. (по презентации)
94% человеческих генов подвергаются альтернативному сплайсингу, причем в разных тканях производятся разные наборы белков. Благодаря этому разнообразие белков в организме млекопитающих значительно выше, чем у низших животных, хотя количество генов у тех и других примерно одинаково.
В остальных 6% генов Ч. просто нет интронов! Интроны – не просто разделители экзонов, а регуляторные участки, в которых зашифрованы инструкции по считыванию экзонов!
Если сплайсинг – еще одна возможность регуляции синтеза белков, то перетасовка экзонов при альтернативном сплайсинге (чаще добавление новых участков к старым) для выработки новых белковых продуктов – важнейшее приобретение в ходе эволюции эукариот

Сплайсинг - один из этапов образования функционально активных молекул РНК (процессинг РНК) из их предшественников[1], который осуществляется после завершения транскрипции (синтез РНК на ДНК-матрице). В результате удаления каждого интрона[2] происходит разрыв двух фосфодиэфирных связей с последующим образованием одной новой.
Механизмы сплайсинга у различных классов РНК различаются между собой. Для всех них характерна точность удаления интронов и соединения экзонов[3].
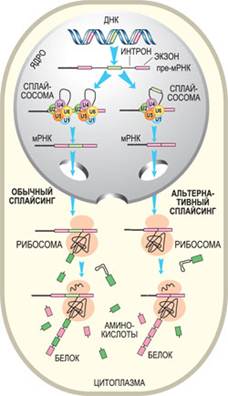
Альтернативный сплайсинг Википедия — процесс, позволяющий одному гену производить несколько мРНК и, соответственно, белков. Большинство генов в эукариотических геномах содержат экзоны и интроны. После транскрипции в процессе сплайсинга интроны удаляются из пре-мРНК. А вот экзон может включаться (или нет) в состав конечного транскрипта. Таким образом, с помощью альтернативного сплайсинга можно получить множество транскриптов, а, следовательно, и белков. Объединение различных сайтов сплайсинга позволяет индивидуальным генам экспрессировать множество мРНК, которые кодируют белки, порой, с антагонистическими функциями. Экзон одного варианта сплайсинга может оказаться интроном в альтернативном пути. Разные варианты сплайсинга могут приводить к образованию разных изоформ одного и того же белка. Например, ген тропонина состоит из 18 экзонов и кодирует многочисленные изоформы этого мышечного белка. Разные изоформы тропонина образуются в разных тканях и на определенных стадиях их развития.
Сущность альтернативного сплайсинга заключается в том, что в результате посттранскрипционного процессинга предшественника мРНК, из которого в результате сплайсинга вырезаются некодирующие последовательности нуклеотидов, соответствующие интронам транскрибированного гена, образуются зрелые мРНК, различающиеся по своей первичной структуре. В результате в разных клетках из одного и того же предшественника получаются молекулы зрелых мРНК, которые объединяют в различных комбинациях последовательности экзонов транскрибированного гена.
Известно, что у человека гигантское разнообразие белков достигается не путем увеличения числа белок-кодирующих генов, а за счет альтернативного сплайсинга — комбинирования разных участков одного и того же гена. Большая интернациональная группа ученых сравнила разнообразие и частоту сплайсинговых вариантов у представителей разных эволюционных линий позвоночных. Они обнаружили, что у всех приматов, а не только у человека, частота сплайсинга примерно в полтора-два раза выше, чем у мыши и других четвероногих. Какую бы ткань мы ни взяли, разнообразие альтернативных вариантов сплайсинга у приматов будет выше, чем у мыши, а у мыши будет выше, чем у лягушки. То есть особенности картины сплайсинга определяются не типом ткани, а биологическим видом. Накопление вариантов сплайсинга идет быстрее, чем изменение белок-кодирующих генов, во всех видах тканей, хотя соотношение скоростей того и другого процесса неоднородно для разных типов тканей. Эти закономерности существенно продвигают исследования новой темы: формообразование и эволюция путем альтернативного сплайсинга.
Альтернативный сплайсинг — устрашающий термин, обозначающий довольно простое и важное биологическое явление. Его суть состоит в том, что считанная с ДНК последовательность РНК в ходе последующей обработки — созревания — может быть по-разному реорганизована. Сырая, незрелая РНК, или РНК-транскрипт, состоит из экзонов и интронов — смысловых и бессмысленных частей. В ходе созревания РНК интроны вырезаются, а экзоны — смысловые части — сшиваются, и получается зрелая матричная РНК определенного белка. Этот процесс называется сплайсингом. Однако есть тут одна хитрость. Сшиваться могут не все экзоны, и в разных условиях разные экзоны отбрасываются вместе с интронами. В результате этой сшивки получаются разные варианты, или изоформы, того или иного белка, а весь процесс носит название альтернативного сплайсинга. Таким образом, из одного гена может быть в конечном итоге получено несколько разных белков.
В основе исследования лежало эмпирическое знание, что специфичность тканей и строения клеток в тканях обеспечивается вариациями сплайсинга одних и тех же генов. Это означает, что эволюция сплайсинга может нацеливаться на совершенствование тканевых функций, а может исходить из необходимостей и истории конкретного вида. В первом случае у разных животных в одной и той же ткани, например в клетках печени, будут реализованы сходные варианты сплайсинга. Эти варианты будут разниться со сплайсингом в другой ткани, например в мышечной, но в то же время мышечные ткани человека и мыши окажутся схожими. Во втором случае сплайсинг в печени и мышцах у человека обнаружит больше общего, чем сплайсинг в одной и той же ткани у человека и мыши (рис. 1).


Рис. 1. Схема, отражающая идеологию исследования. Светло-желтый экзон может присутствовать или отсутствовать в зрелой матричной РНК (такой экзон называют кассетным), в результате чего получаются разные версии белков (показаны зелеными и розовыми шариками) в тканях животных. Сплайсинг может зависеть от биологического вида (правые, верхние, ряды шариков), а может определяться спецификой тканей (нижние, левые, ряды шариков). Изображение из синопсиса к обсуждаемой статье в Science
Ученые определили РНК-транскрипты из разных тканей (коры мозга, мозжечка, переднего мозга, сердца, мышц, печени, почек и семенников) девяти видов животных и человека. Также определили все возможные варианты сплайсинга в родственных (ортологичных) генах у всех 10 видов. На основе этой информации выявили долю общих экзонов, которые участвуют в альтернативном сплайсинге в разных тканях у разных видов. Оказалось, что у человека и обезьян частота сплайсинга примерно в два раза больше, чем у всех других животных, какую бы ткань мы ни взяли. Самую сложную сплайсинговую комбинаторику продемонстрировали гены белков цитоскелета.

Рис. 2. Частота случаев альтернативного сплайсинга в ортологичных генах у разных животных и человека по отношению к минимальному разнообразию (к частоте таких случаев в почках лягушки). По оси абсцисс отложено время расхождения эволюционных линий позвоночных, представленных в данном исследовании. Во всех тканях (они обозначены разными цветами) у приматов примерно в два раза выше частота альтернативного сплайсинга. Изображение из обсуждаемой статьи в Science
Авторы исследования заключают также, что разнообразие альтернатив накапливается по ходу эволюционного развития. Действительно, как хорошо видно из рисунка 2, у млекопитающих по мере углубления в эволюционную историю число сходных с человеком сплайсинговых вариантов снижается. Чем ближе к человеку и другим приматам — а это последняя отделившаяся филогенетическая линия в этом ряду, — тем меньше различий в вариантах сплайсинга. Значит, частота и разнообразие альтернативного сплайсинга эволюционируют по ходу изменения и адаптации представителей филогенетической линии, а не специализации той или иной ткани. Иными словами, разнообразие сплайсинговых вариантов зависит в первую очередь от вида животного, но не от типа ткани. Напротив, общее разнообразие всех экспрессируемых генов определяется типом ткани, а не видом животного.
Получены и приблизительные оценки скорости накопления сплайсингового разнообразия и разнообразия самих генов: сплайсинг дает в полтора-два раза большую скорость накопления новых вариантов, чем прямые мутации. Любопытно, что скорость накопления вариантов сплайсинга в разных тканях неодинакова и отличается от скорости мутирования тканеспецифичных генов. Например, быстрее всего появляются мутации в генах семенников, а вот накопление разнообразия сплайсинговых вариантов в семенниках идет со средней скоростью, примерно такой же, как и в сердце, печени и почках (рис. 3). Этот результат показывает, что полезные мутации в генах появляются и закрепляются реже, чем появляются и закрепляются варианты альтернативного сплайсинга.

Рис. 3. Процент одинаковых случаев альтернативного сплайсинга у человека по сравнению с другими девятью видами животных. Для каждой ткани (см. легенду во врезке) подсчет велся отдельно. Изображение из дополнительных материалов к обсуждаемой статье в Science
При этом картина эволюции сплайсинга несколько видоизменяется, если анализировать более ограниченный набор животных: лягушку, курицу, мышь и человека. То есть нужно отбросить родственных человеку обезьян, чтобы не путали сравнение отдаленных линий; отбросить ящериц, близких по времени дивергенции к птицам. У этого урезанного набора животных нашелся 41 общий экзон (рис. 4). И именно эти общие для всех консервативные экзоны снова проанализировали.
Рис. 4. Общие экзоны, которые участвуют в альтернативном сплайсинге, у человека, мыши, курицы и лягушки. Видно, что у всех этих четырех животных вместе есть 41 общий экзон. Изображение из дополнительных материалов к обсуждаемой статье в Science
Эти консервативные экзоны неожиданно продемонстрировали у всех видов специфическую для каждой ткани картину сплайсинга. Она, оказывается, определяется не биологическим видом, как в целом для всех альтернативных вариантов, а типом тканей. Очевидно, что удачные эволюционные находки, регулирующие функции тканей, кочуют из одной эволюционной линии в другую и мало меняются. Самую консервативную картину сплайсинга у разных видов продемонстрировали гены, связанные с синаптическими передачами, проведением нервных импульсов, развитием нервной ткани.
Таким образом, мы видим, что в некоторых тканях адаптации происходят больше с помощью мутирования белок-кодирующих генов, в других они связаны с альтернативным сплайсингом. С чем связан выбор того или иного пути — пока неизвестно.
Источники:
1) Nuno L. Barbosa-Morais, Manuel Irimia, Qun Pan, Hui Y. Xiong, Serge Gueroussov, Leo J. Lee, Valentina Slobodeniuc, Claudia Kutter, Stephen Watt, Recep Çolak, TaeHyung Kim, Christine M. Misquitta-Ali, Michael D. Wilson, Philip M. Kim, Duncan T. Odom, Brendan J. Frey, Benjamin J. Blencowe. The Evolutionary Landscape of Alternative Splicing in Vertebrate Species // Science. 2012. V. 338. P. 1587–1593.
2) Panagiotis Papasaikas, Juan Valcárcel. Splicing in 4D // Science. 2012. V. 338. P. 1547–1548.
Альтернативный сплайсинг – это метод, используемый клетками для создания множества белков из одной и той же цепи ДНК. Это также называется альтернативным сплайсингом РНК. В обычной ДНК перевод, специализированные белки создают мессенджер РНК (мРНК ) из шаблона ДНК. Эта мРНК затем находит свой путь к рибосома где код РНК переводится в структуру нового белка. В альтернативном сплайсинге, взаимодействия между различными белками, клетка и среда может привести к тому, что разные сегменты исходной ДНК будут исключены из мРНК. Когда это происходит, альтернативная мРНК транслируется в совершенно другой белок.
Белки различаются только по основному расположению их аминокислоты, что продиктовано мРНК. Как только это изменяется, функция белка изменяется. Используя метод альтернативного сплайсинга, организмы могут производить гораздо больше белков, чем может указывать их ДНК. Например, у людей есть около 20 000 генов, которые кодируют белок. Тем не менее, считается, что в организме человека содержится более 100 000 различных белков. Альтернативный сплайсинг создает эти разные формы.
Как работает альтернативный сплайсинг?
Следовательно, прежде чем первичная мРНК транслируется в белок, она должна быть сначала модифицирована и отредактирована. При нормальном сплайсинге особый комплекс белка и РНК, называемый сплайсосомой, присоединяется к первичной мРНК. Первичная мРНК имеет различные области, называемые интронами и экзонами. Эти области смешиваются вместе, и интроны должны быть удалены, чтобы создать функциональный белок.
Однако может также иметь место альтернативный сплайсинг. Хотя весь механизм не совсем понятен, известно, что определенные химические факторы могут стимулировать работу сплайсосомы по-разному. Может быть дан сигнал, чтобы исключить экзон или даже несколько экзонов из конечной мРНК. Другие сигналы и пути могут привести к тому, что сплайсосома оставит нетронутыми интроны или пропустит большие участки белка. Наши тела имеют много разных применений для белков, и часто могут использовать один и тот же план ДНК, чтобы сделать многие из этих белков. См. Раздел примеров для конкретных примеров. Ниже приведена обобщенная диаграмма, показывающая различные способы, которыми сплайсосома может альтернативно сплайсировать первичную РНК.

Существует еще одна форма альтернативного сплайсинга, известная как транс-сплайсинг, в которой экзоны двух разных генов собираются вместе с помощью сплайсосомы. Этот генетический процесс наблюдается только у нескольких одноклеточных организмов, но может помочь объяснить их генетическое разнообразие без половое размножение, В то время как сексуально размножающиеся организмы должны размножаться, чтобы смешать их генетика и производить новые сорта, эти организмы могут сделать это гораздо быстрее. Эта форма альтернативного сплайсинга может легко создать совершенно новые функции в этих организмах, что может оказаться полезным.
Примеры альтернативного сплайсинга
Гены нейрексинов
У людей есть 3 гена, которые кодируют семейство белков, известных как нейрексин. Эти белки включены в плазматическая мембрана, Они распространяются из плазматической мембраны и в пространство между нервами. Здесь они связываются с белком из другой нервной клетки. Этот белковый комплекс удерживает клетки на месте. Хотя есть только 3 разных гена, которые кодируют нейрексин, в семействе нейрексинов более 3000 различных белков.
Это возможно благодаря альтернативному сращиванию. Поскольку сплайсосома обрабатывает первичные молекулы мРНК из этих генов, на нее влияет ряд генов-промоторов, молекул в клетке и других сигналов. Это влияние, которое экзоны включаются в конечную мРНК. Альтернативный сплайсинг может сделать белки больше или меньше, или с отсутствующими областями, но, как правило, все еще производит рабочий белок. Таким образом, каждая вариация клеточного окружения или внеклеточного сигнала создает различный белок с немного другой функцией.
В то время как все белки нейрексина будут функционировать, удерживая вместе синапс между двумя нервами, созданный вариант теоретизируется на ряд вещей. Во-первых, это может изменить сигнал, проходящий между двумя нейронами. Это может дать необходимый эффект для головной мозг обработать сигнал. Разные белки могут быть использованы в разное время, в разных клетках, у одного и того же животного. Это может быть необходимо для приспособления множества различных сред в пределах организм и убедитесь, что нейроны работают правильно.
Создание антител
В аналогичном процессе организм человека вырабатывает антитела для борьбы бактерии, вирусы и инородные тела, которые заражают ткани. Для этого тело должно сделать антитело или белок, специально предназначенный для прилипания к захватчику. Эти белки производятся В-лимфоцитами, которые содержат ДНК и механизмы для создания этих сложных белков. Однако есть проблема.
В-лимфоциты должны прикреплять белок к себе и высвобождать антитело в кровоток. Антитело в кровотоке будет связываться с захватчиками, позволяя иммунным клеткам нацеливаться на них. Прикрепляя антитела непосредственно к В-лимфоцитам, эти клетки могут легко поглотить захватчиков, когда они сталкиваются с ними. Чтобы сделать это с минимальной энергией и с помощью одной и той же ДНК, эти иммунные клетки используют альтернативный сплайсинг.
Последние два экзона в генетический код для антител особенные. Эти два экзона кодируют область белка, которая гидрофобный или сопротивляется воде. Эти области прикрепляются внутри гидрофобного ядра фосфолипид двухслойная. Это эффективно блокирует их в клеточная мембрана, Альтернативный сплайсинг просто удаляет эти два экзона. Теперь белок будет служить той же цели, но он растворим в воде и может проходить через кровь и жидкости.
После получения сигнала для создания антител, B-лимфоцит должен создать много сразу для себя и для высвобождения в организм. Для этого он активно транскрибирует ген для антитела быстро, чтобы создать как можно больше первичных транскриптов. Некоторые из них будут обработаны, чтобы сохранить гидрофобную область, а некоторые сплайсосомы вырежут это. Таким образом, белки для обоих применений создаются из одного и того же сигнала для создания антител. Альтернативный сплайсинг позволяет инициировать много разных процессов из одного и того же сигнала транскрипции ДНК.
викторина
1. Какова основная цель альтернативного сплайсинга?A. Для создания вариантов белковB. Помочь с обменом веществC. Для ускорения процесса создания белков
Ответ на вопрос № 1
верно. Альтернативный сплайсинг позволяет организмам хранить информацию для всего семейства генов в одном месте. Поскольку гены могут быть отредактированы, сращены по-разному и модифицированы, они могут создавать гораздо больше фактических белков, чем количество генов, которые они имеют.
2. Почему организму нужно так много разновидностей одного и того же белка?A. Они не, это просто дополнительная генетическая изменчивость B. Для тысяч различных функций их клетки завершеныC. Ученые не знают ответ
Ответ на вопрос № 2
С верно. Ученым еще предстоит полностью определить функцию альтернативного сплайсинга. Все вышеперечисленное может быть правильным или ни одним из них. Похоже, это связано с повышенной сложностью. Однако обыкновенная плодовая муха является одним из организмов с наиболее сложными альтернативными схемами сплайсинга, которые мы изучали.
3. Как альтернативный сплайсинг может помочь создать интеллект?A. Производя различные белки, он может создавать передовые нервные связиB. Чем больше у вас белка, тем умнее выC. Вряд ли альтернативный сплайсинг создает интеллект
Ответ на вопрос № 3
верно. Альтернативный сплайсинг может, по существу, позволить мозгу картировать связи между различными нервами и определять конкретные нервы для определенных задач. Это основа интеллекта и памяти. Чем более специализированные связи мозг имеет, тем больше организм может запомнить и обработать.
Читайте также:

