2 топ элементтері реферат
Обновлено: 05.07.2024
К p-элементов периодической системы относятся элементы с валентным p-подуровнем. Эти элементы расположены в III, IV, V, VI, VII, VIII группах, главных подгруппах периодической системы Д.И.Менделеева. В периоде орбитальные радиусы атомов с увеличением атомного номера уменьшаются, а энергия ионизации в целом растет. В подгруппах элементов с увеличением номера элемента, размеры атомов в общем увеличиваются, а энергия ионизации уменьшается.
p-Элементы III группы К p-элементов III группе относятся бор B, алюминий Al, галлий Ga, индий In и таллий Tl. По характеру этих элементов бор является типичным неметаллом, остальные - металлы. В пределах подгруппы прослеживаются резкий переход от неметаллу к металлам. Свойствами и поведением бор подобный кремния, что является результатом диагональной сродства элементов в периодической системе, согласно которой смещение в периоде вправо вызывает усиление неметаллического характера, а вниз по группе - металлического, поэтому аналогичные по свойствам элементы оказываются расположенными диагонально рядом, например Li и Mg, Ber и Al, B и Si.
Электронное строение валентных подуровней атомов p-элементов III группы в основном состоянии имеет вид ns 2 np 1 . В соединениях бор и трехвалентные алюминий, галлий и индий, кроме того, могут образовывать соединения со степенью окисления +1, а для таллия последний является довольно характерным.
Алюминий является одним из самых распространенных элементов природы, бор - достаточно распространенный, галлий, индий а таллий распространены мало и очень рассеяны, поэтому относятся к редким.
p-Элементы IV группы К p-элементов IV группы относятся углерод C, кремний Si, германий Ge, олово Sn и свинец Pb. Общая электронная конфигурация валентных подуровней атомов p-элементов в основном состоянии ns 2 np 2 . Вследствие наличия 2-х неспаренных p-электронов в соединениях они могут проявлять степень окисления +2, причем эта тенденция усиливается в направлении к свинцу. Атомы могут переходить в возбужденное состояние с образованием четырех валентных электронов, что обусловливает возникновение соединений со степенью окисления +4. Это состояние является характерным для углерода и кремния, способность к выявлению степени окисления +4 ослабляется в направлении к свинцу.
Характер изменения физических свойств элементов и соответствующих простых веществ свидетельствует о закономерное ослабление неметаллических и усиление металлических свойств в ряду C - Si - Ge - Pb.
Углерод и кремний - типичные неметаллы, образующие атомные кристаллические решетки с ковалентной связью. Их простые вещества характеризуются высокими твердостью, температурами плавления и кипения. Для германия эти параметры остаются относительно большими, что вместе с хрупкостью характеризует его как алмазоподобный кристалл с ковалентным типом связи. В то же время в германию уже обнаружено некоторое взнос металлической связи. На это указывает заметное уменьшение ширины запрещенной зоны и росту электропроводности. Для олова полупроводниковые свойства сохраняются лишь до температуры 13,2°С, при дальнейшем нагревании олово переходит в металлический состояние. Свинец - металл, который не проявляет полупроводниковых свойств. Возрастание металлических свойств сопровождается постепенным уменьшением энергии ионизации элементов, их электроотрицательности и усилением восстановительной способности простых веществ.
p-Элементы V группы К p-элементов V группы относятся азот N, фосфор P, мышьяк As, стибий Sb и висмут Bi, при чем азот и фосфор являются типичными элементами, а остальные элементы образуют подгруппу мышьяка. Электронная конфигурация валентных подуровней элементов в основном состоянии ns 2 np 3 .
На последнем энергетическом уровне атомы элементов этой подгруппы имеют по три одноэлектронные орбита ли, которые могут образовывать три ковалентные связи. В то же время в связывании могут принимать участие двухэлектронная орбиталь, а в случае элементов, размещенных после азота, - также свободные nd-орбитали. Так, азот способен образовывать четвертая ковалентная связь по донорно-акцепторным механизмом с использованием своей неподеленной пары электронов. Примером может служить ион аммония NH4 + и его многочисленные производные. Максимально возможная валентность азота в его соединениях равна 4, и каждая пара электронов четырех ковалентных связей занимает одну из четырех орбиталей.
В отличие от азота остальное атомов p-элементов V группы имеют nd-подуровень, вакантные орбитали которого способны участвовать в образовании дополнительных ковалентных связей, за счет чего их ковалентность может расти до 5.
Факторы увеличения радиусов атомов и уменьшение электроотрицательности в ряду N - P - As - Sb - Bi влияют на свойства простых веществ и соединений элементов: постепенно уменьшается стойкость неметаллических форм простых веществ и увеличивается устойчивость металоподобных (азот — типичный неметал с большой электронегативностью, а висмут — типичный металл, электроотрицательности которого лишь 1,70), ослабляются кислотные и усиливаются основные свойства бинарных соединений элементов, их гидроксидов и тому подобное.
p-Элементы VI группы К p-элементов VI группы относятся кислород O, сера S, селен Se, теллур Te и полоний Po. На валентных подуровням атомов p-Элементы VI группы размещено 6 электронов: электронная конфигурация валентных подуровней атомов в основном состоянии ns 2 np 4 .
За счет использования неспаренных электронов элементы в своих соединениях обнаруживают характерную для них валентность 2. Она может расти в случае образования донорно-акцепторных связей, в которых принимают участие двухэлектронные орбитали. Например, в кислых водных растворах существуют ионы гидроксонию H3O + , в которых атом кислорода соединен с тремя атомами водорода ковалентными связями. В отличие от кислорода атомы остальных p-элементов VI группы имеют свободный nd-подуровень, орбитали которого также способны принимать участие в образовании химических связей, в результате чего валентность серы, селена, теллура и полония может возрастать до 6.
Для атомов p-элементов VI группы характерно присоединение электронов для завершения np-подуровня и образования устойчивой электронной конфигурации следующего благородного газа ns 2 np 6 . Это определяет характерный для них степень окисления -2 в соединениях с менее электронегативными элементами.
С переходом к полонию наблюдается характерное для групп p-элементов уменьшение устойчивости высшей степени окисления. Для полония соединения со степенью окисления +6 очень неустойчивы. Это обусловлено сильным ростом энергетической разницы между ns-и np-подуровнями, что затрудняет участие ns-электронов в образовании химических связей.
В ряду O - S - Se - Te - Po возрастают радиусы атомов, что характерно для групп p-элементов, уменьшение энергии их ионизации и электроотрицательности. Ослабление неметаллических свойств элементов проявляется также в уменьшении стойкости неметаллических форм простых веществ и в росте устойчивости металлических. Это приводит к тому, что в отличие от предыдущих элементов подгруппы полоний уже имеет металлическую кристаллическую решетку и относится к металлам.
p-Элементы VII группы - галогены К p-элементов VII группы относятся фтор F, хлор Cl, бром Br, йод I и астату At. Элементы имеют общее название галогены. Электронная конфигурация валентных подуровней атомов p-элементов VII группы соответствует формуле ns 2 np 5 .
На последнем энергетическом уровне атомы элементов имеют по семь электронов, один из которых является неспаренным. Этим объясняется сходство их свойств. Наличие одноэлектронной орбитали определяет характерную для всех элементов валентность 1. Одновременно галогены (кроме фтора) имеют вакантный nd-подуровень, орбитали которого также могут участвовать в образовании химических связей и увеличивать валентность атомов элементов до 7.
Молекулы галогенов двухатомные, неполярные. Все галогены являются неметаллами. В ряду F - Cl - Br - I - At ослабляются признаки неметаличности: фтор — самый типичный элемент-неметала, а астату обнаруживает некоторые свойства элемента-металла.
В пределах своих периодов галогены характеризуются малыми атомными радиусами, что обуславливает их высокие электроотрицательности и сродство к электрону, поэтому для них в сложных веществах самым стойким является степень окисления -1.
p-Элементы VIII группы К p-элементов VIII группы относятся гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радон Rh, которые составляют главную подгруппу. Атомы этих элементов имеют завершенные внешние электронные слои, поэтому электронная конфигурация валентных подуровней их атомов в основном состоянии имеет вид 1s 2 (Не) и ns 2 np 6 (остальные элементы). Благодаря очень высокой устойчивости электронных конфигураций они в целом характеризуются большими значениями энергий ионизации и химической инертностью, поэтому их называют благородными (инертными) газами. В свободном состоянии они существуют в виде атомов (одноатомных молекул). Атомы гелия (1s 2 ), неона (2s 2 2p 6 ) и аргона (3s 2 3p 6 ) имеют особо устойчивую электронную структуру, поэтому соединения валентного типа для них неизвестны.
Криптон (4s 2 4p 6 ), ксенон (5s 2 5p 6 ) и радон (6s 2 6p 6 ) отличаются от предыдущих благородных газов большими размерами атомов и, соответственно, меньшими энергиями ионизации. Они способны образовывать соединения, которые зачастую имеют низкую стойкость.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам

Описание презентации по отдельным слайдам:

ІІ-топ металдарына жалпы сипаттама. Кальций және магний.

Сабақтың жоспары:
II топ элементтерінің жалпы сипаттамасы;
Табиғатта таралуы;
Физикалық қасиеттері;
Химиялық қасиеттері;
Қосылыстары;
Алынуы;
Қолданылуы;
Қорытынды;

II топтың негізгі топша металдарының жалпы сипаттамасы.Ca мен Mg.

II топ элементтерінің жалпы сипаттамасы:
S-элементтер- металдар класының маңызды өкілдері. Олардың ұқсас қасиеттері атом ядросы мен валенттік электрондардың әлсіз байланысуымен түсіндіріледі. Бірақ сыртқы энергетикалық деңгейдегі электрондар санының әртүрлі болуы жай заттардың физикалық қасиеттері мен элементтердің химиялық белсенділігінің әртүрлілігіне себепші болады.


Ca мен Mg-дің табиғатта таралуы.
Ca
Бор
Әк тас

Mg
Mg 2+ ионы хлорофиллдің түзілуіне қатысады.
Қайың шырынының құрамында минералды элементтер бар.

Mg
Асқазан ауруларын емдейтін дәрілердің құрамына Mg кіреді.

Mg
Турмалин
Гранат
Жердің мантия қабатының құрамында Mg,Si,О2 қосылыс түрінде кездеседі.

Mg
Mg теңіз тұзының құрамында кездеседі.

Ca
Тіс пастасының және опа-далаптың құрамында Ca кездеседі.

Ca
Қақтың құрамында кальций карбонаты кездеседі.
Сылақшы әк таспен жұмыс жасап жатыр.

Ca
Карсттық үңгірлер мен алқаптар.

Ca
Әк тас қатпарлары бар алқаптар.

Ca
Көкөністердің құрамына Ca кіреді.
Құрамында кальцийі бар тағамдар.


ҚОСЫЛЫСТАРЫ: Ca→ CaO → Ca(OH)2 → CaCl2 → CaCO3
1) 2Ca+O2=2CaO

MgS04 — ащы немесе ағылшын тұзы;

Ca мен Mg-дің алынуы:

Сталактиттер және сталагмиттер.

Кальций мен магнийдің қолданылуы.



Кальций гидроксидінің қолданылуы.

Ой толғаныс . Семантикалық карта
- подготовка к ЕГЭ/ОГЭ и ВПР
- по всем предметам 1-11 классов

Курс повышения квалификации
Охрана труда
- Сейчас обучается 124 человека из 45 регионов

Курс профессиональной переподготовки
Охрана труда

Курс профессиональной переподготовки
Библиотечно-библиографические и информационные знания в педагогическом процессе
- ЗП до 91 000 руб.
- Гибкий график
- Удаленная работа
Дистанционные курсы для педагогов
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 597 353 материала в базе
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
Свидетельство и скидка на обучение каждому участнику
Другие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарий
- 23.11.2020 1093
- PPTX 3.9 мбайт
- 54 скачивания
- Оцените материал:
Настоящий материал опубликован пользователем Чиченкова Татьяна Викторовна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
40%
- Подготовка к ЕГЭ/ОГЭ и ВПР
- Для учеников 1-11 классов
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
В Белгородской области отменяют занятия в школах и детсадах на границе с Украиной
Время чтения: 0 минут
Новые курсы: функциональная грамотность, ФГОС НОО, инклюзивное обучение и другие
Время чтения: 15 минут
Ленобласть распределит в школы прибывающих из Донбасса детей
Время чтения: 1 минута
Инфоурок стал резидентом Сколково
Время чтения: 2 минуты
Минпросвещения России подготовит учителей для обучения детей из Донбасса
Время чтения: 1 минута
Каждый второй ребенок в школе подвергался психической агрессии
Время чтения: 3 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
I А тобы элементтеріне сипаттама. Бір жағынан натрий мен литийдің, екінші жағынан калий топшасы элементтерінің кейбір физикалық және химиялық қасиеттерін салыстыру натрийдің анық сілтілік металдарға (калий топшасы) жақын екенін көрсетеді.
Барлық сілтілік металдарға ортақ қасиет – айқын көрінетін оң электрлік және радиустарының үлкен шамасы, иондану потенциалы және СЭТ-тің аз мәні болып табылады.
Төменде I А тобы элементтерінің кейбір қасиеттері келтірілді:
| Тұрақтылары | |||||
| Жер қыртысындағы мөлшері, мас.үлес, % | 3,4·10 - 3 | 2,64 | 2,6 | 1,5·10 -2 | 3,7·10 -4 |
| Валенттік эл-дық конфиг. | [He]2s 1 | [Ne]3s 1 | [Ar]4s 1 | [Kr]5s 1 | [Xe]6s 1 |
| Атомдық радиус, нм | 0,155 | 0,189 | 0,236 | 0,248 | 0,267 |
| Иондық радиус , нм | 0,068 | 0,098 | 0,133 | 0,149 | 0,165 |
| Иондану потенциалы, В | 5,39 | 5,14 | 4,34 | 4,18 | 3,89 |
| СЭТ | 0,95 | 0,90 | 0,80 | 0,80 | 0,75 |
| Балқу т-расы, 0 С | 180,0 | 97,8 | 63,5 | 38,7 | 28,5 |
| Қайнау т-расы, 0 С | 1340,0 | 882,5 | 758,5 | 696,0 | 706,0 |
| Тығыздығы, г/см 3 | 0,53 | 0,97 | 0,86 | 1,52 | 1,89 |
| , В | -3,045 | -2,714 | -2,924 | -2,925 | -2,923 |
Барлық сілтілік металдар ақ-күміс түсті, оттегінің өте аз қоспасы цезийге сары-алтын бояу береді. Натрий мен калий судан жеңіл, ал цезий екі есеге жуық ауыр. Барлық сілтілік металдар жұмсақ, созылғыш, құрғақ ауа атмосферасында тез күңгірттенеді. Онда және оксидтер түзеді, және -пероксидтер түзеді. Натрий сумен қызу әрекеттеседі, калий – қопарылыс шығарады, ал мен мұзбен жанасқанда да тұтанады. Ылғал ауамен әрекеттескенде барлық сілтілік металдар ақырында карбонаттарға айналады. Сондықтан натрий мен калийді әдетте керосин астында сақтайды, ал рубидий мен цезийді – эвакуацияланған ампулаларда. Оттегі атмосферасында сілтілік металдар жанады. Онда натрий пероксид, ал қалғандары надпероксидтер ( ) түзеді. Калий, рубидий және цезий үшін озонидтер белгілі. Кәдімгі жағдайда сілтілік металдар фтор мен хлор атмосферасында жанады, ал аздап қыздырғанда күкірт, сутегі, бром және басқа металл еместермен оңай әрекеттеседі.
Натрий оксиді түссіз, ал калған оксидтер сары және қызғылт-сары ( ) түсті. Олардың барлығы өте гигроскопті, су қосып алып тән гидроксидтеріне айналады.
Сілтілік металдардың гидроксидтері - суда және спирттерде еритін кристалл заттар. Олардың су ерітінділері – күйдіргіш сілтілер – нағыз күшті негіздер. Гидроксидтерді хлоридтердің су ерітінділерін электролиздеп алады. Онда катод кеңістігінде сутегі бөлінеді және сілтілік металдың гидроксиді түзіледі.
Құрамында оттегі бар қышқылдар тұздарының ішіндегі ең маңыздылары карбонаттар. Сода негізгі химия өндірісі өнімдеріне жатады Оны аммиакты әдіспен алады. Онда концентрлі ерітіндісін аммиакпен қанықтырады, сосын көміртегі диоксидімен өңдейді. Бұл процесте гидрокарбонат тұнбаға түседі, оны қуырып қыздырып карбонатқа айналдырады:
Поташ табиғи өңдегенде, сол сияқты жапырақты ағаш тұқымдарының және күнбағыстың күлдерін шаймалау арқылы алынады. Натрий сульфаты және нитраты, сол сияқты калий сульфаты көп мөлшерде жаратылыста кездеседі. -дің аз ерігіштігін пайдаланып, калий нитратын пен -дің арасындағы алмасу реакциясы арқылы алады.

Презентация Алюминий (13-ші топ элементі). Б?л презентацияда алюминийді? таби?атта кездесуі ж?не физикалы? химиялы? ?асиеттері келтірілген. О?ушылармен бірлесе орындау?а болатын кроссворд тапсырмасы мен жеке ж?мыс тапсырмалары келтірілген. ?осымша презентация мен ?осы ?ыс?а мерзімді жоспарды алу?а да болады.

Алюминий ( 13 топ элементі).
Оқу мақсаты:
- 13 топ металдарының қасиеттері мен реакцияларын білу

Ой қозғау
Егер төмендегі жетістік критерийлерін орындаса, оқушы оқу мақсатына жетеді
- Алюминийдің периодтық кестедегі орны мен табиғатта таралуын біледі
- Алюминийдің физикалық қасиеттерін сипаттай алады
- Алюминийдің химиялық қасиеттері: оттегімен, сумен, сұйытылған қышқылдармен реакциясы және екідайлылығын түсінеді
13-топ элементтері
![Физикалық қасиеттері Z 5 Таңба 13 Валентті 31 электрондар Тығыздық [г/см 3 ] 49 Балқу 81 температурасы[°C]](https://fsd.kopilkaurokov.ru/uploads/user_file_566a88e4cace0/img_user_file_566a88e4cace0_4.jpg)
Физикалық қасиеттері
электрондар
Тығыздық [г/см 3 ]
температурасы[°C]
![Тексеру Z 5 Таңба Валентті B 13 Al Тығыздық [г/см 3 ] электрондар 2 s 2 p 1 31 2.34 49 3s 2 p 1 Ga Балқу 2.70 4 s 2 p 1 81 In температурасы[°C] 2027 Tl 5.90 5 s 2 p 1 659 6 s 2 p 1 7.36 39 11.85 156 304](https://fsd.kopilkaurokov.ru/uploads/user_file_566a88e4cace0/img_user_file_566a88e4cace0_5.jpg)
Тексеру
Тығыздық [г/см 3 ]
электрондар
2 s 2 p 1
3s 2 p 1
4 s 2 p 1
температурасы[°C]
5 s 2 p 1
6 s 2 p 1

Табиғатта таралуы
Жер қыртысында таралуы
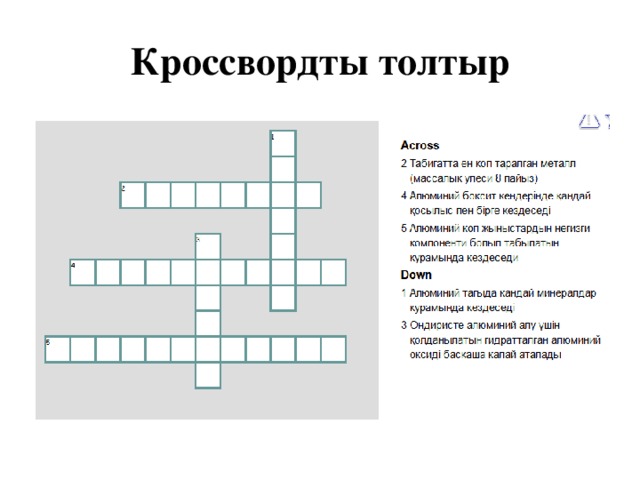
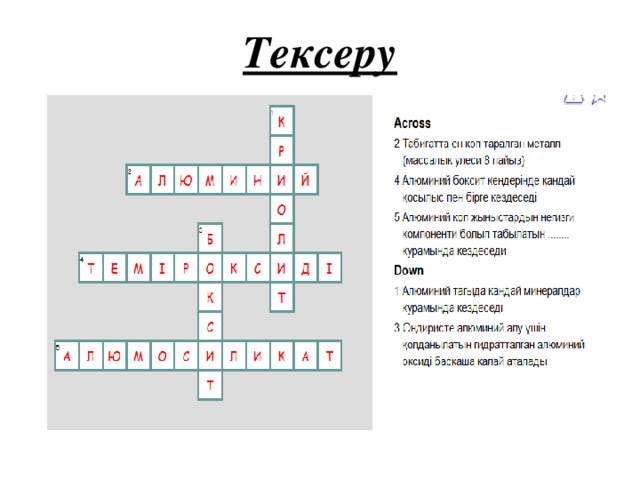
Кроссвордты толтыр
![Алюминий Химиялық қасиеттері Бейметалдармен әрекеттеседі ( оттегімен, күкіртпен, хлормен, азотпен) Сумен әрекеттеседі Қышқылдармен әрекеттесіп нәтижесінде сәйкес тұз бен газ түзеді Сілтілермен әрекеттеседі, нәтижесінде Өзінен төмен металдардың оксидтерімен әрекеттседі 8Al + 3Fe 3 O 4 = 4Al 2 O 3 + 9Fe 2Al + 6NaOH + 6H 2 O = 2Na 3 [Al(OH) 6 ] + 3H 2 ↑ 2Al + 6HCl = 2AlCl 3 + H 2 ↑ 4Аl + 3O 2 = 2Al 2 O 3 2Аl + 3Cl 2 = 2AlCl 3 (Снять оксидную пленку) t 2Al + WO 3 = Al 2 O 3 + W 2Al + 3S = Al 2 S 3 2Al + 3H 2 SO 4 = Al 2 (SO 4 ) 3 + H 2 ↑ 2Al + 2NaOH + 2H 2 O =2NaAlO 2 +3H 2 ↑ 2Al + 6H 2 O = 2Al(OH) 2 + H 2 ↑ 4Al + 3C = Al 4 C 3 Далее](https://fsd.kopilkaurokov.ru/uploads/user_file_566a88e4cace0/img_user_file_566a88e4cace0_10.jpg)
Химиялық қасиеттері
Бейметалдармен әрекеттеседі ( оттегімен, күкіртпен, хлормен, азотпен)
Сумен әрекеттеседі
Қышқылдармен әрекеттесіп нәтижесінде сәйкес тұз бен газ түзеді
Сілтілермен әрекеттеседі, нәтижесінде
Өзінен төмен металдардың оксидтерімен әрекеттседі
8Al + 3Fe 3 O 4 = 4Al 2 O 3 + 9Fe
2Al + 6NaOH + 6H 2 O = 2Na 3 [Al(OH) 6 ] + 3H 2 ↑
2Al + 6HCl = 2AlCl 3 + H 2 ↑
4Аl + 3O 2 = 2Al 2 O 3
2Аl + 3Cl 2 = 2AlCl 3
(Снять оксидную пленку)
2Al + WO 3 = Al 2 O 3 + W
2Al + 3S = Al 2 S 3
2Al + 3H 2 SO 4 = Al 2 (SO 4 ) 3 + H 2 ↑
2Al + 2NaOH + 2H 2 O =2NaAlO 2 +3H 2 ↑
2Al + 6H 2 O = 2Al(OH) 2 + H 2 ↑
4Al + 3C = Al 4 C 3

Зертханалық жұмыс
Қышқылдармен жұмыс жасау техника қауіпсіздігі
Сілтілермен және қышқылдармен абай болып жұмыс жүргіз
Көзге немесе теріге тиген жағдайда сумен лезде жу! Қышқылдарды қыздыр,анда алдымен өне бойын қыздыр, және қасыңдағы оқушыға беттеме.

Демонстрация: Азот қышқылының алюминий мен реакциясын демонстрациялау
Читайте также:

