Волновая теория строения атома кратко
Обновлено: 02.07.2024
Основные типы структур неорганических соединений. Вещества с молекулярной и немолекулярной структурой. Атомные, молекулярные, ионные и металлические кристаллические решетки .
Неорганические вещества классифицируются по составу и по химическим свойствам. По составу неорганические вещества делятся на бинарные – состоящие только из двух элементов, и многоэлементные – состоящие из нескольких элементов.
Оксидами называются бинарные соединения, содержащие кислород в степени окисления -2 . По химическим свойствам оксиды делятся на солеобразующие и несолеобразующие . Солеобразующие, в свою очередь, делятся на основные , кислотные и амфотерные .
Соли можно рассматривать как продукт взаимодействия основания и кислоты. При этом может происходить как полное, так и неполное замещение ионов водорода в кислоте катионами металла (или аммония) или гидроксильных групп в основании кислотными остатками.
Гидроксидами металлов называются вещества, содержащие ион металла и одну или несколько гидроксильных групп.
Гидроксиды делятся на основные (основания) и амфотерные. Основные гидроксиды, в свою очередь, делятся на сильные основания – щелочи, и слабые основания.
С молекулярной: большинство простых веществ неметаллов: O2, S8, P4, H2, N2, Cl2; соединения неметаллов друг с другом (бинарные и многоэлементные): NH3, CO2, H2SO4.
С немолекулярной: простые вещества металлы и их сплавы: Na, Cu, Fe, . ; соединения металлов с неметаллами: NaH, Na2SO4, CuCl2, Fe2O3; неметаллы: бор, кремний, углерод (алмаз), фосфор (чёрный)
Атомная: В узлах атомной кристаллической решетки находятся атомы, связанные прочными ковалентными связями в протяженную пространственную сеть. В этом случае структура отличается таким внутренним единством, что можно сказать, что весь кристалл представляет одну молекулу.
Молекулярная: У веществ с молекулярным строением в узлах кристаллической решетки находятся молекулы с прочными ковалентными связями между атомами. В то же время отдельные молекулы взаимосвязаны гораздо слабее, что делает молекулярный кристалл довольно непрочным.
Ионная: У веществ с ионной решеткой в узлах расположены разноименно заряженные ионы, удерживаемые силами электростатического притяжения.
Металлическая: Этим типом кристаллической решетки обладают металлы с металлической химической связью.
Химические газовые законы .Закон Авогадро .Молярный объем.
1. Закон Авогадро. В одинаковом объеме любого газа при одинаковой температуре и давлении содержится одинаковое количество молекул, т.е. m/M=const при P,V,T=const для любого газа.
2. Закон Бойля-Мариотта. При постоянной массе газа и постоянной температуре давление газа обратно пропорционально занимаемому им объему, т.е. Р•V= const при Т, m=const
3. Закон Гей-Люссака. При постоянных массе газа и давлении объем, занимаемый газом, прямо пропорционален его температуре, то есть v — = const при P, m=const
4. Закон Шарля. При постоянных массе газа и его объеме давление газа прямо пропорционально температуре, то есть
P/T=const при V, m=const ;NA=6,022. ×1023
МОЛЯРНЫЙ ОБЪЕМ , объем, занимаемый одним МОЛЕМ вещества. Он примерно одинаков для всех газов и при СТАНДАРТНОМ ДАВЛЕНИИ и ТЕМПЕРАТУРЕ составляет 22,414 литра.
Основные стехиометрические законы. Закон эквивалентов. Закон постоянства состава Нестехиометрические соединения.
Зак.ЭКВИВАЛЕНТОВ Во всех химических реакциях взаимодействие различных веществ друг с другом происходит в соответствии с их эквивалентами, независимо от того, являются ли эти вещества простыми или сложными.
Зак.Пост.Состава: Всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав. Cостав соединений молекулярной структуры, т.е. состоящих из молекул, - является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
Нестехиометрические соединения, химически индивидуальные вещества переменного состава. Относятся полевые шпаты, цеолиты, шпинели и др. Н. с. обозначают тильдой перед стехиометрической формулой или чертой над ф-лой. Многочисленные случаи образования бертоллидов открыты в металлических системах, а также среди оксидов, сульфидов, карбидов, гидридов и др.
Строение электронных оболочек атома. Волновая теория строения атома. Понятие об электронном облаке.
Энергия свободного электрона, так же как и энергия тела, может изменяться непрерывно, но энергия связанного электрона, в частности электрона в атоме, может принимать только вполне определенные значения. Электрон в атоме может находиться только во вполне определенных состояниях. Электрон в одних случаях проявляет свойства частицы вещества, а в других – волновые свойства. Чем с большей точностью определяют положение электрона в пространстве, тем с меньшей точностью можно определить его скорость. И наоборот, чем с большей точностью определяют скорость электрона (абсолютную величину и направление), тем с меньшей точностью можно определить его положение в пространстве.
Электронное облако – область пространства, ограниченное поверхностью одинакового значения волновой функции и вероятность обнаружения электронов в этой области равна 90%.
Физический смысл волновой функции заключается в том, что согласно копенгагенской интерпретации квантовой механики плотность вероятности нахождения частицы в данной точке пространства в данный момент времени считается равной квадрату абсолютного значения волновой функции этого состояния.
Квантовые числа как характеристика состояния электрона в атоме. Физический смысл квантовых чисел. Энергетический уровень, подуровень. Атомная орбиталь. Форма и ориентация электронных облаков.
Главное квантовое число n определяет общую энергию электрона на данной орбитали. Оно может принимать любые целые значения, начиная с единицы (n = 1,2,3, . ). Под главным квантовым числом, равным ∞, подразумевают, что электрону сообщена энергия, достаточная для его полного отделения от ядра (ионизация атома). Кроме того, оказывается, что в пределах определенных уровней энергии электроны могут отличаться своими энергетическими подуровнями. Существование различий в энергетическом состоянии электронов, принадлежащих к различным подуровням данного энергетического уровня, отражается побочным (иногда его называют орбитальным) квантовым числом l. Это квантовое число может принимать целочисленные значения от 0 до n - 1 (l = 0,1, . n - 1).
Постоянные NA и k(пост. Больцмана) имеют ясный смысл: NA — это число молекул или атомов в единице количества вещества, то есть моле; k — постоянная, определяющая связь между температурой в Кельвинах и температурой в единицах энергии. Но определенные физический смысл (быть может, многим он покажется неожиданным) имеет и комбинация NA и k — постоянная R(газовая пост.).
Энергетический уровень — собственные значения энергии квантовых систем, то есть систем, состоящих из микрочастиц (электронов, протонов и других элементарных частиц) и подчиняющихся законам квантовой механики. Каждый уровень характеризуется определённым состоянием системы, или подмножеством таковых в случае вырождения. Понятие применимо к атомам (электронные уровни), молекулам (различные уровни, соответствующие колебаниям и вращениям), атомным ядрам (внутриядерные энергетические уровни) и т.д.
Энергетический подуровень--это совокупность орбиталей, которые находятся на одном энергетическом уровне и имеют одинаковую форму.
Атомная орбиталь — одноэлектронная волновая функция в сферически симметричном электрическом поле атомного ядра, задающаяся главным n, орбитальным l и магнитным m квантовыми числами.
Современная теория строения атома была впервые предложена австрийским физиком Э. Шредингером (1925–1926), который объединил в едином волновом уравнении описание движения электрона как частицы с его описанием в виде волны. Уравнение Шредингера – фундаментальное уравнение квантовой механики. Оно описывает движение электронов в атоме с учетом их двойственной природы:
где h – постоянная Планка; m – масса электрона; Е – его полная энергия; U – потенциальная энергия, x, y, z – координаты; ψ – волновая функция электрона – амплитуда его волнового движения в трёхмерном пространстве.
При решении уравнения Шредингера находят энергию электрона и его волновую функцию ψ. Точное решение уравнения получается для атома водорода или водородоподобных ионов, а для многоэлектронных систем используются различные приближения. Квадрат волновой функции ψ 2 определяет вероятность обнаружения электрона на том или ином расстоянии от ядра атома.
Согласно принципу Гейзенберга невозможно одновременно определить положение частицы в пространстве и её импульс. Следовательно, нельзя рассчитать траекторию движения электрона в поле ядра, можно лишь оценить вероятность его нахождения в атоме с помощью волновой функции ψ, которая заменяет классическое понятие траектории. Волновая функция ψ характеризует амплитуду волны в зависимости от координат электрона, а ее квадрат ψ 2 определяет вероятность нахождения электрона в определенной точке пространства.
В связи с новыми представлениями о движении электров в атомах в квантовой механике появляется новое понятие – атомная орбиталь.
Атомная орбиталь (АО) – область атомного пространства, в которой движется электрон. Форму АО характеризуют линиями и поверхностями с одинаковым значением ψ 2 , которую называют плотностью электронного облака.
Таким образом, атомной орбитали соответствует волновая функция ψ. Атомная орбиталь характеризуется энергией, формой и направлением в пространстве. Все эти характеристики квантованы (изменяются скачками), они описываются с помощью квантовых чисел.
Волновая теория строения атома
Современная теория строения атома была впервые предложена австрийским физиком Э. Шредингером (1925–1926), который объединил в едином волновом уравнении описание движения электрона как частицы с его описанием в виде волны. Уравнение Шредингера – фундаментальное уравнение квантовой механики. Оно описывает движение электронов в атоме с учетом их двойственной природы:
где h – постоянная Планка; m – масса электрона; Е – его полная энергия; U – потенциальная энергия, x, y, z – координаты; ψ – волновая функция электрона – амплитуда его волнового движения в трёхмерном пространстве.
При решении уравнения Шредингера находят энергию электрона и его волновую функцию ψ. Точное решение уравнения получается для атома водорода или водородоподобных ионов, а для многоэлектронных систем используются различные приближения. Квадрат волновой функции ψ 2 определяет вероятность обнаружения электрона на том или ином расстоянии от ядра атома.
Согласно принципу Гейзенберга невозможно одновременно определить положение частицы в пространстве и её импульс. Следовательно, нельзя рассчитать траекторию движения электрона в поле ядра, можно лишь оценить вероятность его нахождения в атоме с помощью волновой функции ψ, которая заменяет классическое понятие траектории. Волновая функция ψ характеризует амплитуду волны в зависимости от координат электрона, а ее квадрат ψ 2 определяет вероятность нахождения электрона в определенной точке пространства.
В связи с новыми представлениями о движении электров в атомах в квантовой механике появляется новое понятие – атомная орбиталь.
Атомная орбиталь (АО) – область атомного пространства, в которой движется электрон. Форму АО характеризуют линиями и поверхностями с одинаковым значением ψ 2 , которую называют плотностью электронного облака.
Таким образом, атомной орбитали соответствует волновая функция ψ. Атомная орбиталь характеризуется энергией, формой и направлением в пространстве. Все эти характеристики квантованы (изменяются скачками), они описываются с помощью квантовых чисел.
Современная теория строения атома была впервые предложена в 1925 г. физиком Э. Шредингером (Австрия), который объединил в едином волновом уравнении описание движения электрона как частицы с его описанием в виде волны (уравнение Де Бройля (2.2).
Уравнение Шредингера (1926 г.) – фундаментальное уравнение квантовой механики. Оно описывает движение электронов в атоме с учетом их двойственной природы:

или

, (2.4)

где h – постоянная Планка; m – масса электрона; Е – его полная энергия; U – потенциальная энергия, x, y, z – координаты; y – волновая функция электрона (амплитуда его волнового движения в трёхмерном пространстве); - оператор Гамильтона, т.е. набор математических действий, позволяющий вычислить Е из ψ. При решении уравнения Шредингера находят энергию электрона и его волновую функцию y . Точное решение уравнения (2.4) получается для атома водорода или водородоподобных ионов, для многоэлектронных систем используются различные приближения. Квадрат волновой функции ( y 2 ) определяет вероятность обнаружения электрона на том или ином расстоянии от ядра атома.
Согласно принципу Гейзенберга (2.3) невозможно одновременно определить положение частицы в пространстве и ее импульс. Следовательно, нельзя рассчитать траекторию движения электрона в поле ядра, можно лишь оценить вероятность его нахождения в атоме с помощью волновой функции ψ, которая заменяет классическое понятие траектории. Волновая функция ψ характеризует амплитуду волны в зависимости от координат электрона, а ее квадрат ψ 2 определяет вероятность нахождения электрона в определенной точке пространства. Атомная орбиталь (АО) – область атомного пространства, в котором движется электрон.
Форму АО характеризуют линиями и поверхностями с одинаковой y 2 , которую также называют плотностью электронного облака.
Таким образом, АО соответствует волновая функция y , она характеризуется энергией, формой и направлением в пространстве. Все эти характеристики квантованы, то есть изменяются скачками, которые описываются с помощью квантовых чисел.
2.3. Квантовые числа
Четыре квантовых числа описывают состояние электрона в атоме и характеризуют энергию электрона, форму электронного облака, его ориентацию в пространстве и его спин. При переходе атома из одного состояния в другое происходит перестройка электронного облака, то есть изменяются значения квантовых чисел, что сопровождается поглощением или испусканием атомом квантов энергии.

Главное квантовое число (n) - характеризует энергию электрона на данном энергетическом уровне, используется как номер уровня, определяет размеры атомной орбитали. Главное квантовое число может принимать значения от 1 до ¥ (n = 1, 2, 3, 4. ¥). Иногда уровни обозначают буквами: 1 2 3 4. ® . K L M N. соответственно. Чем меньше n, тем больше энергия взаимодействия электрона с ядром. При n = 1 атом водорода находится в основном состоянии, при n > 1 – в возбужденном .
Орбитальное квантовое число (l) - определяет форму атомной орбитали (АО) и принимает значения от 0 до (n-1), то есть n значений. Каждому значению l соответствует орбиталь определенной формы (табл. 2.1, рис. 2.1.). Орбитальное квантовое число принято обозначать буквенными символами:
Движущаяся частица имеет длину волны . Гипотеза была экспериментально подтверждена обнаружением дифракционного эффекта потока электронов.
волновая природа электрона
Невозможно одновременно точно измерить скорость частицы и её положение в пространстве (координаты). Эта мысль была высказана впервые Гейзенбергом (1927 год) и получила название принципа неопределенности. С учетом этого принципа модель атома Бора не годится.
Электроны движутся с определенными скоростями по орбитам определенного радиуса, а эти величины одновременно измерить нельзя. Поэтому модель Бора-Зоммерфельда перестала удовлетворять ученых.
Современная теория строения атома была впервые предложена австрийским физиком Э. Шредингером (1925–1926), который объединил в едином волновом уравнении описание движения электрона как частицы с его описанием в виде волны. Уравнение Шредингера – фундаментальное уравнение квантовой механики. Оно описывает движение электронов в атоме с учетом их двойственной природы:
где h – постоянная Планка; m – масса электрона; Е – его полная энергия; U – потенциальная энергия, x, y, z – координаты; ψ – волновая функция электрона – амплитуда его волнового движения в трёхмерном пространстве.
При решении уравнения Шредингера находят энергию электрона и его волновую функцию ψ. Точное решение уравнения получается для атома водорода или водородоподобных ионов, а для многоэлектронных систем используются различные приближения. Квадрат волновой функции ψ 2 определяет вероятность обнаружения электрона на том или ином расстоянии от ядра атома.
Согласно принципу Гейзенберга невозможно одновременно определить положение частицы в пространстве и её импульс. Следовательно, нельзя рассчитать траекторию движения электрона в поле ядра, можно лишь оценить вероятность его нахождения в атоме с помощью волновой функции ψ, которая заменяет классическое понятие траектории. Волновая функция ψ характеризует амплитуду волны в зависимости от координат электрона, а ее квадрат ψ 2 определяет вероятность нахождения электрона в определенной точке пространства.
В связи с новыми представлениями о движении электров в атомах в квантовой механике появляется новое понятие – атомная орбиталь.
Атомная орбиталь (АО) – область атомного пространства, в которой движется электрон. Форму АО характеризуют линиями и поверхностями с одинаковым значением ψ 2 , которую называют плотностью электронного облака.
Таким образом, атомной орбитали соответствует волновая функция ψ. Атомная орбиталь характеризуется энергией, формой и направлением в пространстве. Все эти характеристики квантованы (изменяются скачками), они описываются с помощью квантовых чисел.
Квантовые числа
Состояние электрона в атоме описывают четыре квантовых числа, которые характеризуют энергию электрона, форму электронного облака, его ориентацию в пространстве и его спин. При переходе атома из одного состояния в другое происходит перестройка электронного облака, то есть изменяются значения квантовых чисел, что сопровождается поглощением или испусканием атомом квантов энергии.
Главное квантовое число(n) характеризует энергию электрона на данном энергетическом уровне, определяет размеры атомной орбитали, используется как номер энергетического уровня Главное квантовое число имеет значения от 1 до ¥ (n = 1, 2, 3, 4. ¥). Иногда энергетические уровни обозначают буквами K, L, M, N. которые соответствуют численным значениям 1, 2, 3, 4…. Чем меньше n, тем больше энергия взаимодействия электрона с ядром.
При n = 1 атом водорода находится в основном состоянии, при n > 1 – в возбужденном.
Орбитальное квантовое число (l) определяет форму атомной орбитали и принимает значения от 0 до (n-1), то есть n значений. Орбитальное квантовое число принято обозначать буквенными символами:
| l | = | |||
| s | p | d | f | g |
Электроны с одинаковым значением l образуют в атоме энергетический подуровень.
Обозначение орбитального квантового числа и подуровней
| n (энергетический уровень) | l (энергетический подуровень) | Обозначение подуровней |
| 1s | ||
| 0, 1 | 2s, 2p | |
| 0, 1, 2 | 3s, 3p, 3d | |
| 0, 1, 2, 3 | 4s, 4p, 4d, 4f |
Каждому значению l соответствует орбиталь определенной формы. Решение уравнения Шредингера показало, что s-орбиталь (l = 0) имеет форму шара, p-орбиталь (l =1) - форму гантели и т. д. (рис. 2.1).
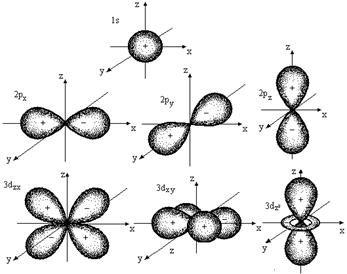
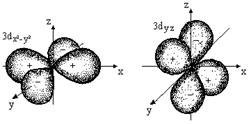
Рис. 2.1. Формы атомных орбиталей
Для электронов первого энергетического уровня (n = 1) возможна только одна форма орбитали (s), для второго (n = 2) - две (s и p) и т. д. Таким образом, энергетические уровни состоят из одного или нескольких энергетических подуровней. Для n = 1 возможен только один подуровень с l = 0, для n = 2 - два с l = 0 и l =1 и т д.
Состояние электрона в атоме обозначают цифрами и буквами. Например, электрон, у которого n = 1 и l = 0, обозначают 1s. Состояние 4p означает, что электрон находится на четвертом энергетическом уровне (n = 4); форма орбитали соответствует гантели (l = 1) и т.д.
Магнитное квантовое число (m) - характеризует пространственную ориентацию орбитали. Оно зависит от орбитального квантового числа и принимает значения от –l до нуля и от нуля до +l. Например, если орбитальное квантовое число равно 0 (s-орбиталь), то магнитное квантовое число имеет одно значение (0), если орбитальное квантовое число равно 1 (р-орбиталь), то магнитное квантовое число имеет три значения: –1, 0 и +1, а если орбитальное квантовое число равно 2 (d-орбиталь), то магнитное квантовое число имеет пять значений: –2, –1, 0, +1 и +2 и т.д. Таким образом, для каждого значения l имеется (2l + 1) значений m.
Все орбитали одного подуровня l обладают одинаковой энергией, но по-разному ориентированы относительно друг друга (рис 2.1).
Такие состояния электронов в квантовой механике называются вырожденными:р-состояние трехкратно вырождено, d-состояние - пятикратно и т.д. (табл. 2.3).
Подуровни и атомные орбитали
| l (подуровень) | m (орбиталь) | Число АО с данным значением l | Графическое обозначение орбиталей |
| 0 (s) | (s) | ||
| 1 (p) | +1, 0, –1 | (p) | |
| 2 (d) | +2, +1, 0, –1, –2 | (d) | |
| 3 (f) | +3, +2, +1, 0, –1, –2, –3, | (f) |
Изучение атомных спектров показало, что трех квантовых чисел недостаточно для описания свойств электронов.
Дополнительное четвертое квантовое число -спиновое(s) ("spin" - вращение, веретено) - характеризует собственный механический момент движения электрона, которое условно представляют как вращение вокруг собственной оси. Оно может происходить в двух взаимно противоположных направлениях. Поэтому спиновое квантовое число имеет только два значения: + 1 /2 и - 1 /2. Наличие спина у электрона было подтверждено экспериментально. Электроны с разными спинами обозначаются стрелками, направленными вверх и вниз .
Читайте также:

