Водородная связь в белках и нуклеиновых кислотах кратко
Обновлено: 04.07.2024
Основным является сессионный cookie, обычно называемый MoodleSession. Вы должны разрешить использование этого файла cookie в своем браузере, чтобы обеспечить непрерывность и оставаться в системе при просмотре сайта. Когда вы выходите из системы или закрываете браузер, этот файл cookie уничтожается (в вашем браузере и на сервере).
Другой файл cookie предназначен исключительно для удобства, его обычно называют MOODLEID или аналогичным. Он просто запоминает ваше имя пользователя в браузере. Это означает, что когда вы возвращаетесь на этот сайт, поле имени пользователя на странице входа в систему уже заполнено для вас. Отказ от этого файла cookie безопасен - вам нужно будет просто вводить свое имя пользователя при каждом входе в систему.
§ 7. ОБЩИЕ ПРЕДСТАВЛЕНИЯ О БЕЛКАХ
Белки – наиболее многочисленные и исключительно многообразные по функциям макромолекулы, играющие фундаментальную роль в формировании и поддержании структуры и функций живых организмов. С белками в живом организме связаны такие биологические процессы, как рост, деление, размножение и развитие клеток, реализация наследственной информации, мышечные сокращения, нервная деятельность, обмен веществ и т.д.
Белки – это высокомолекулярные биополимеры, структурную основу которых составляют полипептидные цепи, состоящие из аминокислотных остатков, связанных друг с другом пептидной связью. При их гидролизе образуются аминокислоты. В составе белков встречаются двадцать стандартных аминокислот. Для каждой стандартной аминокислоты существует генетический код, при помощи которого в генах записана информация о кодируемом белке. Кроме двадцати стандартных аминокислот, в составе белка встречаются и другие аминокислоты, они образуются в результате модификации стандартных аминокислот, после того как последние были включены в состав молекулы белка. Например, в составе белка коллагена содержится 5-гидроксилизин, который образуется в результате модификации стандартной аминокислоты лизина:
Кроме аминокислотных остатков, в состав белков могут входить и другие компоненты: ионы металлов, углеводы, липиды, нуклеиновые кислоты и др. Многообразие белков определяется не только их качественным составом, но и числом аминокислотных остатков, и прежде всего порядком их чередования в молекуле. Потенциально разнообразие белков безгранично.
Между аминокислотными остатками в молекуле белка существуют различные химические взаимодействия, это – ковалентные, ионные, водородные связи, гидрофобные взаимодействия, ван-дер-ваальсовы силы.
Рассмотрим их подробнее.
Ковалентные связи
В молекуле белка аминокислотные остатки соединяются друг с другом пептидной связью. По своей природе пептидная связь является ковалентной. Ее образование происходит за счет аминогруппы одной аминокислоты и карбоксильной группы другой аминокислоты:
В результате взаимодействия двух аминокислот образуется дипептид, состоящий соответственно из двух аминокислотных остатков, расположенных по обе стороны пептидной связи. Аналогичным образом могут соединиться три аминокислоты и при помощи двух пептидных связей образовать трипептид:
Точно так же можно получить тетрапептиды, пентапептиды и т.д. Если таким образом соединить большое число аминокислот, то возникнет структура, называемая полипептидом. Таким образом, молекулы белков представляют собой длинные полипептидные цепи, в которых аминокислотные остатки соединены друг с другом пептидными связями.
В пептидах выделяют особую структуру – пептидную группу. Ее образуют атомы кислорода, углерода, азота и водорода. Все атомы, образующие пептидную группу, находятся в одной плоскости. Пептидная связь в какой-то степени имеет характер двойной связи: вокруг нее нет свободного вращения и она короче других C–N-связей. Кислород и водород относительно пептидной связи находятся преимущественно в транс-положении.
Пептидные связи очень прочные, и для их химического гидролиза требуются жесткие условия, они гидролизуются лишь при длительном нагревании при высоких температурах в кислой среде. В клетке пептидные связи могут разрываться в мягких условиях с помощью ферментов, называемых протеазами, или пептидгидролазами.
Между остатками цистеина в молекуле белка могут образовываться дисульфидные связи (или дисульфидные мостики):
Дисульфидные мостики так же, как и пептидные связи, относятся к ковалентным связям. Дисульфидные мостики могут возникать как внутри полипептидной цепи, так и между различными полипептидными цепями:
Дисульфидные связи имеются не во всех белках.
Интересно знать! В составе волос содержится белок кератин. В его молекуле имеется большое количество дисульфидных связей. С помощью химической завивки волосам можно придать другую форму. Для этого волосы сначала накручивают на бигуди, затем обрабатывают раствором реагента-восстановителя, разрушающего дисульфидные связи, и прогревают. В результате этого кератин приобретает иную пространственную структуру. Далее волосы промывают и обрабатывают реагентом-окислителем, при этом происходит образование новых дисульфидных связей. Вследствие этого вновь приобретенная структура кератина стабилизируется. Волосы приобретают другую форму.
Ионные связи возникают между радикалами аминокислотных остатков, имеющих противоположные заряды, например, между положительно заряженной аминогруппой (-NH3 + ) остатка лизина и отрицательно заряженной карбоксильной группой (-СОО - ) остатка глутаминовой кислоты:
Гидрофобные взаимодействия
Гидрофобные радикалы аминокислот избегают контактов с водой и поэтому стремятся собраться вместе с помощью так называемых гидрофобных взаимодействий, образуя плотное гидрофобное ядро. Такие взаимодействия возможны, например, между остатками изолейцина и фенилаланина:
Водородные связи
Водородная связь в молекуле белка осуществляется между имеющим частично положительный заряд атомом водорода одной группировки и атомом (кислород, азот), имеющим частично отрицательный заряд и неподеленную электронную пару другой группировки. В белках различают два варианта образования водородных связей: между пептидными группами
и между боковыми радикалами полярных аминокислот. В качестве примера рассмотрим образование водородной связи между радикалами аминокислотных остатков, содержащих гидроксильные группы:
Ван-дер-ваальсовы силы имеют электростатическую природу. Они возникают между разноименными полюсами диполя. В молекуле белка существуют положительно и отрицательно заряженные участки, между которыми возникает электростатическое притяжение.
Рассмотренные выше химические связи принимают участие в формировании структуры белковых молекул. Благодаря пептидным связям образуются полипептидные цепи и, таким образом, формируется первичная структура белка. Пространственная организация белковой молекулы определяется в основном водородными, ионными связями, ван-дер-ваальсовыми силами, гидрофобными взаимодействиями. Водородные связи, возникающие между пептидными группами, определяют вторичную структуру белка. Формирование третичной и четвертичной структуры осуществляется водородными связями, образующимися между радикалами полярных аминокислот, ионными связями, ван-дер-ваальсовыми силами, гидрофобными взаимодействиями. Дисульфидные связи принимают участие в стабилизации третичной структуры.

5 Какую роль играет внутримолекулярная водородная связь в организации нативной (природной) структуры биополимеров — белков и нуклеиновых кислот?
*Цитирирование задания со ссылкой на учебник производится исключительно в учебных целях для лучшего понимания разбора решения задания.
Похожие решебники
Популярные решебники 11 класс Все решебники

Главная задача сайта: помогать школьникам и родителям в решении домашнего задания. Кроме того, весь материал совершенствуется, добавляются новые сборники решений.

Аминокислотами называются органические соединения, содержащие аминогруппу и карбоксильную группу. Например:

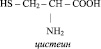
Аминокислоты относятся к веществам со смешанными функциями. Кроме того, они являются азотсодержащими и кислородсодержащими одновременно. Некоторые природные аминокислоты содержат также серу, как, например, цистеин:
Наиболее характерным химическим свойством аминокислот является способность аминогруппы одной молекулы вступать в реакцию замещения с карбоксильной группой другой молекулы:
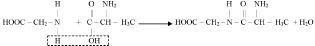
В результате образуется новая аминокислота, но уже с пептидной связью, способная взаимодействовать со следующей молекулой аминокислоты и образовать ещё одну пептидную связь. Последовательное увеличение количества пептидных связей в одной молекуле приводит к образованию полимеров, которые называются полипептидами, важнейшими представителями которых являются белки.
Белки – важнейшая составная часть клеток живых организмов – представляют собой полипептиды, составленные взаимодействием различных α-аминокислот. Таким образом, белки можно рассматривать как полимеры, мономером которых являются α-аминокислоты. Молекулярные массы природных белков колеблются от нескольких десятков тысяч до нескольких сот тысяч а.е.м. Аминокислотные остатки, являющиеся звеньями полипептида называют аминокислотными звеньями. Последовательность аминокислотных звеньев в линейной полипептидной цепи называется первичной структурой белковой молекулы (рис. 2.6).
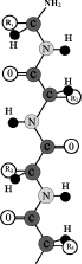
Рис. 2.6. Первичная структура белков.
R1, R2, R3, R4 – радикалы остатков аминокислот
Благодаря многочисленным водородным связям между группами –СО– и –NH– первичная структура белков свёртывается в спираль, которая называется вторичной структурой белковой молекулы (рис. 2.7).
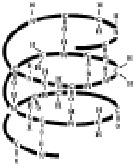
Рис. 2.7. Вторичная структура белков
В свою очередь, вторичная структура также способна свернуться, образовав третичную структуру (рис. 2.8).
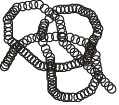
Рис. 2.8. Третичная структура белков
Третичная структура поддерживается уже не только водородными связями, но также и ковалентными. В частности между атомами серы различных участков полипептида часто образуется дисульфидный мостик
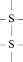
Некоторые белковые макромолекулы могут соединяться друг с другом, образуя относительно крупные агрегаты. Подобные полимерные образования белков называются четвертичными структурами. Примером такого белка является гемоглобин, который представляет комплекс из четырёх макромолекул (рис. 2.9). Оказывается, что только при такой структуре гемоглобин способен присоединять и транспортировать кислород в организме.
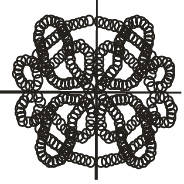
Рис. 2.9. Четвертичная структура белков
Нуклеиновыми кислотами (полинуклеотидами) называют высокомолекулярные органические соединения, повторяющимся звеном которых являются нуклеотиды состоящие из
1. Остатка фосфорной кислоты – НРО3 –
2. Остатка рибозы или дезоксирибозы
3. Радикалов азотистых оснований, а именно таких как: аденин, тимин, гуанин, цитозин, урацил.
Например, если радикал урацила обозначить У, то молекулярную формулу одного из нуклеотидов можно представить следующим образом:
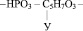
К нуклеиновым кислотам относятся рибонуклеиновые кислоты (РНК) и дезоксирибонуклеиновые кислоты (ДНК). Рибонуклеиновые кислоты – это полинуклеотиды, включающие в себя остаток рибозы, радикалы аденина, гуанина, цитозина и урацила. Поскольку различные нуклеотиды РНК отличаются только радикалами азотистых оснований, то нередко каждый нуклеотид обозначают прописной первой буквой названия этого нуклеотида. Поэтому фрагмент какой либо РНК можно представить так
Первичная структура молекулы белка, синтезируемого на информационной (матричной) рибонуклеиновой кислоте (м-РНК) с помощью ферментов[31], определяется именно последовательностью нуклеотидов на этой РНК. Набору из трёх азотистых оснований, который называется триплет нуклеотидов или кодон, соответствует одна и только одна α-аминокислота. В настоящее время насчитывается 20 таких аминокислот (табл. х). Но одной аминокислоте может соответствовать несколько триплетов нуклеотида. Соответствие аминокислоты кодонам называется генетическим кодом. Реакции синтеза белка, у которого последовательность аминокислотных звеньев определяется последовательностью нуклеотидов м-РНК, называются реакциями матричного синтеза.
Последовательность нуклеотидов и-РНК в свою очередь определяется последовательностью азотистых оснований в дезоксирибонуклеиновой кислоте (ДНК), на которой и происходит синтез м-РНК
Дезоксирибонуклеиновые кислоты – это кислоты, состоящие из двух полинуклеотидных цепей, включающих в себя остаток дезоксирибозы, радикалы аденина, гуанина, цитозина, тимина и соединённых между собой по принципу комплементарности (совместимости) водородными связями. То есть, вместо радикала урацила, нуклеотиды ДНК содержат тимил, вместо остатка рибозы, остаток дезоксирибозы,
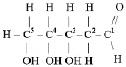
образующей замкнутый цикл соединением альдегидной группы с гидроксогруппой четвёртого атома углерода.
При этом А комплементарен Т, Г комплементарен Ц. То есть, фрагмент первичной структуры ДНК можно представить следующим образом:

Действительно, аденил в ДНК образует водородную связь только с тимилом, а тимил, только с аденилом. Гуанил только с цитозилом, а цитозил только с гуанилом:
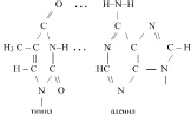
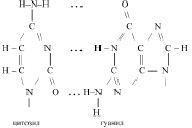
Молекулярную формулу одного из нуклеотидов ДНК можно представить так
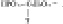
Вторичная структура ДНК представляет собой двойную спираль – две нити ДНК закручены одна вокруг другой (рис. 2.10).
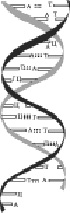
Рис. 2.10. Вторичная структура ДНК
Ферментативный синтез м-РНК осуществляется на одной из цепей ДНК в соответствии с принципом комплементарности. При этом аденин ДНК комплементарен урацилу РНК, тимил ДНК коиплементарен аденину РНК, гуанил ДНК комплементарен цитозилу РНК, цитозил ДНК комплементарен гуанилу РНК. Затем с м-РНК осуществляется матричный синтез белка. К каждому кодону информационной РНК доставляется соответствующая аминокислота с помощью транспортной РНК (т-РНК).
Таким образом, основным хранителем информации о структуре всех белков, вырабатываемых организмом является ДНК.
Отрезок ДНК, содержащий информацию о первичной структуре одного определённого белка, называется геном.
Процесс переписывания информации, содержащейся в гене ДНК на м-РНК называется транскрипцией.
1. Приведите структурные формулы аминокислот, которые Вы знаете. Дайте им названия.
2. Дайте определения понятиям: полипептиды и белки.
3. Что представляют собой первичная, вторичная, третичная и четвертичная структуры белка?
4. В чём сходство и различия химического состава, строения ДНК и РНК? Что такое ген?
5. Каким образом в клетках живых организмов синтезируется м-РНК? Что такое транскрипция?
6. Что такое матричный синтез? Почему в качестве отдельной структурной единицы РНК рассматривают три соседних нуклеотида, а не два или, например, четыре?
Читайте также:

