Виды химических веществ кратко
Обновлено: 08.07.2024
Вещество в химии — физическая субстанция со специфическим химическим составом. В философском словаре Григория Теплова в 1751 году словом вещество переводился латинский термин Substantia.
Вещество в современной физике как правило понимается как вид материи, состоящий из фермионов или содержащий фермионы наряду с бозонами; обладает массой покоя, в отличие от некоторых типов полей, как например электромагнитное [1] . Обычно (при сравнительно низких температурах и плотностях) вещество состоит из частиц, среди которых чаще всего встречаются электроны, протоны и нейтроны. Последние два образуют атомные ядра, а все вместе — атомы (атомное вещество), из которых — молекулы, кристаллы и т. д. В некоторых условиях, как например в нейтронных звездах, могут существовать достаточно необычные виды вещества.
Содержание
Различие между веществом и полем
Исторически в физике делалось фундаментальное различие между веществом и полем. Поле, в отличие от вещества, мыслилось непрерывным и проницаемым, в то время как частицы вещества представлялись дискретными, или по крайней мере достаточно локализованными. Известные в классической физике поля, такие как электромагнитное и гравитационное, противопоставлялись массивным и иногда электрически заряженным частицам вещества.
Современная физика нивелирует различие между веществом и полем, считая, что все частицы (в том числе и частицы вещества, равно как и частицы, относящиеся к классическим полям) есть квантовые возбуждения различных фундаментальных полей, и так или иначе все частицы проявляют такие типично полевые свойства, как делокализованность и подчинение уравнениям движения по сути не отличающимся от полевых (о чем можно говорить как о волновых свойствах всех частиц, в том числе и частиц вещества). Выявление тесной взаимосвязи между полем и веществом привело к углублению представлений о единстве всех форм и структуры физической картины мира.
Впрочем в контексте задач, относящихся к классической физике, а иногда и несколько шире, бывает иногда довольно удобно пользоваться и старой терминологией, хотя в контексте физики в целом она уже и выглядит анахронизмом. Например, если речь идет о взаимодействии заряженных частиц с электромагнитным полем, довольно удобно, следуя традиции называть одно "полем", а другое "веществом", особенно если вещество рассматривается или чисто классически, или - если квантово - то в терминах волновых функций (что позволяет избежать чисто терминологически неудобного пересечения понятий).
Свойства вещества
Каждому веществу присущ набор специфических свойств — объективных характеристик, которые определяют индивидуальность конкретного вещества и тем самым позволяют отличить его от всех других веществ. К наиболее характерным физико-химическим свойствам относятся константы — плотность, температура плавления, температура кипения, термодинамические характеристики, параметры кристаллической структуры. К основным характеристикам вещества принадлежат его химические свойства.
Классификация веществ
Число веществ в принципе неограниченно велико; к известному числу веществ всё время добавляются новые вещества, как открываемые в природе, так и синтезируемые искусственно.
Химическая классификация
Индивидуальные вещества и смеси
В химии принято разделять все объекты изучения на индивидуальные вещества (иначе — соединения) и их смеси. Под индивидуальным веществом понимают абстрактное понятие, обозначающее набор атомов, связанных друг с другом по определённому закону. Граница между индивидуальным веществом и смесью веществ довольно расплывчата, так как существуют вещества непостоянного состава, для которых, вообще говоря, нельзя предложить точной формулы. Кроме того, индивидуальное вещество остаётся абстракцией в силу того, что практически достижима лишь конечная чистота вещества. Это значит, что любой конкретный, реально существующий образец представляет собой смесь веществ, пусть и с подавляющим преобладанием одного из них. Несмотря на кажущуюся надуманность этого ограничения, зачастую чистота вещества играет ключевую роль в его свойствах. Так, знаменитая прочность титана проявляется только после того, как он очищен от кислорода до определённого предела (менее сотых долей процента).
Неорганические вещества
Органические вещества
Физическая классификация
Агрегатные состояния
Все химические вещества в принципе могут существовать в трёх агрегатных состояниях — твёрдом, жидком и газообразном. Так, лёд, жидкая вода и водяной пар — это твёрдое, жидкое и газообразное состояния одного и того же химического вещества — воды H2O. Твёрдая, жидкая и газообразная формы не являются индивидуальными характеристиками химических веществ, а соответствуют лишь различным, зависящим от внешних физических условий состояниям существования химических веществ. Поэтому нельзя приписывать воде только признак жидкости, кислороду — признак газа, а хлориду натрия — признак твёрдого состояния. Каждое из этих (и всех других веществ) при изменении условий может перейти в любое другое из трёх агрегатных состояний.
В физике рассматривается четвёртое агрегатное состояние вещества — плазма, частично или полностью ионизированное состояние, в котором плотность положительных и отрицательных зарядов одинакова (плазма электронейтральна).
При некоторых условиях (обычно достаточно отличающихся от обычных) те или иные вещества могут переходить в такие особые состояния, как сверхтекучее и сверхпроводящее.
Ключевые слова конспекта: предмет химии, вещества и их свойства, чистые вещества и смеси, способо разделения смесей.
Химия – это наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения. Химия является одной из наук, изучающих природу. Вместе с биологией и физикой химия принадлежит к числу естественных наук.
Вещество — это то, из чего состоит физическое тело. Вещество характеризуется определенными физическими свойствами.
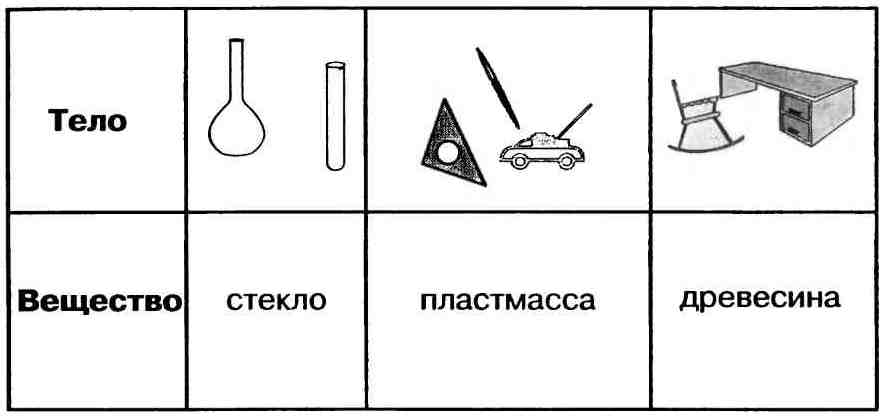
Свойства веществ — это признаки, по которым вещества отличаются друг от друга или сходны между собой, например:
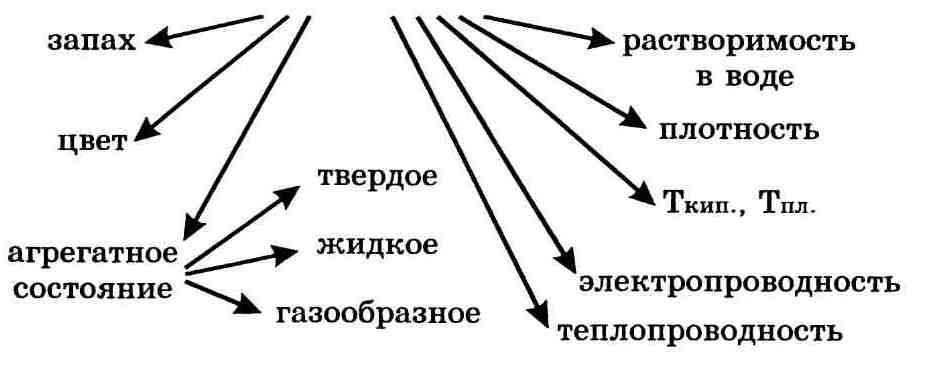
Важнейшие физические свойства вещества следующие: агрегатное состояние, цвет, запах, плотность, растворимость в воде, тепло-и электропроводность, температуры плавления и кипения.
Например, всем известное вещество алюминий можно охарактеризовать так: Алюминий — металл серебристо-белого цвета, сравнительно лёгкий (р = 2,7 г/см3), плавится при температуре 600°С. Алюминий очень пластичен. По электрической проводимости уступает лишь золоту, серебру и меди. Из-за лёгкости алюминий в виде сплавов широко используют в самолёто- и ракетостроении. Его также используют для изготовления электрических проводов и предметов быта.
Чистые вещества и смеси
Чистыми называются вещества, состоящие из одинаковых молекул. Смесь состоит из молекул разных веществ.
Каждое вещество имеет прежде всего свои, характерные именно для него свойства. Они в наибольшей степени проявляются, только если вещество является практически чистым, т. е. содержит мало примесей.
В природе чистых веществ не бывает, они встречаются преимущественно в виде смесей. Во многих случаях смеси нелегко отличить от чистых веществ. Например, сахар, растворяясь в воде, образует однородную по внешнему виду смесь. Даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в эту смесь. Такие смеси называют гомогенными (однородными).
Молоко на первый взгляд тоже кажется однородным веществом. Однако, если рассмотреть каплю молока под микроскопом, можно увидеть, что в ней плавает множество мельчайших капелек жира. Если дать молоку постоять, то эти капельки соберутся в верхнем слое, образуя сливки. Подобные неоднородные смеси называют гетерогенными смесями.
Однородные смеси — это смеси, в которых даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в смесь. Неоднородные смеси — это смеси, в которых невооруженным глазом или с помощью микроскопа можно заметить частицы веществ,составляющие смесь.
Способ разделения смесей
В смеси сохраняются свойства составляющих их веществ компонентов. На основании этих свойств выбирают рациональный способ разделения смесей.
Способы разделения смесей основаны на различии свойств веществ-компонентов, их составляющих: плотности, растворимости в воде и других жидкостях-растворителях, способности плавиться и испаряться.
Способы разделения смесей: неоднородные смеси — отстаивание и фильтрование, действие магнитом; однородные смеси — перегонка, выпаривание, кристаллизация и хроматография.
Отстаивание. Прием разделения смеси твердого и жидкого вещества путем осаждения твердого на дно под действием сил тяжести.
- а) При выдерживании воды, содержащей частички глины, в емкостях глина медленно осаждается на дно, отстаивается. Применяется при очистке питьевой воды.
- б) Чтобы разделить смесь поваренной соли и речного песка, надо поместить ее в колбу и добавить воды. Соль растворится, а песок опустится на дно. Затем осторожно слить раствор, чтобы песок остался в колбе. Соль из раствора получают выпариванием воды.
- в) Для разделения смеси малорастворимых друг в друге жидкостей с различной плотностью используют делительную воронку. Это цилиндрический сосуд с краником внизу. Помещенная в эту воронку смесь бензина с водой или растительного масла с водой быстро расслаивается, причем водный слой оказывается внизу. Открывая кран, сливаем воду, а когда вода заканчивается, закрываем кран. В воронке — бензин или масло.
Фильтрование. Чтобы избавиться от нерастворимых в воде примесей, воду пропускают через фильтр. Материал фильтра — бумага, ткань, пористая керамика. Примеси остаются на фильтре, а вода очищается.
Действие магнитом. Выделение из неоднородной смеси веществ, способных к намагничиванию. К магниту притягиваются железные опилки.
Перегонка. Прием разделения однородных жидких смесей путем испарения летучих жидкостей, различающихся температурами кипения, с последующей конденсацией паров. Так из нефти, представляющей собой смесь жидких, газообразных и твердых углеводородов, получают попутные газы, бензин, керосин, дизельное топливо и другие продукты.
Выпаривание. Способ извлечения растворенного в жидком растворителе твердого или жидкого вещества. Например, упаривая воду из сладкого сиропа, получают сахар.
Кристаллизация. Избирательное извлечение одного из нескольких твердых веществ, содержащихся в растворе. Частичное упаривание воды с последующим охлаждением раствора приводит к осаждению кристаллов главного компонента. Так из морской воды выделяют поваренную соль NaCl, а другие соли, присутствующие в меньшем количестве, остаются в растворе.
Хроматография. Метод разделения смесей, основанный на различиях относительной растворимости веществ в используемом растворителе (жидкая фаза) и прочности связывания этих веществ поверхностью сорбента (твердая фаза).
Бумажная хроматография. Нанесем каплю раствора смеси двух веществ на расстоянии 2 см от края длинной полоски фильтровальной бумаги. Подвесим полоску в стеклянном цилиндре, на дне которого находится растворитель. Нижнюю часть полоски погрузим в растворитель, при этом пятно со смесью находится чуть выше. Верхняя часть полоски удерживается проволокой у отверстия цилиндра. Сверху цилиндр закроем стеклом, чтобы не испарялся растворитель. Боковые стороны полоски не касаются стенок цилиндра. Растворитель смачивает полоску, и жидкий фронт движется вверх за счет капиллярных сил. Вместе с растворителем по бумаге движутся и растворенные вещества. Если они цветные, то за движением можно наблюдать визуально. Вещество, которое лучше растворимо и менее прочно удерживается сорбентом (бумагой), поднимется выше. Когда фронт поднимется достаточно высоко и пятна разделятся, полоску вынимают и разрезают.
Колоночная хроматография — процесс, родственный рассмотренному. В качестве твердой фазы служит силикагель, помещенный в колонку. Только в этом случае смесь наносят равномерно вверху колонки, а потом добавляют растворитель. Разделенные вещества собирают внизу в разные стаканчики.
В неорганической химии вещества по составу делятся на простые и сложные.
- состоят из атомов одного химического элемента: сера S, углерод С, железо Fe, серебро Ag;
- подразделяют на металлы и неметаллы (включая благородные газы).
Сложные вещества — соединения:
- состоят из атомов двух или более химических элементов: N a 2 O , H C l , C u S O 4 ;
- подразделяют на: оксиды, основания, кислоты и соли.
Классификация простых веществ
1. Простые вещества условно делят на две группы: металлы и неметаллы.
Неметаллы в Периодической системе — это все элементы VIII А-группы (благородные газы) и VII А-группы (галогены), элементы VI А-группы (кроме полония), элементы V А-группы: азот, фосфор, мышьяк; углерод, кремний (IV А-группа); бор (III А-группа), а также водород. Остальные элементы относят к металлам.
Отличия свойств металлов и неметаллов приведены в таблице 1:
- газообразные: водород H 2 , азот N 2 , фтор F 2 ;
- жидкие: только бром B r 2 ;
- твёрдые: кремний Si, бор B, мышьяк As.
Амфотерные элементы находятся в А-группах Периодической системы: бериллий Be, алюминий Al, галлий Ga, германий Ge, олово Sn, свинец Pb, сурьма Sb, висмут Bi, полоний Po и др., а также большинство элементов Б-групп: хром Cr, марганец Mn, железо Fe, цинк Zn, кадмий Cd, золото Au и др., проявляют и металлические (оснóвные для соединений), и неметаллические (кислотные для соединений) свойства.
Благородные (инертные) газы (VIII А-группа Периодической системы): гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радиоактивный радон Rn:
- обнаруживаются в воздухе, в малых количествах — в воде, горных породах, природных газах;
- не имеют цвета, вкуса и запаха;
- крайне химически инертны;
- используются в источниках света для создания освещения различных цветов (Ne — огненно-красный, Xe— синевато-серый, тусклый, Ar — фиолетово-голубой и др).
2. Сложные соединения и их отличия от простых веществ.
Сложные вещества бывают органические, в основе которых лежит углерод, и неорганические (безуглеродные и некоторые углеродсодержащие соединения: карбиды, карбонаты, оксиды углерода и другие). Неорганические чаще всего подразделяют на оксиды, основания, кислоты и соли.
Главные отличия сложных неорганических веществ:
- Свойства элементов, входящих в соединение, не сохраняются. Например, металл кальций Ca и неметалл хлор C l 2 . Каждому из этих простых веществ присущи свои характеристики. А соль C a C l 2 имеет новые, отличные от характеристик простых веществ, свойства, сходные со свойствами класса солей.
- В ходе химических реакций сложное вещество может быть получено или разложено на составные части.
- Количественный состав сложного соединения всегда одинаков, независимо от места нахождения и способа получения (для веществ молекулярного состава).
Классификация неорганических соединений и их основные свойства приведены в таблице 2.
- газы: N O , C O 2
- жидкости: H 2 O
- твёрдые: C u O , S i O 2
- газы: H 2 S , H C l
- жидкости: H N O 3 , H 2 S O 4
- твёрдые: H 3 P O 4 , H 3 B O 3
- оксиды металлов (оснóвные): K 2 O , CaO;
- оксиды неметаллов (кислотные): N 2 O 5 , S O 3 ;
- амфотерные: ZnO, A l 2 O 3 .
- оснóвные: LiOH, C a ( O H ) 2 ;
- амфотерные: B e ( O H ) 2 , C r ( O H ) 3 .
- кислородсодержащие: H 2 S O 4 , H N O 3 ;
- бескислородные: H J , H 2 S .
- средние: N a 3 ( P O 4 ) 2 , C a C l 2 ;
- кислые: K H C O 3 , N a 2 H P O 4 ;
- оснóвные: Mg(OH)Cl, C u 2 ( O H ) 2 C O 3 ;
- комплексные: K 2 [ B e ( C O 3 ) 2 ] .
Классы и номенклатура неорганических веществ
Номенклатура — способ называния веществ.
Химическая формула — представление состава вещества с использованием символов химических элементов, числовых индексов и других знаков. Химическое название определяется составом вещества и изображается с помощью слова или группы слов. Названия строятся по номенклатурным правилам, с использованием русских названий элементов, кроме случаев, когда традиционно употребляются латинские корни (таблица 3):
| Ag — аргент | C — карб, карбон | H — гидр, гидроген | N — нитр | Pb — плюмб, | Si — сил, силик, силиц |
| As — арс, арсен | Cu — купр | Hg — меркур | Ni — никкол | S — сульф | Sn -станн |
| Au — аур | Fe — ферр | Mn — манган | O — окс, оксиген | Sb — стиб | |
| Например, оксид натрия N a 2 O , карбонат кальция C a C O 3 , перманганат калия K M n O 4 | |||||
- Названия простых веществ чаще всего совпадают с русскими названиями соответствующих химических элементов. По необходимости к ним добавляется числовая греческая приставка: моно — 1, ди (латинский) — 2, три — 3, тетра — 4, пента — 5, гекса — 6, гепта — 7, окта — 8, нона (латинский) — 9, дека — 10. Например, (моно) кальций Ca, (моно) медь Cu, дикислород O 2 , трикислород O 3 , тетрафосфор P 4 . Исключение: аллотропные модификации: углерода С — графит, сажа, алмаз; кислорода — озон O3.
- Названия сложных веществ составляют по химической формуле справа налево. Для каждого класса веществ существуют свои правила составления формул и названий:
- формула оксидов: ЭnOm, где n и m — числовые индексы, определяющиеся степенями окисления элементов. Например,
Li+1 и O-2→ L i 2 O ; Al+3 и O-2→ A l 2 O 3 ; N+5 и O-2→ N 2 O 5 .
Если элемент образует несколько оксидов, то в конце добавляют степень окисления римскими цифрами, заключая их в скобки:
Оксиды, которым соответствуют кислоты, также называют ангидридами: серный ангидрид S O 3 , азотный ангидрид N 2 O 5 и др.
- формула оснований: Me+n(OH-)n, где нижний индекс n — количество гидроксид-анионов OH-.
K+1 и OH- → KOH, Mg+2 и OH- → M g ( O H ) 2 .
Если элемент образует несколько гидроксидов, то в конце добавляют степень окисления римскими цифрами, заключая их в скобки:
F e ( O H ) 2 — гидроксид железа (II), C r ( O H ) 3 — гидроксид хрома (III).
- формула кислот HnК, где K — кислотный остаток.
Названия наиболее распространенных кислот и их остатков приведены в таблице 4:
| Формула и название кислоты | Название кислотного остатка, образующего соль |
| H A l O 2 метаалюминиевая | метаалюминат |
| H 3 A l O 3 ортоалюминиевая | ортоалюминат |
| H A s O 3 метамышьяковая | метаарсенат |
| H 3 A s O 4 ортомышьяковая | ортоарсенат |
| H 3 B O 3 ортоборная | ортоборат |
| HBr бромоводородная | бромид |
| HBrO бромноватистая | гипобромит |
| H B r O 3 бромноватая | бромат |
| HCN циановодородная | цианид |
| H 2 C O 3 угольная | карбонат |
| HCl хлороводородная | хлорид |
| HClO хлорноватистая | гипохлорит |
| H C l O 2 хлористая | хлорит |
| H C l O 3 хлорноватая | хлорат |
| H C l O 4 хлорная | перхлорат |
| HF фтороводородная | фторид |
| HJ йодоводородная | йодид |
| H M n O 4 марганцовая | перманганат |
| H N O 2 азотистая | нитрит |
| H N O 3 азотная | нитрат |
| H P O 3 метафосфорная | метафосфат |
| H 3 P O 4 ортофосфорная | ортофосфат |
| H 2 S сероводородная | сульфид |
| H 2 S O 3 сернистая | сульфит |
| H 2 S O 4 серная | сульфат |
| H 2 S i O 3 метакремниевая | метасиликат |
| H 3 S i O 4 ортокремниевая | ортосиликат |
Название образуется в зависимости от типа соли.
Бинарные соединения — сложные вещества, состоящие из двух элементов. В таких соединениях встречается два типа химической связи: ковалентная полярная (для неметаллов и некоторых амфотерных элементов) или ионная (для солей бескислородных кислот).
Названия строятся по схеме: к корню более электроотрицательного элемента добавляется окончание -ид (оксид, гидрид, карбид и т.д.) в именительном падеже + название второго элемента в родительном падеже, при необходимости добавляется числовое значение степени окисления: C S 2 — дисульфид углерода или сульфид углерода (IV), M n F 4 — тетрафторид марганца или фторид марганца (IV).
Для некоторых есть тривиальные названия: N H 3 — аммиак, S i Н 4 — силан, P H 3 — фосфин и др.
Строение и химические свойства
Простые вещества состоят из атомов одного химического элемента:
- одноатомные: благородные газы — гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радон Rn;
- двухатомные: водород H 2 , кислород O 2 , азот N 2 и галогены: хлор C l 2 , йод J 2 , бром B r 2 ;
- трех и более атомные: озон O 3 , белый фосфор P 4 , кристаллическая (ромбическая и моноклинная) сера S 8 .
Порядок соединения атомов при образовании из них веществ обусловливает особенности строения веществ. Различают вещества молекулярного и немолекулярного строения. Немолекулярное строение имеют все металлы и большинство их соединений, графит, красный фосфор, алмаз, кремний Si и др. Большинство неметаллов и их соединений состоят из молекул, т. е. имеют молекулярное строение.
Химические свойства металлов и неметаллов
1. Химические свойства металлов определяются способностью отдавать свободные электроны с внешнего уровня. Они являются восстановителями. Взаимодействие идет с:
- неметаллами:
- +кислород O 2 (кроме золота и металлов группы платины) → оксиды: 2 C a + O 2 → 2 C a O ;
- +галогены ( F 2 , C l 2 , B r 2 ) → галогениды (фторид, хлорид, бромид и т.д.): C u + B r 2 → C u B 2 ;
- +азот, фосфор, сера, водород → нитриды, фосфиды, сульфиды, гидриды: 3 C a + N 2 → C a 3 N 2 .
- водой (только щелочные и щелочно-земельные металлы) → гидроксиды: 2 N a + 2 H 2 O → 2 N a O H + H 2 ↑ ;
- кислотами (металлы, стоящие в ряду активности до водорода) → соль: M g + 2 H C l → M g C l 2 + H 2 ↑ ;
- растворами солей менее активных металлов: F e + C u S O 4 → F e S O 4 + C u , при следующих условиях:
- соли, вступающие в реакцию и получающиеся в ходе нее, должны быть растворимы;
- металл вытесняет из соли другой металл, если находится левее в ряду активности;
- щелочные и щелочно-земельные металлы в данном случае будут вступать в реакцию с водой, а не с солью.
- оксидами (более активный металл вытесняет менее активный): F e 2 O 3 + 2 A l → A l 2 O 3 + 2 F e .
2. Химические свойства неметаллов обусловлены свободными электронами (от 3 до 7) на внешнем электронном уровне.
- окислительные свойства наиболее характерны (стремятся присоединять электроны) в реакциях с:
- металлами: O 2 + 2 M g → 2 M g O ; S + 2 N a → N a 2 S ;
- неметаллами:
- кислород O 2 (из галогенов реагирует только фтор): S + O 2 → S O 2 ;
- водород H 2 (кроме кремния, фосфора и бора) : С + 2 H 2 → C 4 ;
- неметалл c меньшей электроотрицательностью: 3 S + 2 P → P 2 S 3 (нагревание без доступа воздуха, сера — окислитель);
- солями (вытесняют менее активные неметаллы): C l 2 + 2 N a B r → 2 N a C l + B r 2 .
- восстановительные свойства (исключение: фтор F — всегда окислитель) в некоторых реакциях с:
- неметаллами, электроотрицательность которых ниже: C + O 2 → C O 2 (углерод — восстановитель);
- сложными веществами — окислителями ( C u O , H N O 3 ) : S + 6 H N O 3 → H 2 S O 4 + 6 N O 2 ↑ + 2 H 2 O .
- и окислительные, и восстановительные свойства проявляют хлор, сера, фосфор, йод и бром в реакциях диспропорционирования:
- C l 2 0 + H 2 O → H C l - 1 + H C l + 1 O ;
- 3 S 0 + 6 N a O H → 2 N a 2 S - 2 + N a 2 S + 6 O 3 + 3 H 2 O .
Химические свойства благородных газов
- плохо растворяются в воде и вступают в реакции с другими веществами только в специально созданных условиях;
- не горят; вытесняют кислород из воздуха, снижая его содержание до критически низких показателей, приводящих к смерти.
Строение и основные химические свойства сложных веществ
Сложные соединения имеют ионную или ковалентную связь между атомами.
- оснóвные + кислоты → соли: C a O + 2 H C l → C a C l 2 + H 2 O ;
- кислотные + основания → соли: S O 3 + 2 N a O H → N a 2 S O 4 + H 2 O ;
- амфотерные реагируют и с кислотами, и с основаниями → соли:
Z n O + H 2 S O 4 → Z n S O 4 + H 2 О ,
Z n O + 2 N a O H + H 2 O → N a 2 [ Z n ( O H ) 4 ] .
Все основания реагируют с кислотами (реакция нейтрализации):
- K O H + 2 H C l → K C l + H 2 O ;
- 2 F e ( O H ) 3 + 3 H 2 S O 4 → F e 2 ( S O 4 ) 3 + 6 H 2 O .
1. Щелочи взаимодействуют с:
- неметаллами: 6 K O H + 3 S → K 2 S O 3 + 2 K 2 S + 3 H 2 O ;
- кислотными оксидами: 2 N a O H + N O 2 → N a N O 2 + N a N O 3 + H 2 O .
2. Нерастворимые основания разлагаются при нагревании: C u ( O H ) 2 → C u O + H 2 O .
- + основания (реакция нейтрализации): 2 F e ( O H ) 3 + 3 H 2 S O 4 → F e 2 ( S O 4 ) 3 + 6 H 2 O ;
- + металлы, стоящие левее водорода в ряду активности: M g + 2 H C l → M g C l 2 + H 2 ↑ ;
- + основные и амфотерные оксиды: C a O + H 2 S O 4 → C a S O 4 + H 2 O ; Z n O + H 2 S O 4 → Z n S O 4 + H 2 O ;
- + соли: B a C l 2 + H 2 S O 4 → B a S O 4 + 2 H C l .
- + кислоты (сильные): N a 2 S i O 3 + 2 H C l → H 2 S i O 3 ↓ + 2 N a C l ;
- + щёлочи, если образуется нерастворимое основание: F e C l 3 + 3 N a O H → F e ( O H ) 3 ↓ + 3 N a C l ;
- + металлы: Z n + P b ( N O 3 ) 2 → P b ↓ + Z n ( N O 3 ) 2 ;
- + соли при условии необратимости реакции: N a 2 C O 3 + C a ( N O 3 ) 2 → C a C O 3 ↓ + 2 N a N O 3 .

Какая сила удерживает вместе атомы в молекуле вещества и почему они не разбегаются в разные стороны? Эта сила называется химической связью, школьники узнают о ней в 8 классе. Еще Ньютон предположил, что она имеет электростатическую природу, но подробнее в этом разобрались лишь в начале ХХ века. Сейчас расскажем, что такое химическая связь и какой она бывает.
О чем эта статья:
Статья находится на проверке у методистов Skysmart.
Если вы заметили ошибку, сообщите об этом в онлайн-чат (в правом нижнем углу экрана).
Химическая связь и строение вещества
| Химическая связь — это взаимодействие между атомами в молекуле вещества, в ходе которого два электрона (по одному от каждого атома) образуют общую электронную пару либо электрон переходит от одного атома к другому. |
Как понятно из определения химической связи, при взаимодействии двух атомов один из них может притянуть к себе внешние электроны другого. Эта способность называется электроотрицательностью (ЭО). Атом с более высокой электроотрицательностью (ЭО) при образовании химической связи с другим атомом может вызвать смещение к себе общей электронной пары.
Существует несколько систем измерения ЭО, но пользоваться для расчетов можно любой из них. Для образования химической связи важно не конкретное значение ЭО, а разница между этими показателями у двух атомов.
Механизм образования химической связи
Существует два механизма взаимодействия атомов:
обменный — предполагает выделение по одному внешнему электрону от каждого атома и соединение их в общую пару;
донорно-акцепторный — происходит, когда один атом (донор) выделяет два электрона, а второй атом (акцептор) принимает их на свою свободную орбиталь.
Независимо от механизма химическая связь между атомами сопровождается выделением энергии. Чем выше ЭО атомов, т. е. их способность притягивать электроны, тем сильнее и этот энергетический всплеск.
| Энергией связи называют ту энергию, которая выделяется при взаимодействии атомов. Она определяет прочность химической связи и по величине равна усилию, необходимому для ее разрыва. |
Также на прочность влияют следующие показатели:
Длина связи — расстояние между ядрами атомов. С уменьшением этого расстояния растет энергия связи и увеличивается ее прочность.
Кратность связи — количество электронных пар, появившихся при взаимодействии атомов. Чем больше это число, тем выше энергия и, соответственно, прочность связи.
На примере химической связи в молекуле водорода посмотрим, как меняется энергия системы при сокращении расстояния между ядрами атомов. По мере сближения ядер электронные орбитали этих атомов начинают перекрывать друг друга, в итоге появляется общая молекулярная орбиталь. Неспаренные электроны через области перекрывания смещаются от одного атома в сторону другого, возникают общие электронные пары. Все это сопровождается нарастающим выделением энергии. Сближение происходит до тех пор, пока силу притяжения не компенсирует сила отталкивания одноименных зарядов.

Основные типы химических связей
Различают четыре вида связей в химии: ковалентную, ионную, металлическую и водородную. Но в чистом виде они встречаются редко, обычно имеет место наложение нескольких типов химических связей. Например, в молекуле фосфата аммония (NH4)3PO4присутствует одновременно ионная связь между ионами и ковалентная связь внутри ионов.
Также отметим, что при образовании кристалла от типа связи между частицами зависит, какой будет кристаллическая решетка. Если это ковалентная связь — образуется атомная решетка, если водородная — молекулярная решетка, а если ионная или металлическая — соответственно, будет ионная или металлическая решетка. Таком образом, влияя на тип кристаллической решетки, химическая связь определяет и физические свойства вещества: твердость, летучесть, температуру плавления и т. д.
Основные характеристики химической связи:
насыщенность — ограничение по количеству образуемых связей из-за конечного числа неспаренных электронов;
полярность — неравномерная электронная плотность между атомами и смещение общей пары электронов к одному из них;
направленность — ориентация связи в пространстве, расположение орбиталей атомов под определенным углом друг к другу.
Ковалентная связь
Как уже говорилось выше, этот тип связи имеет два механизма образования: обменный и донорно-акцепторный. При обменном механизме объединяются в пару свободные электроны двух атомов, а при донорно-акцепторном — пара электронов одного из атомов смещается к другому на его свободную орбиталь.
| Ковалентная связь — это процесс взаимодействия между атомами с одинаковыми или близкими радиусами, при котором возникает общая электронная пара. Если эта пара принадлежит в равной мере обоим взаимодействующим атомам — это неполярная связь, а если она смещается к одному из них — это полярная связь. |
Как вы помните, сила притяжения электронов определяется электроотрицательностью атома. Если у двух атомов она одинакова, между ними будет неполярная связь, а если один из атомов имеет большую ЭО — к нему сместится общая электронная пара и получится полярная химическая связь.
В зависимости от того, сколько получилось электронных пар, химические связи могут быть одинарными, двойными или тройными.
Ковалентная неполярная связь образуется в молекулах простых веществ, неметаллов с одинаковой ЭО: Cl2, O2, N2, F2 и других.
Посмотрим на схему образования этой химической связи. У атомов водорода есть по одному внешнему электрону, которые и образуют общую пару.

Ковалентная полярная связь характерна для неметаллов с разным уровнем ЭО: HCl, NH3,HBr, H2O, H2S и других.
Посмотрим схему такой связи в молекуле хлороводорода. У водорода имеется один свободный электрон, а у хлора — семь. Таким образом, всего есть два неспаренных электрона, которые соединяются в общую пару. Поскольку в данном случае ЭО выше у хлора, эта пара смещается к нему.

Другой пример — молекула сероводорода H2S. В данном случае мы видим, что каждый атом водорода имеет по одной химической связи, в то время как атом серы — две. Количество связей определяет валентность атома в конкретном соединении, поэтому валентность серы в сероводороде — II.

Число связей, которые могут быть у атома в молекуле вещества, называется валентностью.
Характеристики ковалентной связи:

Ионная связь
Как понятно из названия, данный тип связи основан на взаимном притяжении ионов с противоположными зарядами. Он возможен между веществами с большой разницей ЭО — металлом и неметаллом. Механизм таков: один из атомов отдает свои электроны другому атому и заряжается положительно. Второй атом принимает электроны на свободную орбиталь и получает отрицательный заряд. В результате этого процесса образуются ионы.
| Ионная связь — это такое взаимодействие между атомами в молекуле вещества, итогом которого становится образование и взаимное притяжение ионов. |
Разноименно заряженные ионы стремятся друг к другу за счет кулоновского притяжения, которое одинаково направлено во все стороны. Благодаря этому притяжению образуются ионные кристаллы, в решетке которых заряды ионов чередуются. У каждого иона есть определенное количество ближайших соседей — оно называется координационным числом.
Обычно ионная связь появляется между атомами металла и неметалла в таких соединениях, как NaF, CaCl2, BaO, NaCl, MgF2, RbI и других. Ниже схема ионной связи в молекуле хлорида натрия.

Все соли образованы с помощью ионных связей, поэтому в задачах, где нужно определить тип химической связи в веществах, в качестве подсказки можно использовать таблицу растворимости.
Характеристики ионной связи:
не имеет направленности.

Ковалентная и ионная связь в целом похожи, и одну из них можно рассматривать, как крайнее выражение другой. Но все же между ними есть существенная разница. Сравним эти виды химических связей в таблице.
Характеризуется появлением электронных пар, принадлежащих обоим атомам.
Характеризуется появлением и взаимным притяжением ионов.
Общая пара электронов испытывает притяжение со стороны обоих ядер атомов.
Ионы с противоположными зарядами подвержены кулоновскому притяжению.
Имеет направленность и насыщенность.
Ненасыщенна и не имеет направленности.
Количество связей, образуемых атомом, называется валентностью.
Количество ближайших соседей атома называется координационным числом.
Образуется между неметаллами с одинаковой или не сильно отличающейся ЭО.
Образуется между металлами и неметаллами — веществами со значимо разной ЭО.
Металлическая связь
Свободные электроны мигрируют от одного иона к другому, временно соединяясь с ними и снова отрываясь в свободное плавание. Этот механизм по своей природе имеет сходство с ковалентной связью, но взаимодействие происходит не между отдельными атомами, а в веществе.

Характеристики металлической связи:
Металлическая связь присуща как простым веществам — таким как Na, Ba, Ag, Cu, так и сложным сплавам — например, AlCr2, CuAl11Fe4, Ca2Cu и другим.
Схема металлической связи:

M — металл,
n — число свободных внешних электронов.
К примеру, у железа в чистом виде на внешнем уровне есть два электрона, поэтому его схема металлической связи выглядит так:

Обобщим все полученные знания. Таблица ниже описывает кратко химические связи и строение вещества.

Водородная связь
Данный тип связи в химии стоит отдельно, поскольку он может быть как внутри молекулы, так и между молекулами. Как правило, у неорганических веществ эта связь происходит между молекулами.
| Водородная связь образуется между молекулами, содержащими водород. Точнее, между атомами водорода в этих молекулах и атомами с большей ЭО в других молекулах вещества. |
Объясним подробнее механизм этого вида химической связи. Есть молекулы А и В, содержащие водород. При этом в молекуле А есть электроотрицательные атомы, а в молекуле В водород имеет ковалентную полярную связь с другими электроотрицательными атомами. В этом случае между атомом водорода в молекуле В и электроотрицательным атомом в молекуле А образуется водородная связь.
Такое взаимодействие носит донорно-акцепторный характер. Донором электронов в данном случае выступают электроотрицательные элементы, а акцептором — водород.
Графически водородная связь обозначается тремя точками. Ниже приведена схема такого взаимодействия на примере молекул воды.

В отдельных случаях водородная связь может образоваться внутри молекулы. Это характерно для органических веществ: многоатомных спиртов, углеводов, белковых соединений и т. д.
Характеристики водородной связи:

Кратко о химических связях
Итак, самое главное. Химической связью называют взаимодействие атомов, причиной которого является стремление системы приобрести устойчивое состояние. Во время взаимодействия свободные внешние электроны атомов объединяются в пары либо внешний электрон одного атома переходит к другому.
Образование химической связи сопровождается выделением энергии. Эта энергия растет с увеличением количества образованных электронных пар и с сокращением расстояния между ядрами атомов.
Основные виды химических связей: ковалентная (полярная и неполярная), ионная, металлическая и водородная. В отличие от всех остальных водородная ближе к молекулярным связям, поскольку может быть как внутри молекулы, так и между разными молекулами.
Как определить тип химической связи:
Ковалентная полярная связь образуется в молекулах неметаллов между атомами со сходной ЭО.
Ковалентная неполярная связь имеет место между атомами с разной ЭО.
Ионная связь ведет к образованию и взаимному притяжению ионов. Она происходит между атомами металла и неметалла.
Водородная связь появляется при условии, что есть атом с высокой ЭО и атом водорода, связанный с другой электроотрицательной частицей ковалентной связью.
Химическая связь и строение молекулы: типом химической связи определяется кристаллическая решетка вещества: ионная, металлическая, атомная или молекулярная.
Читайте также:

