Валентные электроны это кратко
Обновлено: 30.06.2024
Давно известно, что атом состоит из протонов, нейтронов и электронов. Центральная масса атома состоит из протонов и нейтронов, а электроны вращаются на орбиталях. Количество и расположение протонов, нейтронов и электронов в атоме определяют физические, химические и электрические свойства элемента. Числа и расположение протонов, нейтронов и электронов в атоме все вместе называют структурой атома элемента. Структура альтернативно называется атомной структурой.
Атомная структура углерода и меди не одинакова, следовательно, их свойства различаются. Давайте рассмотрим структуру атома меди. Он имеет 29 электронов. Первая орбита состоит из 2 электронов, вторая-из 8, а третья-из 18 единиц. Четвертая или крайняя орбита состоит из 29 - 28 или 1 электрона. Электрон является наиболее важным элементом для детального изучения, потому что электроника основана на различном поведении электронов.
Электрон отрицательно заряжен очень маленькой и почти безмассовой частицей. Электрический заряд электрона составляет 1,602 × 10 - 19 кулонов. Масса электрона составляет 9 × 10 - 31 кг. Соотношение заряда к массе электрона составляет 1,602 × 10 - 19/9 × 10 - 31 или 1,71 × 10 11 кол / кг. Это соотношение доказывает, что заряд электрона значительно выше по сравнению с его массой. Это делает электрон чрезвычайно подвижным, и на него сильно влияют электрическое поле и магнитное поле.
Есть два типа энергии, связанные с электроном, движущимся вокруг ядра атома. Одним из них является кинетическая энергия из-за движения электрона. Другой является потенциальная энергия из-за заряда электрона, а также заряда ядра. Полная энергия, связанная с электроном, является суммой этих двух энергий. Энергия электрона больше на внешней орбите, чем у электрона на внутренней орбите. Итак, ясно, что электроны, движущиеся по самой внешней орбите, обладают самым высоким уровнем энергии. Вот почему электроны на последней или самой внешней орбите играют жизненно важную роль в определении физических, химических и, очевидно, электрических свойств элемента.
Соавтор(ы): Bess Ruff, MA. Бесс Руфф — аспирантка Университета штата Флорида, работает над получением степени PhD по географии. Получила степень магистра экологии и менеджмента в Калифорнийском университете в Санта-Барбаре в 2016 году. Проводила исследования для проектов по морскому пространственному планированию в Карибском море и обеспечивала научную поддержку в качестве дипломированного участника Группы устойчивого рыболовства.
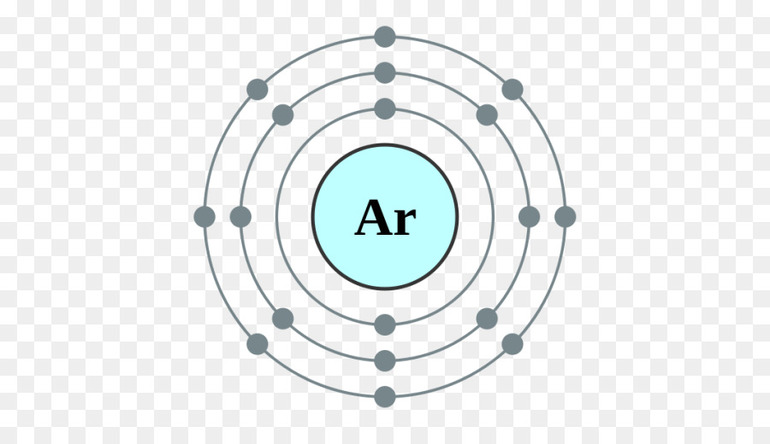
Валентные электроны находятся на внешней оболочке атома. Их количество определяет число возможных химических соединений, которые атом может образовать. Лучший способ определить количество валентных электронов — воспользоваться периодической таблицей Менделеева.
Непереходные металлы

Используйте периодическую таблицу химических элементов (таблицу Менделеева). Это определенным образом раскрашенная таблица, каждая ячейка которой содержит название химического элемента и другую важную информацию, которую можно использовать для определения количества валентных электронов в конкретном атоме. Таблицу Менделеева можно найти в учебнике по химии или здесь.

- Например, над водородом (Н) напишите цифру 1, так как с него начинается первый столбец, а над гелием (He) напишите цифру 18, так как с него начинается восемнадцатый столбец.

- Например, определим число валентных электронов углерода (С). Его атомный номер 6 и с него начинается четырнадцатая группа.
- В этом подразделе мы не рассматриваем переходные металлы, которые расположены в группах с 3 по 12. Эти элементы немного отличаются от остальных, поэтому описанные здесь методы на них не распространяются. Переходные металлы будут рассмотрены в следующем подразделе.

- Группа 1: 1 валентный электрон
- Группа 2: 2 валентных электрона
- Группа 13: 3 валентных электрона
- Группа 14: 4 валентных электрона
- Группа 15: 5 валентных электрона
- Группа 16: 6 валентных электрона
- Группа 17: 7 валентных электрона
- Группа 18: 8 валентных электрона (за исключением гелия, у которого 2 валентных электрона)
- В нашем примере, так как углерод находится в группе 14, можно заключить, что один атом углерода имеет четыре валентных электрона.
Переходные металлы

- Например, рассмотрим тантал (Ta); его атомный номер 73. Далее мы найдем число его валентных электронов (или, по крайней мере, попробуем это сделать).
- Обратите внимание, что переходные металлы включают лантаноиды и актиноиды (они также называются редкоземельными металлами) — два ряда элементов, которые, как правило, расположены ниже основной таблицы и которые начинаются с лантана и актиния. Все эти элементы относятся к группы 3 периодической таблицы.

- В атоме электроны расположены на электронных орбиталях. Каждая электронная орбиталь может содержать только какое-то определенное число электронов, причем заполняются орбитали, начиная с ближайшей к ядру атома и заканчивая наиболее далекой.
- При заполнении электронами внешней орбитали атома переходного металла они становятся валентными электронами, но на какое-то время, после чего в роль валентных электронов вступают электроны с других орбиталей. Это означает, что число валентных электронов может меняться.
- Для получения детальной информации о валентных электронах прочитайте эту статью. [3] X Источник информации

- Группа 3: 3 валентных электрона
- Группа 4: 2–4 валентных электрона
- Группа 5: 2–5 валентных электронов
- Группа 6: 2–6 валентных электронов
- Группа 7: 2–7 валентных электронов
- Группа 8: 2 или 3 валентных электрона
- Группа 9: 2 или 3 валентных электрона
- Группа 10: 2 или 3 валентных электрона
- Группа 11: 1 или 2 валентных электрона
- Группа 12: 2 валентных электрона
- В нашем примере тантал расположен в группе 5, поэтому можно заключить, что его атом имеет от двух до пяти валентных электрона (в зависимости от ситуации).
- Например, рассмотрим электронную конфигурацию натрия (Na): 1s 2 2s 2 2p 6 3s 1
- Обратите внимание, что электронная конфигурация строится по формуле: (цифра)(буква) (надстрочная цифра) (цифра)(буква) (надстрочная цифра) .
- . и так далее. Здесь (цифра)(буква) — это обозначение электронной орбитали, а (надстрочная цифра) — это число электронов на этой орбитали.
- В нашем примере в атоме натрия 2 электрона на 1s-орбитали плюс 2 электрона на 2s-орбитали плюс 6 электронов на 2р-орбитали плюс 1 электрон на 3s-орбитали. Всего 11 электронов, что верно, так как атомный номер натрия 11.
- Учтите, что подуровни электронных оболочек имеют определенное число электронов. Максимальное количество электронов для орбиталей следующее:
- s: 2 электрона
- p: 6 электронов
- d: 10 электронов
- f: 14 электронов
![Изображение с названием Find Valence Electrons Step 9]()
- Вот полная электронная конфигурация оганесона (Og; атомный номер 118): 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 6
- Теперь, чтобы определить электронную конфигурацию любого элемента, вам просто нужно заполнить этот шаблон (до тех пор, пока у вас не останется электронов). Это проще, чем кажется. Например, определите электронную конфигурацию хлора (Cl; атомный номер 17), атом которого имеет 17 электронов: 1s 2 2s 2 2p 6 3s 2 3p 5
- Обратите внимание, что общее число электронов равно 17: 2 + 2 + 6 + 2 + 5 = 17. Вам нужно изменить количество электронов на последней орбитали, так как предыдущие орбитали такие же, как в шаблоне (ибо полностью заполнены электронами).
- Для получения подробной информации об электронных конфигурациях прочитайте эту статью.
![Изображение с названием Find Valence Electrons Step 10]()
- Например, рассмотрим бор (B). Его атомный номер 5, то есть атом бора включает пять электронов, а его электронная конфигурация выглядит следующим образом: 1s 2 2s 2 2p 1 . Так как первая орбитальная оболочка имеет только два электрона, то можно заключить, что у бора только две оболочки: первая с двумя электронами (на 1s-орбитали), а вторая с тремя (на 2s- и 2р-орбиталях).
- В качестве другого примера рассмотрим хлор (Cl), у которого три орбитальные оболочки: первая с двумя электронами на 1s-орбитали, вторая с двумя электронами на 2s-орбитали и шестью электронами на 2р-орбитали, третья с двумя электронами на 3s-орбитали и пятью электронами на 3p-орбитали.
![Изображение с названием Find Valence Electrons Step 11]()
- Например, рассмотрим бор. Так как на внешней оболочке бора находятся три электрона, то можно заключить, что у бора три валентных электрона.
![Изображение с названием Find Valence Electrons Step 12]()
- Например, мы знаем, что у селена четыре орбитальные оболочки, потому что этот элемент расположен в четвертом периоде. Так как это шестой элемент (слева) четвертого периода (без учета переходных металлов), можно заключить, что внешняя четвертая оболочка содержит шесть электронов, и, таким образом, у селена шесть валентных электрона.
- Обратите внимание, что электронные конфигурации могут быть записаны в сокращенном виде с использованием благородных газов (элементы группы 18). Например, электронную конфигурацию натрия можно записать так: [Ne]3s1 — по сути, она напоминает электронную конфигурацию неона, но с одним дополнительным электроном на 3s-орбитали. [5] X Источник информации
- У переходных металлов есть валентные подуровни, незаполненные полностью. Определение точного числа валентных электронов в переходных металлах включает в себя принципы квантовой теории и не рассматривается в данной статье.
- Обратите внимание, что форма (вид) периодической таблицы химических элементов может отличаться в разных странах. Поэтому убедитесь, что вы пользуетесь формой периодической таблицы химических элементов, которая принята в вашей стране (чтобы избежать ошибок).
- Следите за действиями (вычитание или сложение) при нахождении валентных электронов.
Дополнительные статьи
![найти число протонов, нейтронов и электронов]()
![пользоваться таблицей Менделеева]()
![написать электронную конфигурацию атома любого элемента]()
![рассчитать концентрацию раствора]()
![сделать слоновью зубную пасту]()
![посчитать pH]()
![найти число нейтронов в атоме]()
![посчитать молярную массу]()
![написать ионное уравнение]()
![определить степень окисления]()
![рассчитать атомную массу]()
![рассчитать электроотрицательность]()
![сделать кристаллы соли]()
![разбавить раствор]()
Об этой статье
В химии валентными электронами (ВЭ) называют те электроны, которые находятся на внешней оболочке атомного ядра. Они имеют важное значение, потому что дают глубокое понимание химических свойств элемента. Например, является ли вещество по своей природе электроположительным или электроотрицательным, или порядок связей может образовываться между двумя атомами.
![Валентные электроны]()
Электроны и валентность
Международный союз теоретической и прикладной химии определил валентность как максимальное число одновалентных атомов (первоначально — водорода или хлора), которые могут объединяться с атомом или фрагментом рассматриваемого элемента.
Современная альтернативная трактовка звучит несколько иначе: валентность — это число атомов водорода, которые могут объединяться с элементом в бинарном гидриде, или удвоенное количество атомов кислорода, объединяющихся с элементом в его оксиде или оксидах. Это определение отличается от формулировки МСТПХ, поскольку большинство веществ имеет более чем одну валентность.
Модель ядерного атома Резерфорда (1911) показала, что внешнюю оболочку атома занимают заряженные частицы, это свидетельствует о том, что электроны ответственны за взаимодействие атомов и образование химических связей.
В 1916 году Гилберт Н. Льюис объяснил валентность и химическую связь с точки зрения тенденции атомов достигать стабильного октета из 8 электронов в валентной оболочке.
![Электроны]()
В 1930-х годах Линус Полинг предположил, что существуют также полярные ковалентные связи, которые являются промежуточными, а степень ионного характера зависит от разницы электроотрицательности двух связанных атомов.
Полинг также рассматривал гипервалентные молекулы, в которых элементы имеют кажущиеся валентности, например, в молекуле гексафторида серы (SF6). Учёный считал, что сера образует 6 истинных двух электронных связей с использованием sp 3 d 2 гибридных атомных орбиталей, которые объединяют одну s, три p и две d орбитали.
Для основных элементов в периодической таблице Менделеева валентность может варьироваться от 1 до 7. Многие вещества имеют общую валентность, связанную с их положением в таблице. Для описания ионов в зарядовых состояниях 1, 2, 3 и т. д. (соответственно) используются греческие/латинские цифровые префиксы (моно- / уни- / би- / три-).
![Валентные электроны как определить]()
Виды с одним зарядом являются одновалентными. Например, Cs + — одновалентный катион, тогда как Ca 2+ является двухвалентным, а Fe 3+ — трёхвалентным. Существуют также поливалентные катионы, которые не ограничены определённым количеством валентных связей.
В отличие от Cs и Ca, Fe может существовать в других зарядовых состояниях, особенно 2+ и 4+, и поэтому известен как многовалентный (поливалентный) ион.
Переходные металлы и металлы, как правило, многовалентны, но, к сожалению, не существует простой схемы, предсказывающей их валентность.
Определение количества
Можно определить количество электронов с помощью специального онлайн-калькулятора. Однако его нахождение под рукой не всегда возможно. Поэтому следующий вариант — обратиться к атомной конфигурации элемента и просто сосчитать число заряженных частиц в самой внешней оболочке атома. Однако это чрезвычайно утомительное занятие, так как, возможно, придётся пролистать много учебников, чтобы найти конфигурации, с которыми исследователь не знаком.
![Определение валентности по формуле]()
Количество ВЭ элемента и его валентность определить по таблице Менделеева проще всего. Нужно обратить внимание на вертикальный столбец, в котором указана классификация.
Исключением являются переходные металлы — 3−12 группы.
Цифра в порядковом номере группы показывает, сколько валентных электронов связано с нейтральным атомом вещества, указанного в этом конкретном столбце.
Пример в таблице:
Группа ВЭ 1 (I) (щелочные металлы) 1 2 (II) (щёлочноземельные металлы) 2 3−12 (переходные металлы) 3−12 13 (III) (борная группа) 3 14 (IV) (углеродная) 4 15 (V) (группа азота) 5 16 (VI) (кислородная группа) 6 17 (VII) (галогены) 7 18 (VIII или 0) (благородные газы) 8 Надо сказать, что периодическая таблица — это аккуратное расположение всех элементов, которые известны науке на данный момент.
Они располагаются слева направо в порядке возрастания их атомарных номеров или числа протонов (электронов), которые они содержат.
Все вещества в таблице Менделеева делятся на четыре категории:
- элементы основной группы;
- переходные элементы;
- лантаноиды;
- актиниды.
Последние два — это внутренние переходные элементы, образующие мост в группах 2 и 13. Таблица содержит строки — периоды — и 18 столбцов, известных как группы. Есть ещё подтаблица, которая содержит 7 строк и 2 столбца с более редкими веществами.
Номер строки (периода) элемента показывает количество оболочек, окружающих его ядро.
Химические реакции
Число электронов, содержащихся во внешней оболочке атома, которая ещё называется валентной, определяет его способность образовывать связи. Поэтому элементы с одинаковым количеством валентных электронов в атоме группируются в периодическую таблицу. Обычно вещества главной группы, исключая гелий и водород, имеют тенденцию вступать в реакцию с образованием замкнутой оболочки, которая соответствует конфигурации электронов s 2 p 6 . Это называется правилом октетов, поскольку у каждого связанного атома будет восемь ВЭ, учитывая общие электроны.
![Валентные электроны количество]()
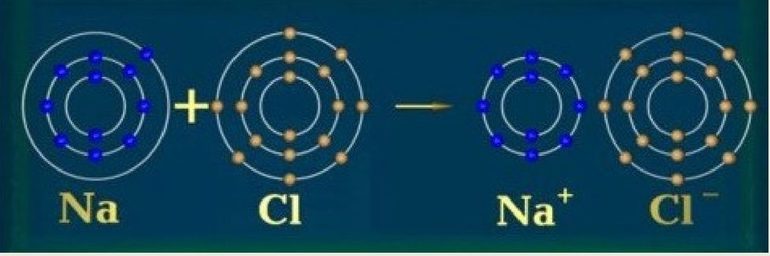
Из металлических элементов наиболее реакционноспособными являются щелочные металлы первой группы, например, калий и натрий. Такой атом имеет только один ВЭ. Эта единственная заряженная частица с лёгкостью теряется во время образования ионной связи, после чего образуется катион (положительный ион), например, K + или Na + , оболочка которого будет закрыта.
Вторая группа — щёлочноземельные металлы, например, магний, — менее реактивны. Чтобы получить положительный ион (Mg 2+ ), каждому их атому нужно отдать два ВЭ.
В любой группе (в столбце таблицы Менделеева) металлов реакционная способность становится больше, если двигаться от лёгкого вещества к более тяжёлому, то есть увеличивается с каждым нижним рядом таблицы. Происходит это просто потому, что у тяжёлых элементов больше оболочек. Их ВЭ приходится существовать в условиях более высоких главных квантовых чисел.
Они находятся дальше от атомного ядра и, следовательно, обладают более высокой потенциальной энергией, это означает, что связь между ними менее тесная.
Атом неметалла настроен привлекать дополнительные ВЭ, чтобы образовать полную валентную оболочку. Это может быть достигнуто одним из двух способов:
- посредством ковалентной связи, то есть атом поделится электронами с соседом;
- будет использована ионная связь, то есть электроны возьмут из другого атома.
![Как определить валентность по таблице менделеева]()
Наиболее реактивными видами неметаллических элементов являются галогены. К ним можно отнести хлор (Cl) или, например, фтор (F).
Если двигаться от лёгкого элемента к тяжёлому, в пределах каждой группы неметаллов их реакционная способность будет уменьшаться. Это потому, что ВЭ будут терять тесную связь, поскольку приобретают более высокую энергию. По факту, самый лёгкий элемент в группе 16 — кислород — наиболее реакционноспособный неметалл, после фтора, конечно.
В таких простых случаях, когда соблюдается правило октета, валентность атома равна количеству разделённых электронов, потерянных или полученных для того, чтобы сформировался стабильный октет. Однако есть также много молекул, для которых валентность менее чётко определена, но это скорее исключения.
Электронная конфигурация
Заряженные частицы, определяющие химическую реакцию атома, — это те, чьё среднее расстояние от ядра самое большое, то есть они обладают самой высокой энергией. Для элемента основной группы ВЭ определяются как те, что находятся в электронной оболочке с наибольшим главным квантовым числом n.
Следовательно, число валентных электронов, которое может быть у вещества, зависит от конфигурации самих частиц. Например, чтобы определить валентные электроны фосфора, нужно записать его конфигурацию: 1s 2 2s 2 2p 6 3s 2 3p 3 . Итак, получается 5 ВЭ (3s 2 3p 3 ), что соответствует максимальной валентности для P, равной 5.
![число валентных электронов]()
Однако переходные элементы имеют частично заполненные (n — 1) d энергетические уровни, к слову, довольно близкие по энергии к уровню ns. Поэтому, в отличие от веществ основной группы, ВЭ для переходного металла определяется как частица, которая находится вне ядра благородного газа.
Как правило, d-электроны в переходных металлах ведут себя как валентные, хотя они не находятся в оболочке. Например, марганец (Mn) имеет конфигурацию 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 , это сокращённо — [Ar] 4s 2 3d 5 , где [Ar] — обозначение конфигурации ядра, идентичной благородному газу — аргону. Электрон 3d этого атома имеет энергию, аналогичную 4s, но превышающую 3s или 3p.
Чем правее вещество расположено в ряду переходных металлов, тем энергия его заряженной частицы в субоболочке ниже, и тем меньше валентных свойств у такого электрона.
Например, хотя обычно у атома никеля десятая валентность (4s 2 3d 8 ), его степень окисления никогда не превышает четырёх. Для цинка 3d-оболочка является полной и ведёт себя подобно электронам ядра.
Поскольку количество ВЭ, участвующих в химических реакциях фактически, предсказать сложно, концепция этой частицы несёт мало пользы для переходных металлов, если сравнивать с элементами из основной группы. Однако подсчёт электронов для понимания химии переходных металлов является альтернативным инструментом.
Электрическая проводимость
Ответственность за электрическую проводимость вещества в том числе лежит и на электронах. Вследствие чего элементы классифицируются следующим образом:
В твёрдом состоянии металлические элементы обычно имеют высокую электропроводность. Поскольку валентный электрон металла обладает небольшой энергией ионизации, находясь в твёрдом состоянии, он относительно свободно покидает атом, чтобы связываться с другими.
Когда электрон свободный, он может перемещаться под воздействием электрического поля, то есть создавать электрический ток, отвечая за электропроводность металла. Примером хороших проводников могут служить серебро, равно как и золото, алюминий и, конечно, медь.
![валентность элементов]()
Как изолятор действует неметаллический элемент, поскольку имеет низкую электропроводность. В таблице Менделеева такие вещества находятся справа. Их валентная оболочка заполнена наполовину (исключение составляет бор). Когда на атом воздействует некоторое электрическое поле, заряженная частица не может его легко покинуть, поэтому такой элемент может проводить слабый постоянный или переменный электрический ток. Например, сера и алмаз — одни из таких веществ.
Изолятором также может быть твёрдое соединение, которое содержит металлы, если для образования ионных связей используются ВЭ атомов металла. К примеру, натрий, хоть он и представляет собой мягкий металл, однако твёрдый хлорид натрия является изолятором.
Поскольку для образования ионной связи ВЭ натрия переносятся в хлор, электроны не имеют возможности легко перемещаться.
Полупроводники обладают промежуточной между металлами и неметаллами электрической проводимостью. Интересно, что при увеличении температуры у этих веществ улучшается проводимость. Германий и кремний можно отнести к типичным элементарным полупроводникам, каждый их атом имеет 4 ВЭ. Надо сказать, что лучше всего свойства полупроводников объясняются с помощью теории зон.
Мы приступаем к изучению химии - мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными формулами элементов.
Атом (греч. а - отриц. частица + tomos - отдел, греч. atomos - неделимый) - электронейтральная частица вещества микроскопических размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется "планетарной" и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом
![Планетарная модель атома]()
Протон (греч. protos - первый) - положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов элементов. Нейтрон (лат. neuter - ни тот, ни другой) - нейтральная (0) элементарная частица, присутствующая в ядрах всех химических элементов, кроме водорода.
Электрон (греч. elektron - янтарь) - стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома - порядковый номер в таблице Менделеева - равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.
![Электроны и протоны]()
Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Состоит из s-подуровня: одной "1s" ячейки, в которой помещаются 2 электрона (заполненный электронами - 1s 2 )
Состоит из s-подуровня: одной "s" ячейки (2s 2 ) и p-подуровня: трех "p" ячеек (2p 6 ), на которых помещается 6 электронов
Состоит из s-подуровня: одной "s" ячейки (3s 2 ), p-подуровня: трех "p" ячеек (3p 6 ) и d-подуровня: пяти "d" ячеек (3d 10 ), в которых помещается 10 электронов
Состоит из s-подуровня: одной "s" ячейки (4s 2 ), p-подуровня: трех "p" ячеек (4p 6 ), d-подуровня: пяти "d" ячеек (4d 10 ) и f-подуровня: семи "f" ячеек (4f 14 ), на которых помещается 14 электронов
![Энергетические уровни]()
Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: "s", "p" и "d", которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный "рисунок".
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь - клеверный лист.
![Атомные орбитали]()
Правила заполнения электронных орбиталей и примеры
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной "ячейке") не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются еще одним электроном с противоположным направлением
- Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
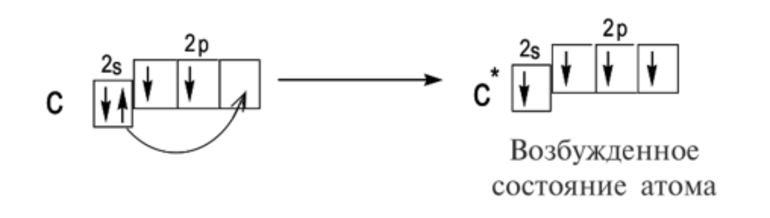
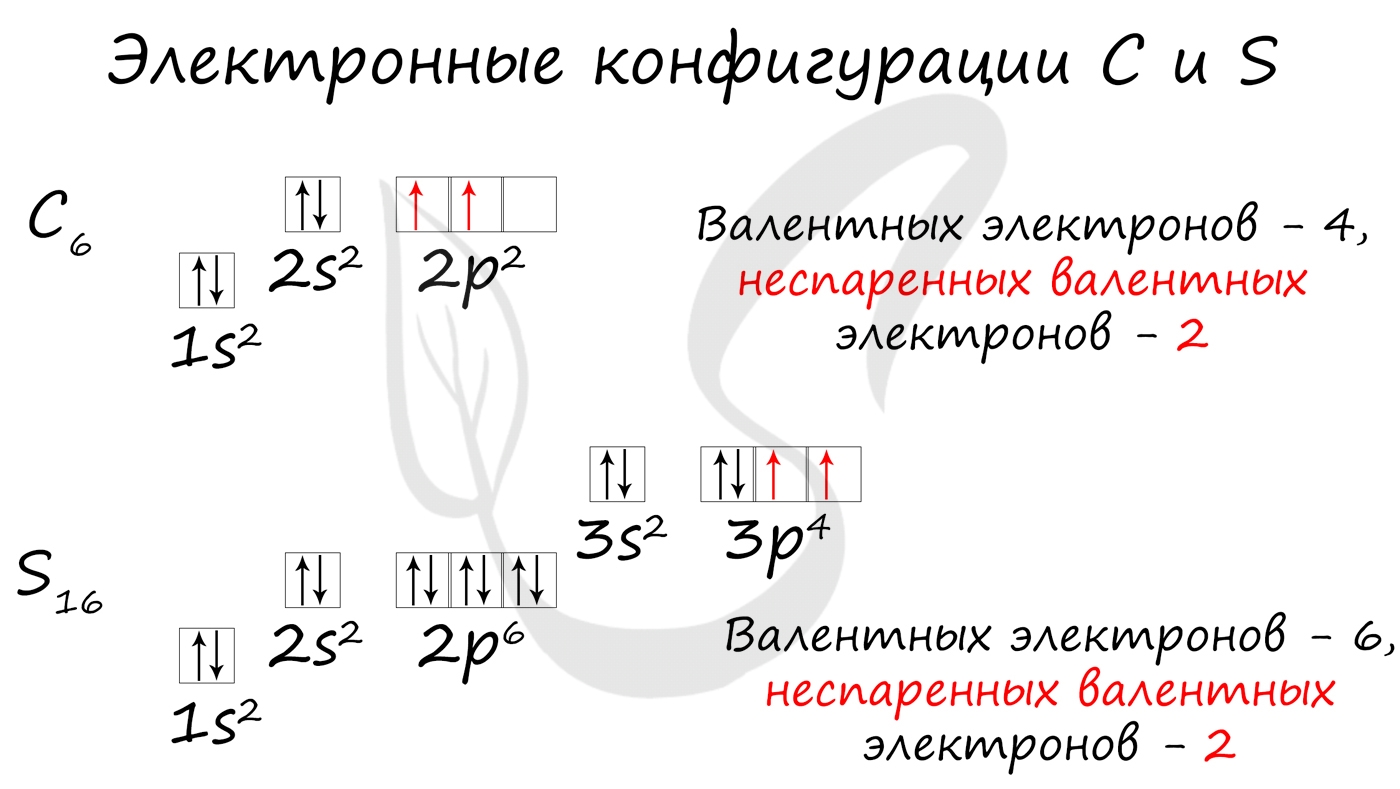
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода - 6, у серы - 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
![Электронные конфигурации углерода и серы]()
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
- Углерод - 1s 2 2s 2 2p 2
- Серы - 1s 2 2s 2 2p 6 3s 2 3p 4
Внешний уровень и валентные электроны
- Углерод - 2s 2 2p 2 (4 валентных электрона)
- Сера -3s 2 3p 4 (6 валентных электронов)
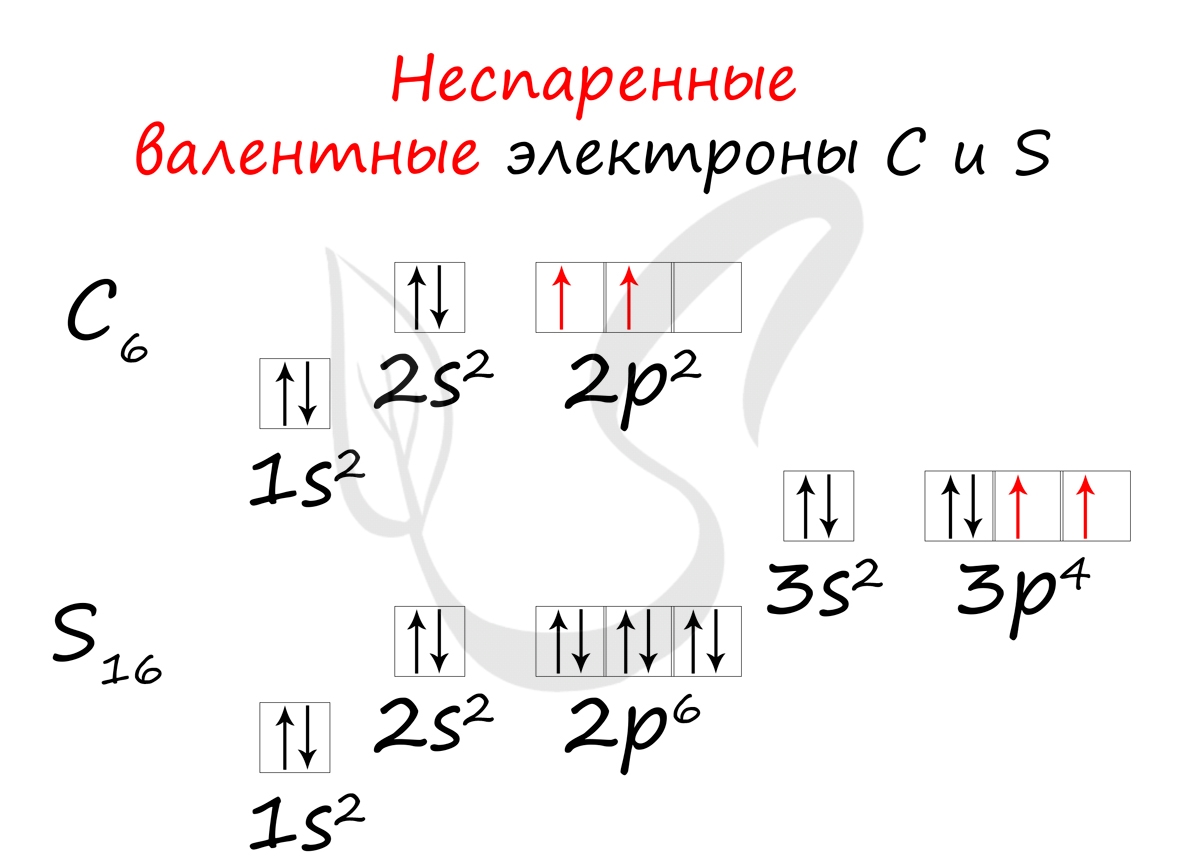
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью - способностью атомов образовывать определенное число химических связей.
![Валентные электроны углерода и серы]()
- Углерод - 2s 2 2p 2 (2 неспаренных валентных электрона)
- Сера -3s 2 3p 4 (2 неспаренных валентных электрона)
Тренировка
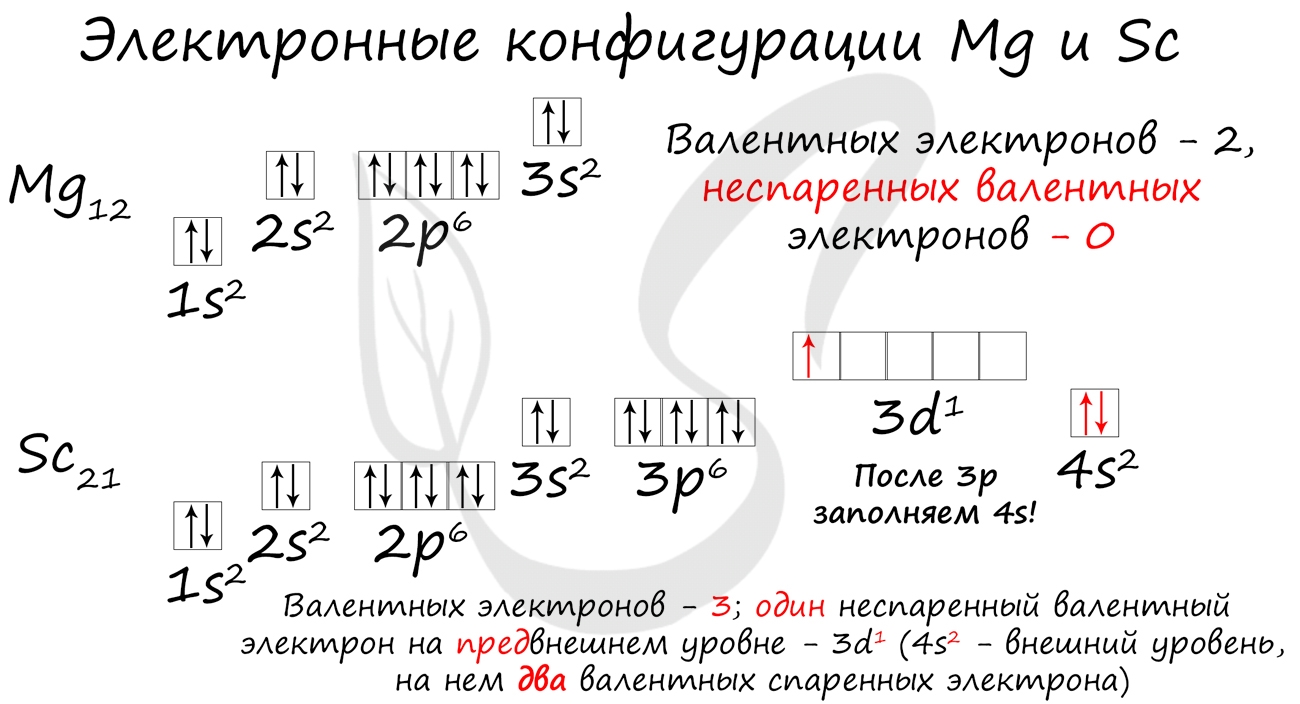
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.
![Электронные конфигурации магния и фтора и их валентные электроны]()
- Магний - 1s 2 2s 2 2p 6 3s 2
- Скандий - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1
Читайте также: