Углерод нахождение в природе кратко
Обновлено: 05.07.2024
Углерод расположен в группе IVA, во втором периоде периодической системы. Конфигурация внешнего электронного слоя атома в основном состоянии 2s 2 p 2 . Важнейшие степени окисления +2 +4, –4, валентности IV и II. Радиус нейтрального атома углерода 0, 077 нм. Радиус иона C 4+ 0, 029 нм (координационное число 4), 0, 030 нм (координационное число 6). Энергии последовательной ионизации нейтрального атома равны 11, 260, 24, 382, 47, 883, 64, 492 и 392, 09 эВ. Электроотрицательность по Полингу 2, 5.
Историческая справка
В СССР искусственные алмазы впервые были получены в 1960 группой ученых под руководством В. Н. Бакуля и Л. Ф. Верещагина. В 1961 группой советских химиков под руководством В. В. Коршака была синтезирована линейная модификация углерода — карбин. Вскоре карбин был обнаружен в метеоритном кратере Рис (Германия). В 1969 в СССР были синтезированы нитевидные кристаллы алмаза при обычном давлении, обладающие высокой прочностью и практически лишенные дефектов. В 1985 Г. Крото обнаружил новую форму углерода —фуллерены С60 и С70 в масс-спектре испаряемого при облучении лазером графита. При высоких давлениях получен лонсдейлит.
Нахождение в природе
Содержание в земной коре 0, 48% по массе. Накапливается в биосфере: в живом веществе 18% угля, в древесине 50%, торфе 62%, природных горючих газах 75%, горючих сланцах 78%, каменном и буром угле 80%, нефти 85%, антраците 96%. Значительная часть угля литосферы сосредоточена в известняках и доломитах. Углерод в степени окисления +4 входит в состав карбонатных пород и минералов (мел, известняк, мрамор, доломиты). Углекислый газ CO2 (0, 046% по массе) постоянный компонент атмосферного воздуха. Углекислый газ в растворенном виде всегда присутствует в воде рек, озер и морей. В атмосфере звезд, планет и в метеоритах обнаружены вещества, содержащие углерод.
Получение
С древности уголь получали при неполном сгорании древесины. В 19 веке древесный уголь в металлургии заменили каменным углем (коксом). В настоящее время для промышленного получения чистого углерода используют крекинг природного газа метана СН4:
Уголь для медицинских целей готовят сжиганием кожуры кокосовых орехов. Для лабораторных нужд чистый уголь, не содержащий несгораемых примесей, получают неполным сжиганием сахара.
Физические и химические свойства
Алмаз — минерал с кубической гранецентрированной решеткой. Атомы С в алмазе находятся в sp 3 -гибридизованном состоянии. Каждый атом образует 4 ковалентные s-связи с четырьмя соседними атомами С, расположенными по вершинам тетраэдра, в центре которого находится атом С. Расстояния между атомами в тетраэдре 0, 154 нм. Электронная проводимость отсутствует, ширина запрещенной зоны 5, 7 эВ. Из всех простых веществ алмаз имеет максимальное число атомов, приходящихся на единицу объема. Его плотность 3, 51 г/см 3. . Твердость по минералогической шкале Мооса принята за 10. Алмаз можно поцарапать только другим алмазом; но он хрупок и при ударе раскалывается на куски неправильной формы. Термодинамически устойчив лишь при высоких давлениях. Однако, при 1800 °C превращение алмаза в графит происходит быстро. Обратное превращение графита в алмаз происходит при 2700°C и давлении 11-12 ГПа.
Графит — слоистое темно-серое вещество с гексагональной кристаллической решеткой. Термодинамически устойчив в широком интервале температур и давлений. Состоит из параллельных слоев, образованных правильными шестиугольниками из атомов С. Углеродные атомы каждого слоя расположены против центров шестиугольников, находящихся в соседних слоях; положение слоев повторяется через один, а каждый слой сдвинут относительно другого в горизонтальном направлении на 0, 1418 нм. Внутри слоя связи между атомами ковалентные, образованы sp 2 -гибридными орбиталями. Связи между слоями осуществляются слабыми ван-дер-ваальсовыми силами, поэтому графит легко расслаивается. Такое состояние стабилизирует четвертая делокализованная π-связь. Графит обладает хорошей электрической проводимостью. Плотность графита 2, 1-2, 5 кг/дм 3 .
Во всех аллотропических модификациях при обычных условиях углерод химически малоактивен. В химические реакции вступает только при нагревании. При этом химическая активность углерода убывает в ряду сажа—древесный уголь—графит—алмаз. Сажа на воздухе воспламеняется при нагревании до 300°C, алмаз — при 850-1000°C. При горении образуется углекислый газ СО2 и CO. Нагревая СО2 с углем, также получают оксид углерода (II) CО:
Синтезирован оксид углерода С2О3. СО2 — кислотный оксид, ему отвечает слабая неустойчивая, существующая только в сильно разбавленных холодных водных растворах угольная кислота Н2СО3. Соли угольной кислоты — карбонаты (К2СО3, СаСО3) и гидрокарбонаты (NaHCO3, Са(НСО3)2).
С водородом графит и древесный уголь реагируют при температуре выше 1200°C, образуя смесь углеводородов. Реагируя со фтором при 900°C, образует смесь фторуглеродных соединений. Пропуская электрический разряд между угольными электродами в атмосфере азота, получают газ циан (CN)2; если в газовой смеси присутствует водород, образуется синильная кислота HCN. При очень высоких температурах графит реагирует с серой, кремнием, бором, образуя карбиды — CS2, SiC, В4С.
Карбиды получают взаимодействием графита с металлами при высоких температурах: карбид натрия Na2C2, карбид кальция CaC2, карбид магния Mg2C3, карбид алюминия Al4C3. Эти карбиды легко разлагаются водой на гидроксид металла и соответствующий углеводород:
С переходными металлами углерод образует металлоподобные химически стойкие карбиды, например, карбид железа (цементит) Fe3C, карбид хрома Cr2C3, карбид вольфрама WС. Карбиды — кристаллические вещества, природа химической связи может быть различной. При нагревании уголь восстанавливает многие металлы из их оксидов:
углерод в природе это может быть найдено в алмазах, нефти и граффити, среди многих других сценариев. Этот химический элемент занимает шестое место в периодической таблице и находится в горизонтальном ряду или периоде 2 и столбце 14. Он неметаллический и четырехвалентный; то есть вы можете установить 4 химические связи общих электронов или ковалентных связей.
Углерод - это элемент с наибольшим изобилием в земной коре. Это изобилие, его уникальное разнообразие в образовании органических соединений и его исключительная способность образовывать макромолекулы или полимеры при температурах, обычно встречающихся на Земле, делают его общим элементом всех известных форм жизни.

Углерод существует в природе как химический элемент без объединения в форме графита и алмаза. Тем не менее, по большей части он объединяется с образованием химических соединений углерода, таких как карбонат кальция (CaCO).3) и другие соединения в нефти и природном газе.
- 1 Где находится углерод и в какой форме?
- 1.1 Кристаллические формы
- 1.2 Аморфные формы
- 1.3 Нефть, природный газ и битум
- 2.1 Химический символ
- 2.2 Атомный номер
- 2.3 Физическое состояние
- 2,4 Цвет
- 2.5 Атомная масса
- 2.6 Точка плавления
- 2.7 Точка кипения
- 2.8 Плотность
- 2.9 Растворимость
- 2.10 Электронная конфигурация
- 2.11 Количество электронов во внешнем или валентном слое
- 2.12 Емкость канала
- 2.13 Катенасьон
- 3.1 Фотосинтез
- 3.2 Дыхание и разложение
- 3.3 Геологические процессы
- 3.4 Вмешательство человеческой деятельности
- 4.1 Нефть и природный газ
- 4.2 Графит
- 4.3 Алмаз
- 4.4 Антрацит
- 4.5 каменный уголь
- 4.6 лигнит
- 4.7 Торф
Где находится углерод и в какой форме?
Помимо того, что он является химическим компонентом, общим для всех форм жизни, углерод в природе присутствует в трех кристаллических формах: алмаз, графит и фуллерен..
Есть также несколько аморфных минеральных форм угля (антрацит, лигнит, уголь, торф), жидких форм (разновидности масел) и соды (природный газ)..
Кристаллические формы
В кристаллических формах атомы углерода объединяются, образуя упорядоченные структуры с геометрическим пространственным расположением.
графит
Это мягкий сплошной черный цвет с блеском или металлическим блеском теплостойким (огнеупорным). Его кристаллическая структура представляет собой атомы углерода, соединенные в гексагональные кольца, которые, в свою очередь, соединяются вместе, образуя листы.
Месторождения графита редки и были обнаружены в Китае, Индии, Бразилии, Северной Корее и Канаде..
бриллиант
Это очень твердое твердое вещество, прозрачное для прохождения света и намного более плотное, чем графит: значение плотности алмаза эквивалентно почти в два раза больше, чем у графита.
Атомы углерода в алмазе соединяются в тетраэдрической геометрии. Аналогично, алмаз сформирован из графита, подвергнутого условиям очень высоких температур и давлений (3000 ° С и 100 000 атм).
Большая часть алмазов находится на глубине от 140 до 190 км в мантии. Через глубокие извержения вулканов магма может переносить их на расстояния, близкие к поверхности.
Алмазные месторождения имеются в Африке (Намибия, Гана, Демократическая Республика Конго, Сьерра-Леоне и Южная Африка), Америке (Бразилия, Колумбия, Венесуэла, Гайана, Перу), Океании (Австралия) и Азии (Индия)..
![]()
фуллерены
Это молекулярные формы углерода, которые образуют кластеры из 60 и 70 атомов углерода в почти сферических молекулах, похожих на футбольные мячи.
Есть также фуллерены, меньшие, чем 20 атомов углерода. Некоторые формы фуллеренов включают углеродные нанотрубки и углеродные волокна.
![]()
Аморфные формы
В аморфных формах атомы углерода не объединяются, образуя упорядоченную и правильную кристаллическую структуру. Вместо этого они даже содержат примеси от других элементов.
антрацит
Это самый старый метаморфический минеральный уголь (который происходит от модификации горных пород под воздействием температуры, давления или химического воздействия жидкостей), поскольку его образование относится к первичной или палеозойской эре, каменноугольному периоду..
Антрацит - это аморфная форма углерода, в которой содержание этого элемента выше: от 86 до 95%. Серо-черный и металлический глянец, тяжелый и компактный.
Как правило, антрацит находится в зонах геологической деформации и составляет приблизительно 1% мировых запасов угля..
Географически он встречается в Канаде, США, Южной Африке, Франции, Великобритании, Германии, России, Китае, Австралии и Колумбии..
![]()
Каменный уголь
Это минеральный уголь, осадочная порода органического происхождения, образование которой относится к эпохам палеозоя и мезозоя. Содержание углерода составляет от 75 до 85%..
Это черный, он характеризуется непрозрачностью и имеет матовый и жирный вид, так как он содержит большое количество битумных веществ. Образуется при сжатии лигнита в палеозойскую эру, в каменноугольный и пермский периоды..
Это самая распространенная форма угля на планете. В Соединенных Штатах, Великобритании, Германии, России и Китае имеются крупные месторождения угля..
бурый уголь
Это ископаемый минеральный уголь, образовавшийся в третичном возрасте из торфа при сжатии (высокие давления). Он имеет более низкое содержание углерода, чем уголь, от 70 до 80%.
Это немного компактный материал, рассыпчатый (характеристика, которая отличает его от других углеродных минералов), коричневый или черный. Его текстура похожа на древесину, а содержание углерода колеблется от 60 до 75%..
Это топливо с легким воспламенением, с низкой теплотворной способностью и более низким содержанием воды, чем торф.
В Германии, России, Чехии, Италии (в регионах Венето, Тоскана, Умбрия) и Сардинии имеются важные шахты с бурым углем. В Испании месторождения лигнита находятся в Астурии, Андорре, Сарагосе и Ла-Корунья.
торф
Это материал органического происхождения, образование которого происходит из четвертичной эры, гораздо более поздней, чем предыдущие угли..
Это коричневато-желтый цвет и выглядит как губчатая масса низкой плотности, в которой вы можете увидеть остатки растений от того места, где они произошли.
В отличие от перечисленных выше углей, торф не происходит в результате процессов карбонизации древесного материала или дерева, а образуется в результате скопления растений - в основном трав и мхов - в болотистых районах в результате процесса карбонизации, который еще не завершен..
Торф имеет высокое содержание воды; по этой причине требует использования сушки и уплотнения перед использованием.
Имеет низкое содержание углерода (всего 55%); следовательно, он имеет низкую энергетическую ценность. Когда он подвергается сгоранию, его остаток золы в изобилии и выделяет много дыма.
Существуют важные месторождения торфа в Чили, Аргентине (Огненная Земля), Испании (Эспиноса-де-Серрато, Паленсия), Германии, Дании, Голландии, России, Франции..
![]()
Нефть, природный газ и битум
Он образовался в недрах, на больших глубинах и в особых условиях, как физических (высокие давления и температуры), так и химических (присутствие определенных каталитических соединений) в процессе, который занял миллионы лет.
Во время этого процесса C и H высвобождались из органических тканей и снова объединялись, образуя огромное количество углеводородов, которые смешиваются в соответствии с их свойствами, образуя природный газ, нефть и битум..
Нефтяные месторождения планеты расположены в основном в Венесуэле, Саудовской Аравии, Ираке, Иране, Кувейте, Объединенных Арабских Эмиратах, России, Ливии, Нигерии и Канаде..
Есть запасы природного газа в России, Иране, Венесуэле, Катаре, Соединенных Штатах, Саудовской Аравии и Объединенных Арабских Эмиратах, среди других..
Физико-химические свойства
Среди свойств углерода можно отметить следующие:
Химический символ
С.
Атомный номер
6.
Физическое состояние
Твердый, при нормальных условиях давления и температуры (1 атмосфера и 25 ° C).
цвет
Серый (графит) и прозрачный (алмаз).
Атомная масса
Точка плавления
Точка кипения
плотность
растворимость
Нерастворим в воде, растворим в четыреххлористом углероде CCl4.
Электронная конфигурация
Количество электронов во внешнем слое или валентности
4.
Пропускная способность
4.
сцепление
Обладает способностью образовывать химические соединения в длинных цепях..
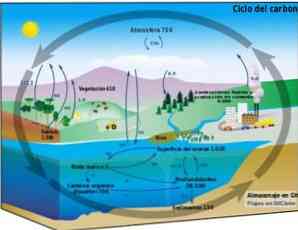
Биогеохимический цикл
Углеродный цикл представляет собой круговой биогеохимический процесс, посредством которого углерод может обмениваться между биосферой, атмосферой, гидросферой и земной литосферой..
Знание этого циклического углеродного процесса на Земле позволяет продемонстрировать действия человека в этом цикле и его последствия для глобального изменения климата..
Углерод может циркулировать между океанами и другими водоемами, а также между литосферой, почвой и недрами, атмосферой и биосферой. В атмосфере и гидросфере углерод существует в газообразной форме в виде СО2 (углекислый газ).
фотосинтез
Углерод в атмосфере поглощается наземными и водными организмами экосистем (фотосинтезирующими организмами)..
Фотосинтез позволяет химической реакции между СО происходить2 и вода, опосредованная солнечной энергией и хлорофиллом из растений, для производства углеводов или сахаров. Этот процесс превращает простые молекулы с низким содержанием энергии CO2, H2O и кислород O2, в сложных молекулярных формах высокой энергии, которые являются сахарами.
Гетеротрофные организмы, которые не могут осуществлять фотосинтез и являются потребителями в экосистемах, получают углерод и энергию при питании самих производителей и других потребителей..
Дыхание и разложение
Дыхание и разложение - это биологические процессы, которые выделяют углерод в окружающую среду в форме CO2 или СН4 (метан образуется при анаэробном разложении, то есть в отсутствие кислорода).
Геологические процессы
В результате геологических процессов и, как следствие, с течением времени, углерод анаэробного разложения может превращаться в ископаемое топливо, такое как нефть, природный газ и уголь. Кроме того, углерод также является частью других минералов и горных пород..
Вмешательство человеческой деятельности
Когда человек использует сжигание ископаемого топлива для получения энергии, углерод возвращается в атмосферу в виде огромных количеств СО2 которые не могут быть ассимилированы естественным биогеохимическим циклом углерода.
Это избыток СО2 вызванный деятельностью человека отрицательно влияет на баланс углеродного цикла и является основной причиной глобального потепления.
![]()
приложений
Использование углерода и его соединений чрезвычайно разнообразно. Наиболее выдающийся со следующим:
Нефть и природный газ
Основное экономическое использование углерода заключается в его использовании в качестве углеводородного ископаемого топлива, такого как газообразный метан и нефть..
Масло перегоняется на нефтеперерабатывающих заводах для получения различных производных, таких как бензин, дизельное топливо, керосин, асфальт, смазочные материалы, растворители и другие, которые, в свою очередь, используются в нефтехимической промышленности, которая производит сырье для пластмасс, удобрений, фармацевтической и лакокрасочной промышленности. среди прочих.
графит
Графит используется в следующих действиях:
- Используется при изготовлении карандашей, смешанных с глинами.
- Это часть производства огнеупорных кирпичей и тиглей, термостойких.
- В различных механических устройствах, таких как шайбы, подшипники, поршни и прокладки.
- Это отличная твердая смазка.
- Из-за его электрической проводимости и его химической инертности, он используется в производстве электродов, углей электродвигателей..
- Используется в качестве модератора на атомных электростанциях.
бриллиант
Алмаз обладает особенно исключительными физическими свойствами, такими как более высокая степень твердости и теплопроводность, известные до сих пор..
Эти особенности позволяют промышленное применение в инструментах, используемых для резки и полировки инструментов для их высокой абразивности.
Его оптические свойства, такие как прозрачность и способность расщеплять белый свет и преломлять свет, дают ему множество применений в оптических приборах, например, в производстве линз и призм..
Характерная яркость, полученная из его оптических свойств, также очень ценится в ювелирной промышленности..
антрацит
Антрацит с трудом поджигается, медленно горит и требует много кислорода. Его сгорание производит небольшое пламя бледно-синего цвета и выделяет много тепла.
Несколько лет назад антрацит использовался в термоэлектростанциях и для отопления домов. Его использование имеет такие преимущества, как производство небольшого количества золы или пыли, небольшое количество дыма и медленный процесс сгорания..
Из-за высокой экономической стоимости и дефицита антрацит был заменен природным газом на термоэлектростанциях и электроэнергией в домах..
Каменный уголь
Уголь используется в качестве сырья для получения:
- Кокс, топливо из доменных печей сталелитейных заводов.
- Креозот, полученный путем смешивания смолистых дистиллятов из каменного угля и используемый в качестве защитного герметика для древесины, подверженной атмосферным воздействиям.
- Крезол (химически метилфенол) извлекают из угля и используют в качестве дезинфицирующего и антисептического средства,
- Другие производные, такие как газ, смола или смола, а также соединения, используемые в производстве парфюмерии, инсектицидов, пластмасс, красок, шин и дорожных покрытий, среди прочих.
бурый уголь
Лигнит представляет собой топливо среднего качества. Струя, разновидность лигнита, характеризуется очень компактным из-за длительного процесса карбонизации и высокого давления и используется в ювелирном деле и украшении..
Углеро́д в виде древесного угля применялся в глубокой древности для выплавки металлов. Издавна известны алмаз и графит. Элементарная природа углерода установлена А. Лавуазье в конце 1780-х годов.
Происхождение названия
Международное название происходит от латинского carbo — уголь, связанного с древним корнем kar — огонь. Этот же корень в латинском cremare — гореть, а возможно, и в русском «
Содержание
Физические свойства
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими и химическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать Изотопы углерода
Подробнее в статье изотопы углерода
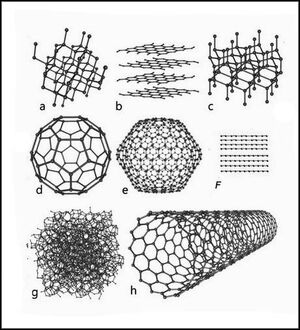
Аллотропные модификации углерода
![]()
Упрощенная фазовая диаграмма углерода, заштрихованы области где аллотропные модификации могут быть метастабильны. (diamond — алмаз, graphite — графит, liquid — жидкость, vapor — газ)
![]()
Электронное строение атома углерода
Графит и алмаз
![]()
Элементарная ячейка (углерода) алмаза
Основные и хорошо изученные алмаз и графит. При нормальных условиях термодинамически устойчив только графит, а алмаз и другие формы плотность на 15—20 % выше плотности алмаза), имеющей металлическую проводимость. При высоких давлениях и относительно низких температурах (ок. 1 200 K) из высокоориентированного графита образуется гексагональная модификация углерода с кристаллической решеткой типа плотность 3,51 г/см³, т. е. такая же, как у алмаза. Лонсдейлит найден также в метеоритах.
Ультрадисперсные алмазы (наноалмазы)
Карбин
Кристаллическая модификация углерода гексагональной сингонии с цепочечным строением молекул называется карбин. Цепи имеют либо полиеновое строение (—C≡C—), либо поликумуленовое (=C=C=). Известно несколько форм карбина, отличающихся числом атомов в элементарной ячейке, размерами ячеек и плотностью (2,68—3,30 г/см³). Карбин встречается в природе в виде минерала Фуллерены и углеродные нанотрубки
Аморфный углерод
Содержание углерода в земной коре 0,1 % по массе. Свободный углерод находится в природе в виде алмаза и графита. Основная масса углерода в виде природных известняки и доломиты), горючих ископаемых — антрацит (94—97 % С), бурые угли (64—80 % С), каменные угли (76—95 % С), горючие сланцы (56—78 % С), нефть (82—87 % С), горючих природных газов (до 99 % метана), торф (53—56 % С), а также атмосфере и диоксида углерода СО2, в воздухе 0,046 % СО2 по массе, в водах рек, морей и океанов в ~60 раз больше. Углерод входит в состав растений и животных (~18 %). Кругооборот углерода в природе включает биологический цикл, выделение СО2 в атмосферу при сгорании тропосферы растениями. Затем из биосферы вновь возвращается в азотом и водородом углерод обнаружен в атмосфере Солнца, планет, он найден в каменных и железных метеоритах.
Большинство соединений углерода, и прежде всего углеводороды, обладают ярко выраженным характером ковалентных соединений. Прочность простых, двойных и тройных связей атомов С между собой, способность образовывать устойчивые цепи и циклы из атомов С обусловливают существования огромного числа углеродсодержащих соединений, изучаемых органической химией.
Химические свойства
При обычных температурах углерод химически инертен, при достаточно высоких соединяется со многими элементами, проявляет сильные восстановительные свойства. Химическая активность разных форм углерода убывает в ряду: аморфный углерод, графит, алмаз, на воздухе они воспламеняются при температурах соответственно выше 300—500 °C, 600—700 °C и 850—1000 °C.
Степени окисления +4, −4, редко +2 (СО, карбиды металлов), +3 (C2N2, галогенцианы); сродство к электрону 1,27 эВ; энергия ионизации при последовательном переходе от С 0 к С 4+ соответственно 11,2604, 24,383, 47,871 и 64,19 эВ.
Неорганические соединения
Углерод реагирует со многими элементами с образованием карбидов.
Графит с галогенами, щелочными металлами и др. веществами образует серой углерод дает сероуглерод CS2, известны также CS и C3S2. С большинством металлов, бором и кремнием углерод образует Газификация твердых топлив ). При нагревании углерод восстанавливает оксиды металлов до металлов, что широко используется в металлургии.
Органические соединения
Благодаря способности углерода образовывать полимерные цепочки, существует огромный класс соединений на основе углерода, которых значительно больше, чем неорганических, и изучением которых занимается органическая химия. Среди них наиболее обширные группы: углеводороды, белки, Применение
графит в форме пластин)
угля и нефть, природный газ) — один из важнейших источников энергии для человечества.Углерод в сталелитейной промышленности один из важнеших компонентов сплавов железо-углерод (производсво чугуна и стали).
Графит используется в карандашной промышленности. Также его используют в качестве смазки при особо высоких или низких температурах.
Алмаз, благодаря исключительной твердости, незаменимый бриллианты используются в качестве теплопроводность алмаза (до 2000 Вт/м•К) делает его перспективным материалом для полупроводниковой техники в качестве Токсическое действие
Углерод входит в состав атмосферных аэрозолей, в результате чего может изменяться региональный климат, уменьшаться количество солнечных дней. Частицы углерода поглощают солнечное излучение, что может вызвать нагревание поверхности Земли. Углерод поступает в окружающую среду в виде сажи в составе выхлопных газов автотранспорта, при сжигании угля на верхних дыхательных путей и ДНК и РНК), определяется радиационным воздействием бета частиц и ядер отдачи азота ( 14 С (β) → 14 N) и трансмутационным эффектом — изменением химического состава молекулы в результате превращения атома С в атом N. Допустимая концентрация 14 С в воздухе рабочей зоны ДКА 1,3 Бк/л, в атмосферном воздухе ДКБ 4,4 Бк/л, в воде 3,0•10 4 Бк/л, предельно допустимое поступление через органы дыхания 3,2•10 8 Бк/год.
![Углеродный цикл]()
В природе углерода не так уж и много, но он есть везде: в воздухе (углекислый газ и угарный газ), растворен в океанах и реках, залегает в ископаемых породах в земле, содержится в каждой клетке растения, животного, человека. Существует круговорот углерода в природе:
— углекислый газ выделяется в атмосферу с вулканическими газами, из горячих источников, из поверхностных слоев рек и океанов, при сгорании топлив, при дыхании растений и животных;
— в тоже время, углекислый газ поглощается растениями, переходит в организм животных и людей, а после их смерти возвращается в почву.В чистом виде и в значимых количествах углерод встречается только в виде алмазов и графитов. Но он — составная часть ископаемого топлива (уголь, нефть, газ, сланцы), торфа, битумов, природных минералов (мел, известняк, доломиты, карбонаты).
Токсическое действие
![Опасность углерода]()
При разработках угольных месторождений, при сжигании топлив, в процессе деятельности человека в воздух поступает большое количество аэрозолей углерода, попадающих в органы дыхания человека и животных. Регулярное вдыхание аэрозолей с высокой концентрацией углерода приводят к таким заболеваниям, как пылевой бронхит, антракоз. На всех производствах, связанных с углеродными аэрозолями и пылью, обязательно нормируется ПДК содержания алмазов, кокса, угля, углеродной пыли, сажи и др. Работники обязательно должны использовать средства защиты органов дыхания при работе с ними.
Угарный газ и углекислый газ обладают токсическим действием, превышение ПДК этих газов в воздухе может вызвать летальный исход. Поэтому в закрытых помещениях большое внимание должно уделяться поглощению и удалению из воздуха углекислоты, выделяемой при дыхании.
Токсическим действием обладает радиоактивный изотоп С-14. Встраиваясь в молекулы белков, особенно в ДНК и РНК, он может оказывать мутагенное воздействие, поэтому для него тоже установлены ПДК содержания в воздухе рабочего помещения.
Применение
Нет ни одной области промышленности, в которой в той или иной степени не использовался бы углерод. Расскажем об основных сферах его использования:
![свойства углерода]()
• Основные виды ископаемого топлива на земле: нефть, уголь и газ — это соединения углерода. Они нужны для получения тепла, энергии, огромного количества химических материалов.
• В сельском хозяйстве, в медицине, энергетике, в ядерной отрасли.
• В промышленной индустрии очень востребованы карбонаты.
• Графит используется при изготовлении карандашей, электродов, высокотемпературных и низкотемпературных смазок, красителей; тиглей для металлических заготовок, углепластиков, углеродных волокон, стеклоуглерода и других углеграфитовых материалов, отличающихся особо высокой жаростойкостью.
• Стеклоуглерод идет на производство тиглей и электродов.
• Техуглерод применяется как наполнитель при производстве резин для шин и пластмасс. Придает им прочность, долговечность и некоторые особые свойства.
• Алмазы применяются в технике, сверлении, лазерных установках, в ювелирном деле. Технические алмазы используются для получения абразивных материалов. Только сложность обработки и высокая стоимость мешают алмазам стать лучшим материалом для подложек процессоров.
• В медицине используется активированный уголь для вывода токсинов, а графит — в мазях для лечения болезней кожи.
• Фильтры на основе угля применяются в противогазах, респираторах, лицевых масках и сменных патронах для них; системах очистки воды.
• В научных исследованиях радиоуглеродный анализ на основе изотопа С-14 — один из самых важных анализов в археологии, геологии, палеонтологии.
• Большие перспективы у применения новых неорганических материалов на основе углерода. Об этом — следующая статья.Читайте также: