Титрант это в химии кратко
Обновлено: 08.07.2024
Этот справочник начинается с определения титрования, затем рассматриваются основные типы титрования с примерами, иллюстрациями и принципами анализа результатов.
Титрование — это аналитический метод, предназначенный для количественного определения конкретного вещества, растворенного в образце.
В справочнике приведены сведения, необходимые для понимания этого метода, описаны и проиллюстрированы разные типы титрования и принципы анализа результатов. Особый акцент делается на правильной процедуре титрования, соблюдение которой необходимо для получения надежных результатов. И наконец, в справочнике кратко описана суть химических реакций, происходящих при титровании.
Среди прочего справочник охватывает следующие темы:
- определение титрования;
- теория титрования;
- автоматические титраторы;
- управление качеством при титровании;.
- определение титра;
- химическая теория (моль, реакционная стехиометрия и т. д.);
- словарь (титрование, титр, титрант, индикация, аналит и т. д.).
Скачайте справочник, чтобы познакомиться с основами титрования. В справочнике вы найдете полезные основные сведения о распространенных методах.
Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена.
Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники.
Эта отметка установлена 10 ноября 2011.
Титрант (в титриметрическом анализе) — реагент с точно известным титром (концентрацией), добавляемый к исследуемому раствору для количественного анализа содержащихся в нем веществ или их элементов (ионов, функциональных групп).
В зависимости от вида титриметрического анализа в качестве титранта могут выступать:
- в кислотно-основном титровании: сильные кислоты и основания, например, NaOH, KOH, HCl.
- в окислительно-восстановительном титровании: окислители и восстановители, например перманганат калия и йод
- в комплексонометрии: этилендиаминтетрауксусная кислота или другие комплексоны
- в аргентометрии (анализе, основанном на реакциях осаждения): растворимые соли серебра
- Дополнить статью (статья слишком короткая либо содержит лишь словарное определение).
- Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное.
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Титрант" в других словарях:
титрант — (стандартный раствор) – раствор с известной концентрацией, с помощью которого в процессе титрования определяется концентрация анализируемого раствора. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
титрант — titrantas statusas T sritis chemija apibrėžtis Tirpalas, kuriuo titruojama. atitikmenys: angl. titrant rus. титрант … Chemijos terminų aiškinamasis žodynas
титрант — у, ч. Розчин реагенту або газова суміш, що містить його, із точно відомою концентрацією, які використовуються в титриметричному аналізі … Український тлумачний словник
ХИМИЯ АНАЛИТИЧЕСКАЯ — наука о методах определения химического состава веществ. Химический анализ буквально пронизывает всю нашу жизнь. Его методами проводят скрупулезную проверку лекарственных препаратов. В сельском хозяйстве с его помощью определяют кислотность почв… … Энциклопедия Кольера
ТИТРИМЕТРИЯ — (от франц. titre качество, характеристика и греч. metreo измеряю), совокупность методов количеств. анализа, основанных на измерении кол ва реагента, необходимого для взаимод. с определяемым компонентом в р ре или газовой фазе в соответствии со… … Химическая энциклопедия
КУЛОНОМEТРИЯ — электрохим метод исследования и анализа, основанный на измерении кол ва электричества (Q), прошедшего через электролизер при электрохим. окислении или восстановлении в ва на рабочем электроде. Согласно объединенному Фарадея закону, масса… … Химическая энциклопедия
Амперометрическое титрование — (a. amperometric titration; н. amperometrisches Titrieren; ф. titrage amperometrique; и. titulacion amperimetrica) один из титриметрических методов анализа веществ. Mомент при титровании, когда кол во прибавляемого реагента становится… … Геологическая энциклопедия
АМПЕРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ — метод количеств. анализа, основанный на волътамперометрии с линейной разверткой потенциала. Конечную точку титрования устанавливают по зависимости диффузионного тока d при постоянном потенциале Е с индикаторного электрода от объема Vприбавленного … Химическая энциклопедия
ВАНАДАТОМЕТРИЯ — титриметрич. метод определения восстановителей, основанный на окислит. восстановит. р циях: (стандартные электродные потенциалы соотв. +0,994 и +1,31 В). Условный электродный потенциал системы VO2+/VO2+ в 1 М р ре H2SO4 составляет + 1,02 В, в 8 М … Химическая энциклопедия
ТИТРАТОРЫ — приборы, предназначенные для автоматич. или полуавтоматич. выполнения титриметрич. анализа (см. Титриметрия). Т. удобны при выполнении массовых однотипных анализов, а также для анализа проб, содержащих ядовитые радиоактивные или взрывоопасные в… … Химическая энциклопедия

Титрование это
Титрование является очень популярной процедурой определения относительных концентраций химических эквивалентов в кислотных или основных растворах. И если Вам не приходилось выполнять лабораторные работы по титрованию в школе, то в университете или колледже титровать Вы будете не раз! Итак, переходим к определению:
Титрование — это способ определения концентрации кислоты или основания в растворе, путем измерения объема титранта (основания или кислоты с заданной концентрацией) необходимого для полной нейтрализации имеющегося реагента.
Точка эквивалентности
Поговорим о сущности процесса кислотно-основного титрования. Из необходимого оборудования, грубо говоря, вам понадобится лишь бюретка (стеклянная трубка с краником) и колба. Бывают два случая:
- Когда нужно определить концентрацию основания в колбе путем добавления из бюретки кислоты известной концентрации.
- Наоборот, когда необходимо определить концентрацию кислоты в колбе путем добавления основания известной концентрации.
Рассмотрим титрование в первом случае, когда титруемый раствор — основание, а титрант — кислота. Начинаем к анализируемому образцу основания постепенно добавлять раствор кислоты с заранее определенной концентраций до тех пор, пока число эквивалентов кислоты не будет равно числу эквивалентов основания. Продолжая титровать, в конце концов мы достигнем конечной точки титрования, или, как ее еще называют, точки эквивалентности — момент титрования, когда число эквивалентов титранта и титруемого раствора будут точно равны.
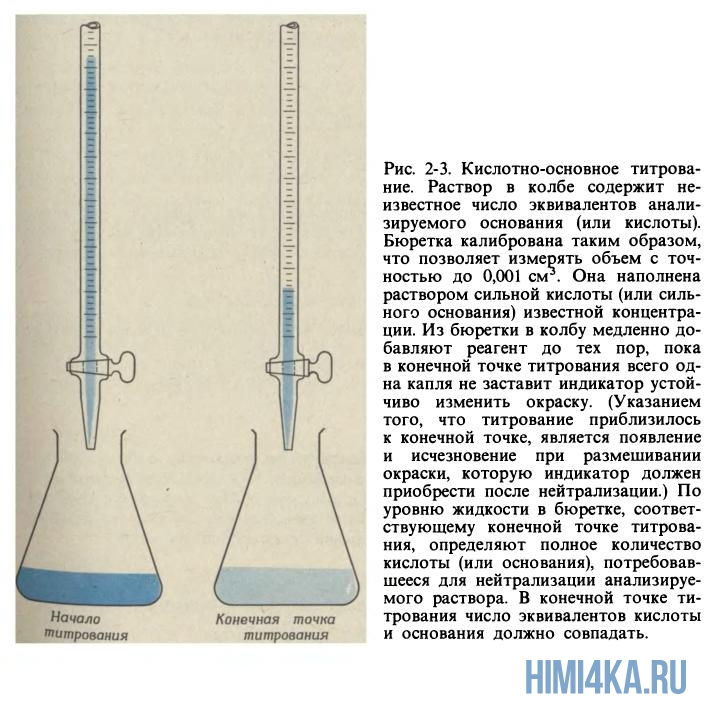
Чтобы понять, достигнута точки эквивалентности или еще нет, обычно используют различные кислотно-основные индикаторы. Для этого перед непосредственным титрованием в колбу с анализируемым раствором добавляют пару капель необходимого индикатора, и в момент достижения точки эквивалентности раствор начинает менять свой цвет.
Зная использованный объем титранта и его концентрацию, можно вычислить число эквивалентов основания в анализируемом образце. Если NA и NB — нормальности растворов кислоты и основания, а VA и VB — их объемы в момент нейтрализации, то:
С теорией покончено, переходим к решению задач на титрование.
Задачи на титрование
Пример 1. Допустим, химичка потребовала, чтобы вы нейтрализовали 25,00 мл раствора кислоты H3PO4. На титрование у вас ушло 30,25 мл раствора NaOH. Вычислите отношение нормальных и молярных концентраций обоих растворов.
Нормальная концентрация NaOH совпадает с молярной, а у H3PO4 нормальность в три раза больше молярной концентрации, поэтому:
Пример 2. Вы израсходовали 10,81 мл 0,1 н раствора HCl на титрование 25,00 мл раствора Ca(OH)2. Какую нормальность и молярность имеет анализируемый раствор? Сколько граммов Ca(OH)2 содержится в растворе?
Первым делом вычислим нормальную концентрацию анализируемого раствора Ca(OH)2:
- NCa(OH)2 = ( VHCl/ VCa(OH)2) × NHCl = ( 10,81 мл / 25,00 мл ) × 0,1 н = 0,0432 н
Молярная концентрация Ca(OH)2 вдвое меньше его нормальной концентрации, так как химический эквивалент Ca(OH)2 равен 2. Поэтому анализируемый раствор имеет молярность 0,0216 М Ca(OH)2. Чтобы ответить на вопрос, сколько граммов Ca(OH)2 содержится в растворе, необходимо найти его количество вещества в растворе, для этого следует множить молярность на объем:
По таблице Менделеева определяем, что молекулярная масса Ca(OH)2 равна 74,1 г/моль, а значит в растворе содержится:
Пример 3. Химик-органик синтезирует новую кислоту. Он растворяет 0,5 г этой кислоты в определенном объеме воды и устанавливает, что для нейтрализации полученного раствора требуется 15,73 мл 0,437 н. раствора NaOH. Чему равен грамм-эквивалент синтезированной им кислоты? Если известно, что эта кислота содержит три ионизуемые группы –COOH, чему равна ее молекулярная масса?
Число эквивалентов основания, понадобившееся для нейтрализации, равно:
Грамм-эквивалент кислоты определяется из соотношения:
Так как грамм-эквивалент кислоты равен 72,8 г, а каждый ее моль высвобождает 3 эквивалента ионов водорода H + , молекулярная масса кислоты должна быть равна 3·72,8 г = 218 г.
Раствор титранта должен иметь точно известную концентрацию.
По свойствам веществ и способу их приготовления титранты бывают двух типов: стандартные, с приготовленным титром, стандартизированные или с установленным титром.
Стандартные растворы или с приготовленным титром называют первичный стандартный раствор. Он готовится растворением точного количества чистого химического вещества в определенном объеме растворителя.
Растворы этого типа готовятся следующим образом. Рассчитывается навеска вещества для приготовления раствора определенной концентрации, взвешивается в чистом, сухом бюксе на аналитических весах (нет необходимости добиваться, чтобы взятая навеска точно отвечала рассчитанной, важно знать ее истинную величину, по которой можно рассчитать концентрацию полученного раствора), затем точно взятая навеска вещества количественно переносится в мерную колбу, растворяется в воде (или в другом растворителе), доводится объем полученного раствора до метки. Колба плотно закрывается пробкой и тщательно перемешивается раствор. Концентрация полученного раствора рассчитывается по точно взятой навеске.
Описанным выше способом можно готовить титрованные растворы только тех веществ, которые удовлетворяют следующим требованиям:
· Вещество должно быть химически чистым;
· Состав вещества должен строго соответствовать формуле;
· Вещество должно быть устойчивым при хранении и в твердом виде, и в растворе;
· Желательно, чтобы вещество имело возможно большую эквивалентную массу.
К первичным стандартным веществам относятся: Na2CO3, Na2B4O7*10H2O, Na2SO4, CaCO3, CaCI2, MgSO4, MgCI2, H2C2O4*2H2O, Na2C2O4, K2Cr2O7, бикарбонат натрия, бромат калия, иодат калия и другие.
Первый тип титрантов (с приготовленным титром) применяют в титриметрии для количественных определений тех или иных веществ и для установки титров второго типа - вторичных стандартных растворов.
Вторичный стандартный раствор - это растворы таких веществ, концентрация которых устанавливается (стандартизируется) по концентрации первичных стандартных растворов или готовится по известной массе вторичного стандартного вещества.
Ко второму типу титрантов относят растворы таких веществ, которые не удовлетворяют требованиям, предъявляемые к первичным стандартным веществам. К ним относятся: щелочи, растворы кислот HCI, H2SO4, HNO3, CH3COOH, KMnO4, AgNO3, Na2S2O3 и другие. При приготовлении этих растворов нет необходимости брать точную навеску вещества, так как при всей тщательности взятия навески нельзя получить раствор с известной концентрацией. Навеску вещества берут на технических весах, переносят в мерную колбу, растворяют ее и разбавляют полученный раствор до метки. Точную концентрацию раствора устанавливают (стандартизируют) титрованием первичных стандартных растворов.
Типовые расчеты в титриметрическом анализе. Способы выражения концентраций в титриметрическом анализе /молярная концентрация, молярная концентрация эквивалента, титр, титриметрический фактор пересчета /титр по определяемому веществу/, поправочный коэффициент/. Расчет массы стандартного вещества, необходимой для приготовления титранта. Расчет концентрации титранта при его стандартизации. Расчет массы и массовой доли определяемого вещества по результатам титрования.
Расчеты в титриметрии
Закон эквивалентов : вещества реагируют друг с другом в эквивалентных количествах. В общем виде для любых реагирующих веществ по закону эквивалентов
где n - количество моль эквивалентов реагирующих веществ.
где Сэ - молярная концентрация эквивалента , моль/л.
При одинаковой концентрации растворов реагирующих веществ реакции идут между их равными объемами.
Например. На 10,00 мл раствора кислоты расходуется 10,00 мл раствора щелочи, если их концентрации равны 0,1 моль/л.
Титр ( Т ) раствора - это масса вещества, содержащегося в 1 мл раствора ( или в 1 см3 ), размерность - г/мл.
Т = m ( вещества ) / V ( раствора )
Способы выражения концентраций в титриметрическом анализе /молярная концентрация, молярная концентрация эквивалента, титр, титриметрический фактор пересчета /титр по определяемому веществу/, поправочный коэффициент/.
Эквивалент - условная или реальная частица, которая может присоединять,
высвобождать, замещать один протон в кислотно-основных реакциях или быть
эквивалентна одному электрону в окислительно-восстановительных реакциях.
Если определяемое вещество А реагирует с титрантом В по уравнению:
то из этого уравнения следует, что одна частица А эквивалентна в/а частицам
вещества В. Отношение в/а называют фактором эквивалентности и обозначают
Например, для кислотно-основной реакции
Молярной массой эквивалента (Mэ) вещества X называют массу одного моля эквивалента этого вещества, равную произведению фактора эквивалентности на молярную массу вещества X. Для молярной массы эквивалента в литературе встречается также термин "эквивалентная масса".
Таким образом, молярная масса эквивалента – это масса авогадрова числа эквивалентов (вообще говоря, условных частиц): Mэ=fэ×M, где M – молярная масса вещества (масса авогадрова числа молекул, т.е. реальных частиц). Следовательно, масса вещества может быть выражена из соотношений m=ν×M=ν×Mэ/fэ=n×Mэ, где n=ν/fэ – количество вещества эквивалента.
Отношение количества вещества эквивалента в растворе к объему раствора называется молярной концентрацией эквивалента: C(fэ(X)X)=n(fэ(X)X)/V.
Например, C(1/2 H2SO4) = 0,1 моль/л.
Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора.
C(B) = n(B) / V = m(B) / (M(B) · V), где М(B) - молярная масса растворенного вещества г/моль.
Молярная концентрация измеряется в моль/л и обозначается "M". Например, 2 M NaOH - двухмолярный раствор гидроксида натрия. Один литр такого раствора содержит 2 моль вещества или 80 г (M(NaOH) = 40 г/моль).
Вместо обозначения единицы измерения моль/л допускается сокращение "н", происхождение которого связано с тем, что молярную концентрацию эквивалента называют также нормальной концентрацией. Например, 1н. H2SO4, т.е. 1 моль эквивалента H2SO4 на литр раствора. При использовании молярной концентрации эквивалента следует указывать реакцию, в которой применяется раствор данной нормальности, или приводить фактор эквивалентности.
Титр раствора — масса растворённого вещества в 1 мл раствора.

,
где: m1 — масса растворённого вещества, г; V — общий объём раствора, мл;
Титр по определяемому веществу (или титриметрический фактор пе-
ресчета) – это масса анализируемого вещества (в г), взаимодействующая с
где С – молярная концентрация титранта в моль/л;
M (1/ z ) _ молярная масса эквивалента определяемого вещества в г/моль.
Читайте также:

