Термодинамика газовой коррозии кратко
Обновлено: 02.07.2024
С термодинамических позиций протекание химической реакции окисления металлов обусловлено изменением свободной энергии Гиббса - ΔGТ (изобарно - изотермического потенциала), являющейся движущей силой процесса. При постоянной температуре и давлении окисление возможно, если ΔGТ 0. Вероятность образования оксидов возрастает при уменьшении величины ΔGТ. Система “металл – оксид – окислитель” находится в равновесии при ΔGТ = 0, когда скорости прямой (образования оксида) и обратной (разложения) реакции равны и роста образовавшегося оксида не происходит. Это равновесие характеризуется константой равновесия реакции, Кр.
Для реакция окисления металла кислородом:
в которой активности металла и оксида постоянны и равны 1, изменение энергии Гиббса согласно уравнению изотермы Вант-Гоффа (Р, Т = const):
, (2.2) где R = 8,314 Дж/(моль . К) – универсальная газовая постоянная; T – температура, К; - парциальное давление кислорода в газовой среде; - парциальное давление кислорода в равновесном состоянии, равное давлению (упругости) диссоциации оксида (атм); Кр = - константа равновесия, = -RT ln Кр – стандартное изменение энергии Гиббса при температуре Т.
Из уравнения 2.2 следует, что окисление металла термодинамически возможно (ΔGТ (2.3)
Величина служит мерой термодинамической устойчивости оксида (меньшее значение соответствует большей устойчивости), чем меньше ΔGТ и , тем больше сродство металла к окислителю. Условие (2.3) имеет важное практическое значение и является основой выбора безокислительных защитных атмосфер.
Равновесное парциальное давление (упругость) диссоциации оксида можно определить из уравнения (2.2):
, (2.4) где - стандартное изменение энергии Гиббса при = 1 атм, откуда
Приближенные значения приведены в приложении 1. В уравнении (2.5) при заданной температуре Т вычисляется по уравнению Гиббса-Гельмгольца:
, (2.6) где и - стандартное изменение энтальпии (тепловой эффект) и энтропии соответственно в результате протекания реакции при заданной Т.
Расчет производится на основе таблиц термодинамических величин, методами М.И. Темкина – Д.А. Шварцмана, М.Х. Карапетьянца и др., в т.ч. экспериментально - методом измерения ЭДС гальванического элемента типа М|MO|O2, у которого анод - поверхность металла на границе с оксидной пленкой, где происходит образование катионов и свободных электронов. Катодом является поверхность оксидной пленки на границе с газовой средой, где происходит ассимиляция электронов кислородом. Оксидная пленка имеет как ионную, так и катионную проводимость, и является одновременно как внутренней, так и внешней частью этого гальванического элемента. ЭДС такого элемента определяется как:
Еизм = Емах(tк+ tа) = Емах(1 – tе), (2.7) где - Емах – максимальная ЭДС, соответствующая изменению энергии Гиббса в реакции окисления; tк, tа, tе – число переноса катионов, анионов и электронов соответственно (tк + tа + tе = 1).
Пример 1.[*] Определить возможность окисления палладия в воздухе ( = 0,21 атм) и кислороде при 1123 К, если упругость (давление) диссоциации его оксида = 0,658 атм (0,667∙10 5 Па).
Решение. Реакция окисления палладия: .
Т.к. в воздухе Po2 =0,21 атм, (Po2)p> Po2, процесс окисления невозможен.
К этому же приводит расчет изменения энергии Гиббса для реакции окисления:
В кислороде процесс окисления возможен: (Po2)p 5 Па)]. Расчет энергии Гиббса дает тот же результат:
Влияние температуры на термодинамическую возможность окисления металлов и константу равновесия определяется уравнением изобары Вант-Гоффа:
Образование оксидов является экзотермическим процессом ( . Выше этой температуры образование оксидной пленки термодинамически невозможно.
При комнатных температурах на воздухе ( =0,21 атм 21278 Па) термодинамически невозможно образование оксидов Au, все остальные металлы окисляются. Температурная зависимость давления диссоциации оксидов металлов, lg = f(1/T), приведена на рис.2.1. С ростом температуры становятся устойчивыми: Ag при температурах более 420 К, Pd > 1080 K , Ir > 950 K.
Без учета взаимодействия компонентов сплава и продуктов окисления, в сплавах избирательно окисляются компоненты, обладающие наибольшим сродством к кислороду (щелочно-земельные и легкие металлы, Cr, Тi и тугоплавкие металлы).
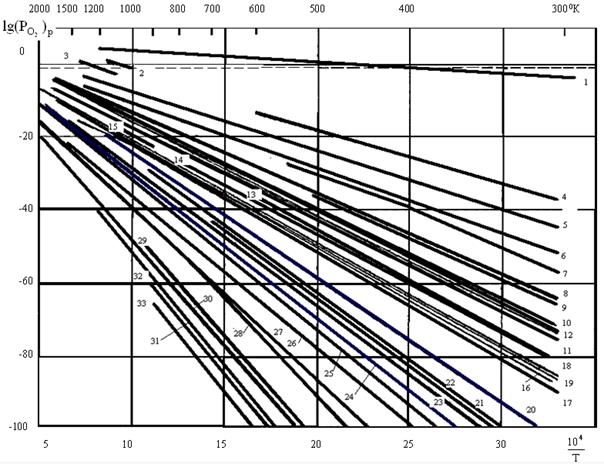
Рис.2.1 Температурная зависимость давления диссоциации оксидов: 1 – Ag2O, 2 – PdO, 3 – IrO2, 4 – PbO2, 5 – CuO, 6 – Cu2O, 7 – Bi2O3, 8 – Co3O4, 9 – As2O3 (орторомбич.), 10 – Sb2O3, 11 – NiO, 12 – CoO, 13 – CdO, 14 – MnO2, 15 – MoO2, 16 – WO2, 17 – Fe3O4, 18 – FeO, 19 – Fe2O3, 20 – Mn2O3, 21 – V2O5, 22 – ZnO, 23 – Mn3O4, 24 – Cr2O3, 25 – V2O4, 26 – MnO, 27 – V2O3, 28 – TiO2, 29 – Al2O3, 30 – ZrO2, 31 – BeO, 32 – MgO, 33 – CaO. Штриховая линия соответствует парциальному давлению кислорода в атмосфере.
Обычно сплавы на основе железа, никеля, меди для повышения жаростойкости легируют металлами, имеющими большее сродство к кислороду сравнительно с металлом основы. Эти легирующие компоненты, избирательно окисляясь, образуют на поверхности оксиды, часто обладающие более высокими защитными свойствами, которые определяются механизмом и кинетикой окисления. Термодинамическая возможность является необходимым, но недостаточным условием для повышения жаростойкости металлов сплавов.
Следует учитывать, что реальная температурная зависимость кинетики окисления, в отличие от термодинамической возможности, иная: термодинамическая нестабильность при повышении температуры снижается, а реальная скорость окисления возрастает (если процесс термодинамически возможен).
При окислении металлов оксиды низшей валентности всегда являются внутренними слоями оксидной пленки (рис. 2.2). При окислении сплава слой оксида металла, имеющего большее сродство к окислителю, всегда будет вблизи металлической поверхности, а внешним слоем – оксид более благородного металла.
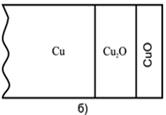
Рис. 2.2 Схема расположения слоев оксидной пленки: а) на железе при Т>570°С на воздухе; б) и в) на меди при 1000°С Ро2 > 13170 Па (0,13 атм) и Ро2 7 8910>
Первопричиной коррозии является термодинамическая неустойчивость металлов в различных средах при данных внешних условиях. Принципиальная возможность самопроизвольного протекания процесса коррозии определяется законами термодинамики.
Стремление металла перейти из металлического в ионное состояние характеризуется величиной уменьшения свободной энергии, что и составляет сущность процесса химической коррозии.
В качестве критерия равновесия и самопроизвольности процессов коррозии металлов наиболее удобно пользоваться изобарно-изотермическим потенциалом.
ΔG – функцией состояния системы, убыль которой в обратимом процессе при постоянных давлениях и температуре равна максимальной полезной работе.
Таким образом, процесс можно охарактеризовать тремя состояниями системы:
• 1) коррозионный процесс невозможен ΔG > 0;
• 2) коррозионный процесс возможен ΔG
1) перенос реагирующих веществ к поверхности раздела фаз;
2) собственно гетерогенная реакция;
3) отвод продуктов реакции из реакционной зоны.
Установившаяся суммарная скорость коррозионного процесса, состоящего из нескольких последовательных стадий, определяется скоростью самой заторможенной стадии.
При параллельном протекании отдельных стадий процесса суммарная скорость коррозии определяется самой быстрой стадией. Поэтому в случае, если одна из стадий протекает значительно быстрее другой, второй стадией можно пренебречь.
Классификация процессов коррозии
Независимо от огромного разнообразия условий протекания коррозионных процессов они могут быть классифицированы по двум основным признакам: по механизму протекания процесса и по характеру коррозионного разрушения.
Классификация процессов коррозии по механизму протекания
Различают химическую и электрохимическую коррозию. Химическая коррозия имеет место в жидких неэлектролитах и в сухих газах. При воздействии на металлы водных растворов электролитов и влажных газов коррозия протекает по электрохимическому механизму.
Отличительными особенностями электрохимического процесса коррозии являются следующие:
1. одновременное протекание двух раздельных процессов - окислительного (растворение металла) и восстановительного (выделение водорода, восстановление кислорода, выделение металла из раствора и др.);
2. процесс растворения металла сопровождается направленным перемещением электронов в металле и ионов в электролите, т.е. возникновением электрического тока;

3. продукты коррозии образуются в результате вторичных реакций.
Окислительно-восстановительные процессы, протекающие при электрохимической коррозии, могут быть представлены в виде следующих реакций:
Ме → Ме n + + ne (анодный процесс) (1)
ox + ne → mred (катодный процесс), (2)
где ox – окислитель;
red – его восстановленная форма;
е – электроны;
m, n – стехиометрические коэффициенты.
В качестве примера электрохимической коррозии можно привести процесс ржавления железа под воздействием воды:
Fe → Fе 2+ + 2е (анодный процесс – растворение железа)
2е + H2O +1\2О2 → 2OH – (катодный процесс – восстановление кислорода)
Fe 2+ + 2OH – → Fe(OH)2(образование продуктов коррозии)
Реакции 1 и 2 протекают сопряженно, но подчиняются своим кинетическим закономерностям. При этом необходимо соблюдение условий стационарности процесса, т.е. равенства скоростей окисления металла и восстановления окислителя. Реакции 1 и 2 могут быть территориально разделены – протекать на разных участках поверхности. Из условий стационарности вытекает, что достаточно затормозить одну из сопряженных реакций, чтобы скорость всего процесса уменьшилась.
Если среда не является электролитом (сухие газы или жидкие неэлектролиты), то обмен электронами совершается непосредственно между металлом и окислителем по реакции:
mMe + nox → Me m(red)n (3)
В данном случае окисление совершается по химическому механизму.
Первопричиной коррозии является термодинамическая неустойчивость металлов в различных средах при данных внешних условиях. Принципиальная возможность самопроизвольного протекания процесса коррозии определяется законами термодинамики.
Стремление металла перейти из металлического в ионное состояние характеризуется величиной уменьшения свободной энергии, что и составляет сущность процесса химической коррозии.
В качестве критерия равновесия и самопроизвольности процессов коррозии металлов наиболее удобно пользоваться изобарно-изотермическим потенциалом.
ΔG – функцией состояния системы, убыль которой в обратимом процессе при постоянных давлениях и температуре равна максимальной полезной работе.
Таким образом, процесс можно охарактеризовать тремя состояниями системы:
• 1) коррозионный процесс невозможен ΔG > 0;
• 2) коррозионный процесс возможен ΔG n + + ne (анодный процесс) (1)
ox + ne → mred (катодный процесс), (2)
где ox – окислитель;
red – его восстановленная форма;
е – электроны;
m, n – стехиометрические коэффициенты.
В качестве примера электрохимической коррозии можно привести процесс ржавления железа под воздействием воды:
Fe → Fе 2+ + 2е (анодный процесс – растворение железа)
2е + H2O +1\2О2 → 2OH – (катодный процесс – восстановление кислорода)
Fe 2+ + 2OH – → Fe(OH)2(образование продуктов коррозии)
Реакции 1 и 2 протекают сопряженно, но подчиняются своим кинетическим закономерностям. При этом необходимо соблюдение условий стационарности процесса, т.е. равенства скоростей окисления металла и восстановления окислителя. Реакции 1 и 2 могут быть территориально разделены – протекать на разных участках поверхности. Из условий стационарности вытекает, что достаточно затормозить одну из сопряженных реакций, чтобы скорость всего процесса уменьшилась.
Если среда не является электролитом (сухие газы или жидкие неэлектролиты), то обмен электронами совершается непосредственно между металлом и окислителем по реакции:
Коррозией металлов называется самопроизвольное их разрушение вследствие химического или электрохимического взаимодействия с окружающей средой.
Химическая коррозия – это процесс, при котором окисление металла и восстановление окислительного компонента среды протекают в одном акте. Типичный пример: окисление железа кислородом воздуха:
Наиболее распространенным и практически важным видом химической коррозии является газовая коррозия – коррозия металлов в газах при высоких температурах. В настоящем курсе лекций, в котором рассматриваются вопросы противокоррозионной защиты металлических сооружений в морской воде, морской атмосфере и других естественных средах, химическая коррозия рассматриваться не будет, как практически мало существенная в данных условиях.
Электрохимическая коррозия – это разрушение металлов вследствие их электрохимического взаимодействия с электролитически проводящей средой, при котором ионизация атомов металла и восстановление окислительного компонента среды протекает не в одном акте и их скорости зависят от величины электродного потенциала металла. Этот вид коррозии наиболее распространен и является превалирующим для интересующих нас условий эксплуатации металлоконструкций.
Первопричиной коррозии металлов является их термодинамическая неустойчивость в различных средах при данных внешних условиях. Термодинамика определяет возможность или невозможность самопроизвольного протекания коррозионного процесса при определенных условиях.
Скорость коррозионного процесса может быть представлена в общем виде с помощью уравнения:
Скорость коррозии (СК)= .ДСП / ТП
ДСП - движущая сила процесса
ТП - Торможение процесса
ДСП может быть определена с помощью термодинамики. ТП не может быть определено термодинамически, однако с помощью термодинамики можно оценить условия, уменьшающие или исключающие протекание процесса (применение защитных сред, катодная защита, обескислороживание и др.).
Независимо от механизма коррозии возможность ее протекания определяется знаком изменения термодинамического потенциала. Процессы коррозии наиболее часто описывают изменением изобарно-изотермического потенциала – энергии Гиббса.
Любое изменение энергии системы характеризует переход ее в новое состояние и является мерой стабильности системы:
где ΔG – энергия, израсходованная на изменение состояния системы, например, на процесс коррозии; GI - энергия системы в исходном состоянии, например, металла в конкретных условиях; GII - энергия системы в новом состоянии, например, прокорродировавшего металла.
Очевидно, что при ΔG = 0 система находится в равновесии; при ΔG 0 процесс коррозии невозможен.
Процесс электрохимической коррозии включает в себя пять основных этапов. Например, для случая коррозии углеродистой стали в воде или влажном воздухе процесс протекает следующим образом:
1) ионизация атомов железа с образованием гидратированных ионов в воде и некомпенсированных электронов на анодных участках металла
Fe + mH2O → Fe +2 m H2 O + 2e -
2) переход электронов на катодные участки и их ассимиляция деполяризаторами (в нейтральных растворах кислородом) с образованием ионов гидроксила
3) образование в растворе гидрата закиси железа
4) доокисление до гидрата окиси железа Fe (ОН)3 и преобразование его в окончательный продукт коррозии Fe2 O3 ∙ mH2 O
Суммарная реакция коррозии стали будет иметь вид:
Коррозия металла представляется как результат работы большого числа коррозионных гальванических элементов, возникающих на отдельных участках поверхности вследствие ее гетерогенности. Электрохимическая гетерогенность поверхности металла, обуславливающая ее дифференциацию на анодные и катодные участки, может быть вызвана различными причинами: макро- и микровключениями примесей, анизотропностью кристаллической решетки, наличием оксидных пленок и других загрязнений, неравномерностью приложения механических нагрузок, наличием пар дифференциальной аэрации и др.
Скорость и характер коррозионного процесса определяется в конечном итоге величиной стационарного потенциала металла φ , отвечающей установившейся скорости ионизации металла.
Усредненные значения стационарных потенциалов металлов в морской воде (по водородному электроду, В*) можно расположить в ряд:
Магний - 1,45
Марганец - 0,96
Цинк - 0,80
Алюминий - 0,54
Железо -0,40
Кадмий -0,40
Свинец -0,30
Олово -0,20
Медь -0,10
Титан -0
Ниобий +0,10
Никель +0,10
Серебро +0,15
Платина +0,80
Исходя из теории локальных элементов, ток коррозии в общем виде может определяться по закону Ома:
где , φk - φa - потенциалы катодных и анодных участков;
, Rнк + Rna- соответственно поляризационное сопротивление на катоде и аноде;
Rом- сопротивление электролита.
Определяющие скорость коррозии соотношения обычно наглядно представляются в виде коррозионных диаграмме, где потенциалы анода и катода представляются в функции силы тока.

Чаще всего скорость коррозионного процесса определяется следующими факторами:
- медленностью диффузии реагентов к поверхности металла или продуктов реакции в обратном направлении ( диффузионный контроль процесса);
- медленностью реакции взаимодействия металла с коррозионной средой или ее компонентами, обусловленной энергией активации реакции ( кинетический контроль);
- медленностью обеих стадий при соизмерении их торможений (диффузионно-кинетический котроль).
*Здесь и далее величины потенциалов даны по водородному электроду. На практике обычно применяются хлорсеребряные электроды сравнения, имеющие собственный потенциал +240 мВ по отношению к нормальному водородному электроду, реже медносульфатные +310мВ и цинковые – 800мВ.
Теоретические сведения.
Термодинамика газовой коррозии.
При взаимодействии металла с сухими газами (воздухом, газообразными продуктами горения топлива и др.) при высоких температурах происходит газовая химическая коррозия.
Газовая коррозия может протекать в атмосферных условиях (на воздухе), в сухой среде, содержащей водород, метан, другие углеводороды, оксиды углерода и серы, сероводород, галогены и их соединения. Чаще всего газовая коррозия возникает при окислении металлов О2, SO2, H2S, Cl2, НСl,
NO3, CO2, CO и H2.
Результатом газовой коррозии является появление на поверхности металлов и сплавов продуктов коррозии (окалины и шлаков) при плавлении и термической обработке, при эксплуатации газовых турбин, аппаратов химического производства, двигателей внутреннего сгорания, оборудования для хранения, транспортировки и переработки природных газов и нефтепродуктов. Газовая коррозия наносит ущерб многим отраслям промышленности, но наибольшие потери металла наблюдаются в металлургии, нефтегазовой и химической промышленности.
Процесс газовой коррозии, в том числе с участием кислорода, включает следующие стадии:
1-я стадия: ионизация металла и кислорода на границе твердой и газообразной фаз;
2-я стадия: физическая адсорбция кислорода, т. е. увеличение концентрации растворенного вещества на чистой поверхности металла, приводящее к ослаблению связей между атомами в молекуле кислорода.
Ионы кислорода удерживаются на поверхности благодаря межмолекулярным
силам (силам Ван-дер-Ваальса);
соотношения между объемами продуктов коррозии VОК и металла VМ, из которого они образовались:
𝑉
ok
𝑉
𝑀
=
𝑀
𝑜𝑘
𝜌
𝑀
𝑛𝑀
𝑀
𝜌
𝑜𝑘
где V
ОК
– объем оксида; M
ОК
– молярная масса оксида; ρ
М
– плотность металла; n – число атомов металла в молекуле оксида: M
М
– молярная масса металла; ρ
ОК
– плотность оксида.
Если V
ОК
/ V
М
1), процесс коррозии тормозится в связи с замедлением диффузии ионов через утолщающуюся пленку. Для таких металлов (Fе, Со, Ni, Мn, Тi) наиболее характерна параболическая зависимость для кинетики окисления которая в простейшем случае
(исключая начальный период роста пленки) может быть определена следующим выражением: где k – константа; D – коэффициент диффузии иона;C
o2
– концентрация кислорода в газе.
Для ряда металлов (Zn, Аl, Cr) установлена логарифмическая зависимость роста пленки во времени:
Пленки, растущие по логарифмическому закону, обладают высокими защитными свойствами.
Разрушение пленки возможно по ряду причин. Если объем пленки больше объема металла, на месте которого она образовалась, то это приводит к появлению внутренних напряжений, сжимающих пленку параллельно поверхности и стремящихся оторвать ее от металла. При высоких внутренних напряжениях пленка разрушается. Таким условиям соответствуют пленки соотношением V
ОК
/V
М
> 2,5. Таким образом, важны не только защитные свойства пленки, но и ее механические свойства – прочность, упругость.
Скорость коррозии возрастает с увеличением температуры из-за повышения коэффициента диффузии и изменения защитных свойств пленки.
Быстрое разрушение защитной пленки часто вызывают резкие температурные изменения.
Определение законов изменения массового показателя коррозии в
зависимости от температуры, химического состава и времени.
Nb – Cu (5 %)
0 10 20 30 40 50 60 70 5 10 15 30 45 60 90 120 150 180 210 240 270 300 330 360 390 420 450 480
Δm/S, мг/см2
Время, мин
500 °С
600 °С
0 20 40 60 80 100 120 140 160 5 10 15 30 45 60 90 120150180210240270300330360390420
Δm/S, мг/см2
Время, мин
700 °С
900 °С
Nb – Cu (10 %)
0 50 100 150 200 250 5
10 15 30 45 60 90 120 150 180
Δm/S, мг/см2
Время, мин
800 °С
0 10 20 30 40 50 60 70 5
10 15 30 45 60 90 120 150 180
Δm/S, мг/см2
Время, мин
500 °С
600 °С
0 50 100 150 200 250 300 5
10 15 30 45 60 90 120 150 180
Δm/S, мг/см2
Время, мин
700 °С
900 °С
0 50 100 150 200 250 300 5
10 15 30 45 60 90 120 150 180
Δm/S, мг/см2
Время, мин
800 °С
Nb – Cu (30 %)
0 20 40 60 80 100 120 140 160 5
10 15 30 45 60 90 120 150
Δm/S, мг/см2
Время, мин
500 °С
600 °С
0 50 100 150 200 250 5
10 15 30 45 60 90 120 150
Δm/S, мг/см2
Время, мин
700 °С
800 °С
Nb – Cu (50 %)
0 50 100 150 200 250 300 350 400 5 10 15 30 45 60 90 120150180210240270300330360390420450480 Время, мин
500 °С
600 °С
0 50 100 150 200 250 300 350 5
10 15 30 45 60 90 120 150 180 210 240 270 300 330 360
Δm/S, мг/см2
Время, мин
700 °С
900 °С
Nb – Cu (70 %)
0 50 100 150 200 250 300 350 5 10 15 30 45 60 90 120 150 180 210 240 270 300 330 360 390 420 450 480
Δm/S, мг/см2
Время, мин
800 °С
0 10 20 30 40 50 60 5
10 15 30 45 60 90 120 150 180
Δm/S, мг/см2
Время, мин
500 °С
600 °С
0 20 40 60 80 100 120 140 160 180 200 5
10 15 30 45 60 90 120 150 180
Δm/S, мг/см2
Время, мин
700 °С
900 °С
0 10 20 30 40 50 60 70 80 90 100 5
10 15 30 45 60 90 120 150 180
Δm/S, мг/см2
Время, мин
800 °С
Nb – Cu (90 %)
0 0.5 1
1.5 2
2.5 3
5 10 15 30 45 60 90 120 150 180 210 240 270 300 330 360 390 420 450 480
Δm/S, мг/см2
Время, мин
500 °С
600 °С
0 20 40 60 80 100 120 5
10 15 30 45 60 90 120 150 180 210 240 270 300 330 360 390 420 450 480
Δm/S, мг/см2
Время, мин
700 °С
900 °С
Анализ графиков.
Nb – Cu (5 %)
При температуре 500 и 600°С сплав окисляется по параболическому закону. При температуре 700 и 900°С сплав окисляется по линейному закону.
При температуре 800°С сплав окисляется по параболическому закону.
Вывод: Для сплава состава Nb – Cu (5 %)преобладает параболический закон развития коррозии.
Nb – Cu (10 %)
При температуре 500 и 600°С сплав окисляется по параболическому закону. При температуре 700 и 900 °С сплав окисляется по параболическому закону. При температуре 800°С сплав окисляется по параболическому закону.
Вывод: Для сплава состава Nb – Cu (10 %)преобладает параболический закон развития коррозии.
Nb – Cu (30 %)
0 2
4 6
8 10 12 5
10 15 30 45 60 90 120 150 180 210 240 270 300
Δm/S, мг/см2
Время, мин
800 °С
При температуре 500 и 600°С сплав окисляется по линейному закону.
При температуре 700 °С сплав окисляется по линейному закону. При температуре 800°С сплав окисляется по линейному закону.
Вывод: Для сплава состава Nb – Cu (30 %)преобладает линейный закон развития коррозии.
Nb – Cu (50 %)
При температуре 500°С сплав окисляется по линейному закону. При температуре 600°С сплав окисляется по линейному закону. При температуре
700 и 900 °С сплав окисляется по линейному закону. При температуре 800°С сплав окисляется по линейному закону.
Вывод: Для сплава состава Nb – Cu (50 %)преобладает линейный закон развития коррозии.
Nb – Cu (70 %)
При температуре 500 и 600°С сплав окисляется по параболическому закону. При температуре 700 и 800 °С сплав окисляется по параболическому закону. При температуре 900°С сплав окисляется по логарифмическому закону.
Вывод: Для сплава состава Nb – Cu (70 %)преобладает параболический закон развития коррозии.
Nb – Cu (90 %)
При температуре 500 и 600°С сплав окисляется по логарифмическому закону. При температуре 700 °С сплав окисляется по линейному закону. При температуре 800°С сплав окисляется по параболическому закону. При температуре 900°С сплав окисляется по линейному закону.
Вывод: Для сплава состава Nb-Cu (90%)преобладает логарифмический закон развития коррозии.
Определение рационального состава сплава при эксплуатации при
температуре 500 °С в течение 2 часа.
Состав сплава, %
∆m
S
; мг/см
2
v кор
;
мг см
2
∗ ч
Nb
Cu
95 5
12,1 6
90 10 16,1 8
70 30 58 29 50 50 36,9 18,4 30 70 15,9 7,9 10 90 0,3 0,15
Вывод:
При эксплуатации при температуре 500 °С в течение 2 часов целесообразно использовать сплавы с содержанием Nb 10% и Co 90%, так как именно он окисляются с наименьшей скоростью.
0 5
10 15 20 25 30 35 5
10 30 50 70 90
vкор,
мг/(см^2*ч)
Cu,%
Определение рационального состава сплава при эксплуатации при
температуре 600 °С в течение 3 часа.
Состав сплава, %
∆m
S
; мг/см
2
v кор
;
мг см
2
∗ ч
Nb
Cu
95 5
28,5 9,5 90 10 61,5 20,5 70 30 150,3 50,1 50 50 159,4 53,1 30 70 49,4 16,5 10 90 1,2 0,4
Вывод:
При эксплуатации при температуре 600 °С в течение 3 часов целесообразно использовать сплавы с содержанием Nb 10% и Cu 90%, так как именно он окисляются с наименьшей скоростью.
0 10 20 30 40 50 60 5
10 30 50 70 90
vкор,
мг/(см^2*ч)
Сu,%
Читайте также:

