Световая микроскопия это в биологии кратко
Обновлено: 03.07.2024
Световая, или оптическая, микроскопия — это один из основных методов исследования частиц, неразличимых человеческим глазом. Данный метод имеет широкое распространение в медицине, фармакологии, биологии, металлографии, криминалистике и других сферах.
Увеличение изображения в световом микроскопе обеспечивается системой собирательных линз, расположенных в окуляре и объективе.

Световой микроскоп — оптический прибор, позволяющий рассмотреть мелкие детали.
Метод световой микроскопии
Предельная разрешающая способность человеческого глаза составляет около 0,1 мм. Это понятие отражает минимальное расстояние, на котором 2 соседние точки определяются как отдельные объекты. Микрочастицы, клеточные структуры и дефекты поверхности имеют размер менее 100 мкм, поэтому для их исследования требуется специальное оборудование.
Историческая справка
Первые оптические микроскопы были изобретены в XVI-XVII вв. Первым, кто заметил увеличительный эффект комбинации из нескольких линз, был венецианский врач Джироламо Фракасторо. В 1609 г. Галилео Галилей представил собственный вариант прибора с 2 стеклами: выпуклым и вогнутым. Первое устройство называлось оккиолино (occhiolino).
Через 10 лет после этого голландский ученый Корнелиус Дреббель усовершенствовал конструкцию, использовав для объектива 2 выпуклые линзы.
Практическое применение микроскопа началось с конца XVII в., когда Антони Ван Левенгук использовал собственное оптическое устройство для исследования биологических структур. Его микроскоп содержал всего одно мощное стекло, что уменьшало количество дефектов картинки.
Приборы Левенгука позволяли увеличить изображение в 275 раз и рассмотреть строение бактерий, дрожжей, эритроцитов, одноклеточных микроорганизмов и насекомых.

Методы микроскопии выбираются в зависимости от характера и свойств изучаемых объектов.
В течение следующих столетий конструкция оптического микроскопа непрерывно совершенствовалась. Несмотря на то, что в первой половине XX в. были изобретены электронные приборы, которые позволяли рассмотреть нанообъекты, световой метод не теряет своей популярности. В 2006 г. группа немецких ученых разработала оптическое устройство под названием наноскоп, которое обладает разрешающей способностью 10 нм.
Подробно о принципе действия
Принцип работы оптического микроскопа основывается на прохождении прямого или отраженного луча света через систему линз.
Объектив прибора содержит до 14 стекол. При прохождении светового пучка через эту часть устройства изображение увеличивается до 100 раз, а при прохождении окуляра — в 20-24 раза. Выпуклые и вогнутые стекла позволяют сфокусировать картинку на сетчатке или приспособлениях для документирования информации.
Видимое излучение, которое создает осветительная система прибора, ограничивают несколькими диафрагмами. Это повышает четкость изображения.
Увеличивающие линзы имеют 2 дефекта. Сферическая аберрация мешает фокусировать сразу все поле исследования, а хроническая приводит к появлению яркой каймы по контуру изображения. Чтобы компенсировать дефекты, окуляр и объектив оснащаются корригирующими стеклами.
Где применяется
Методы световой микроскопии применяют в следующих областях науки и промышленности:
- медицине и лабораторной диагностике;
- биологии;
- металлографии, неразрушающих методах контроля на производстве;
- микроэлектронике;
- минералогии, кристаллографии;
- археологии, геологии;
- криминалистике;
- пищевой промышленности;
- ювелирном деле и др.
.jpg)
Световая микроскопия применяется в медицине и биологии.
В целом об устройстве светового микроскопа
Оптический микроскоп состоит из следующих элементов:
- штатива;
- тубуса;
- окуляра;
- объектива;
- призмы;
- источника света;
- конденсора;
- апертурной и полевой диафрагм;
- фокусировочного механизма;
- светофильтра;
- зеркала;
- предметного столика.
.jpg)
Устройство светового микроскопа.
Некоторые модели прибора оборудованы дополнительными объективами, системами записи и передачи информации.
Виды световых микроскопов с описанием
Особенности конструкции зависят от предназначения микроскопа. Для увеличения четкости изображения используют методы флуоресценции, люминесценции, инверсии и др.
Биологическое оборудование
Биологические приборы позволяют исследовать прозрачные или полупрозрачные объекты. Принцип их работы основан на изучении светлого поля в потоке проходящего света. Такие микроскопы применяют в лабораторной диагностике, ботанике, цитологии, микроэлектронике, археологии и пищевой промышленности.

Биологическое оборудование позволяет исследовать прозрачные объекты.
Для повышения разрешающей способности используют иммерсионные оптические системы. В этом случае между образцом и первым стеклом вводится жидкость с высоким коэффициентом преломления (минеральное масло, раствор глицерина, дистиллированная вода и др.).
Криминалистическое оборудование
Главная особенность криминалистического микроскопа — это возможность сравнения 2 объектов. Такое исследование помогает найти сходство между компонентами взрывных устройств, гильзами, пулями, волосами, волокнами и другими уликами.
Приборы для криминалистики оснащают фото- и видеокамерами, а также программным обеспечением.
Это позволяет снизить вероятность ошибок, построить модели объектов и сравнить с данными из электронных источников.
Флуоресцентные микроскопы
Флуоресцентные, или люминесцентные, микроскопы позволяют исследовать объекты, которые испускают световой поток после облучения ультрафиолетом. Они оборудованы коротковолновым источником освещения, светофильтрами и интерференционной пластинкой.

Флуоресцентный микроскоп — оптический прибор, показывающий в увеличенном виде клетки.
Флуоресцентные микроскопы активно применяют в лабораторной диагностике, в частности, при изучении клеток крови и антигенов. Для анализа предметов, которые не излучают свет, используют люминесцентные красители и порошки.
Поляризационные микроскопы
Поляризационный прибор является наиболее сложным из всех представленных видов микроскопов. Его используют для исследования анизотропных материалов, полимеров, некоторых клеток и микробиологических объектов.
Источник света со специальными фильтрами формирует поляризованный поток, который облучает образец.
Оптическая система интерпретирует двойное лучепреломление среды и позволяет изучить ее структуру.
Инвертированные с перевернутым положением объектива
В инвертированном микроскопе объектив располагается не над образцом, а под предметным столиком. Такие приборы применяют в биологии, медицине, промышленности, металлографии, криминалистике и других сферах.

Инвертированный микроскоп имеет особенную конструкцию.
Перевернутое положение оптической системы позволяет изучать более крупные образцы и работать со специальной посудой.
Микроскопы для металлографии
Металлографические микроскопы предназначены для исследования поверхности непрозрачных объектов. Изображение получают путем преломления отраженного светового луча.
Предметом изучения являются микродефекты поверхности и зерна сплавов. Помимо металлургии и промышленности, такие устройства применяют в геологии и археологии. Для обеспечения четкости используют специальные системы линз и зеркал.
Стереомикроскопы (дают объемное изображение)
Стереомикроскопы оснащены 2 объективами, что позволяет получать объемное изображение исследуемого образца. По сравнению с устройствами плоского поля они дают более резкую, четкую и контрастную картинку.

Стереомикроскопы позволяют получать объемное изображение.
Такие приборы используют в точном машиностроении, ювелирном деле и других областях промышленности.
Моновидеомикроскопы с возможностью получения видео
Видеомикроскопы предназначены для динамического наблюдения за образцом и фиксации изображения. Для повышения эффективности работы их оснащают специальными линзами, светофильтрами и адаптерами.
Разновидности методов световой микроскопии
Выбор метода оптической микроскопии определяется особенностями объектов и целью исследования.
Светлое поле в потоке проходящего света
Данный метод основан на принципе прохождения потока света через образец. Предмет частично поглощает и рассеивает попадающие на него лучи, что позволяет сформировать изображение.

Светлое поле в потоке — метод, который построен на принципе прохождения света.
Светлопольную микроскопию применяют для изучения окрашенных тканей животных и растений, тонких шлифов и др. Для прохождения светового пучка препарат должен быть прозрачным.
Косое освещение
Данный метод является разновидностью микроскопии светлого поля. Чтобы выявить рельеф и сделать изображение более контрастным, поток направляют под большим углом к образцу.
Светлое поле в отраженном свете
Светопольная микроскопия в отраженном свете позволяет исследовать поверхности непрозрачных предметов (сплавов, покрытий, руд и др.). Свет падает на образец сверху, а основная оптическая система исполняет роль объектива и конденсора.
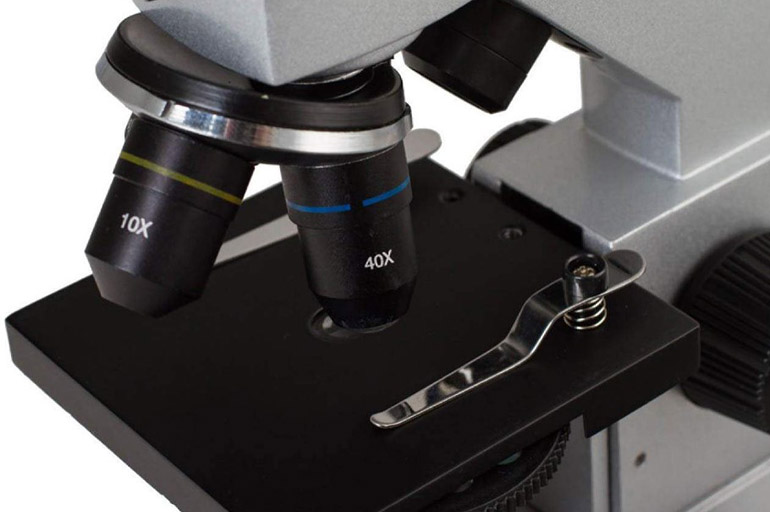
Светлое поле в отраженном свете позволяет исследовать поверхности непрозрачных предметов.
Изображение формируется за счет того, что элементы поверхности по-разному отражают и рассеивают попадающие лучи. Травление дает возможность изучить не только дефекты, но и микроструктуру и фазовый состав образца.
Темное поле
Метод темного поля предназначен для изучения прозрачных образцов, которые не абсорбируют свет. Специальный конденсор направляет лучи так, что они формируют полый конус, в центре которого находится объектив. Таким образом, большая часть лучей не попадает в оптическую систему.
Изображение представляет собой темное поле с небольшими светлыми включениями, которые формируются за счет рассеяния света частицами препарата.
Ультрамикроскопия
Метод ультрамикроскопии является разновидностью темнопольного. Для исследования образцов используют сильные источники света, а лучи направляют перпендикулярно предметному столу. Эффект рассеяния волн позволяет обнаружить частицы менее 10 нм.

Ультрамикроскопия — метод наблюдения и анализа коллоидных частиц.
Фазовое контрастирование
Метод фазового контраста позволяет изучать прозрачные и неокрашенные образцы. При малом различии в коэффициенте преломления изображение нельзя получить ни на светлопольном, ни на темнопольном микроскопе, поскольку разница в поглощении и рассеянии света будет минимальной.
Однако при прохождении через образец волна приобретает фазовый рельеф, который фиксируется специальным объективом. В изображении он отображается как различие в яркости элементов.
Аноптральный контраст
Данная методика является подвидом фазовой микроскопии. На иммерсионную линзу наносят кольцо из сажи, которое пропускает 10% лучей и совпадает с контуром кольцевой диафрагмы конденсора. При отсутствии образца амплитуда световых волн уменьшается на 90%.
Проходя через среды разной плотности, лучи дифрагируют, в результате чего их амплитуда остается неизменной.
За счет этого поле исследования получается темным, а частицы образца — светлыми.
Поляризационный метод
Анализ анизотропных материалов проводят в свете, пропущенном через специальную фильтрующую пластинку. При прохождении через образец плоскость поляризации лучей меняется.
По разнице между начальными и конечными характеристиками волн определяют количество оптических осей, их ориентацию и др.
Интерференционная микроскопия
Интерференционный метод основан на параллельном прохождении 2 лучей через предметный столик и мимо него. В окуляре микроскопа когерентные волны соединяются и интерферируют между собой.
При прохождении через образец первый луч запаздывает по фазе, что влияет на результирующую амплитуду и яркость изображения.
Люминесценция или флуоресценция
Принцип люминесцентной микроскопии основан на том, что некоторые образцы испускают видимый свет после облучения ультрафиолетом. Перед исследованием препараты обрабатывают флуоресцирующими антисыворотками, порошками или маркерами.
Волны ультрафиолетового спектра применяют для повышения разрешающей способности микроскопа. Для изучения препаратов, которые не испускают видимый свет после воздействия УФ-лучей, используют фотокамеры и кварцевые линзы.
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
Описание презентации по отдельным слайдам:




Функции: Световая микроскопия обеспечивает: увеличение до 2-3 тысяч раз цветное и подвижное изображение живого объекта возможность микрокиносъемки и длительного наблюдения одного и того же объекта и оценку его динамики и химизма.

Методы световой микроскопии: Метод светлого поля. Метод темного поля . Метод фазового контраста. Поляризационная микроскопия. Метод интерференционного контраста. Метод исследования в свете люминесценции. Иммерсионная световая микроскопия.



Применение: В лабораторных биологических и медицинских исследованиях, на различных производствах для получения увеличенных изображений объектов во время проведения рабочих операций, в научных и промышленных лабораториях и т.д.

Достоинства и недостатки: Достоинства: получение цветного и подвижного изображения движущегося объекта; возможность делать микрокиносъёмку; долгое наблюдение за одним и тем же объектом; возможность оценивать динамику и химизм элементов. Недостатки: Высокая разрешающая способность электронного микроскопа позволяет наблюдать объекты, размеры которых лежат за пределами разрешающей способности светового микроскопа.

Краткое описание документа:
Световая микроскопия обеспечивает увеличение до 2-3 тысяч раз, цветное и подвижное изображение живого объекта, возможность микрокиносъемки и длительного наблюдения одного и того же объекта, оценку его динамики и химизма.
Основными характеристиками любого микроскопа являются разрешающая способность и контраст. Разрешающая способность - это минимальное расстояние, на котором находятся две точки, демонстрируемые микроскопом раздельно. Разрешение человеческого глаза в режиме наилучшего видения равно 0.2 мм.
Контраст изображения - это различие яркостей изображения и фона. Если это различие составляет менее 3 - 4 %, то его невозможно уловить ни глазом, ни фотопластинкой; тогда изображение останется невидимым, даже если микроскоп разрешает его детали. На контраст влияют как свойства объекта, которые изменяют световой поток по сравнению с фоном, так и способности оптики уловить возникающие различия в свойствах луча.
Возможности светового микроскопа ограничены волновой природой света. Физические свойства света - цвет (длина волны), яркость (амплитуда волны), фаза, плотность и направление распространения волны изменяются в зависимости от свойств объекта. Эти различия и используются в современных микроскопах для создания контраста.
Увеличение микроскопа определяется как произведение увеличения объектива на увеличение окуляра. У типичных исследовательских микроскопов увеличение окуляра равно 10, а увеличение объективов – 10, 45 и 100. Соответственно, увеличение такого микроскопа составляет от 100 до 1000. Некоторые из микроскопов имеют увеличение до 2000. Еще более высокое увеличение не имеет смысла, так как при этом разрешающая способность не улучшается. Напротив, качество изображения ухудшается.
Методы световой микроскопии
Методы световой микроскопии (освещения и наблюдения). Методы микроскопии выбираются (и обеспечиваются конструктивно) в зависимости от характера и свойств изучаемых объектов, так как последние, как отмечалось выше, влияют на контрастность изображения.
Световая микроскопия
Электронная микроскопия
Другие методы
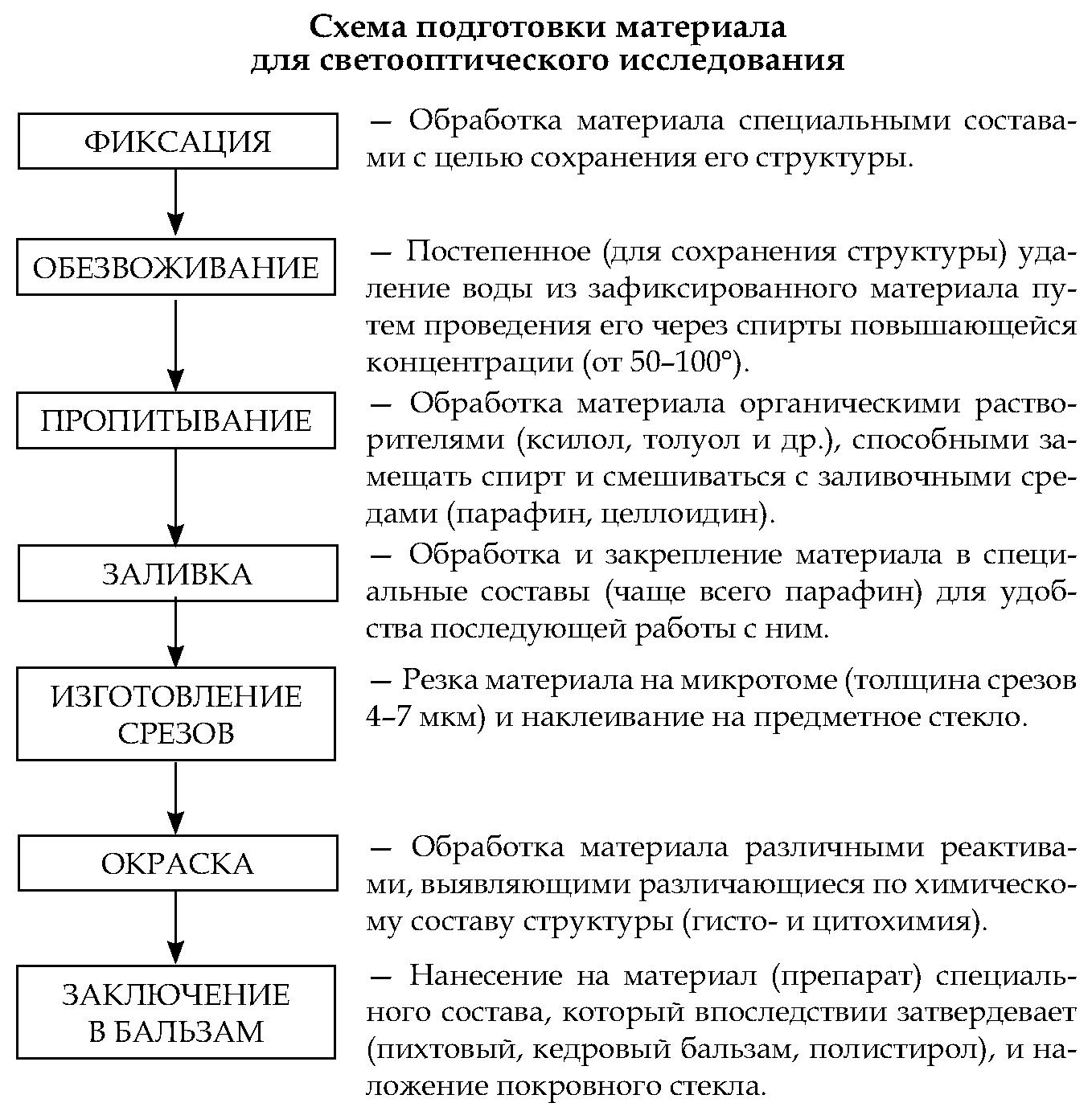
Современная биология располагает большим разнообразием ме- тодов, позволяющих изучать структуру и функции живых и фиксированных клеток на микроскопическом и субмикроскопическом уровнях. Наиболее широко применяются следующие методы:
• прижизненное окрашивание;
• темнопольная микроскопия;
• флуоресцентная микроскопия;
• фазово-контрастная микроскопия;
• культивирование клеток и тканей;
• электронная микроскопия;
• рентгеноструктурный анализ;
• цито- и гистохимия;
• цитоспектрофотометрия;
• дифференциальное центрифугирование;
• гистоавторадиография.
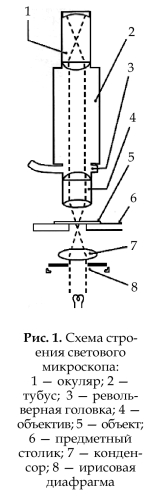
Световая микроскопия Схема строения светового микроскопа представлена на рис. 1. Окуляр (1): увеличивает изображение, получаемое в линзах объектива; в окуляр может быть вставлена измерительная сетка, если необходимо измерить размеры объекта.
Тубус (2): трубка, по которой свет проводится от объектива к окуляру; может перемещаться в штативе для фокусировки изображения объекта.
Револьверная головка (3): в нее вставлены 2, 3 или 4 объектива. Головка поворачивается так, чтобы можно было использовать объективы с разным фокусным расстоянием (а значит, и с разным увеличением).
Объектив (4): увеличивает изображение объекта.
Объект исследования (5): закреплен на прозрачной стеклянной пластине (предметное стекло).
Предметный столик (6): удерживает объект в нужной позиции по отношению к оптической системе микроскопа.
Конденсор (7): фокусирует лучи света от осветителя на объекте исследования.
Ирисовая диафрагма (8): регулирует вели- чину светового потока к объекту. Лучшее разрешение достигается при уменьшении осве- щения (а не при увеличении). Для освещения чаще всего используется белый свет. Для повышения разрешения применяется свет коротковолновой части спектра (например, синий), излучаемый специальной лампой или системой фильтров. Свет на объект должен падать только из-под предметного столика. Диаметр типичной клетки приблизительно 10–20 мкм, что в 5 раз меньше размеров мельчайшей видимой частицы глазом, так как разрешающая способность человеческого глаза 100 мкм (0,1 мм).
Метод сравнительной микроскопиии используется для исследования двух объектов путем визуального наблюдения или фотографирования. В поле зрения микроскопа сравниваемые объекты видны одновременно. Метод используется в различных областях биоло- гии и медицины.
Метод прижизненного (витального) окрашивания основан на использовании очень низких концентраций красителя (растворы от 0,1% до 0,01%). В такой концентрации красители являются малотоксичными для клеток. Чаще используют конгорот, нейтральный красный, трипановый синий и другие соединения ароматического ряда. В живой клетке при введении красителя наблюдается гранулообразование, в погибающей — диффузное окрашивание. По способности клеточных структур воспринимать краситель можно судить о степени повреждения клетки. Таким образом, метод позволяет судить о жизнедеятельности клеток при различных внешних воздействиях.
Метод микроскопирования в темном поле (темнопольная микроскопия) используется для рассматривания особо мелких структур (менее 0,2 мкм). Метод основан на том, что мелкие структуры, невидимые при обычном микроскопировании, светятся в отраженных лучах (эффект Тиндаля: светящиеся пылинки в луче солнечного света). Используется специальный конденсор, который пропускает только косые краевые лучи источника света. Поскольку краевые лучи имеют сильный наклон, они не попадают в объектив и поле зрения оказывается темным, а объект — светлым.
Флуоресцентная микроскопия основана на том, что некоторые вещества и структуры способны светиться (флуоресцировать, люминисцировать) при поглощении световой энергии. Для наблюдения флуоресценции используют либо фильтры, дающие освещение в сине-фиолетовой области, либо ультрафиолетовые и люминисцентные микроскопы. Собственной (естественной) флуоресцен- цией обладают: хлорофилл, витамины А, В12, некоторые гормоны. Хлорофилл при освещении в ультрафиолетовых лучах светится красным цветом. Для изучения структур и веществ, не обладающих естественной флуоресценцией, можно использовать флуорохромы (флуоресцирующие красители). Флуорохром акридиновый оранжевый избирательно соединяется с нуклеиновыми кислотами и при рассмотрении срезов в ультрафиолетовых лучах ДНК светится зеленым, а РНК — красным цветом. Таким образом, этот метод позво- ляет изучать локализацию различных химических веществ в живой и фиксированной клетке. Существуют флуорохромы, избирательно связывающиеся с липидами, полисахаридами, кератином и др.
Фазово-контрастная микроскопия основана на том, что отдельные структуры прозрачной в целом клетки отличаются друг от друга по плотности и светопреломлению. Проходя через структуры различной плотности, луч света изменяет свою фазу, но наш глаз не способен улавливать этот сдвиг фазы. Глаз чувствителен только к изменениям интенсивности света (яркости), последняя зависит от величины амплитуды световой волны. Специальный объектив вызы- вает дополнительный сдвиг фазы колебания. При построении изображения взаимодействуют уже лучи, находящиеся в одной фазе, но обладающие разной амплитудой. Тем самым создается черно-белое контрастное изображение объекта.
Методы цито- и гистохимииоснованы на способности красителей избирательно окрашивать химические вещества. Методы используют- ся для изучения химического состава тканей и клеток при сохранении их структуры, а также для определения локализации химических ве- ществ. Например, реакция Фельгена на ДНК или окраска метиловым- зеленым-пиронин на нуклеиновые кислоты (метод Браше). В основе реакции Фельгена лежит кислотный гидролиз ДНК на срезе фиксиро- ванной ткани, в процессе которого от ДНК отщепляется альдегидная группа, которая и реагирует с реактивом Шиффа (фуксинсернистой кислотой). В итоге ДНК хроматина приобретает яркую красно-фио- летовую окраску. При окраске по методу Браше пиронин связывается с РНК, окрашивает ее в розовый цвет, а метиловый зеленый связывает- ся только с ДНК, окрашивая ее в сине-зеленый цвет.
Метод цитоспектрофотометрии основан на том, что интенсивность поглощения лучей прямо пропорциональна концентрации вещества. При помощи специального прибора (микроспектрофотометра) измеряется оптическая плотность окрашенных цито- и гисто- химическими методиками субстратов (нуклеиновых кислот, белков, углеводов, ферментов). Величина оптической плотности характе- ризует концентрацию изучаемого вещества в структурах. Для количественного анализа необходимо знать площадь и объем структур (ядер, цитоплазмы), в которых измеряется оптическая плотность субстрата. Количество вещества выражается в условных единицах (ДНК можно выразить в единицах плоидности, если отфотометрировать в качестве стандарта сперматиды семенников (n) или лимфоциты крови (2n)). Метод применяется для изучения плоидности ядер, для изучения концентрации РНК, полисахаридов, белков и других веществ при развитии патологического процесса или при экспериментальном воздействии.
Метод гистоавторадиографии основан на использовании радиоактивных изотопов: трития (Н3), S35, С14 и др. Когда какое-либо вещество, содержащее радиоактивный атом, вводят в живую клетку, то клетка использует его наравне с нерадиоактивными изотопами для синтеза новых веществ. Меченый атом, таким образом, становится изотопным индикатором. Тритий используют в составе тимидина (для ДНК), уридина (для РНК), S35в составе метионина (для белка). Следы разлета частиц, которые испус кают распадающиеся радиоактивные изотопы, регистрируют путем нанесения светочувствительной эмульсии на гистологический препарат. В местах прохождения частиц светочувствительная эмульсия засвечивается, а после проявления эти участки выглядят как черные точки (треки). Чем интенсивнее изотоп включается в метаболизм, тем больше треков будет на препарате. Треки видны только над теми структурами, в составе которых появились радиоактивные молекулы. Так, например, Н3-тимидин входит в состав только молекулы ДНК, а основная масса ДНК локализована в ядре — следовательно, треки будут только над ядрами, и только над теми, в которых идет синтез ДНК. Метод используется для изучения обменных процессов (репликации ДНК, синтеза белка) на клеточном и тканевом уровнях.
Метод культивирования клеток и тканей основан на выращивании (эксплантации) изолированных клеток, кусочков тканей, орга- нов вне организма (in vitro). Различают клеточное, тканевое и органное культивирование. При клеточном и тканевом культивировании отдельные клетки или кусочки ткани выращивают погруженными в питательную среду. Такой способ позволяет сохранить морфологическую структуру культивируемых клеток, тканей. Культуры клеток дают возможность получить однородный клеточный материал в больших количествах. На клеточных культурах можно изучать физические и химические воздействия. На культурах клеток разработан комплекс специальных методов, в том числе гибридизация соматических клеток и образование гетерокарионов. При органном культивировании клетки кусочки ткани или органа (чаще всего взятые у эмбриона) выращивают на поверхности питательной среды. Кусочек органа или ткани в стерильных условиях извлекают из эмбриона, измельчают (до 0,2 мм), промывают в растворе Хенкса и помещают на поверхность мембранного фильтра, расположенного на плотике из органического стекла. Плотик помещают в чашку Петри с питательной средой так, чтобы нижняя поверхность фильтра касалась поверхности питательной среды. Питательная среда включает сбалансированный состав аминокислот, всех необходимых солей, сюда добавляется бычья сыворотка, куриный эмбриональный экстракт, витамин С, глюкоза, антибиотики. Чашки Петри помещают в термостат при 37 °С. Смена питательной среды проводится каждые два дня. При этом в стерильных условиях плотик с фильтрами и с кусочками тканей переносят в новую чашку Петри со свежей питательной средой. В таких условиях можно наблюдать за эксплантатом в течение длительного времени (28 и более суток). Органное культивирование позволяет сохранить морфологическую структуру выращиваемого органа, свойственную ему в условиях целого организма. При этом сохраняется не только морфологическая структура, но и функциональные свойства ткани, что позволяет наблюдать процессы дифференцировки, пролиферации, выявлять действие биологически активных веществ на культуру, проследить за динамикой возникающих изменений.
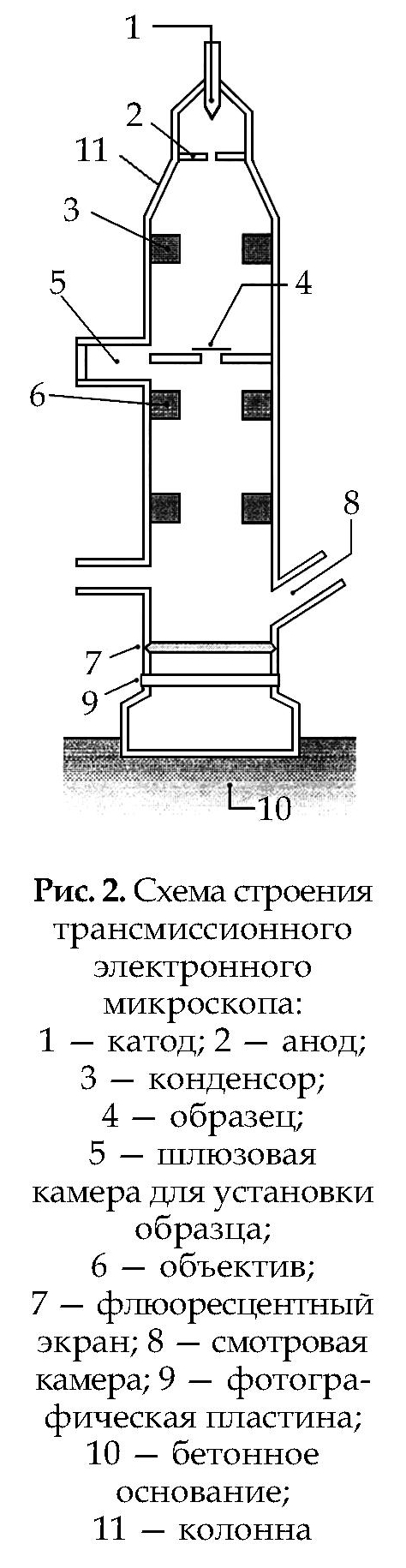
Электронная микроскопия Схема строения трансмиссионного электронного микроскопа представлена на рис. 2.
Катод (1): металлический электрод (обычно платиновый), который излучает мощный высокоскоростной электронный луч. Электроны — отрицательно заряженные частицы (e–).
Анод (2): положительно заряженный электрод с напряжением 50 кВ относительно катода. Служит для ускорения электронного луча.
Конденсор (3): электронная линза, фокусирующая электронный луч на образце (4).
Шлюзовая камера для установки образца (5): позволяет поместить образец (исследуемый материал) в микроскоп без потери вакуума внутри аппарата.
Объектив (6): электромагнитная линза, которая фокусирует первое изображение и увеличивает его (в зависимости от прилагаемого напряжения).
Флюоресцентный экран (7): покрыт составом, чувствительным к столкновению с электронами. Необходим для перевода электронного изображения в световое, так как преломленный электронный луч (изображение) не может наблюдаться непосредственно.
Фотографическая пластина (9): позволяет зафиксировать черно-белое изображение. При печати на фотобумагу изображение еще больше увеличивается.
Бетонное основание (10): жестко закреплено для уменьшения вибрации и нежелатель- ных отклонений электронного луча. Электронная микроскопия основана на рассмотрении объекта в проходящем пучке электронов. Длина волны электронов при напряжении в 100 000 Вт (100 кВт) составляет 0,04–0,05 Å1(0,004–0,005 нм) и разрешающая способность для биологических объектов в данном случае — 20 Å (2 нм, 0,002 мкм), т. е. в 100 раз выше, чем у светового микроскопа и достигается при увеличении в 250 000 раз, которое и является мак- симально полезным. Последние модели электронных микроскопов позволяют достигнуть разрешающей способности в 1 Å. Для исследования структуры клетки в электронном микроскопе требуются ульт ратонкие срезы толщиной 400–1200 Å (40–120 нм; в среднем — 0,1 мкм), так как электроны обладают низкой проникающей способностью.

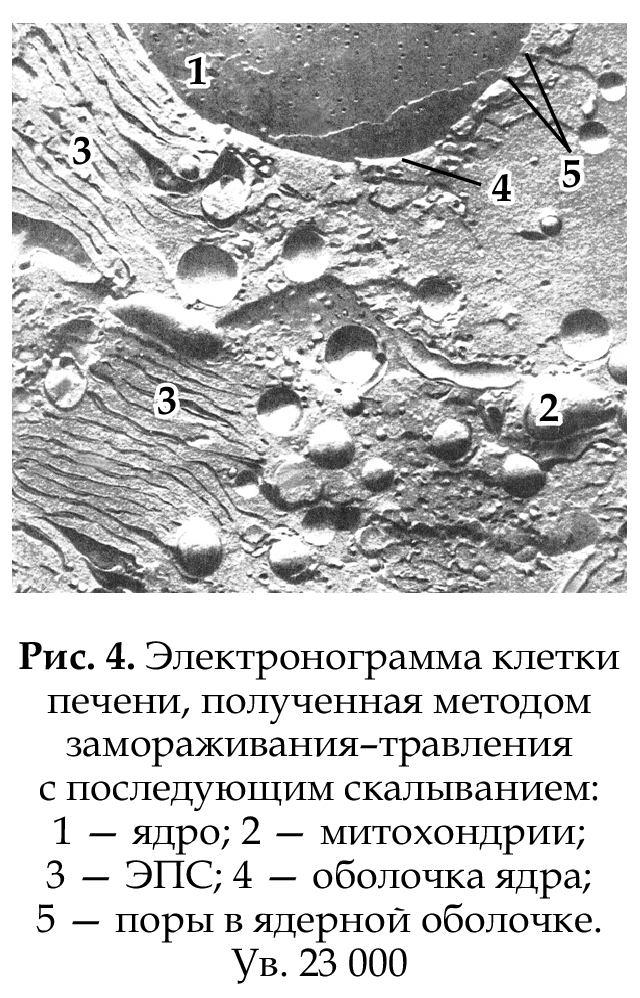
Таким образом, разрешающая способность электронного микроскопа в 106 раз выше разрешающей способности глаза и в 103 выше, чем разрешающая способность светового микроскопа. Различают трансмиссионную (просвечивающую), сканирующую и высоковольтную электронную микроскопию. Трансмиссионная микроскопия принципиально сходна со световой, но в колонне микроскопа создается вакуум, так как электроны, сталкиваясь с молекулами газов, отклоняются и могут не достигать объекта. Использование вакуума не позволяет исследовать живые объекты. Сканирующий микроскоп создает эффект трехмерности и способен охватывать большие поверхности. Материал фиксируют, специальным образом высушивают, покрывают тонким слоем испаренного металла (чаще всего золота), от которого электроны отражаются и попадают в приемное устройство, передающее сигнал на электронно-лучевую трубку. Используется в биологии для изучения поверхности лейкоцитов, про- стейших. Высоковольтныймикроскоп позволяет изучать более толстые (до нескольких микрометров) объекты. Это обусловлено усилением проникающей способности электронов в результате увеличения их скорости под воздействием высокого напряжения. Использование ускоренного пучка электронов и герметичных микрокамер позволяет изучать живые объекты (бактерии), хотя и в течение короткого времени. Объекты, изображенные на экране, можно фотографировать и получать электронограммы. Объемное изображение внутреннего строения клетки можно получить методом замораживания-травления с последующим скалыванием материала охлажденным ножом в специальной вакуумной установке. Поверхность скола последовательно покрывается тонким слоем испаренного углерода, а затем проводят напыление металлом. Таким образом получают пленкреплику, которую и изучают в электронном микроскопе (рис. 4).
Другие методы Метод рентгеноструктурного анализа основан на явлении дифракции рентгеновских лучей и дает возможность определить про- странственное расположение молекул. Применяется для изучения структуры белков, нуклеиновых кислот и других веществ, входящих в состав цитоплазмы и ядра клетки.
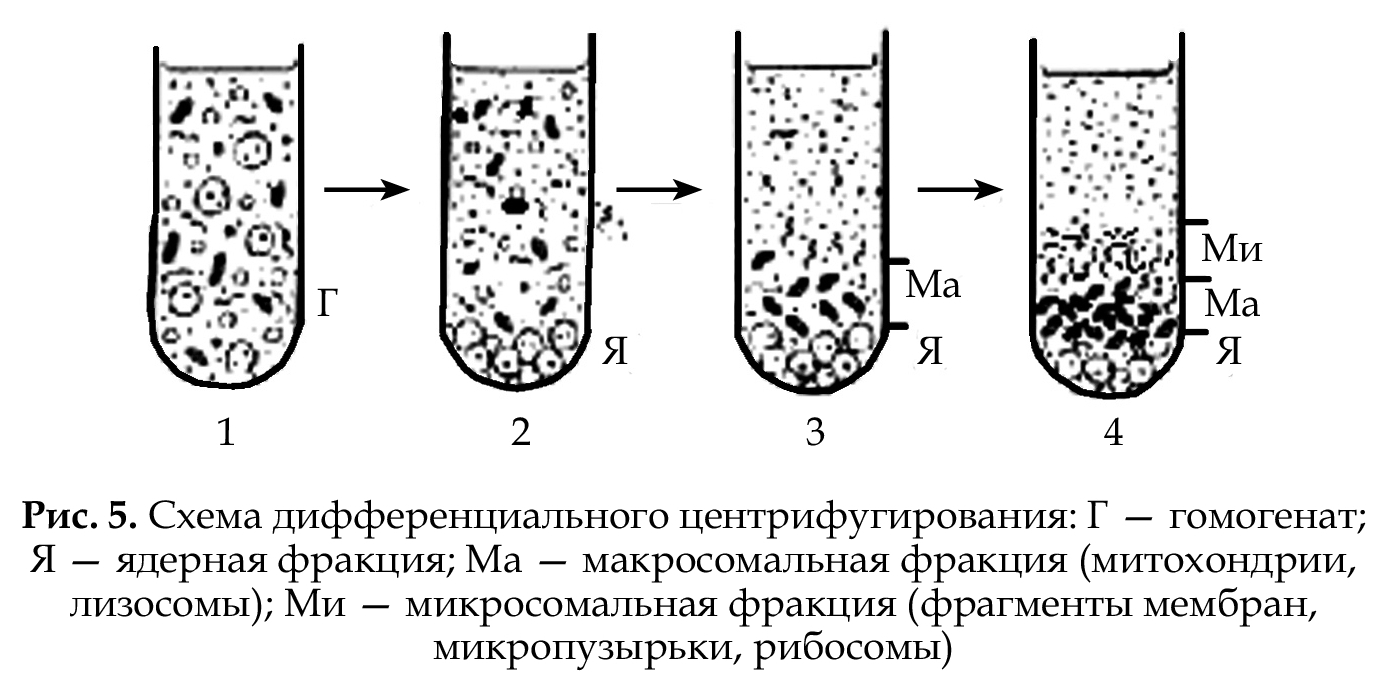
Метод дифференциального центрифугирования основан на разной скорости осаждения (седиментации) отдельных частиц под действием центробежной силы и используется для разделения внутриклеточных структур. Коэффициент седиментации (S) определяется скоростью движения макромолекул в поле с ускорением, равным I, измеряется в единицах, называемых СВЕДБЕРГАМИ. Для определения S используется центрифугирование при высокой скорости (30 000–60 000 об./мин). Исследуемый материал предварительно измельчают в гомогенизаторе. При скоростной седиментации используется среда одинаковой плотности. Компоненты клетки, вначале равномерно распределенные по всему объему пробирки, при центрифугировании оседают каждый со своей скоростью. В результате, содержимое пробирки разделяется на фракции (слои), из которых нижняя представлена самыми тяжелыми структурами, а верхняя — самыми легкими (рис. 5).
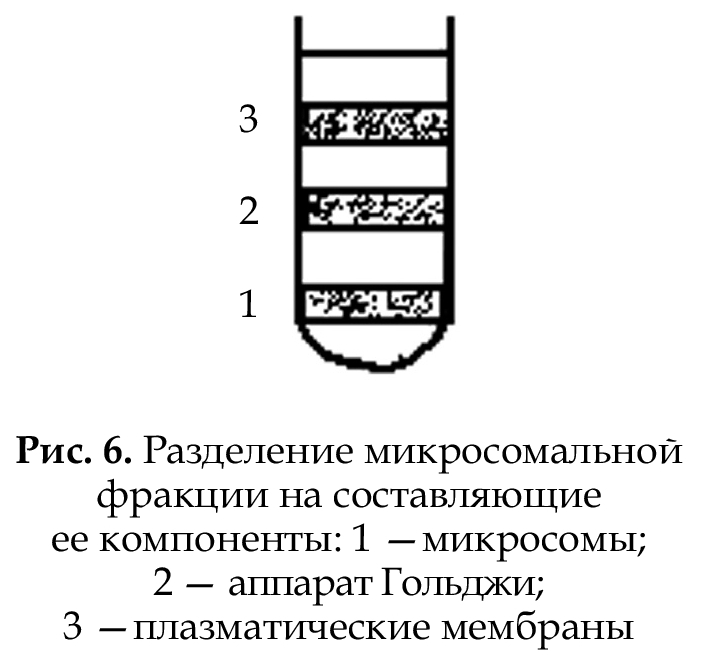
В последующем фракции (макросомальную и микросомальную) разделяют на отдельные компоненты, исполь- зуя методы седиментации в градиенте плотности среды. Наиболее распространенным компонентом для получения градиента среды является сахароза. В процессе центрифугирования субклеточные структуры, входящие в одну фракцию, концентрируются в виде отдельных зон в той части пробирки, где молярная концентрация сахарозы обеспечива- ет такую плотность раствора, при которой дальнейшее оседание частиц уже не происходит (рис. 6). Помимо перечисленных методов в цитологии используются и так называемые пограничные методы:
― гибридизация нуклеиновых кислот на срезах;
― иммуноцитохимия с при менением моноклональных антител на световом и электронно-микроскопическом уровне;
― микрохирургия и др.
Световой микроскоп – прибор для рассмотрения объектов. Он представляет собой оптическую систему, состоящую из следующих элементов:
Принцип работы светового микроскопа
Пучок света от источника освещения собирается в конденсаторе и направляется на объект. Прошедшие сквозь объект лучи света попадают в систему линз объектива. Таким образом строится первичное изображение, которое увеличивается линзами окуляра.
Объектив является главным элементом оптической системы микроскопа, который определяет возможности прибора. В современных микроскопах используются сменные объективы, позволяющие изучать клетки при разной степени увеличения.
Важнейшая характеристика микроскопа – разрешающая способность. Разрешающая способность объектива –это минимальное расстояние между двумя точками, которые видны раздельно; вычисляется по формуле:

λ – длина волны света, используемого для освещения объекта, n – коэффициент преломления среды, α – угол между оптической осью объектива и наиболее отклоняющимся лучом, попадающим в объектив.
Из формулы следует:
- чем меньше длина волны, тем выше разрешение (тем меньшего размера объект можно увидеть)
- чем выше нумерическая апертура объектива (n⋅sin α), тем выше разрешение
При использовании источников освещения в видимой области спектра (400-700 нм), максимальное разрешение микроскопа не превышает 200-350 нм (0,2-0,35 мкм).
При использовании источников освещения ультрафиолетовой области спектра (260-280 нм), максимальное разрешение микроскопа не превышает 130-140 нм (0,13-0,14 мкм), что является пределом теоретического разрешения светового микроскопа, которое определяется волновой природой света.
Таким образом, световой микроскоп увеличивает разрешающую способность глаза в 1000 раз (разрешающая способность невооруженного глаза приблизительно 0,1 мм).
Метод ультрамикроскопии позволяет увидеть объекты величиной менее 0,2 мкм. Метод основан на эффекте Тиндаля: при боковом освещении в клетке светятся мельчайшие частицы, от которых отраженный свет попадает в объектив микроскопа. Ультрамикроскопия успешно используется для изучения живых клеток.
Метод фазово-контрастной микроскопии
Большинство компонентов клетки мало отличаются по коэффициентам преломления и поглощения от среды (вода, тканевый раствор) и друг от друга, поэтому они мало контрастны и плохо различимы при рассмотрении клетки в проходящем свете. Для исследования клеточных структур меняют освещенность, жертвуя четкостью изображения, а также используют специальные приборы и методы.
Среди этих методов – фазово-контрастная микроскопия. Метод основан на различии (хоть и небольшом) в плотности и светопреломлении клеточных компонентов. Свет, проходя сквозь них, изменяет фазу, что неуловимо человеческим глазом, так как глаз чувствителен только к изменению интенсивности. Изменение фазы преобразовывается в изменение интенсивности (яркости), зависящей от амплитуды волны. В объектив фазово-контрастного микроскопа встроена специальная пластинка, проходя через которую луч света испытывает дополнительный сдвиг фазы колебаний. При построении изображения происходит взаимодействие лучей, находящихся в одной фазе либо в противофазе, но обладающих разной амплитудой. Таким образом, создается светло-темное контрастное изображение объекта.
Интерференционная микроскопия
В интерференционном микроскопе пучок параллельных световых лучей от источника разделяется на два потока: один проходит через объект и меняет фазу колебания, другой идет мимо объекта. В объективе два потока соединяются и интерферируют между собой. В результате интерференции образуется изображение, на котором компоненты клетки в зависимости от плотности имеют разную контрастность.
Поляризационная микроскопия
Поляризационный микроскоп позволяет исследовать объекты, обладающие изотропией – упорядоченной ориентацией субмикроскопических частиц (миофибриллы, волокна веретена деления). В оптическую систему такого микроскопа входят поляризатор и анализатор, представляющие собой призмы, которые пропускают световые волны с определенной плоскостью поляризации. Помещенный между призмами объект, который обладает двойным лучепреломлением, будет виден как светящийся на темном поле.
Электронная микроскопия
Электронная микроскопия – это метод изучения структур, которые находятся вне пределов видимости светового микроскопа (размеры объектов меньше 1 мк).
В отличие от свтеового микроскопа, в электронном вместо светового луча используется поток электроннов, а вместо линз – магниты (магнитные линзы).
Различные участки объекта по-разному задерживают электроны, и на экране электронного микроскопа образуется черно-белое изображение объекта, увеличенное в сотни тысяч раз.
Читайте также:

