Субстратная специфичность это в биологии кратко
Обновлено: 04.07.2024
Активный центр ферментов, обладающих абсолютной субстратной специфичностью, комплементарен только одному субстрату. Следует отметить, что таких ферментов в живых организмах мало.
Пример фермента с абсолютной субстратной специфичностью - аргиназа, катализирующая реакцию расщепления аргинина до мочевины и орнитина: Другой пример фермента с абсолютной субстратной специфичностью - уреаза, катализирующая гидролиз мочевины до диоксида углерода и аммиака.
Групповая субстратная специфичность
Большинство ферментов катализирует однотипные реакции с небольшим количеством (группой) структурно похожих субстратов. Так, фермент панкреатическая липаза катализирует гидролиз жиров в двенадцатиперстной кишке человека, катализируя превращение любой молекулы жира (триацилглицерола) до молекулы моноацилглицерола и двух молекул высших жирных кислот. Панкреатическая липаза гидролизует эфирную связь у α-атомов углерода глицерола, независимо от того, какие жирные кислоты входят в состав молекулы жира
Большинство протеолитических ферментов, осуществляющих гидролиз белков, имеет групповую субстратную специфичность, гидролизуя пептидные связи, образованные разными аминокислотами.
Стереоспецифичность
При наличии у субстрата нескольких стерео-изомеров фермент проявляет абсолютную специфичность к одному из них. В организме человека наблюдают специфичность ферментов к следующим стереоизомерам.
· Стереоспецифичность к D-сахарам.Большинство моносахаридов и продуктов их обмена в организме человека и других млекопитающих относят к D-стереоизомерам. Ферменты, осуществляющие их метаболизм, имеют специфичность к D-, а не к L-сахарам.

· Стереоспецифичность к L-аминокислотам.Белки человека состоят из аминокислот L-ряда. Большинство ферментов, обеспечивающих превращение аминокислот, имеет Стереоспецифичность к L-аминокислотам.
· Стереоспецифичность к цистрансизомерам.Фермент фумараза оказывает действие только на фумарат. Малеинат (цис-изомер фумарата) не является субстратом фумаразы.

· Исключение составляют только ферменты эпимеразы (рацемазы), катализирующие превращение оптических изомеров.
· Стереоспецифичносгь кα- иβ-гликозидным связям.Фермент амилаза действует только на а-гликозидные связи, что позволяет гидролизотать крахмал и гликоген (полимеры глюкозы), остатки глюкозы в которых соединены α-гликозидными связями. Целлюлоза - также полимер глюкозы, однако остатки глюкозы в нём связаны β-гликозидными связями. В результате отсутствия у человека ферментов, специфичных к β-гликозидной связи, целлюлоза не гидролизуется в кишечнике человека и не может служить источником глюкозы.
· Этапы ферментативного катализа
· 1. Формирование фермент-субстратного
комплекса
· Тот факт, что ферменты обладают высокой специфичностью, позволил в 1890 г. выдвинуть гипотезу, согласно которой активный центр фермента комплементарен субстрату, т.е. соответствует ему как "ключ замку". После взаимодействия субстрата ("ключ") с активным центром ("замок") происходят химические превращения субстрата в продукт. Активный центр при этом рассматривался как стабильная, жёстко детерминированная структура.
· В 1959 г. был предложен другой вариант гипотезы "ключ-замок", объясняющий события в активном центре фермента. По этой гипотезе активный центр является гибкой структурой
·
· по отношению к субстрату. Субстрат, взаимодействуя с активным центром фермента, вызывает изменение его конформации, приводя к формированию фермент-субстратного комплекса, благоприятного для химических модификаций субстрата. При этом молекула субстрата также изменяет свою конформацию, что обеспечивает более высокую эффективность ферментативной реакции. Эта "гипотеза индуцированного соответствия" впоследствии получила экспериментальное подтверждение.
· 2. Последовательность событий в ходе
ферментативного катализа
· Процесс ферментативного катализа условно можно разделить на следующие этапы
· Первый, второй и четвёртый этапы катализа непродолжительны и зависят от концентрации субстрата (для первого этапа) и констант связывания лигандов в активном центре фермента (для первого и третьего этапов). Изменения энергетики химической реакции на этих стадиях незначительны.
· Третий этап наиболее медленный; длительность его зависит от энергии активации химической реакции. На этой стадии происходят разрыв связей в молекуле субстрата, образование новых связей и формирование молекулы продукта.
· 3. Роль активного центра в ферментативном
катализе
· В результате исследований было показано, что молекула фермента, как правило, во много раз больше молекулы субстрата, подвергающегося химическому превращению этим ферментом. В контакт с субстратом вступает лишь небольшая часть молекулы фермента, обычно от 5 до 10 аминокислотных остатков, формирующих активный центр фермента. Роль остальных аминокислотных остатков состоит в обеспечении правильной конформации молекулы фермента для оптимального протекания химической реакции.
· Активный центр на всех этапах ферментативного катализа нельзя рассматривать как пассивный участок для связывания субстрата. Это комплексная молекулярная "машина", использующая разнообразные химические механизмы, способствующие превращению субстрата в продукт.
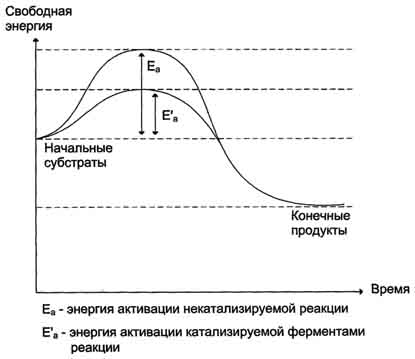
· В активном центре фермента субстраты располагаются таким образом, чтобы участвующие в реакции функциональные группы субстратов находились в непосредственной близости друг к другу. Это свойство активного центра называют эффектом сближения и ориентации реагентов. Такое упорядоченное расположение субстратов вызывает уменьшение энтропии и, как следствие, снижение энергии активации (Еа), что определяет каталитическую эффективность ферментов.
· Активный центр фермента также способствует дестабилизации межатомных связей в молекуле субстрата, что облегчает протекание химической реакции и образование продуктов. Это свойство активного центра называют эффектом деформации субстрата.
23.понятие холофермент, апофермент, кофактор, субстрат, продукт реакции, ингибитор,активатор.примеры.
Примером может являться гем, который является простетической группой в молекуле гемоглобина.
2.Кофактор-небелковое вещество, которое обязательно должно присутствовать в организме в небольших количествах, чтобы соответствующие ферменты смогли выполнить свои функции. В состав кофактора входят коферменты и ионы металлов (например, ионы натрия и калия).
3.субстрат-вещество, подвергающееся превращению под действием фермента;
4. Ферментативный ингибитор — вещество, замедляющее протекание ферментативной реакции. Различают обратимые и необратимые ингибиторы.Изучение ингибирования ферментов играет важную роль в создании лекарств, в изучении механизма действия и структуры ферментов.
Это способность фермента катализировать превращения только одного определенного субстрата или же группы сходных по строению субстратов. Определяется структурой адсорбционного участка активного центра фермента.
Различают 3 типа субстратной специфичности:
1) АБСОЛЮТНАЯ субстратная специфичность - это способность фермента катализировать превращение только одного, строго определенного субстрата.
2) ОТНОСИТЕЛЬНАЯ субстратная специфичность - способность фермента катализировать превращения нескольких, сходных по строению, субстратов.
3) СТЕРЕОСПЕЦИФИЧНОСТЬ - способность фермента катализировать превращения определенных стереоизомеров.
4) Относительная групповая специфичность-фермент специфически действует на вещества , имеющие определенный тип химической связи; такие ферменты проявляют широкий спектр действия
5)Абсолютная групповая специфичность — фермент действует на субстраты, имеющие общую функциональную группу.( алкоголь- дегидрогеназа катализирует превращение не только этанола , но и ряд других алифатических спиртов)
Например, фермент оксидаза L-аминокислот способен окислять все аминокислоты, но относящиеся только к L-ряду. Таким образом, этот фермент обладает относительной субстратной специфичностью и стереоспецифичностью одновременно.
Специфичность действия - это способность фермента катализировать только определенный тип химической реакции.
В соответствии со специфичностью действия все ферменты делятся на 6 классов. Классы ферментов обозначаются латинскими цифрами. Название каждого класса ферментов соответствует этой цифре.
Принцип количественного определения активности фермента. Единица активности.
Определение активности фермента.
Ввиду того, что ферменты в тканях присутствуют в ничтожно малых концентрациях, мерой активности ферментов служит скорость исчезновения субстрата или нарастание конечного продукта реакции в единицу времени.
Длявыражения концентрации фермента Комиссией по ферментам Международного биохимического союза предложена стандартная единица (Е). За международную единицу активности фермента принимается количество фермента, способное превратить один микромоль ( мкМоль) субстрата за 1 минуту в стандартных условиях ( при с=25 С, оптимуме рН и концентрации субстрата, превышающей концентрацию насыщения), выражается мкмоль/мин.
Удельная активность фермента- количество ( в мг), способное превратить 1 мкмоль субстрата за 1 мин в стандартных условиях, выражается в МКМОЛЬ/ МИН*МГ(БЕЛКА).
В соответствии с единицами измерения, принятыми в системе СИ , введена также единица каталитической активности ферментов КАТАЛ — количество фермента, способное осуществить превращение 1 моль субстрата в 1 с в стандартных условиях моль/с.
( может так же применяться иммуноферментный анализ)
Применение ферментов в медицине. Основные принципы Энзимодиагностики. Применение ферментов в качестве лекарственных средств.
Наибольший вклад современная медицинская энзимология вносит в области:
- энзимопатологии
- энзимодиагностики
- энзимотерапии
Ферментам принадлежит большая роль в диагностике заболеваний. Особое значение имеет узучение ферментного состава кроки и других биологических жидкостей. Понижение или повышение активности фермента в крови , а так же появление в крови ферментов, отсутствующих в ней в норме, служат объективными диагностическими критериями патологических изменений.
Достоинства:
- высокая специфичность
- возможность проявления отклонений на ранних , нередко на доклинических стадиях заболевания
Определение активности фермента в биологических жидкостях в настоящее время является обязательным компонентом диагностики:
- инфаркта миокарда ( креатинкиназа, лактатдегидрогеназа и их изоформы)
- заболеваний поджелудочной железы( амилаза сыворотки крови и мочи)
- патологии печени
- врожденных гемолитических анемий
- патологий мозга (изоферменты креатинкиназы)
Энзимотерапия
разработаны лекарственные формы ферментных препаратов . Широко распространена заместительная терапия заболеваний желудочно-кишечного тракта (фестал,панкреатин, мезим-форте)
протеазы (трипсин, химотрипсин) широко применяются в лечении:
- воспалительных заболеваний
- раневого процесса
- ожогов
- обструктивных состояний дыхательной системы
Ингибиторы протеаз (контрикал, трасилол, ингитрил) занимают важное место в лечении деструктивных форм панкреатита, при чрезмерной активности системы фибринолиза; ингибиторы ангиотензинконвертирующего фермента — в терапии артериальных гипертензий
Так же применяются иммобилизованные ферменты ( нерастворимые ферменты) :
- использование тампонов, бинтов с иммобилизованными на них протеазами — для ускорения заживания ран и ожогов и предотвращения гнойных образований.
- Создание протезов кровеносных сосудов и сердечных клапанов из тромборезистентного материала на основе полимеров с иммобилизованными ферментами
Билет 4
Вопрос 1.Сам термин "иммобилизованные ферменты узаконен в 1971 году, и означает любое ограничение свободы передвижения белковых молекул в пространстве.
Преимущества иммобилизованных ферментов перед нативными предшественниками:
1. Гетерогенный катализатор легко отделим от реакционной среды, что дает возможность остановить реакцию в любой момент, использовать фермент повторно, а также получать чистый от фермента продукт.
2. Ферментативный процесс с использованием иммобилизованных ферментов можно проводить непрерывно, регулируя скорость катализируемой реакции и выход продукта.
3. Модификация фермента целенаправленно изменяет его свойства, такие как специфичность (особенно в отношении макромолекулярного субстрата), зависимость каталитической активности от рН, ионного состава и других параметров среды, стабильность к денатурирующим воздействиям.
4. Можно регулировать каталитическую активность иммобилизованных ферментов путем изменения свойств носителя действием физических факторов, таких как свет и звук. Иммобилизовать ферменты можно как путем связывания на нерастворимых носителях, так и путем внутримолекулярной или межмолекулярной сшивки белковых молекул низкомолекулярными бифункциональными соединениями, а также путем присоединения к растворимому полимеру.
Для проведения потенциометрического анализа обычно собирают гальванический элемент, на одном из электродов которого протекает электрохимическая реакция с участием определяемого иона или иона, который реагирует с определяемым. При схематическом изображении разных гальванических элементов или электродов используют условную запись, которая достаточно полно отображает состав и характерные особенности элемента.
Полярография органических соединений.Можно определять:1. вещества, имеющие полярографично активные группы 2. вещества, которые могут адсорбироваться на поверхности электрода.
Особенность полярографии органических соединений – существует зависимость потенциала полуволны от природы и рН раствора, так как ионы Н + принимают участие в электрохимической реакции
Второй особенностью является достаточно низкая растворимость органических веществ в воде, поэтому часто добавляют органические растворители: спирты, ацетон, ацетатна кислота, диметилформамид и т.д.
Вопрос 2.Свойства ферментов
1. Влияние на скорость химической реакции: ферменты увеличивают скорость химической реакции, но сами при этом не расходуются. 2. Специфичность действия ферментов. Специфичность действия фермента – это способность ускорять протекание одной определенной реакции, не влияя на скорость остальных, даже очень похожих.
Различают:Абсолютную – когда Ф катализирует только одну определенную реакцию (аргиназа – расщепление аргинина)
Относительную (групповую спец) – Ф катализирует определенный класс реакций (напр. гидролитическое расщепление) или реакции при участии определенного класса веществределенной реакции, не влияя на скорость остальных, даже очень похожих. Активность ферментов – способность в разной степени ускорять скорость реакции. Активность выражают в:
1) Международных единицах активности – (МЕ) количество фермента, катализирующего превращение 1 мкМ субстрата за 1 мин.
2) Каталах (кат) – количество катализатора (фермента), способное превращать 1 моль субстрата за 1 с.
3) Удельной активности – число единиц активности (любых из вышеперечисленных) в исследуемом образце к общей массе белка в этом образце.
4) Реже используют молярную активность – количество молекул субстрата превращенных одной молекулой фермента за минуту.
Активность зависит в первую очередь от температуры. Наибольшую активность тот или иной фермент проявляет при оптимальной температуре. Для Ф живого организма это значение находится в пределах +37,0 - +39,0 °С, в зависимости от вида животного. При понижении температуры, замедляется броуновское движение, уменьшается скорость диффузии и, следовательно, замедляется процесс образования комплекса между ферментом и компонентами реакции (субстратами). В случае повышения температуры выше +40 - +50 °С молекула фермента, которая является белком, подвергается процессу денатурации. При этом скорость химической реакции заметно падает
Активность ферментов зависит также от рН среды. Для большинства из них существует определенное оптимальное значение рН, при котором их активность максимальна. Поскольку в клетке содержатся сотни ферментов и для каждого из них существуют свои пределы опт рН, то изменение рН это один из важных факторов регуляции ферментативной активности. Так, в результате одной химреакции при участии определенного фермента рН опт которого лежит в перделах 7.0 – 7.2 образуется продукт, который является кислотой. При этом значение рН смещается в область 5,5 – 6.0. Активность фермента резко снижается, скорость образования продукта замедляется, но при этом активизируется другой фермент, для которого эти значения рН оптимальны и продукт первой реакции подвергается дальнейшему химическому превращению. (Еще пример про пепсин и трипсин).
Вопрос 3.ИЗОФЕРМЕНТЫ (изоэнзимы, изозимы), ферменты, катализирующие идентичные р-ции, но отличающиеся друг от друга строением и каталитич. св-вами. К Изоферментам относят только те формы ферментов, появление к-рых связано с генетически детерминир. различиями в первичной структуре пептидной цепи. Более широкое понятие - множественные формы ферментов - включает как И., так и те формы ферментов, к-рые обладают св-вами Изоферментов, но образуются в результате посттрансляц. модификаций. О важной роли И. в тонкой регуляции метаболич. процессов свидетельствует также изменение их спектра под влиянием разл. воздействий и физиол. состояний (охлаждение, гипоксия, денервация и др.). Для исследования спектра И. используют ионообменную хроматографию, гель-фильтрацию, электрофорез и изоэлектрофокусирование, а также иммунохим. методы с использованием антител. В фармацевтической промышленности, фарманализе и медицине ферменты часто применяют в качестве аналитических реагентов. Для ферментативного анализахарактерны безвредность и высокая специфичность. Например, для определения глюкозы в биологических жидкостях и тканях используется глюкозоокси-даза.
Билет 5.
Ферменты обладают более высокой специфичностью действия по сравнению с неорганическими катализаторами. Различают специфичность по отношению к типу химической реакции, катализируемой ферментом, и специфичность по отношению к субстрату. Эти два вида специфичности характерны для каждого фермента.
Специфичность по отношению к субстрату – это предпочтительность фермента к субстрату определенной структуры в сравнении с другими субстратами.
Различают 4 вида субстратной специфичности ферментов:
1. Абсолютная специфичность – способность фермента катализировать превращение только одного субстрата. Например – глюкокиназа фосфорилирует только глюкозу, аргиназа расщепляет только аргинин, уреаза – мочевину.
2. Относительная специфичность – фермент катализирует превращение нескольких субстратов, имеющих один тип связи. Например – липаза расщепляет сложноэфирную связь в триацилглицеролах.
3. Относительная групповая специфичность – фермент катализирует превращение нескольких субстратов, имеющих один тип связи, но требуется наличие определенных функциональных групп, входящих в состав субстратов. Например, все протеолитические ферменты расщепляют пептидную связь, но пепсин – образованную аминогруппами ароматических аминокислот, химотрипсин – образованную карбоксильными группами этих же аминокислот, трипсин – пептидную связь, образованную карбоксильной группой лизина, аргинина.
4. Стереохимическая специфичность – фермент катализирует превращение только одного стереоизомера. Например, бактериальная аспартатдекарбоксилаза катализирует декарбоксилирование только L-аспартата и не действует на D-аспарагиновую кислоту.
Специфичность по отношению к реакции
Каждый фермент катализирует одну реакцию или группу реакций одного типа. Часто одно и то же химическое соединение выступает как субстрат для разных ферментов, причем каждый из них катализирует специфическую для него реакцию, приводящую к образованию разных продуктов. Специфичность по типу реакции лежит в основе единой классификации ферментов.
Данный текст является ознакомительным фрагментом.
Продолжение на ЛитРес
МЕСТО ДЕЙСТВИЯ — АФРИКА
МЕСТО ДЕЙСТВИЯ — АФРИКА Заглянем в 1924 год и выясним, что так внимательно рассматривает профессор Раймонд Дарт, стоя возле только что распакованных ящиков, которые привезли его ученики из известкового карьера Таунг, что в Бечуаналенде. В руках у профессора из
Микробы — продуценты ферментов
Микробы — продуценты ферментов Мы уже знаем, что ферменты — это биологические катализаторы, то есть вещества, способствующие осуществлению многих химических реакций, которые-происходят в живой клетке и необходимы для получения питательных веществ и построения ее
Механизм действия нервной системы
Глава 3. Ферменты. Механизм действия ферментов
Глава 3. Ферменты. Механизм действия ферментов Ферментами или энзимами называют специфические белки, входящие в состав всех клеток и тканей живых организмов и выполняющие роль биологических катализаторов.Общие свойства ферментов и неорганических катализаторов:1. Не
Структура молекулы ферментов
Структура молекулы ферментов По строению ферменты могут быть простыми и сложными белками. Фермент, являющийся сложным белком называют холоферментом. Белковая часть фермента называется апоферментом, небелковая часть – кофактором. Различают два типа кофакторов:1.
Механизм действия ферментов
Механизм действия ферментов В любой ферментативной реакции выделяют следующую стадийность:E + S ? [ES] ?E + Pгде Е – фермент, S – субстрат, [ES] – фермент-субстратный комплекс, Р – продукт.Механизм действия ферментов может быть рассмотрен с двух позиций: с точки зрения изменения
Глава 4. Регуляция активности ферментов. Медицинская энзимология
Глава 4. Регуляция активности ферментов. Медицинская энзимология Способы регуляции активности ферментов:1. Изменение количества ферментов.2. Изменение каталитической эффективности фермента.3. Изменение условий протекания реакции.Регуляция количества
Применение ферментов в медицине
Применение ферментов в медицине Ферментные препараты широко используют в медицине. Ферменты в медицинской практике находят применение в качестве диагностических (энзимодиагностика) и терапевтических (энзимотерапия) средств. Кроме того, ферменты используют в качестве
Глава 13. Особенности действия гормонов
Глава 13. Особенности действия гормонов Гормоны гипоталамуса ЦНС оказывает регулирующее действие на эндокринную систему через гипоталамус. В клетках нейронов гипоталамуса синтезируются пептидные гормоны двух типов. Одни через систему гипоталамо-гипофизарных сосудов
Диапазон действия экологических факторов
Диапазон действия экологических факторов Все живые организмы способны воспринимать только определенный диапазон интенсивности воздействий любого экологического фактора, что определяется нормой реакции генотипа. Этот диапазон выработался в процессе
6.4. Возрастающая специфичность морфического резонанса в процессе морфогенеза
Как наши действия рассказывают нам о мире
Как наши действия рассказывают нам о мире Для мозга между восприятием и действиями существует тесная связь. Наше тело служит нам, чтобы познавать окружающий мир. Мы взаимодействуем с окружающим миром посредством своего тела и смотрим, что из этого выйдет. Этой
Программа действия
Программа действия Выбор или создание программы действия непосредственно предшествует двигательному акту. В подавляющем большинстве случаев ни человек, ни животные не разрабатывают программу действия, а используют ту, которая уже применялась ранее при схожей
2.2. Общая характеристика пищеварительных ферментов
2.2. Общая характеристика пищеварительных ферментов Обращает на себя внимание принципиальное сходство, а иногда и поразительное совпадение ферментных систем, реализующих пищеварение у различных организмов. Поэтому те характеристики, которые будут представлены ниже,
Изменение активности некоторых Ферментов крови и печени крыс при экспериментальном голодании А. А. ПОКРОВСКИЙ, Г. К. ПЯТНИЦКАЯ (Москва)
Изменение активности некоторых Ферментов крови и печени крыс при экспериментальном голодании А. А. ПОКРОВСКИЙ, Г. К. ПЯТНИЦКАЯ (Москва) Проблема влияния голодания на разные показатели обменных процессов в организме животных и человека продолжает привлекать внимание
Влияние голодания на активность ферментов пентозофосфатного пути в печени и мозге крыс Ю. Л. ЗАХАРЬИН (Москва)
Влияние голодания на активность ферментов пентозофосфатного пути в печени и мозге крыс Ю. Л. ЗАХАРЬИН (Москва) В последние годы в клинике часто применяется с лечебными целями, в частности, для лечения психических заболеваний, полное голодание. Не вызывает сомнения, что
СПЕЦИФИЧНОСТЬ ФЕРМЕНТОВ.
Различают два главных вида специфичности ферментов: СУБСТРАТНУЮ СПЕЦИФИЧНОСТЬ и СПЕЦИФИЧНОСТЬ ДЕЙСТВИЯ.
СУБСТРАТНАЯ СПЕЦИФИЧНОСТЬ.
Это способность фермента катализировать превращения только одного определенного субстрата или же группы сходных по строению субстратов. Определяется структурой адсорбционного участка активного центра фермента.
Различают 3 типа субстратной специфичности:
1) АБСОЛЮТНАЯ субстратная специфичность - это способность фермента катализировать превращение только одного, строго определенного субстрата.
2) ОТНОСИТЕЛЬНАЯ субстратная специфичность - способность фермента катализировать превращения нескольких, сходных по строению, субстратов.
3) СТЕРЕОСПЕЦИФИЧНОСТЬ - способность фермента катализировать превращения определенных стереоизомеров. Например, фермент оксидаза L-аминокислот способен окислять все аминокислоты, но относящиеся только к L-ряду. Таким образом, этот фермент обладает относительной субстратной специфичностью и стереоспецифичностью одновременно.
СПЕЦИФИЧНОСТЬ ДЕЙСТВИЯ.
Специфичность действия - это способность фермента катализировать только определенный тип химической реакции.
В соответствии со специфичностью действия все ферменты делятся на классы.
Читайте также:

