Строение атома по резерфорду и бору кратко
Обновлено: 05.07.2024
На уроке рассматриваются: понятия атомное ядро, опыты Резерфорда, планетарная модель строения атома; сравниваются модели атома Томсона и Резерфорда, даны некоторые сведения о фактах, подтверждающих сложное строение атома, о работах учёных по созданию модели строения атома.
Атомное ядро — тело малых размеров, в котором сконцентрирована почти вся масса и весь положительный заряд атома.
Размеры ядра: диаметр порядка 10 -12 —10 -13 см (у разных ядер диаметры различны).
Размер атома: примерно 10 -8 см, т. е. от 10 до 100 тысяч раз превышает размеры ядра.
Планетарная модель атома Резерфорда: в целом атом нейтрален, в центре атома расположено положительно заряжённое ядро, в котором сосредоточена почти вся масса атома, электроны движутся по орбитам вокруг ядра, заряд ядра, как и число электронов в атоме, равен порядковому номеру элемента в периодической системе Д.И.Менделеева.
Ядро атома водорода названо протоном и рассматривается как элементарная частица.
Ядро атома водорода имеет положительный заряд, равный по модулю заряду электрона, и массу, примерно в 1836,1 раза больше массы электрона.
Частота излучений атома водорода составляет ряд серий: серия Бальмера, серия Лаймана, серия Пашена и другие, каждая из которых образуется в процессе перехода атома в одно из энергетических состояний.
Обязательная литература по теме урока:
Основное содержание урока
Долгое время, физика накапливала факты о свойстве вещества для полного представления о строении атома. И только в XIX веке изучение атомического строения вещества существенно сдвинулось с точки покоя.
Большую роль в развитии атомистической теории сыграл выдающийся русский химик Дмитрий Иванович Менделеев, разработавший в 1869 году периодическую систему элементов, в которой впервые был поставлен вопрос о единой природе атомов.
Важным свидетельством сложной структуры атомов явились исследования спектров, излучаемые веществом, которые привели к открытию линейчатых спектров атомов. В начале XIX века в излучении атома водорода были открыты спектральные линии в видимой части спектра.
Идеи электронной структуры атома теоретически и гипотетически формулировались учёными. В 1896 году Хендрик Лоренц создал электронную теорию о том, что электроны являются частью атома. Эту гипотезу в 1897 году подтвердили эксперименты Джозефа Джона Томсона. Им был сформулирован вывод о том, что существуют частицы с наименьшим отрицательным зарядом - электроны и они являются частью атомов.
Таким образом, к началу XX века учёные сделали вывод о том, что атомы материи имеют сложную внутреннюю структуру. Они являются электрически нейтральными системами, а носителями отрицательного заряда атомов являются лёгкие электроны, масса которых составляет лишь малую долю массы атомов. Однако модель атома Томсона находилась в полном противоречии с экспериментами по изучению распределения положительных зарядов.
Электрон – наименьшая электроотрицательная заряжённая элементарная частица
Масса покоя электрона me = 9,1·10 -31 кг;

- отношение заряда электрона к его массе.
Немецкий физик Филипп фон Ленард в 1903 году проводил опыты, в которых пучок быстрых электронов легко проходил через тонкую металлическую фольгу. На основании этого Ленард предположил, что атом состоит из нейтральных частиц или нейтральных дуплетов с совмещённым положительным и отрицательным зарядами, рассредоточенными в атоме, где большая площадь представляет собой пустоту.

В 1904 году японский физик Хентаро Нагаока выдвинул гипотезу о том, что атом состоит из тяжелого положительно заряженного ядра, окруженного кольцами из большого числа электронов, колебания которых и являются причиной испускания атомных спектров, по аналогии с теорией устойчивости колец Сатурна.

Но в физике уже более 200 лет существует главное правило: окончательный выбор между гипотезами может быть сделан только на основе опыта. Эксперименты, проведенные в первый раз Эрнестом Резерфордом, сыграли решающую роль в понимании структуры атома.

30.08.1871 г. – 19.10.1937 г.
Британский физик новозеландского происхождения
Лауреат Нобелевской премии по химии 1908 года
Для экспериментального изучения распределения положительного заряда, а значит, и массы внутри атома Эрнест Резерфорд в 1906 г. предложил применить зондирование атома α-частицами, скорость которых составляет 1/15 скорости света.
Эти частицы возникают при распаде, например, радия и некоторых других радиоактивных элементов. Сами же α-частицы – это ионизированные атомы гелия, положительный заряд гелия в два раза больше заряда электрона +2He. Этими частицами Резерфорд бомбардировал атомы тяжёлых элементов (золото, медь и др.). Если бы электроны были равномерно распределены по всему объёму атома (по модели атома Томсона), электроны не могли бы заметно изменять траекторию α –частиц, так как размеры и масса электронов в 8000 раз меньше массы α-частиц. Точно так же камушек в несколько десятков граммов при столкновении с автомобилем не может изменить его скорость.
Изменение направления движения α-частиц может вызвать только массивная часть атома, при этом положительно заряжённая. Весь прибор размещался в сосуде, из которого был откачан воздух. Радиоактивный препарат, помещался внутри свинцового цилиндра, вдоль которого был высверлен узкий канал. Пучок α -частиц из канала падал на тонкую фольгу из тяжёлого металла. После рассеяния α-частицы попадали на полупрозрачный экран, покрытый сульфидом цинка. Столкновение каждой частицы с экраном сопровождалось сцинтилляцией (вспышкой света), которую можно было наблюдать в микроскоп.
Чтобы обнаружить отклонение α-частиц на большие углы Резерфорд окружил фольгу экранами. Сотрудники Резерфорда вели счёт α-частиц, попадающих в регистрирующее устройство при отклонении их на от первоначального направления на определённый угол φ (фи). Данные из серии опытов, за определённый период времени, приведены в таблице:

По мере накопления знаний о материи и веществе происходило появление и уточнение теорий, объясняющих особенности строения атомов. Поговорим кратко о теории строения атома Бора.
Проблемы планетарной модели атома
В начале XXв Э. Резерфорд установил, что распределение заряда внутри атома крайне неравномерно. В центре атома находится компактное ядро, содержащее весь положительный заряд, а вокруг него на достаточно большом расстоянии (по сравнению с ядром) обращаются электроны. Была построена планетарная модель атома.
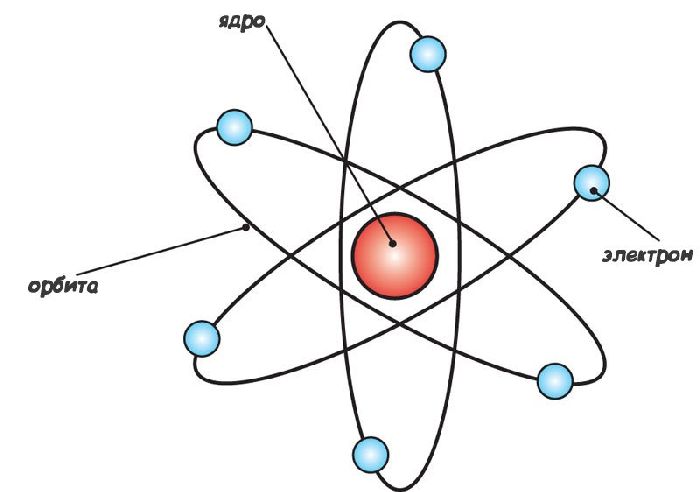
Рис. 1. Планетарная модель атома.
Эта модель хорошо объяснила результаты опытов по зондированию атомов α-частицами, однако, она противоречила достаточно хорошо обоснованной и подтвержденной к тому времени теории электродинамики Максвелла.
Согласно теории Максвелла, любой заряд, движущийся с ускорением, излучает электромагнитные волны и теряет энергию. Электрон, двигаясь по круговой орбите вокруг ядра, движется с постоянным центростремительным ускорением, и поэтому должен излучать, терять энергию, и в конце концов, упасть на ядро. Расчеты показывали, что это должно происходить в очень короткий промежуток времени, порядка десятков наносекунд. В реальности же атомы стабильны.
Вторым затруднением планетарной модели были сложности объяснения линейчатых спектров – противоречия здесь не было, но и обосновать наличие спектральных линий эта модель не могла.
Постулаты Бора
Для объяснения наблюдаемых явлений в 1913 г Н. Бор предложил свою теорию, базирующуюся на двух постулатах:
- Существуют особые стационарные состояния атома, находясь в которых электроны не излучают энергию, хотя двигаются с ускорением. В каждом стационарном состоянии электрон обладает некоторой энергией $E_n$, разной для разных состояний.
- Электроны излучают или поглощают энергию, переходя из одного стационарного состояния в другое, количество излучаемой или поглощаемой энергии равно разности энергий стационарных состояний.
Постулаты Н.Бора были допущениями, которые никак не обосновывались, исходя из классических теорий того времени. Однако, они явились первой ласточкой новой теории – квантовой механики.
Модель атома Н. Бора
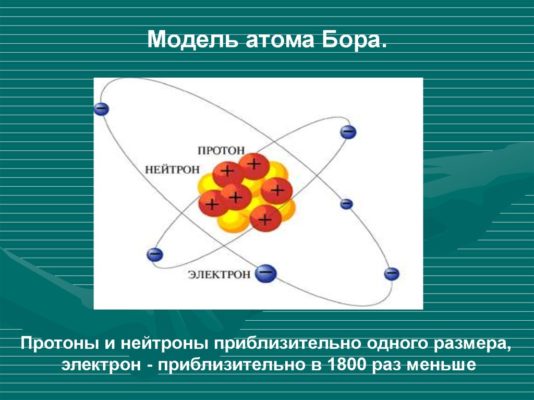
Рис. 2. Модель атома Бора.
На основе своих постулатов и законов механики И.Ньютона Н.Бор смог определить радиусы орбит электрона в атоме водорода, а также энергию, соответствующую стационарному уровню $n$:
- $n$ – номер энергетического уровня (1,2,3…);
- $E_n$ – энергия электрона на уровне $n$;
- $R_y$ – постоянная Ридберга, численно равная 13.6 эВ.
Теория Бора объяснила как стабильность атомов, так и линейчатый характер спектров. Например, серия самых ярких линий спектра водорода, открытая в 1885 г И. Бальмером (названная его именем), соответствует переходам на второй энергетический уровень с третьего, четвертого и более высоких уровней.
Атом водорода способен излучать и более мощную серию, соответствующую переходам на первый энергетический уровень с более высоких, однако, эта серия лежит в ультрафиолетовой области, и была открыта только в 1906 г. Т. Лайманом. Есть и другие серии линий, соответствующих переходам на третий и более высокие уровни.
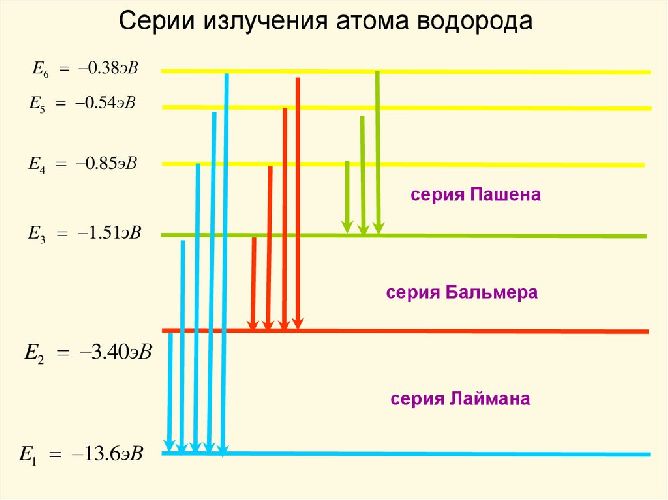
Рис. 3. Серия Бальмера серия Лаймана серия Пашена.
Что мы узнали?
Н. Бор разработал теорию строения атомов на основе своих двух допущений-постулатов. Эта теория смогла объяснить противоречие с электродинамикой Максвелла и линейчатый спектр излучения вещества.

Разница между моделью Резерфорда и Бора - Разница Между
Содержание:
Главное отличие - модель Резерфорда против Бора
Модель Резерфорда и модель Бора являются моделями, которые объясняют структуру атома. Модель Резерфорда была предложена Эрнестом Резерфордом в 1911 году. Модель Бора была предложена Нильсом Бором в 1915 году. Модель Бора рассматривается как модификация модели Резерфорда. Основное отличие модели Резерфорда от Бора состоит в том, что Модель Резерфорда не объясняет энергетические уровни в атоме, тогда как модель Бора объясняет энергетические уровни в атоме.
Ключевые области покрыты
1. Что такое модель Резерфорда
- определение, объяснение модели
2. Что такое модель Бора
- определение, объяснение модели
3. В чем разница между моделью Резерфорда и Бора
- Сравнение основных различий
Ключевые слова: альфа-частицы, атом, модель Бора, электрон, линейные спектры, ядро, орбитали, модель Резерфорда.

Что такое модель Резерфорда
Модель атома Резерфорда описывает, что атом состоит из центрального ядра, и почти вся масса этого атома сконцентрирована, и легкие частицы движутся вокруг этого центрального ядра. В нем также говорится, что центральное ядро заряжено положительно, а составляющие, которые движутся вокруг центрального ядра, заряжены отрицательно.

Рисунок 1: Структура атома, предложенная Резерфордом
Чтобы объяснить эту модель, Резерфорд предложил следующее.
- Атом состоит из центрального ядра, которое имеет положительный заряд.
- Вокруг этого центрального ядра расположены отрицательно заряженные составляющие.
- Положительные и отрицательные заряды балансируют друг с другом.
Однако эта модель атома Резерфорда также была отвергнута, потому что она не могла объяснить, почему электроны и положительные заряды в ядре не притягиваются друг к другу.
Что такое модель Бора
Модель Бора является модификацией модели Резерфорда. Эта модель была предложена на основе линейчатых спектров атома водорода. Эта модель предполагала, что электроны всегда движутся в определенных оболочках или орбитах вокруг ядра. Модель Бора также указала, что эти оболочки имеют разные энергии и имеют сферическую форму.
Кроме того, модель Бора объяснила, что электроны на одной орбите могут перемещаться на другую орбиту, либо поглощая энергию, либо выделяя энергию.

Рисунок 2: Структура атома в соответствии с моделью Бора
Спектры линий атома водорода имели много дискретных линий. Чтобы объяснить этот спектр, Бор предложил следующее.
- Электроны движутся вокруг ядра в определенных оболочках или
- Эти оболочки имеют дискретные уровни энергии.
- Энергия орбиты связана с размером орбиты. Самая маленькая орбита имеет самую низкую энергию.
- Электроны могут перемещаться с одного энергетического уровня на другой.
Хотя эта модель идеально соответствует атомной структуре атома водорода, при применении этой модели к другим элементам были определенные ограничения. Одним из таких ограничений является невозможность объяснить эффект Зеемана и эффект Штарка, наблюдаемый в линейных спектрах.
Разница между моделью Резерфорда и Бора
Определение
Модель Резерфорда: Модель Резерфорда утверждает, что атом состоит из центрального ядра, где сосредоточена почти вся масса этого атома, и легкие частицы движутся вокруг этого центрального ядра.
Модель Бора: Модель Бора объясняет, что электроны всегда движутся в определенных оболочках или орбитах, которые расположены вокруг ядра, и эти оболочки имеют дискретные уровни энергии.
наблюдение
Модель Резерфорда: Модель Резерфорда была разработана на основе наблюдений за экспериментом с золотой фольгой.
Модель Бора: Модель Бора была разработана на основе наблюдений линейных спектров атома водорода.
Уровни энергии
Модель Резерфорда: Модель Резерфорда не описывает наличие дискретных уровней энергии.
Модель Бора: Модель Бора описывает наличие дискретных уровней энергии.
Размер орбиталей
Модель Резерфорда: Модель Резерфорда не объясняет связь между размером орбиты и энергией орбиты.
Модель Бора: Модель Бора объясняет связь между размером орбиты и энергией орбиты; самая маленькая орбиталь имеет самую низкую энергию.
Заключение
И модель Резерфорда, и модель Бора объясняют одну и ту же концепцию строения атома с небольшими вариациями. Основное различие между моделью Резерфорда и моделью Бора состоит в том, что модель Резерфорда не объясняет энергетические уровни в атоме, тогда как модель Бора объясняет энергетические уровни в атоме.
Рекомендации:
Большинство из нас думает, что знает об атомах достаточно много. Мы знаем какие они маленькие и даже можем дать определение атому. Но как же человечество пришло к пониманию, что такое атом и каковы основы строения атомов?
Модель атома Томпсона (пудинг с изюмом)
Эти лучи он назвал катодными лучами, позднее их стали называть электронными лучами. С помощью магнита, Томпсон определил, что эти лучи содержат частицы с отрицательным зарядом. После большой серии опытов ему удалось установить, что отрицательные частицы (электроны) очень малы, по сравнению с тем, что дает положительный заряд атому.


Модель атома Томпсона
Модель атома Резерфорда (ядерная модель)

Опыт резерфорда
Но вот произошло то, что он никак не ожидал увидеть: хотя большинство частиц летели прямо, некоторые отклонялись на большой угол, а некоторые летели назад в сторону источника. Этот эксперимент позволил предположить, что весь положительный заряд находится в ядре атома, а отрицательно заряженные электроны плавают вокруг него. Согласно ядерной модели строения атома по Резерфорду, большую часть атома занимает пустое пространство.
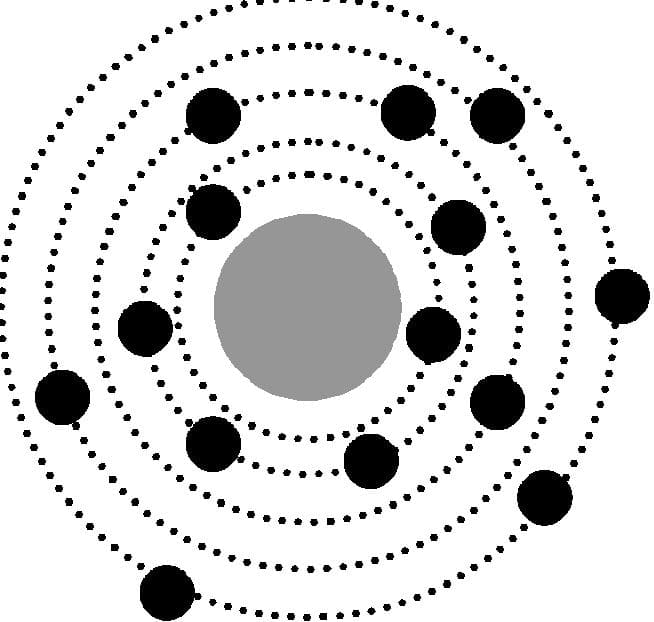
Модель атома Резерфорда
Модель атома Бора (планетарная модель)
Пока другие ученые ставили эксперименты с катодными лучами, Нильс Бор был озадачен теми линиями, которые давал водород при добавлении ему энергии. И вот возникла планетарная модель атома, в которой Бор предположил, что электроны движутся вокруг ядра по круговым орбитам, подобно планетам, вращающихся вокруг Солнца.
Также он полагал, что чем дальше электрон находится от ядра, тем большей энергией он обладает. При получении атомом дополнительной энергии, электроны с ближних орбит могут перескакивать на более отдаленные. Начальная орбиталь называется основной, а конечная – возбужденной. Энергия, полученная атомом должна куда-то уйти, и она высвобождается в виде квантов электромагнитного излучения. Т.к. существует несколько возбужденных состояний, то испускаются кванты различных энергий. Этим он объяснил полученный спектр водорода.

Опыт Нильса Бора
Современная модель атома (квантовая модель)
Во что мы верим сейчас? Из предыдущего раздела Основные понятия и законы химии, мы знаем, что Атом состоит из ядра и электронов. Атомное ядро имеет положительный заряд и состоит из протонов (Z) и нейтронов (N), а сумма масс протонов (Z) и нейтронов (N) атомного ядра называется массовым числом A = Z + N. Электроны атома расположены вокруг ядра на своих орбиталях.
Читайте также:

