Способы получения алифатических и ароматических аминов кратко
Обновлено: 30.06.2024
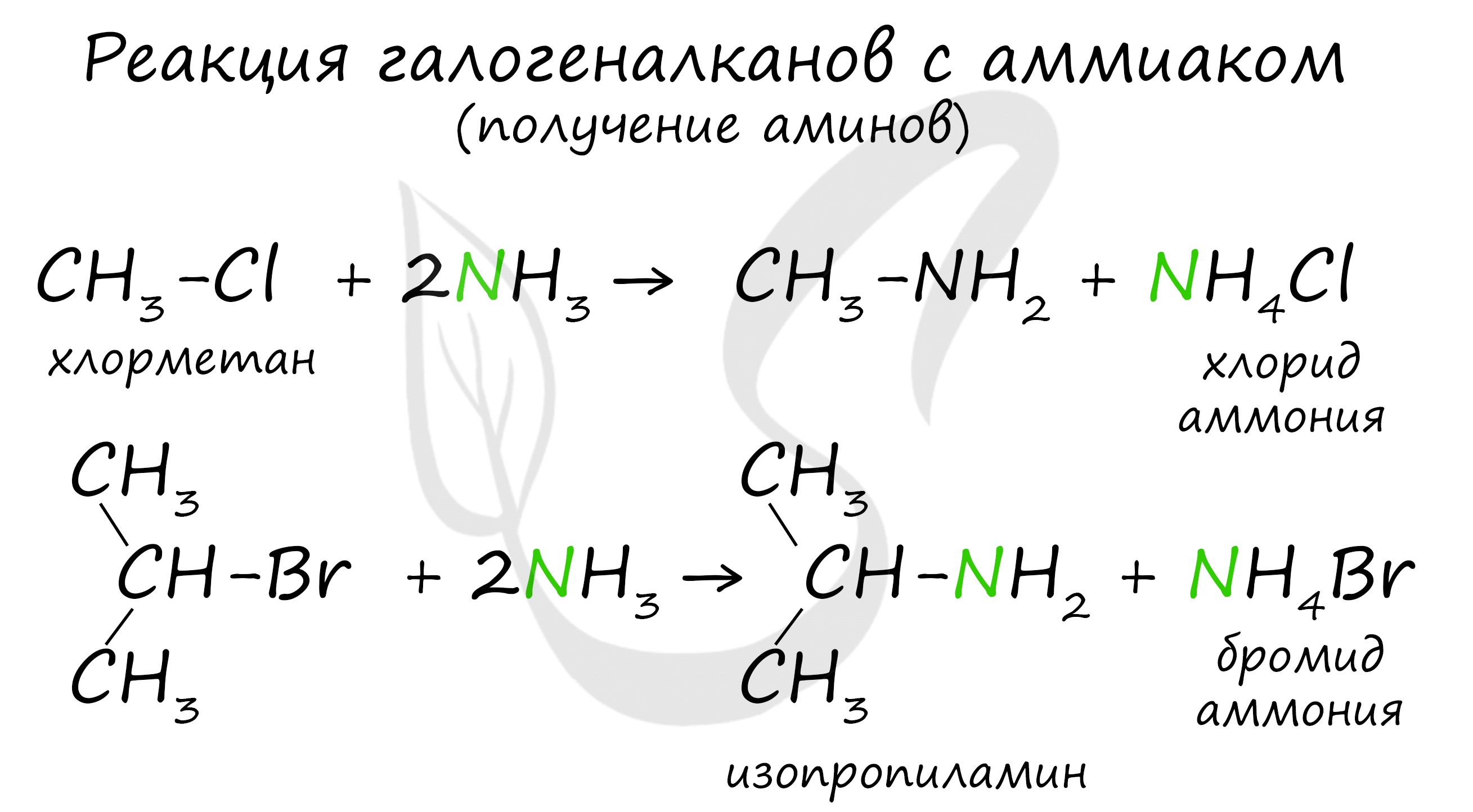
1. Нуклеофильное замещение галогенов в алкилгалогенидах под действием аммиака и аминов (реакция Гофмана).
Данная реакция используется редко, так как замещенные амины, как правило, являются более сильными нуклеофилами, чем аммиак, и остановить реакцию на стадии монозамещения практически невозможно. В редких случаях, используя многократный избыток аммиака, удается получить первичные амины по реакции Гофмана. Реакцию прямого алкилирования используют в основном для получения четвертичных аммонийных солей и оснований.
2. Нуклеофильное замещение галогенов в алкилгалогенидах под действием фталимида калия (реакция Габриэля).
Нуклеофильное замещения галогена под действием фталимида калия – удобный метод получения первичных аминов. За счет резкого снижения нуклеофильных свойств при переходе от фталимида калия к алкилфталимиду, реакция протекает однозначно и с хорошими выходами. Образующийся N-алкилфталимид для выделения амина обрабатывают гидразином или концентрированной бромистоводородной кислотой.
По реакции Габриэля получают многие природные амины, включая аминокислоты.
3. Восстановление алифатических и ароматических нитросоединений.
Основной способ синтеза ароматических аминов (анилинов) заключается в восстановлении ароматических нитросоединений. Последние, легко получаются прямым нитрованием соответствующих производных ароматических соединений. К числу восстановителей относятся переходные металлы (Zn, Fe) в кислой среде, хлорид олова (II) в кислой среде, а также гидросульфид натрия. Использование NaHS часто позволяет селективно восстановить одну из нескольких нитрогрупп в молекуле.
Восстановление алифатических соединений также можно осуществить под действием вышеуказанных восстановителей, однако эта реакция используется редко, по причине гораздо большей доступности алифатических аминов по сравнению с нитропроизводными.
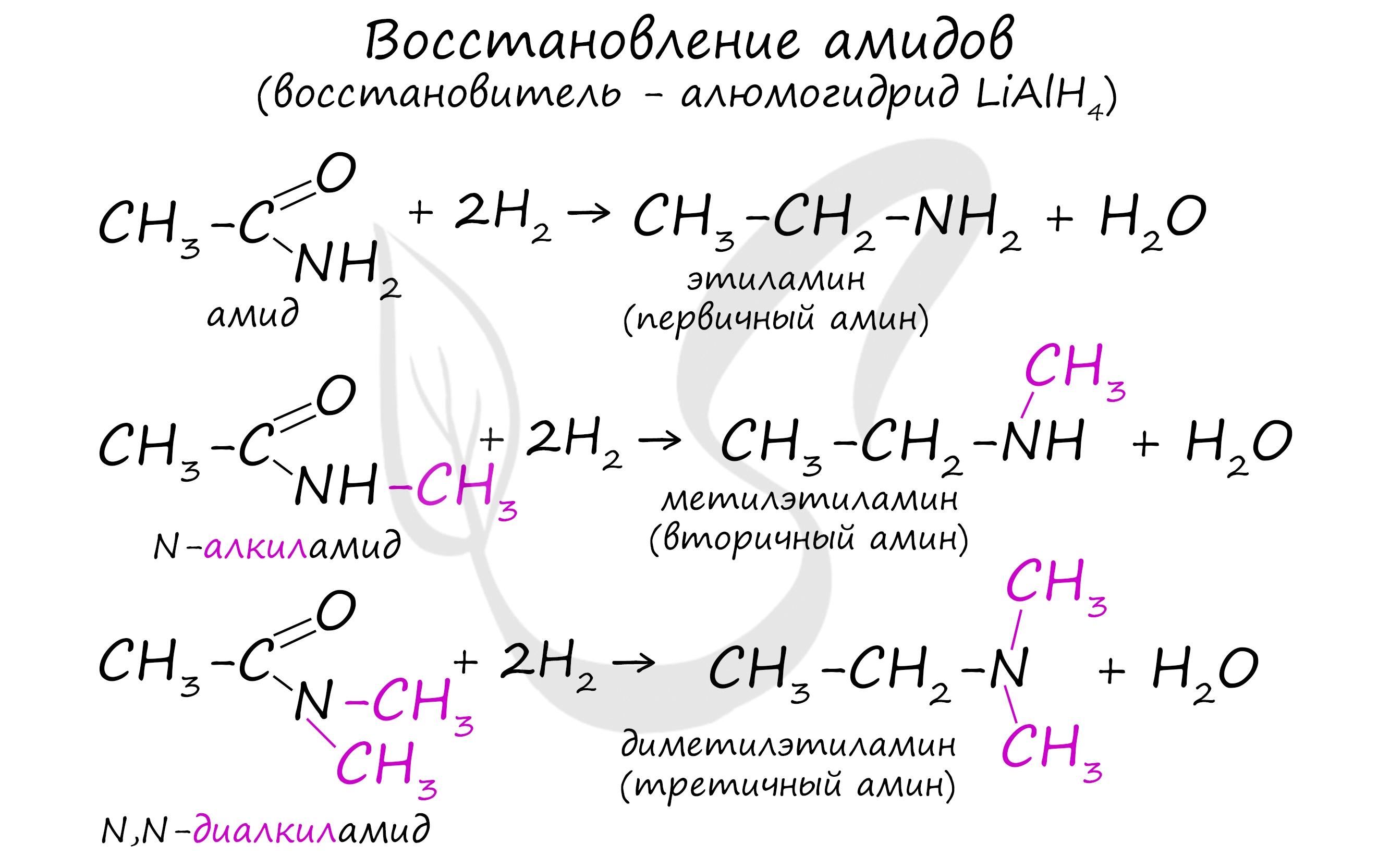
4. Восстановление амидов карбоновых кислот, иминов и оксимов альдегидов и кетонов.
Азотистые производные карбонильных соединений (амиды карбоновых кислот, имины и оксимы) восстанавливают до аминов под действием металлокомплексных гидридов.
Также восстановление азотистых производных альдегидов и кетонов осуществляют металлическим натрием в среде кипящего спирта (восстановление по Буво-Блану).
5. Восстановление нитрилов.
Алифатические нитрилы легко восстанавливаются металлокомплексными гидридами и гидридом алюминия до соответствующих аминов. Исходные нитрилы синтезируют по реакции нуклеофильного замещения из алкилгалогенидов. Следует обратить внимание, что амин получается на один атом углерода длиннее, чем исходный галоидный алкил.
Амины - органические соединения, продукты замещения атомов водорода в аммиаке NH3 различными углеводородными радикалами. Функциональная группой аминов является аминогруппа - NH2.

Классификация аминов
По числу углеводородных радикалов амины подразделяются на первичные, вторичные и третичные.
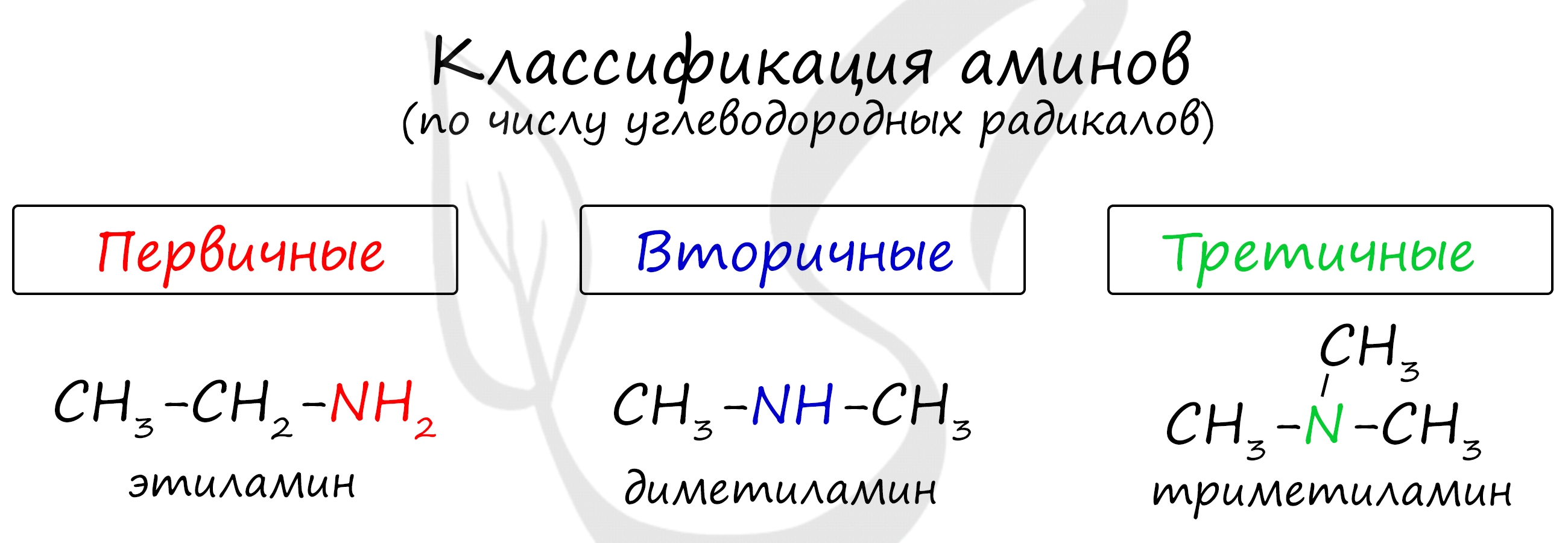
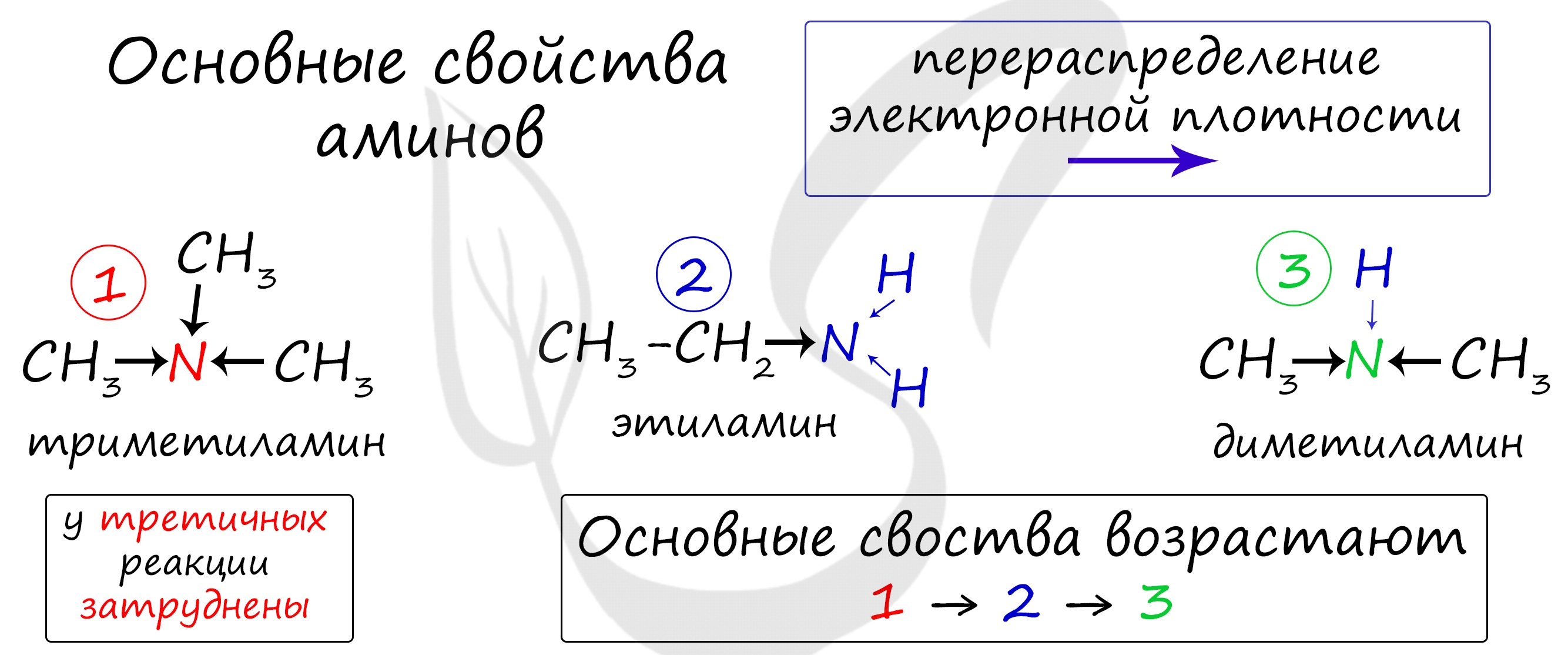
Запомните, что основные свойства аминов выражены тем сильнее, чем больше электронной плотности присутствует на атоме азота. Однако, у третичных аминов три углеводородных радикала создают значительные затруднения для химических реакций.
Таким образом, у третичных аминов основные свойства выражены слабее, чем у вторичных аминов. Основные свойства возрастают в ряду: третичные амины (слабые основные свойства) → первичные амины → вторичные амины (основные свойства хорошо выражены).
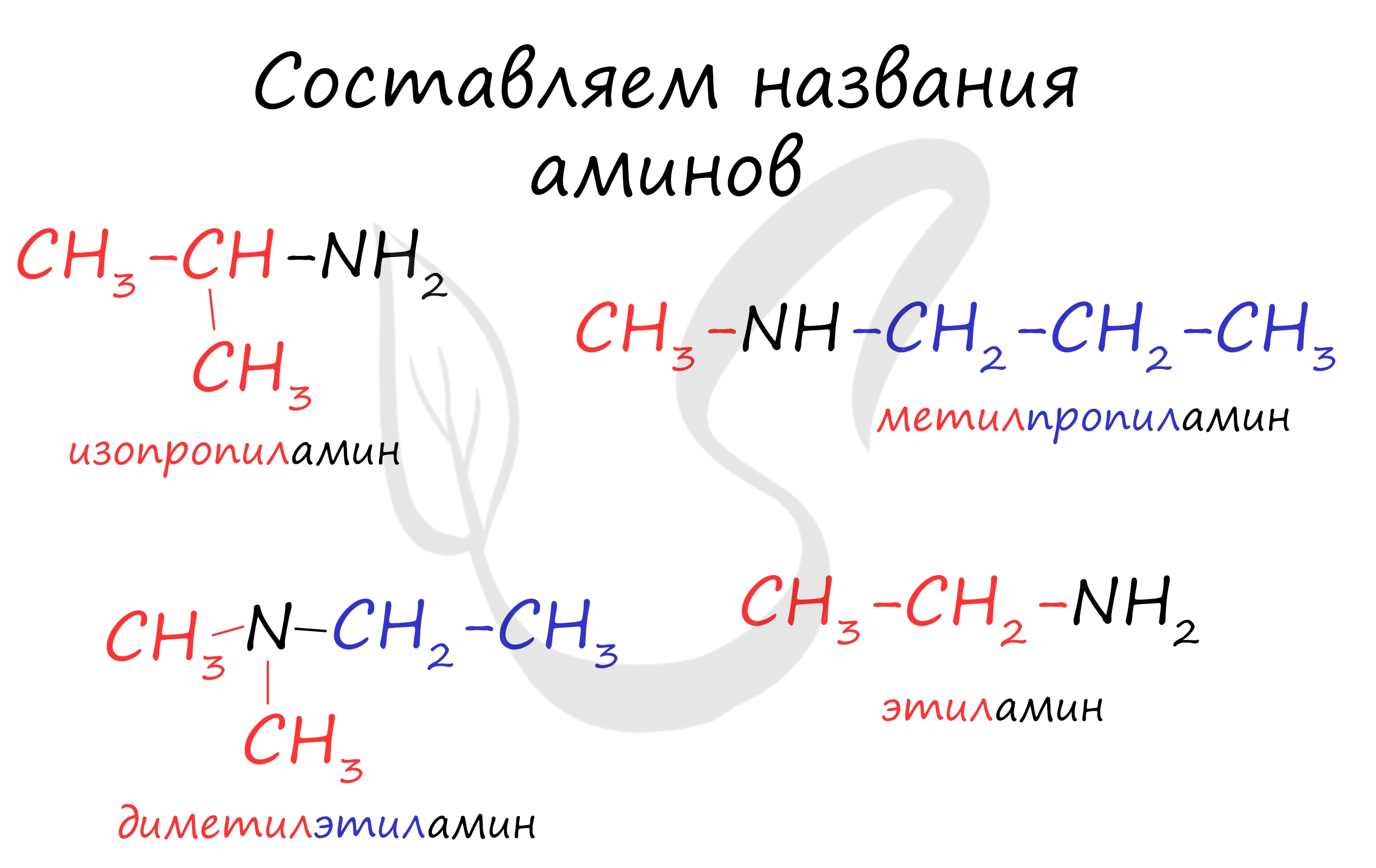
Номенклатура и изомерия аминов
Названия аминов формируются путем добавления суффикса "амин" к названию соответствующего углеводородного радикала: метиламин, этиламин, пропиламин, изопропиламин, бутиламин и т.д. В случае если радикалов несколько, их перечисляют в алфавитном порядке.
Общая формула предельных аминов CnH2n+3N. Атомы углерода находятся в sp3 гибридизации.
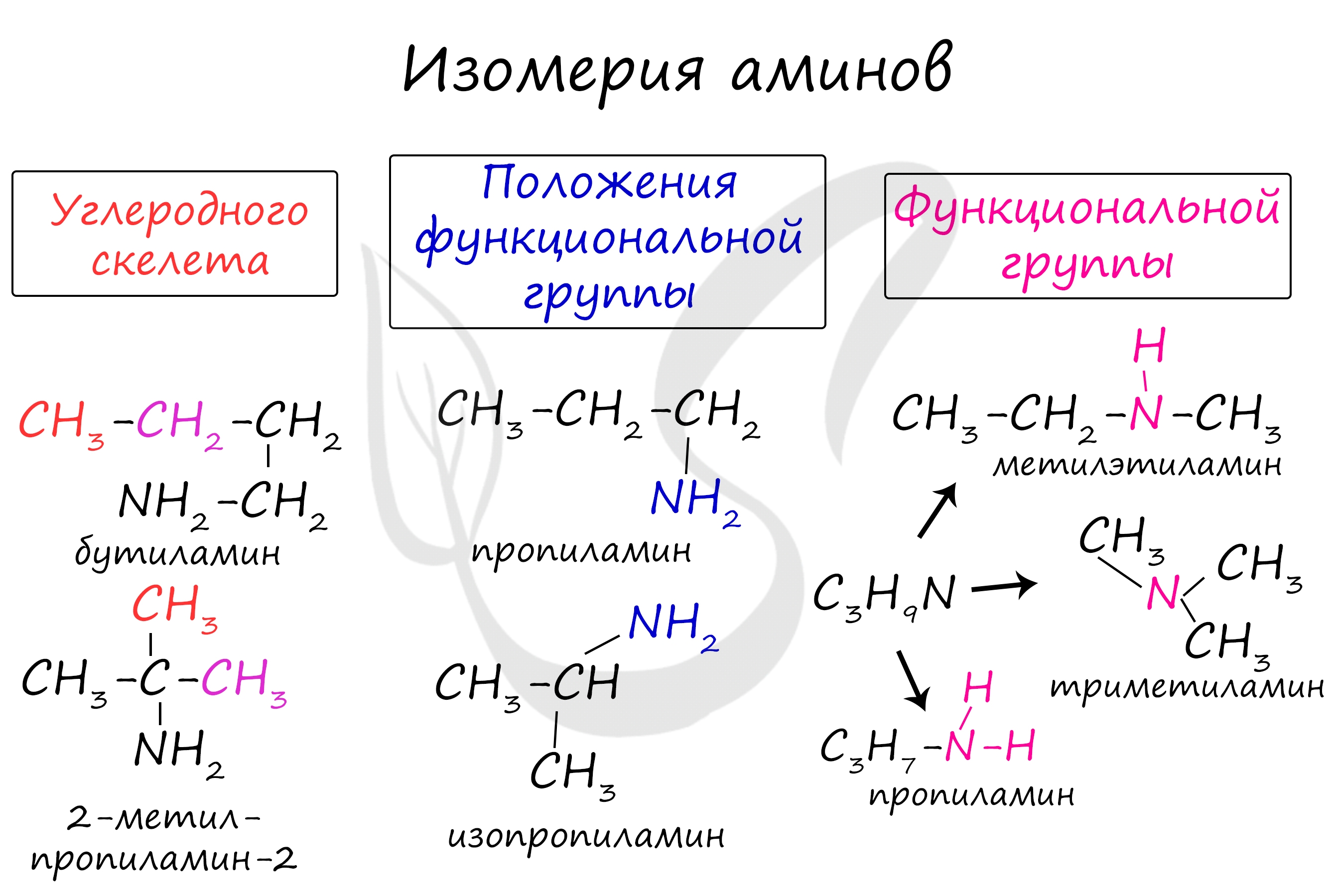
Для аминов характерна структурная изомерия: углеродного скелета, положения функциональной группы и изомерия аминогруппы.
Получение
В основе этой реакции лежит замещение атома галогена в галогеналканах на аминогруппу, при этом образуются амин и соль аммония.
При такой реакции нитрогруппа превращается в аминогруппу, образуется вода.

Знаменитой является предложенная в 1842 году Н.Н. Зининым реакция получения аминов восстановления ароматических нитросоединений (анилина и других). Она возможна в нескольких вариантах, главное, чтобы в начале реакции выделился водород.

Реакция сопровождается разрушением карбонильной группы и отщеплении ее от молекулы амида в виде воды.
Этим способом в промышленности получают гексаметилендиамин, используемый в изготовлении волокна - нейлон.

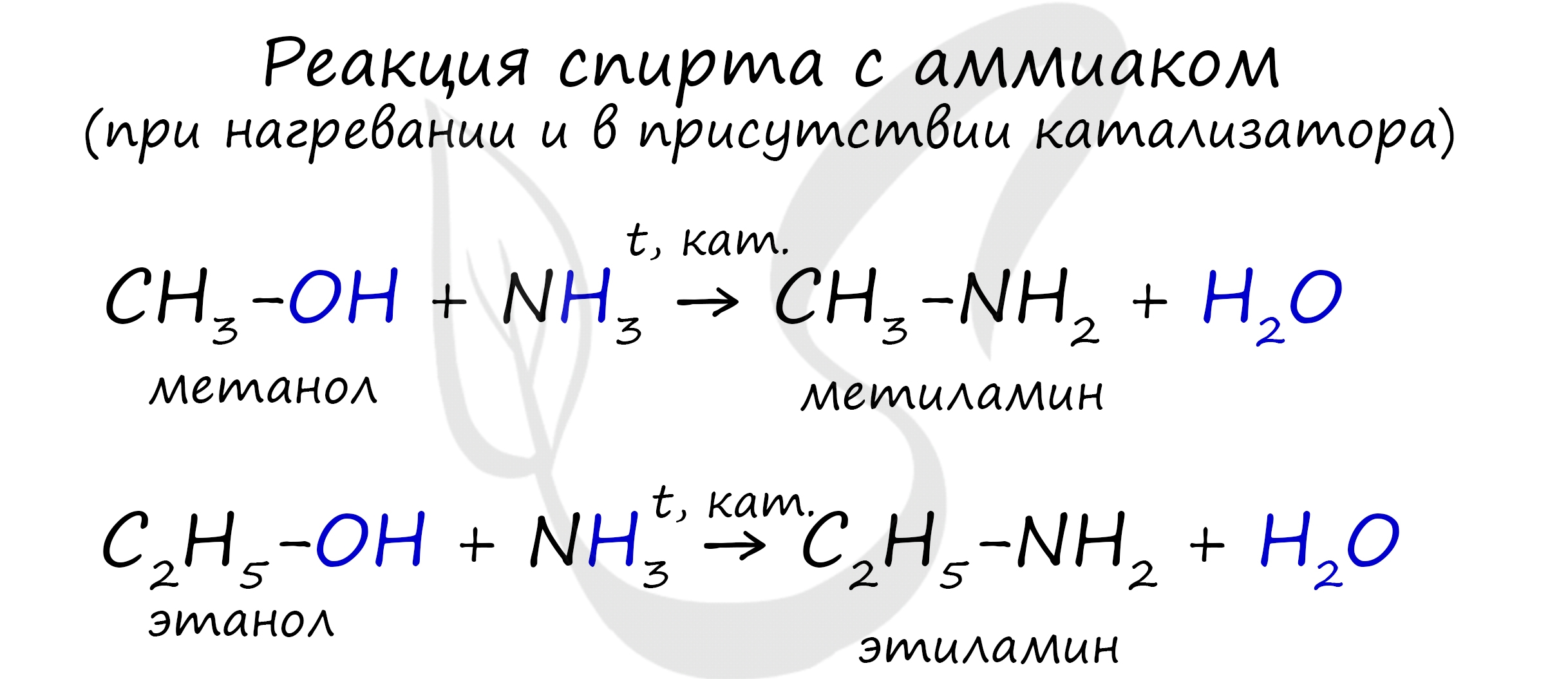
В промышленности амины получают реакцией аммиака со спиртами, в ходе которой происходит замещение гидроксогруппы на аминогруппу.
В ходе реакции галогеналканов с аммиаком, аминами, становится возможным получение первичных, вторичных и третичных аминов.
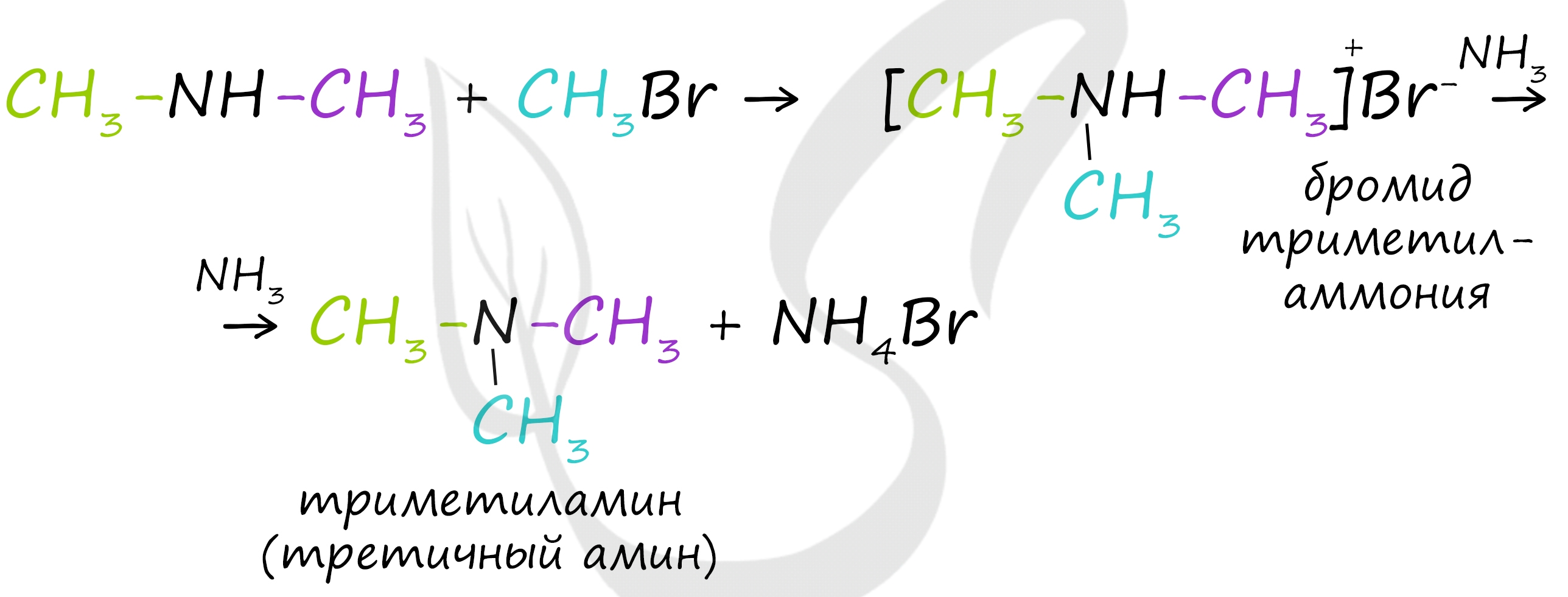
Химические свойства аминов
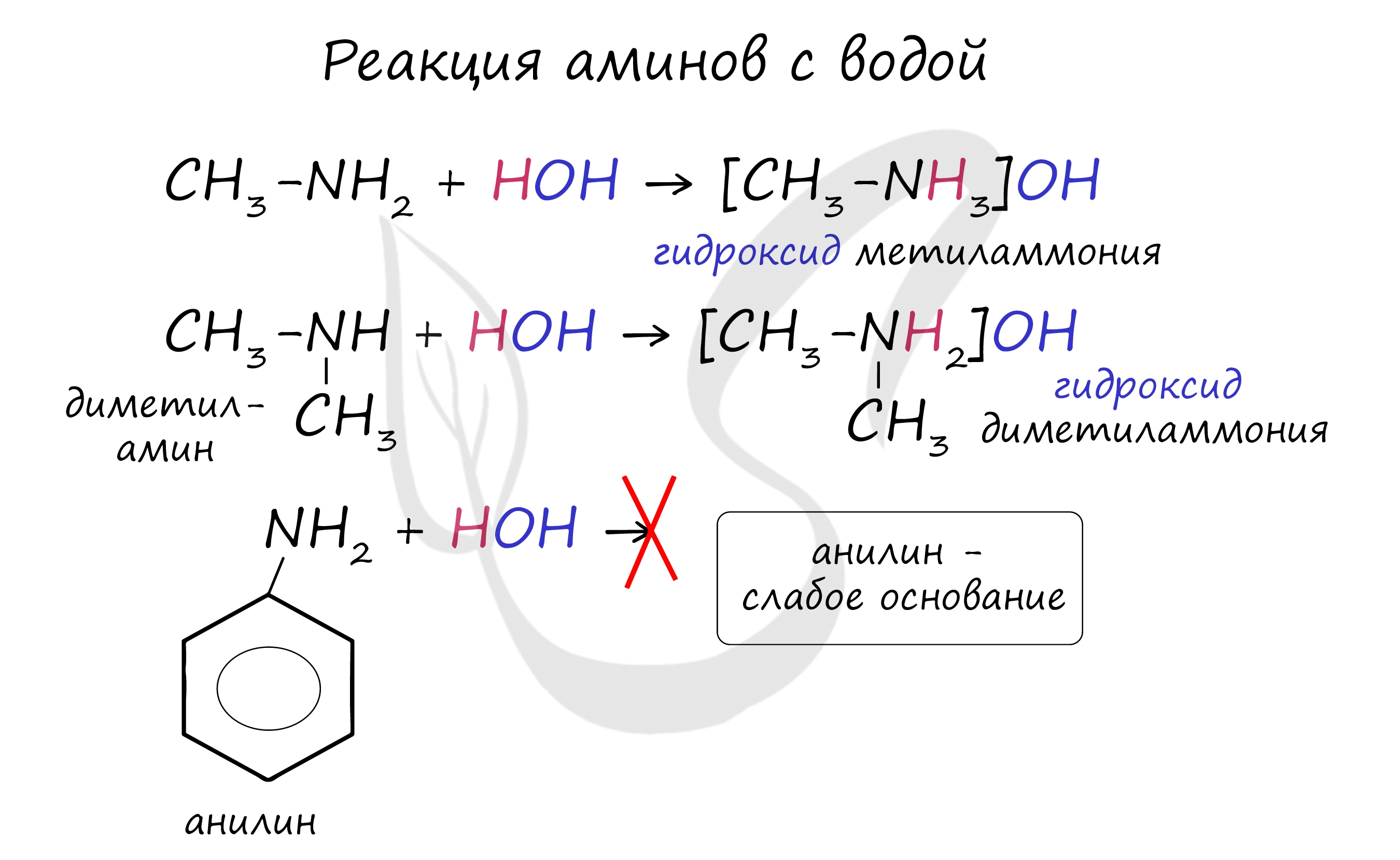
Как и аммиак, амины обладают основными свойствами, их растворы окрашивают лакмусовую бумажку в синий цвет.
В реакции с водой амины образуют гидроксиды алкиламмония, которые аналогичны гидроксиду аммония. Анилин с водой не реагирует, так как является слабым основанием.
Как основания, амины вступают в реакции с различными кислотами и образуют соли алкиламмония.

Данная реакция помогает различить первичные, вторичные и третичные амины, которые по-разному с ней взаимодействуют.
При конденсации первичных аминов с альдегидами и кетонами получают основания Шиффа, соединения, которые содержат фрагмент "N=C".

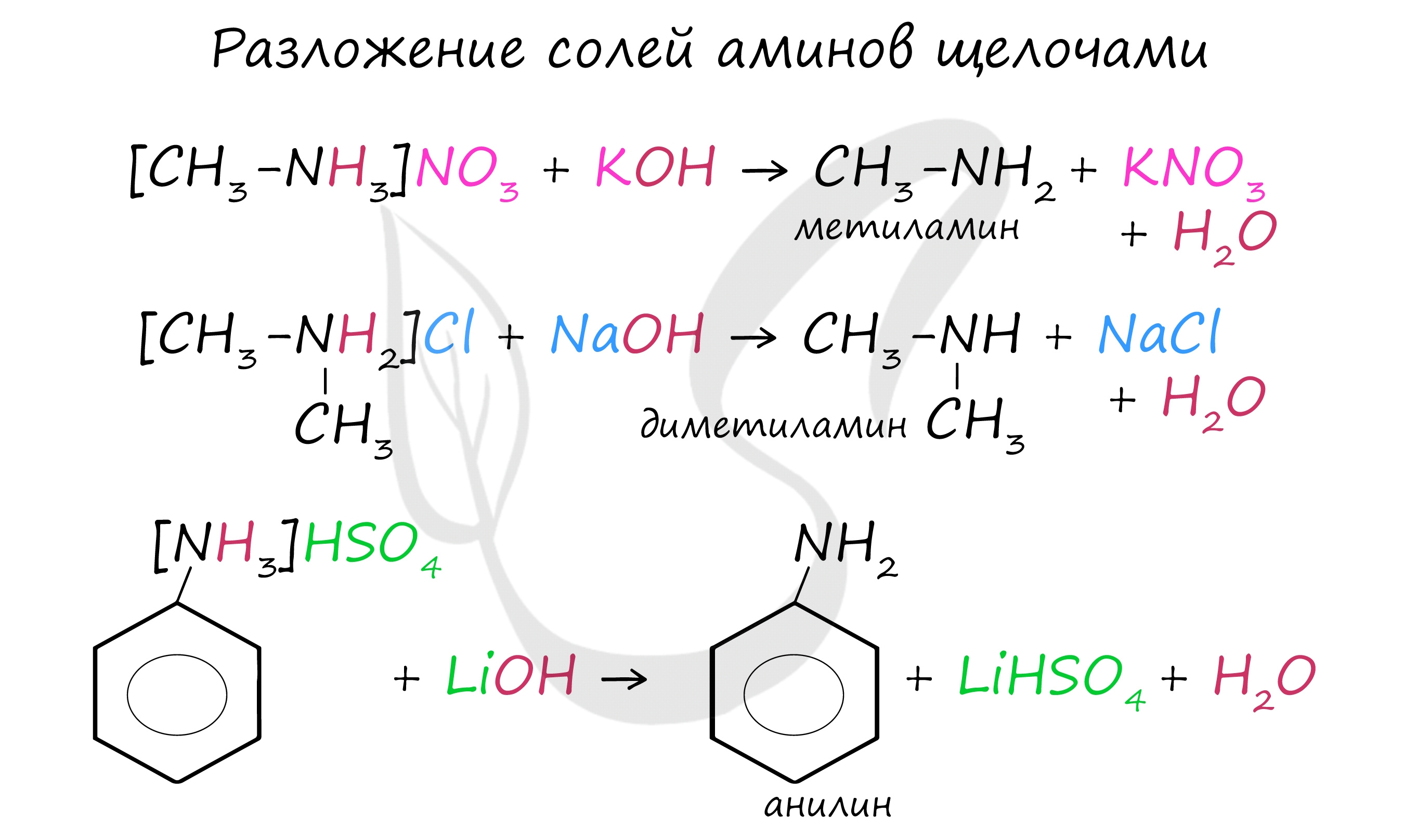
Соли аминов легко разлагаются щелочами (растворимыми основаниями). В результате образуется исходный амин, соль кислоты и вода.
При горении аминов азот чаще всего выделяется в молекулярном виде, так как для реакции азота с кислородом необходима очень высокая температура. Выделение углекислого газа и воды обыкновенно при горении органических веществ.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
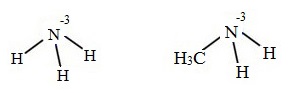
В молекулах аминах атом азота находится в низшей степени окисления -3:
Степени окисления атома азота в молекулах аммиака и метиламина
Поэтому многие способы получения аминов основаны на процессах восстановления азотсодержащих соединений других классов.
1. Восстановление нитросоединений
Наиболее общим методом получения первичных аминов является восстановление нитросоединений.
Восстановление осуществляется атомарным водородом (т.е. водородом, получаемым в момент его выделения), который является более сильным восстановителем, чем молекулярный:
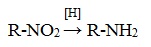
Для получения атомарного водорода используется реакция цинка или железа в кислой среде (с соляной кислотой), алюминий в щелочной среде (с гидроксидом натрия).
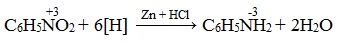
Нитросоединения при восстановлении образуют первичные амины.
Для получения алифатических аминов этот способ используется редко, но важен для получения ароматических аминов и лег в основу промышленного производства анилина.
Реакция получения анилина открыта в 1842 г. профессором Н.Н. Зининым (реакция Зинина). В качестве восстановителя Зинин использовал сульфид аммония:

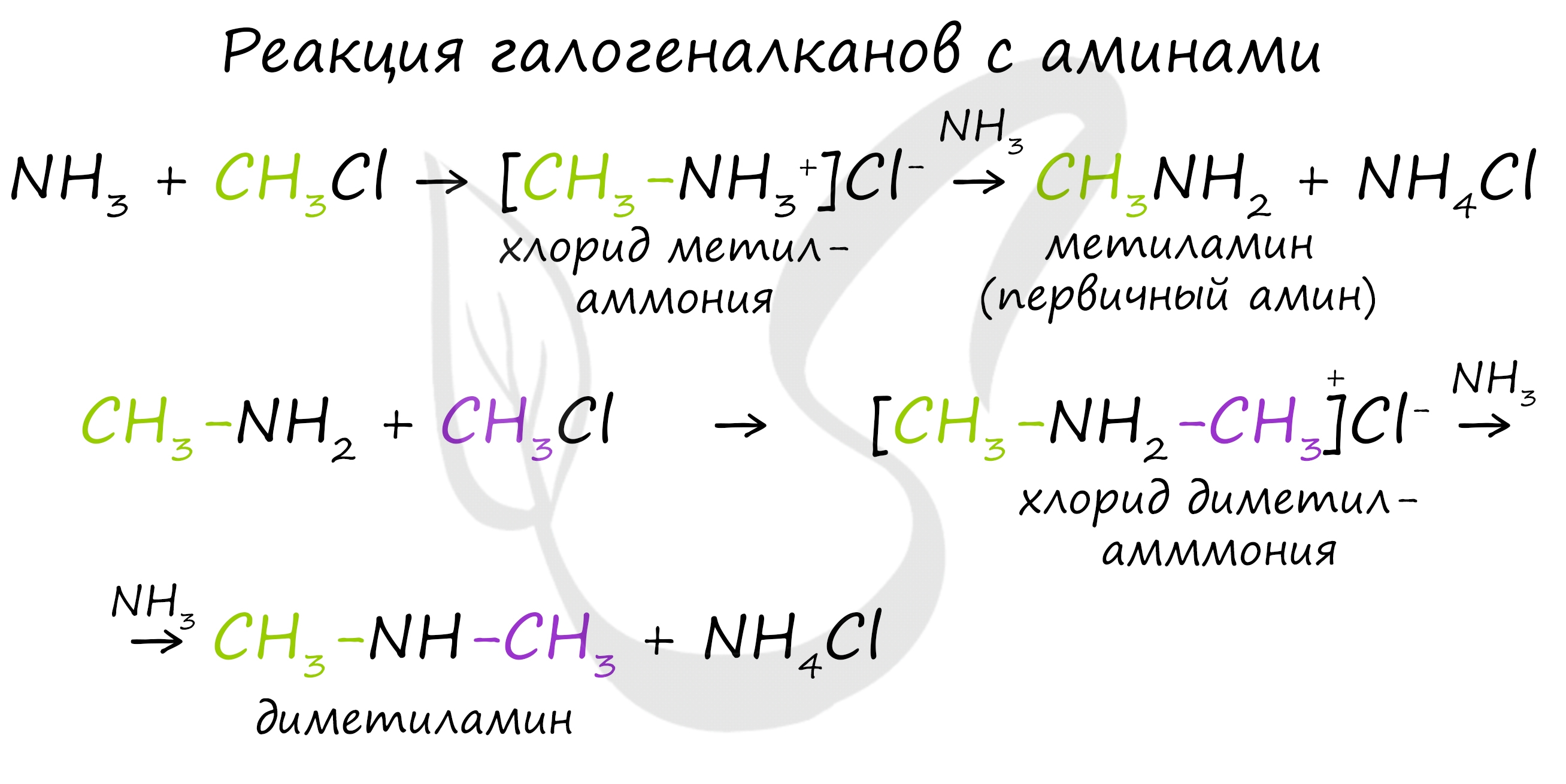
2. Взаимодействие алкилгалогенидов (галогеналканов) с аммиаком (алкилирование по Гофману)
Алкилирование аммиака — основной способ получения аминов. Эта реакция была открыта немецким химиком А.В. Гофманом и является наиболее простым методом синтеза первичных, вторичных и третичных аминов.
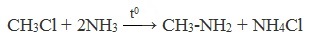
Получение аминов происходит путем замещения атома водорода аммиака на углеводородный радикал:
Смеси аминов разделяют перегонкой, используя большие различия в температурах кипения.
3. Реакция аммиака со спиртом (аммонолиз спиртов)
В промышленности алкилирование аммиака в большинстве случаев проводится не галогеналканами, а спиртами, в молекулах которых происходит нуклеофильное замещение ОН-группы на аминогруппу.
Пропусканием паров спирта и аммиака при температуре 300-500 0 С над катализатором получают смесь первичных, вторичных и третичных спиртов:
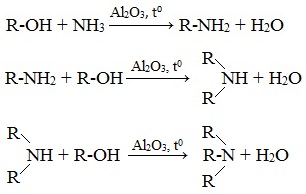
4. Действие щелочей на соли алкиламмония
Лабораторный способ
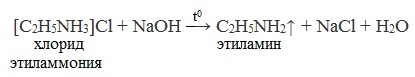
Вытеснением аминов из их солей при нагревании более сильным основанием можно получить первичные, вторичные и третичные амины. Щелочь как более сильное основание вытесняет амин, который выделяется при нагревании в виде газа.
5. Восстановление нитрилов
Первичные амины могут быть получены восстановлением нитрилов тетрагидридоалюминатом (III) лития LiAlH4 в диэтиловом эфире:
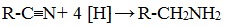
Этим способом в промышленности получают гексаметилендиамин, который используется в производстве полиамидного волокна нейлон.
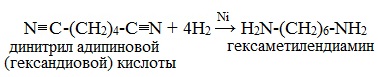
6. Восстановление амидов
Амиды карбоновых кислот восстанавливаются до аминов алюмогидридом лития LiAlH4. Из соответствующих амидов могут быть получены первичные, вторичные и третичные амины.

Атом азота находится в состоянии sp 3 -гибридизации, поэтому молекула имеет форму тетраэдра.
Также атом азота в аминах имеет неподелённую электронную пару, поэтому амины проявляют свойства органических оснований.
По количеству углеводородных радикалов, связанных с атомом азота, различают первичные, вторичные и третичные амины.
По типу радикалов амины делят на алифатические, ароматические и смешанные.
- Названия аминов образуют из названий углеводородных радикалов и суффикса амин. Различные радикалы перечисляются в алфавитном порядке.
При наличии одинаковых радикалов используют приставки ди и три.
- Первичные амины могут быть названы как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2.
В этом случае аминогруппа указывается в названии приставкой амино-:
| 1-Аминопропан | 1,3-Диаминобутан |
| CH3-CH2-CH2-NH2 | NH2-CH2-CH2-CH(NH2) -CH3 |
- Для смешанных аминов, содержащих алкильные и ароматические радикалы, за основу названия обычно берется название первого представителя ароматических аминов – анилин.
Например, N-метиланилин:

Символ N- ставится перед названием алкильного радикала, чтобы показать, что этот радикал связан с атомом азота, а не является заместителем в бензольном кольце.
Для аминов характерна изомерия углеродного скелета, изомерия положения аминогруппы и изомерия различных типов аминов.
Изомерия углеродного скелета
Для аминов характерна изомерия углеродного скелета (начиная с С4H9NH2).
| Например. Ф ормуле С4Н9NH2 соответствуют два амина-изомера углеродного скелета. |
| н-Бутиламин (1-аминобутан) | Изобутиламин (1-амин-2-метилпропан) |
 |  |
Изомерия положения аминогруппы
Для аминов характерна изомерия положения аминогруппы (начиная с С3H9N).
| Например. Ф ормуле С4Н11N соответствуют амины положения аминогруппы. |
Изомерия между типами аминов
| Например. Формуле С3Н9N соответствуют первичный, вторичный и третичный амины. |
При обычной температуре низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха.
Ароматические амины – бесцветные жидкости с высокой температурой кипения или твердые вещества.
Первичные и вторичные амины образуют слабые межмолекулярные водородные связи:
Это объясняет относительно более высокую температуру кипения аминов по сравнению с алканами с близкой молекулярной массой.
Амины также способны к образованию водородных связей с водой:
Поэтому низшие амины хорошо растворимы в воде.
С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается. Ароматические амины в воде не растворяются.
Аммиак :NH3
| Поэтому амины и аммиак обладают свойствами оснований. |
1. Основные свойства аминов
| Алифатические амины являются более сильными основаниями, чем аммиак, а ароматические — более слабыми. |
Это объясняется тем, что радикалы СН3–, С2Н5– увеличивают электронную плотность на атоме азота:
Это приводит к усилению основных свойств.
| Основные свойства аминов возрастают в ряду: |

1.1. Взаимодействие с водой
В водном растворе амины обратимо реагируют с водой. Среда водного раствора аминов — слабощелочная:

1.2. Взаимодействие с кислотами
Амины реагируют с кислотами, как минеральными, так и карбоновыми, и аминокислотами, образуя соли (или амиды в случае карбоновых кислот):

При взаимодействии аминов с многоосновными кислотами возможно образование кислых солей:

1.3. Взаимодействие с солями
Амины способны осаждать гидроксиды тяжелых металлов из водных растворов.
| Например, при взаимодействии с хлоридом железа (II) образуется осадок гидроксида железа (II): |

2. Окисление аминов
Амины сгорают в кислороде, образуя азот, углекислый газ и воду. Например, уравнение сгорания этиламина:

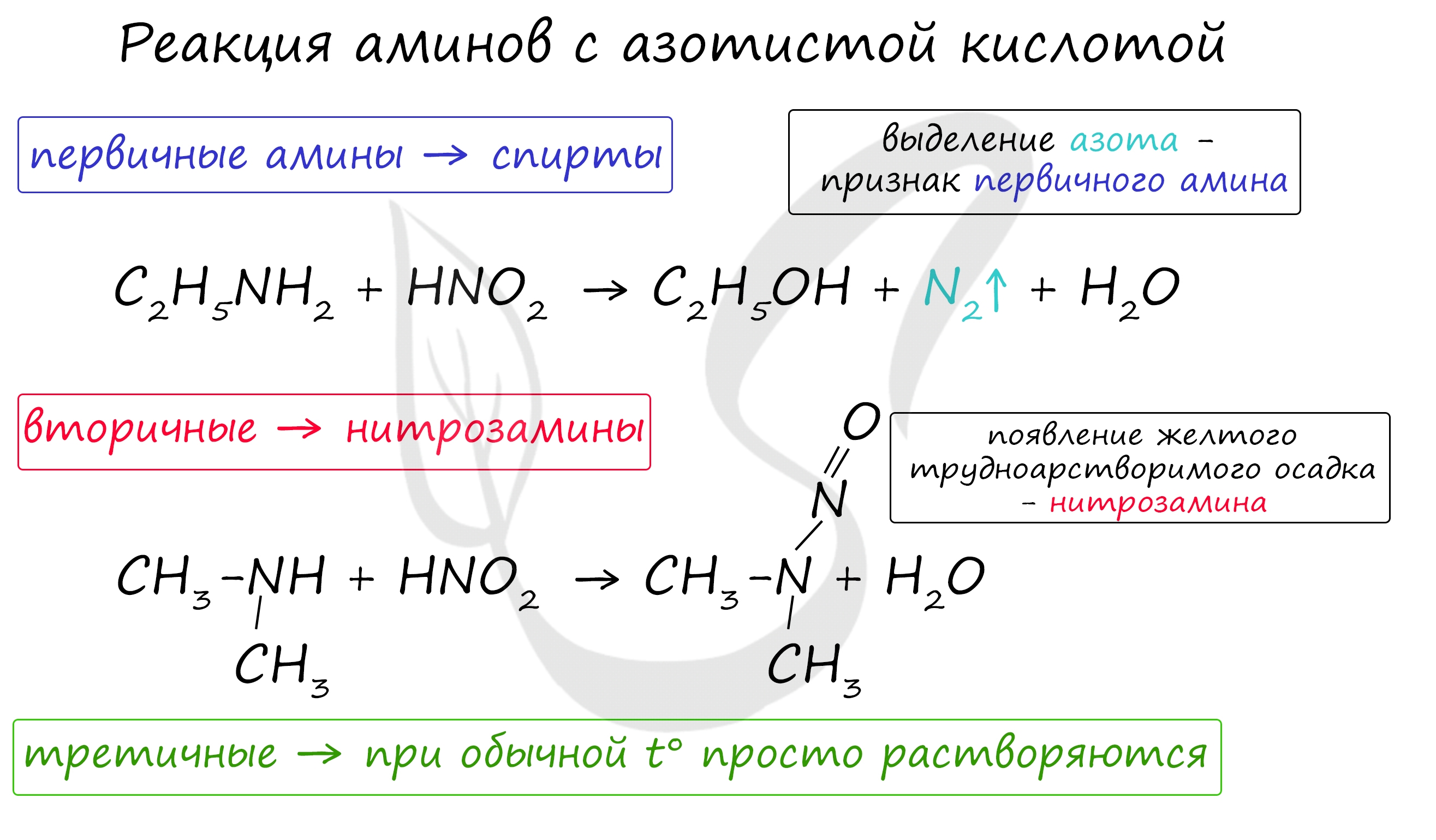
3. Взаимодействие с азотистой кислотой
Первичные алифатические амины при действии азотистой кислоты превращаются в спирты:

| Это качественная реакция на первичные амины – выделение азота. |
Вторичные амины (алифатические и ароматические) образуют нитрозосоединения — вещества желтого цвета:

4. Алкилирование аминов
Первичные амины способны взаимодействовать с галогеналканами с образованием соли вторичного амина:

Из полученной соли щелочью выделяют вторичный амин, который можно далее алкилировать до третичного амина.
Особенности анилина
Анилин С6H5-NH2 – это ароматический амин.

| Анилин – бесцветная маслянистая жидкость с характерным запахом. На воздухе окисляется и приобретает красно-бурую окраску. Ядовит. В воде практически не растворяется. |
При 18 о С в 100 мл воды растворяется 3,6г анилина. Раствор анилина не изменяет окраску индикаторов.
| Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. |
- Бензольное кольцо уменьшает основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком:
Анилин не реагирует с водой, но реагирует с сильными кислотами, образуя соли:

- Бензольное кольцо в анилине становится более активным в реакциях замещения, чем у бензола.
Реакция с галогенами идёт без катализатора во все три орто- и пара- положения.
| Качественная реакция на анилин: реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок ↓). |

Восстановление нитросоединений
Первичные амины можно получить восстановлением нитросоединений.


Алюминий реагирует с щелочами с образованием гидроксокомплексов.

В щелочной и нейтральной среде получаются амины.
Восстановлением нитробензола получают анилин.
- Металлами в кислой среде – железом, оловом или цинком в соляной кислоте.
При этом образуются не сами амины, а соли аминов:

Амины из раствора соли выделяют с помощью щелочи:
Алкилирование аммиака и аминов
При взаимодействии аммиака с галогеналканами происходит образование соли первичного амина, из которой действием щелочи можно выделить сам первичный амин.


Если проводить реакцию с избытком аммиака, то сразу получится амин, а галогеноводород образует соль с аммиаком:

Гидрирование нитрилов
Таким образом получают первичные амины. Возможно восстановление нитрилов водородом на катализаторе:

.
Соли аминов
- Соли аминов — это твердые вещества без запаха, хорошо растворимые в воде, но не растворимые в органических растворителях (в отличие от аминов).
- При действии щелочей на соли аминов выделяются свободные амины:

- Соли аминов вступают в обменные реакции в растворе:

Соль амина с более слабыми основными свойствами может реагировать с другим амином, образуя новую соль (более сильные амины вытесняют менее сильные из солей):
15 комментариев
Добавить ваш
Где получение аминов , там 2) Реакция Зинина слева написано R как радикал, а справа (после равно) уже метиламин, почему метиламин справа, а слева просто R? Разве Зинин не анилин получил этим способом?
Да, спасибо, поправил. В узком смысле реакцией Зинина называют получение именно ароматических аминов, в широком смысле так называют восстановление любых нитросоединений сульфидом аммония.
Здравствуйте! Скажите, пожалуйста, реагируют ли третичные амины с галогеналканами? Если да, то как идет реакция и что получается? Например,при взаимодействии триметиламина с хлорметаном?
Здравствуйте! Реагируют, но дальнейшее замещение по связям N-H не идет.
Здравствуйте! Не показано взаимодействие аминов со спиртами.
Третичные амины с алкилгалогенидами реагируют. Получаются четвертичные аммониевые соли. Говорить, что они вообще не реагируют, неправильно. Они не вступают в реакцию алкилирования.
R3N + RCl = R4N(+)Cl(-)
По такой схеме за счет пары электронов на азоте реагируют алифатические амины, ароматические амины, пиридин с получением N-алкилпиридинийхлорида (иодида) и пр.
Да, спасибо за комментарий. Я имел в виду, что не идет дальнейшее замещение.
спасибо, отличная идея!
для полноты информации я бы добавил оптическую изомерию и примеры этой изомерии ко всем классам органических веществ, потому что на егэ это есть
На ЕГЭ пока оптической изомерии нет.
Admin>Здравствуйте! Реагируют, но дальнейшее замещение по связям N-H не идет.
Читайте также:


