Спирты гомологический ряд кратко
Обновлено: 05.07.2024

В этой статье мы разберемся, какие вещества называют спиртами, а также узнаем о них все, что требует школьная программа по химии за 10 класс.
О чем эта статья:
Спирты — это большая группа химических соединений, производные углеводородов, у которых один или несколько атомов водорода замещены на гидроксильную группу ОН − .
Гидроксильная группа является функциональной группой спиртов.
Классификация спиртов
Спирты классифицируют по различным признакам: по количеству гидроксильных групп; по типу атома углерода, с которым связана гидроксогруппа; а также по строению углеводородного радикала.
По количеству гидроксогрупп
По этому признаку выделяют одноатомные и многоатомные спирты.
У одноатомных спиртов одна группа ОН−. Пример — этиловый спирт (этанол):
У многоатомных — несколько групп ОН − .
Например, предельный двухатомный спирт этиленгликоль (этандиол):

Трехатомный спирт глицерин:

Современное название многоатомных спиртов — полиолы (диолы, триолы и т. д.).
По типу атома углерода, с которым связана гидроксогруппа
Выделяют первичные, вторичные и третичные спирты. Показали примеры каждого вида спиртов в таблице.

По строению углеводородного радикала
По строению углеводородного радикала спирты бывают:
Номенклатура спиртов
По систематической номенклатуре ИЮПАК (IUPAC)
Спиртам дают название по названию углеводорода с добавлением суффикса -ол и цифры, которая показывает положение гидроксильной группы. Для того, чтобы правильно определить, с каким по счету атомом углерода соединена гидроксильная группа, необходимо учитывать следующие правила:
Выбрать самую длинную углеводородную цепь, в состав которой входит гидроксильная группа. Таким образом устанавливают число атомов углерода и соответственно формируют название.
Нумерацию длинной цепи осуществляют с того края, к которому ближе расположена гидроксильная группа.
Местоположение гидроксогруппы в названии определяют написанием цифры после суффикса -ол.

Если в составе спирта присутствуют другие функциональные группы, то нумерация углеродного скелета начинается с того края, где расположена старшая функциональная группа. В таком случае перед названием указывают цифрой, от какого атома углерода идет ответвление.

Радикально-функциональная номенклатура
СH3—OH — метанол или метиловый спирт;
C2H5OH — этанол или этиловый спирт;
Тривиальная номенклатура
Тривиальные названия были даны спиртам по источнику природного получения. Например, метанол называют древесным спиртом, а этанол — винным спиртом. Показали некоторые тривиальные названия спиртов в таблице:

Двухатомные спирты с двумя и тремя гидроксогруппами у одного атома углерода R‒CH(OH)2 или R-C(OH)3 неустойчивы, от них легко отрывается вода и образуется карбонильное соединение.
Классификация по числу углеводородных радикалов у атома углерода при гидроксильной группе
- Первичные спирты – группа ОН соединена с первичным атомом углерода. Например, этанол СН3–СН2–ОН.
- Вторичные спирты – группа ОН соединена с вторичным атомом углерода. Например, пропанол-2: СН3–СН ( СН3)–ОН.
- Третичные спирты – группа ОН соединена с третичным атомом углерода. Например, 2-метилпропанол-2: (СН3)3С–ОН.
- Метанол не относится ни к первичным, ни к вторичным, ни к третичным спиртам.

Классификация по строению углеводородного радикала
- Предельные спирты – группа ОН соединена с предельным радикалом. Например, пропанол-1: СН3–СН2–СН2–ОН.
- Непредельные спирты – группа ОН соединена с непредельным радикалом. Например, алкенолы: СН2=СН–СН2–ОН.
Непредельные спирты, в которых гидроксильная группа соединена с атомом углерода при двойной связи (алкенолы), неустойчивы и изомеризуются в соответствующие карбонильные соединения.
- Ароматические спирты – содержат в радикале ароматическое кольцо, не связанное непосредственно с группой ОН. Например, бензиловый спирт.

В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .

Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:

Поэтому спирты – жидкости с относительно высокой температурой кипения (температура кипения метанола +64,5 о С). Температуры кипения многоатомных спиртов и фенолов значительно выше.
Таблица. Температуры кипения некоторых спиртов и фенола.
| Название вещества | Температура кипения |
| Метанол | 64 |
| Этанол | 78 |
| Пропанол-1 | 92 |
| Бутанол-1 | 118 |
| Этиленгликоль | 196 |
| Фенол | 181,8 |
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:

| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Низшие спирты (метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин) смешиваются с водой в любых соотношениях.
Нумерация ведется от ближайшего к ОН-группе конца цепи.

Например: СН3ОН – метиловый спирт, С2Н5ОН – этиловый спирт и т.д.
- В названиях многоатомных спиртов количество групп ОН указывают суффиксами -диол в при наличии двух ОН-групп, -триол при наличии трех ОН-групп и т.д. После этого добавляют номера атомов углерода, связанных с гидроксильными группами.
Например, пропандиол-1,2 (пропиленгликоль):

Структурная изомерия
Для спиртов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения гидроксильной группы и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета характерна для спиртов, которые содержат не менее четырех атомов углерода.
| Например. Ф ормуле С4Н9ОН соответствуют четыре структурных изомера, из них два различаются строением углеродного скелета |
| Бутанол-1 | 2-Метилпропанол-1 |
 |  |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С2Н6О: этиловый спирт СН3–CH2–OH и диметиловый эфир CH3–O–CH3 |
| Этиловый спирт | Диметиловый эфир |
| СН3–CH2–OH | CH3–O–CH3 |
Изомеры с различным положением группы ОН отличаются положением гидроксильной группы в молекуле. Такая изомерия характерна для спиртов, которые содержат три или больше атомов углерода.
| Например. Пропанол-1 и пропанол-2 |
| Пропанол-1 | Пропанол-2 |
 |  |
Добавить комментарий
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.

Спирты – это производные углеводородов с одной или несколькими гидроксильными группами -ОН (гидроксилами). В зависимости от количества группы -ОН в соединениях выделяют одно-, двух-, трёх- и многоатомные спирты. Рассмотрим одноатомные спирты.
Общее описание
В состав одноатомных спиртов входит несколько групп -СН- и одна гидроксильная группа -ОН. Одноатомные спирты происходят от предельных углеводородов – алканов. При замещении одного атома водорода группой -ОН образуется предельный или насыщенный одноатомный спирт. Поэтому общая формула одноатомных спиртов – CnH2n+1-OH или CnH2n+2O.
Например, этанол, пропанол, бутанол. Наиболее простой одноатомный спирт – метанол – содержит всего один атом углерода (CH3OH). Это первый представитель гомологического ряда одноатомных спиртов.
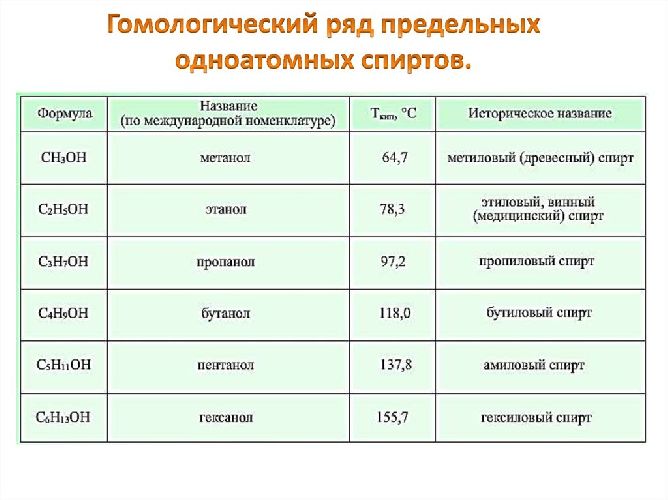
Рис. 1. Гомологический ряд одноатомных спиртов.
Химические и физические свойства спиртов обусловлены наличием гидроксила – функциональной группы.
Изомерия
Для одноатомных спиртов характерны два типа изомерии:
- структурная – изомерия углеродного скелета и положение гидроксильной группы;
- межклассовая с простыми эфирами.
Изомерия углеродного скелета характерна спиртам с четырьмя и более атомами углерода. Например, изомеры бутанола (C4H9OH):
В зависимости от положения группы -ОН в молекуле выделяют три группы насыщенных спиртов:
- первичные – гидроксил присоединён к первому атому углерода;
- вторичные – гидроксил присоединён ко второму атому углерода;
- третичные – гидроксил присоединён к третьему атому углерода.
Первая цифра в названии спирта указывает на положение метильной группы -CH3. Второе число показывает, где находится гидроксил.
Получение
Существует несколько способов получения насыщенных спиртов:
-
гидратация алкенов – присоединение воды:
Свойства
Насыщенные спирты, содержащие не более 15 атомов углерода, – жидкости, более 15 – твёрдые вещества. Метанол, этанол, пропанол-2 хорошо смешиваются с водой. Насыщенные спирты имеют высокие температуры плавления и кипения.
Химические свойства предельных спиртов зависит от типа разрываемой связи. С разрывом связи О-Н протекают реакции:
-
со щелочными металлами –
Реакции с разрывом С-О связей:
-
дегидратация в присутствии катализатора –
Насыщенные спирты имеют применение в химической и пищевой промышленности. Из спиртов производят растворители, кислоты, медикаменты, топливо.
Что мы узнали?
Из урока химии 10 класса узнали, что такое одноатомные спирты. Производные углеводородов, содержащие одну гидроксильную группу, называются насыщенными или предельными одноатомными спиртами. Для них свойственна межклассовая и структурная изомерия. Одноатомные спирты получают из алкенов, алкилгалогенидов, альдегидов, кетонов, глюкозы. Это активные вещества, вступающие в реакцию с кислородом, активными металлами, кислотами. Применяются для изготовления растворителей, топлива, кислот.

Одноатомные спирты
Ключевые слова конспекта: Функциональная группа. Спирты. Предельные одноатомные спирты. Изомерия положения функциональной группы. Водородная связь. Реакция этерификации.
Этиловый спирт и его действие на организм
Изготавливать алкогольные напитки люди научились ещё до нашей эры. С давних времён способ получения вин сбраживанием фруктовых соков дошёл до наших дней.
Дурманящий компонент алкогольных напитков впервые был выделен алхимиками только в XI в. и получил название aqua vitae — жизненная вода. Вскоре за ним закрепилось название винный спирт. Употребление алкоголя нашими предками преследовало практическую цель: за счёт вина, разбавленного водой, или пива организм получал до 25 % энергии. До сих пор можно услышать, как пиво за его калорийность называют жидким хлебом.
Коварство алкогольных напитков заключается в том, что они очень быстро вызывают привыкание, а их токсическое действие на организм проявляется не сразу. Однозначно доказано, что любое, даже незначительное, употребление алкоголя вредит здоровью человека. При попадании винного спирта в организм происходят психические и неврологические изменения, снижаются острота мышления и чёткость восприятия, формируется неадекватное поведение. Кроме этого, под действием алкоголя происходит обезвоживание организма, кровеносные сосуды расширяются, усиливается ток крови в капиллярах, в результате чего появляется ощущение тепла и покраснение кожи. В больших количествах алкоголь приводит к тяжёлым отравлениям и гибели клеток печени.
Химическое название винного спирта вам уже знакомо: этиловый спирт, или этанол. Его химическая формула С2Н5ОН. Его молекулы содержат функциональную гидроксильную группу —ОН.
Гомологический ряд предельных одноатомных спиртов
Этиловый спирт относится к одному из классов кислородсодержащих органических соединений — спиртам.

В молекуле этилового спирта содержится одна гидроксильная группа, связанная с остатком предельного углеводорода — этильным радикалом. Именно поэтому этиловый спирт относится к гомологическому ряду предельных одноатомных спиртов. Их состав соответствует общей формуле CnH2n+1OH.
Этиловый спирт, содержащий в молекуле два углеродных атома, является вторым представителем предельных одноатомных спиртов. Родоначальник гомологического ряда — метиловый спирт СН3ОН.
Химические формулы и названия первых представителей гомологического ряда предельных одноатомных спиртов приведены в таблице.

Номенклатура и изомерия спиртов
По международной номенклатуре названия спиртов образуют от названия соответствующего алкана с добавлением суффикса -ол, указывающего на принадлежность вещества к данному классу органических соединений. Обратите внимание, что при составлении названия спиртов углеродные атомы нумеруют с того конца цепи, к которому ближе гидроксильная группа.
Два последних спирта (см. табл.) обладают одной и той же молекулярной формулой С3Н7ОН, а вот химическое строение у них различное. Пропанол-1 и пропанол-2 — это изомеры, различающиеся положением функциональной группы в молекуле. Это ещё один вид структурной изомерии.

Физические свойства спиртов
В отличие от углеводородов, гомологические ряды которых начинаются с газообразных веществ, в ряду предельных одноатомных спиртов нет газов. Кроме того, в противоположность углеводородам, практически нерастворимым в воде, спирты с числом углеродных атомов от 1 до 4 смешиваются с водой в любых соотношениях. Оба эти свойства обусловлены способностью спиртов за счёт гидроксильных групп образовывать между молекулами особые связи, которые называют водородными связями.

За счёт водородных связей молекулы спиртов ассоциированы в жидкости (рис. 23, а) и хорошо растворимы в воде (рис. 23, б).
Спирты — прекрасные растворители органических веществ.
Способы получения спиртов

В промышленности спирты получают присоединением воды к этиленовым углеводородам. Например, в присутствии кислот этилен вступает в реакцию гидратации с образованием этилового спирта:

Ввести в молекулу органического вещества гидроксильную группу можно и с помощью реакции замещения. Так, при обработке галогеналканов водным раствором щёлочи атом галогена замещается группой ОН:
Химические свойства спиртов
Подобно большинству органических веществ, спирты горят. Пламя, образующееся при горении спиртов с небольшим числом атомов углерода в молекуле, бледно-голубое, практически не коптит, при горении выделяется большое количество теплоты:
Горючесть спиртов позволяет использовать их в качестве добавки к автомобильному бензину. В некоторых странах (Бразилия, США, Венесуэла) миллионы автомобилей адаптированы к использованию в качестве топлива чистого этанола.
Данную реакцию можно использовать для обнаружения спиртов.
Из курса химии основной школы вам известно, что вода бурно реагирует с активными металлами (щелочными, щелочноземельными) с выделением водорода:
2Н—О—Н + 2Na = 2NaOH + H2↑

По строению молекулы спиртов напоминают молекулы воды, только вместо одного из двух атомов водорода они содержат углеводородный радикал. Как и вода, спирты способны взаимодействовать со щелочными металлами. При этом также выделяется водород и образуется производное спирта, подобное солям:

Ещё одно важное свойство спиртов — взаимодействие с карбоновыми кислотами с образованием сложных эфиров:
Реакцию образования эфира называют реакцией этерификации.
Применение спиртов
Область применения спиртов чрезвычайно широка. Метанол используют в качестве сырья для производства формальдегида, уксусной кислоты, пластмасс, лекарственных веществ. В некоторых странах его также используют как добавку к моторному топливу. В нашей стране в этих целях метанол не используют. Он очень ядовит! Уже 5—7 мл метанола, попавшие в организм, вызывают полную потерю зрения в результате поражения сетчатки глаза, а 30 мл и более могут привести к летальному исходу.
Этиловый спирт благодаря своей растворяющей способности используют в качестве растворителя лаков и красок. Также его применяют как компонент моющих жидкостей, в парфюмерной и фармацевтической промышленности. Кроме того, этиловый спирт широко применяют в медицине для дезинфекции, компрессов, обтираний и др.
На основе этилового спирта в промышленности получают десятки органических веществ: сложные эфиры, галогенпроизводные углеводородов, уксусную кислоту. Помимо спиртных напитков, этанол в небольших количествах содержат и продукты, получаемые брожением: кефир (0,1—0,2 %), квас (0,5—1 %), кумыс (до 3 %).
Читайте также:

