Резидентная микрофлора это кратко
Обновлено: 08.07.2024
В 1681 году А.В.Левенгук сделал эпохальное научное открытие. Он обнаружил микроорганизмы в фекалиях и выдвинул гипотезу о совместном существовании различных видов микроорганизмов в желудочно-кишечном тракте (ЖКТ). В дальнейшем воззрения на микрофлору человека менялись. От негативного мнения И.И.Мечникова, представлявшего причину инфекционных болезней совокупным воздействием на организм токсинов бактерий пищеварительного тракта, до резко позитивного мнения о той пользе, которую получает человек от совместного существования организма и бактерий.
В настоящее время микрофлору кишечника рассматривают как самостоятельный дополнительный многоклеточный орган, участвующий в гомеостазе – динамическом постоянстве внутренней среды организма, обеспечивающей сбалансированную работу всех органов и систем. Общая численность микроорганизмов, обитающих в различных отделах человеческого организма 10 15 (100 трлн) на 2 порядка больше, чем клеток человека. Вес нормальной микрофлоры составляет 5-6% веса организма. Из них 60% находится в желудочно-кишечном тракте, 15% – в респираторном тракте, 11% – в мочеполовой системе, 14% – на кожных покровах человека. В толстой кишке обитает более 1000 видов микробов. Причем, общее количество генов кишечной микробиоты (совокупности бактерий, вирусов, грибков и простейших, заселяющих полости и покровы человека) ~ 10 6 ,что на 2 порядка больше, чем генов человека.
Нормальная микробиота кишечника – это1 800 родов и 15 000–36 000 видов бактерий. На питание микрофлоры расходуется около 20% питательных веществ, поступающих в кишечник и 10%, вырабатываемой организмом энергии.
Кишечная микрофлора состоит из двух взаимосвязанных популяций: полостная и пристеночная (мукозная) микрофлора. Мукозная микрофлора– это колонии бактерий, продуцируемые ими метаболиты, а также эпителиальные клетки, муцин бокаловидных клеток, фибробласты, лейкоциты, лимфоциты, иммунные клетки. Просветная микрофлора находится в просвете ЖКТ, не взаимодействует со слизистой оболочкой, более изменчива, зависит от поступления пищевых волокон. Нормальная микрофлора толстой кишки состоит из облигатной, факультативной и транзиторной флоры. Облигатная флора (постоянная), содержит бифидобактерии, лактобациллы, энтерококки, кишечную палочку, пропионибактерии, пептострептококки. Факультативная (непостоянная) – клостридии, стафилококки, протеи, дрожжеподобные грибы. Транзиторная (случайная) – синегнойную палочку, грибы рода Кандида, патогенные энтеробактерии.
Микрофлора желудочно-кишечного тракта многообразна.
Микрофлора полости рта – стрептококки, лактобациллы, нейссерии, вейонеллы, фузобактерии, бактероиды, бифидобактерии, стафилококки, грибы, простейшие и др.Микрофлора желудка и 12-перстной кишки – стрептококки, лактобациллы, энтерококки. Микрофлора тонкой кишки – стрептококки, лактобациллы, бифидобактерии. Микрофлора толстой кишки содержит анаэробы: бифидобактерии, бактероиды, пропионибактерии, пептострептококки, вейонеллы, эубактерии, фузобактерии, катенобактерии; микроаэрофиллы: лактобациллы и аэробы: эшерихии, молочнокислый стрептококк, фекальные стрептококки, стафилококки.
В норме в бактериоценозе толстой кишки детей 90-95% общего количества микроорганизмов составляют бифидобактерии, а у взрослых их уже не более 10%.
Функции кишечной микрофлоры это: защитная, пищеварительная, детоксикационная, антиканцерогенная, иммуногенная, генетическая, функции регуляции обмена холестерина и синтеза витаминов.
Что же такое дисбактериоз и когда он возникает?
Дисбактериоз (дисбиоз) – клинико-микробиологический синдром, характеризующийся стойкими и выраженными изменениями качественного и/или количественного состава микрофлоры кишечника, неисчезающими после устранения неблагоприятного фактора, сопровождающийся расширением сферы ее обитания (заселением тонкой кишки) и нарушением кишечных функций. Дисбактериоз кишечника всегда вторичен, возникает, обычно, на фоне неблагоприятных внешних факторов и патологических состояний, и, следовательно, не может являться основным диагнозом.
Причины дисбактериоза кишечника различны и многообразны. К ним относятся нерациональное питание и нерациональная антибиотикотерапия, хронические заболевания ЖКТ, острые инфекционные заболевания ЖКТ, гнойно-инфекционные заболевания, иммуннодефицитные состояния, стрессы.
Пути поддержки и коррекции кишечной микрофлоры: устранение причин дисбактериоза, пребиотики в питании, пробиотики в составе продуктов, пробиотики в составе препаратов, для младенцев – сохранение грудного вскармливания.
Пробиотики – препараты (лекарства), состоящие из живых непатогенных микроорганизмов. Существуют различные типы пробиотиков:
- монокомпонентные (бифидумбактерин, лактобактерин);
- поликомпонентные или симбиотики, содержащие несколько штаммов или видов бактерий (линекс);
- комбинированные – синбиотики, содержащие бактерии и ингредиенты, способствующие их росту или размножению (аципол, кипацид, нормоспектрум, бифидум-мульти);
- поликомпонентные комбинированные – симбиотик+синбиотик (бифиформ, бион);
- конкурентного действия, вытесняющие условно-патогенные и патогенные микробы (энтерол, бактисубтил, биоспорин, бактистатин).
Пребиотики – лекарственные средства, пищевые волокна или добавки к пище, не содержащие живых микроорганизмов, стимулирующие рост или размножение нормальной микрофлоры:
- олигосахариды – крупы, фасоль, молочные продукты;
- инулин – топинамбур, артишок, одуванчик; – дюфалак, нормазе.
Решение проблемы дисбактериоза связано с необходимостью оберегать собственную микрофлору, способствовать улучшению экологии, питания, рациональному применению антибиотиков и других лекарственных средств.
Современные представления о микрофлоре человека: что такое дисбактериоз? : применяемые препараты безрецептурного отпуска 2

Резидентная микрофлора кишечника может помочь останавливать развитие инфекций, однако механизмы этого явления до конца не изучены. Как удалось выяснить, определенные изменения в микробиоме, происходящие после заражения, способствуют повышению концентрации одного соединения, которое играет ключевую роль в борьбе с вредоносными бактериями.
Принято считать, что микробиота может препятствовать колонизации кишечника патогенами [4], и существуют доказательства, подтверждающие идею о том, что микробиота кишечника может играть роль в ограничении развития патогенов. Например, длительный прием и/или высокие дозы антибиотиков способствуют распространению Clostridium difficile [5], бактерии, вызывающей тяжелую форму диареи и воспаление толстой кишки, что приводит к повышению риска развития тяжелого декомпенсированного состояния и даже летального исхода. Низкое разнообразие видов, присутствующих в микробиоте, — характеристика, обычно наблюдаемая у жителей промышленно развитых стран, — связана с повышенной восприимчивостью к инфекционным заболеваниям [6]. Более того, мыши, которых лечили антибиотиками или выращивали в стерильных условиях (следовательно, они были лишены микробиоты), более восприимчивы к кишечным патогенам, чем мыши с нормальной микрофлорой [7].
Наоборот, отдельные формы микробиомов могут способствовать росту патогенов или высоковирулентной инфекции. Например, различные микробиоты мышей определяют восприимчивость к патогену Citrobacter rodentium, вызывающему аномальный рост эпителиальных тканей в толстой кишке (гиперплазию) [8]. Трансплантация микробиоты восприимчивых мышей особям, не чувствительным к инфекциям, приводит к развитию инфекции C. rodentium, тогда как трансплантация микробиоты от нечувствительных восприимчивым животным приводит к устойчивости к инфекции [8]. Согласно эпидемиологическим данным, восприимчивость к инфекциям, вызываемым пищевым патогеном Campylobacter jejuni, у жителей Швеции зависит от видового состава их микробиоты [9]. Подчеркивается, что определенные кишечные патогены, такие как Salmonella enterica и C. rodentium, используют сигналы микробиома хозяина для точной модуляции своего метаболизма и выработки энергии с помощью процессов клеточного дыхания. Также, воспринимая эти сигналы и отвечая на них, патогены могут повышать или снижать степень экспрессии компонентов своих факторов вирулентности, которые используются для колонизации кишечника организма хозяина [10–12].
Сейчас начаты уникальные исследования о роли микробиоты в развитии инфекций. Такая работа выходит за рамки обычной фиксации корреляции между инфекцией и наличием или отсутствием видов или различий видового состава. Раскрываются механизмы, с помощью которых определенный состав микробиоты обеспечивает устойчивость к инфекции или способствует проникновению патогенов.
Stacy с соавт. сообщают, что после заражения кишечным патогеном Klebsiella pneumoniae у мышей повышается способность противостоять последующему заражению этой бактерией (рис. 1). Чтобы попытаться разобраться в механизме, лежащем в основе вышесказанного, авторы проанализировали микробную ДНК, проводя оценку метагеномов (т. е. всех микробных генов, обнаруженных в сообществе) в постинфекционных и нативных микробиотах (тех, которые ранее не подвергались воздействию бактерии), чтобы определить, как микроорганизмы могут способствовать сопротивлению колонизации. Команда ученых выявила, что гены, кодирующие белки, необходимые для метаболизма серосодержащих молекул, таких как таурин, оказались в значительно большей степени обогащены (имеется в виду обмен генетической информацией между бактериями посредством плазмид — прим. перев.) у постинфекционных микробиот, чем у нативных микробиот.
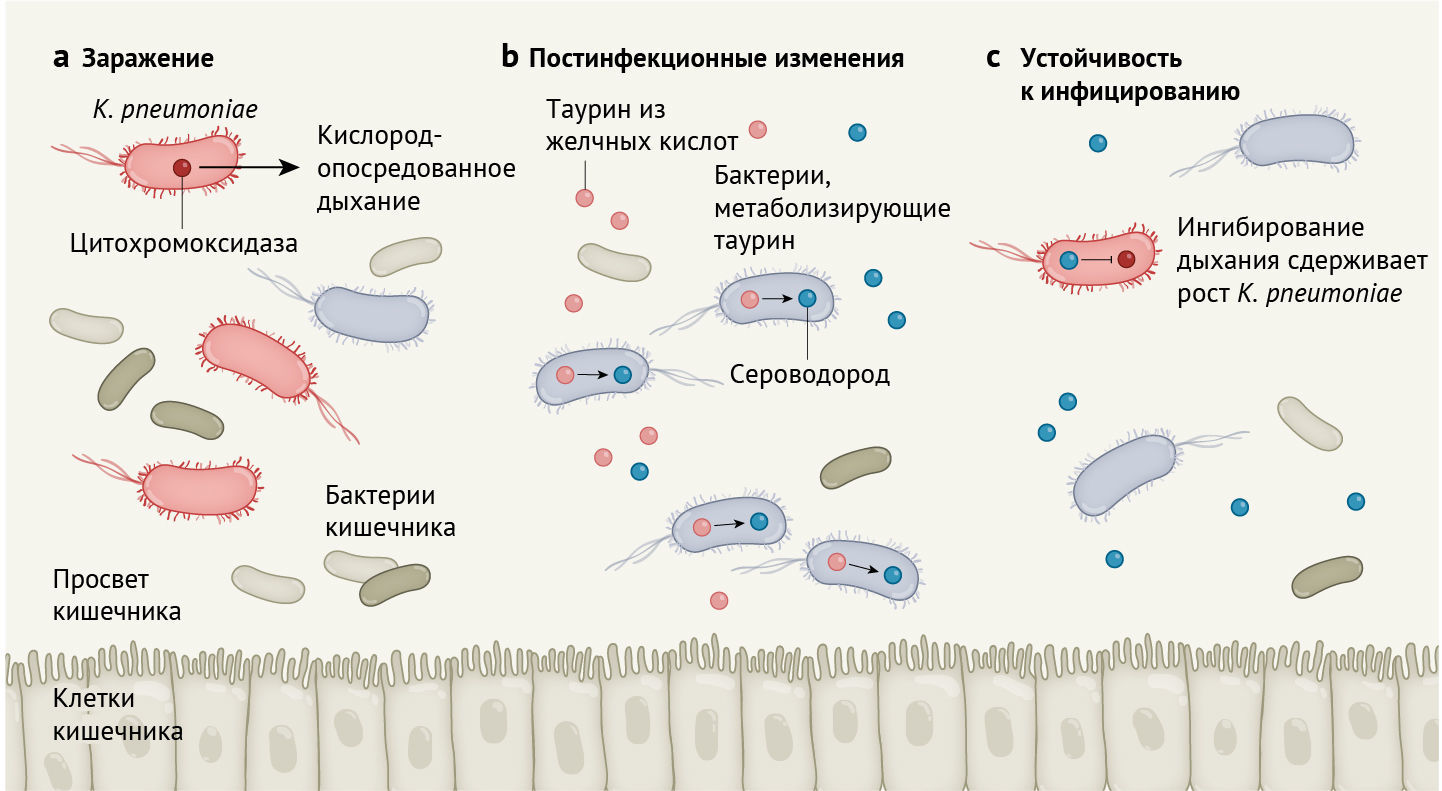
Желчные кислоты вырабатываются в печени и хранятся в желчном пузыре. Они являются основным источником таурина в кишечнике. Они выделяются в кишечник, способствуя перевариванию жиров и масел из пищи. Отдельные представители микробиоты расщепляют желчные кислоты, высвобождая таурин, который может служить источником энергии для других кишечных бактерий. Использование таурина в метаболических путях бактерий приводит к образованию сероводорода как побочного продукта. Высокие концентрации сероводорода могут подавлять активность ферментов цитохромоксидаз, которые катализируют реакции, происходящие во время кислородозависимого (аэробного) дыхания.
Кишечные патогены часто используют кислород, генерируемый хозяином, для получения энергии посредством аэробного дыхания и таким образом закрепляют свою колонизацию организма-хозяина [13]. Stacy с соавт. сообщают о корреляции между таурин-опосредованным синтезом сульфидов (в том числе сероводорода) микробиотой после инфекции и сопутствующим ингибированием дыхания патогена, что в итоге подавляет инфицирование патогеном. Авторы зафиксировали этот эффект у двух патогенов (K. pneumoniae и C. rodentium), что позволяет предположить, что постинфекционный микробиом обеспечивает широкий спектр защиты от последующих контаминаций бактериями. Stacy с соавт. отмечают, что добавление таурина в воду для питья животным способствовало развитию аналогичных эффектов. Таурин — обычный компонент энергетических напитков, и открытие его роли в функционировании микробиома кишечника выглядит захватывающе. Более глубокое понимание таких механизмов могло бы открыть поле для точных манипуляций с микробиотой для борьбы с некоторыми инфекционными заболеваниями.

Микроорганизмы также бывают облигатными (бифидобактерии, бактероиды, пропионовокислые бактерии, лактобактерии кишечная палочка, стрептококки) то есть являться основными представителями микрофлоры, факультативными (условно-патогенные микробы и сапрофиты) и транзиторными, которые не способны длительно жить в организме человека.
Микрофлора желудочно-кишечного тракта
Облигатная микрофлора желудочно-кишечного тракта представлена бифидобактериями, лактобактериями, кишечной палочкой, пропионобактериями, стрептококками, энтерококками, эубактериями и бактероидами. Сейчас ученые склоняются ко мнению, что хеликобактер пилори также является облигатной микрофлорой желудка.
Лактобактерии обитают во всех отделах ЖКТ и их количество так же высоко, как и у бифидобактерий. Роль этих микроорганизмов для человека трудно переоценить. Они подавляют рост и размножение патогенных и условно-патогенных микроорганизмов, стимулируют иммунную систему, участвуют в пищеварении.
Кишечная палочка, или эшерихия коли, так же как и лактобактерии заселяет организм ребенка в первые дни после рождения. Эшерихия коли образует в толстом отделе кишечника пленку, прилипая к ворсинкам эпителия. Благодаря такой пленке болезнетворным микробам очень трудно закрепиться в организме. Количество кишечной палочки в толстой кишке варьирует от 10 6 до 10 8 КОЕ/г.
Пропионобактерии обладают активными анатагонистическими свойствами против патогенных и условно-патогенных бактерий, таким образом принимая участие в иммунных процессах. Пептострептококки лизируют (расщепляют) молочные белки, а также участвуют в ферментации углеводов (сахаров).
Энтерококки относят к условно-патогенным микробам, но в то же время в организме человека они выполняют важную миссию – тренируют иммунитет. Содержание этих бактерий колеблется от 10 6 до 10 9 КОЕ/г.
Микрофлора влагалища

Колебания гормонального фона происходят у женщины на протяжение всей жизни. Поэтому колебания состава микрофлоры происходят регулярно. Эстрогены (женские половые гормоны) участвуют в образовании гликогена, который в свою очередь регулирует количество лактобактерий, а соответственно и кислотно-щелочной баланс. В зависимости от этого во время беременности, менопаузы, в разные периоды менструального цикла микрофлора может претерпевать значительные изменения.
В первые часы жизни влагалище новорожденной девочки стерильно. Затем начинает накапливаться гликоген, который является замечательным пищевым субстратом для лактобактерий. И эти бациллы начинают активно размножаться, расщепляя гликоген до молочной кислоты. В связи с увеличением концентрации молочной кислоты рН сдвигается в кислую сторону, что препятствует размножению некислотоустойчивых бактерий. Различные виды лактобактерий составляют основную массу микрофлоры влагалища (до 95%). Когда меняется гормональный фон, то и кислотность среды изменяется, предоставляя возможность другим микроорганизмам колонизировать новую среду обитания. Так во влагалище появляются стрептококки, стафилококки, дифтероиды.
Кроме вышеперечисленных бактерий во влагалище встречаются также бифидобактерии, превотеллы, пропионобактерии, клостридии, гарднереллы, кандиды и могут даже присутствовать в норме кишечные палочки (у 30-40% женщин). И если во влагалище взрослых женщин бифидобактерии высеваются приблизительно у каждой десятой, то пептострептококки обитают у каждой третей, а по некоторым данным — и у 90% женщин.

Микрофлора кожи подушечек пальцев рук — это совокупность живых организмов и бактерий, обитающих на поверхности кожи человека [1].
Микрофлора кожи рук: I. Резидентная (нормальная) микрофлора — это микроорганизмы, постоянно живущие и размножающиеся на коже. II. Транзиторная микрофлора — это неколонизирующая микрофлора, приобретённая медицинским персоналом в процессе работы в результате контакта с инфицированными объектами окружающей среды.
Резидентная микрофлора стимулирует образование антител и препятствует заселению кожи грамотрицательными микроорганизмами. Обитает в роговом слое кожи, находится в волосяных фолликулах, сальных, потовых железах, в области ногтевых валиков, под ногтями, между пальцами. Она преимущественно представлена кокками: эпидермальным и другими видами стафилококков, дифтероидами, пропионибактериями. Ее невозможно полностью удалить при обычном мытье рук и обработке антисептиками.
Транзиторная микрофлора. Представлена преимущественно микроорганизмами, находящимися во внешней среде учреждения, опасными в эпидемиологическом отношении: патогенные микроорганизмы (сальмонеллы, шигеллы, ротавирусы, вирусы гепатита А и др.); условно-патогенные микроорганизмы: — грамположительные (стафилококки золотистый и эпидермальный); грамотрицательные (кишечная палочка, клебсиеллы, псевдомонады); грибы (кандиды, аспиргиллы). Сохраняется на руках не более 24 часов и может быть удалена путем обычного мытья рук и обработки антисептиками. Наиболее загрязненными участками кожи рук являются: подногтевое пространство; околоногтевые валики; подушечки пальцев [3].
Более ста лет важнейшим способом предупреждения распространения инфекции считают мытье рук. Подобно другим установившимся традициям эта процедура в настоящее время стала ритуалом и догмой. В середине XVIII столетия была продемонстрирована важность дезинфекции кожи рук для предупреждения распространения возбудителей инфекционных болезней. Но и сегодня многие вопросы относительно оптимальных средств и способов мытья рук и обработки кожи все еще остаются актуальными. Так давайте же разберемся какие средства дезинфекции являются наиболее эффективными в борьбе с микроорганизмами.
Цель исследования — определение чувствительности микрофлоры кожи человека к средствам дезинфекции.
Материал иметоды
Для эксперимента задействовали 10 студентов медицинского университета в возрасте от 18 до 20 лет.
Исследование проводили в 2 этапа:
I этап. Для исследования брали 5 чашек Петри с мясопептонным агаром. Каждую их них делили на 3 части, что соответствовало трем состояниям чистоты рук:
1) предварительно немытые руки;
2) руки, помытые с мылом;
3) руки, помытые с мылом и обработанные спиртом.


Далее в каждую секцию на питательную среду прикладывали три пальца на 2 минуты в соответствии с обозначениями.
После этого чашки ставили в термостат на 20 часов при температуре 37ᵒС.
II этап. Через сутки осматриваем чашки Петри и сравниваем количество, а также разнообразие колоний микробов, выросших из отпечатков пальцев.
Результаты и обсуждения
В результате макроскопического исследования были выявлены белые, непрозрачные, точечные колонии округлой формы, с гладкой поверхностью и ровными краями [4–6].
Читайте также:

