Регенерация нервных волокон кратко
Обновлено: 02.07.2024
1. Гомазков О.А. Нейрогенез, как адаптивная функция мозга. – М.: И-т биомедицинской химии, 2014. – 85 с.
2. Григорян А.С., Кругляков П.В. Клеточная терапия при травме мозга // Клет. трансплантология и тканевая инженерия. – 2008. Т.4, № 1. – С. 35–42.
3. Коржевский Д.Э. Петрова Е.С., Кирик О.В., Безлин Г.В., Сухорурока Е.Г. Нейральные маркеры, используемые при изучении дифференцировки стволовых клеток // Клет. трансплантология и тканевая инженерия. – 2010. – Т.5, № 3. – С. 57–63.
4. Коржевский Д.Э., Кирик О.В., Григорьев И.П., Сухорукова Е.Г. Сырцова М.А. Маркирование дифференцирующихся нервных клеток при изучении развития и патологии головного мозга // Вопросы морфологии ХХI века. – 2015. – Вып. 4. – С. 34–36.
5. Обухов Д.К., Пущина Е.В. Радиальная глия – как источник новых нейронов в постнатальном развитии ЦНС // Межд. журн. экспер. обр. – 2011. – № 6. – С. 10–11.
6. Обухов Д. К., Пущина Е. В., Вараксин А. А. Структура пролиферативных зон в ЦНС взрослых позвоночных животных // Вопросы морфологии ХХI века. – 2015. – Вып. 4. – С. 43–51.
7. Полежаев Л.В., Александрова М.А., Витвицкий В.Н. Трансплантация ткани мозга в биологии и медицине. – М.: Наука, 1993. – 239 с.
8. Пущина Е.В., Вараксин А.А., Обухов Д.К. Газообразные посредники в головном мозге симы // Журн.эвол.физиол. и биох. – 2012. – Т. 48. – С. 85–96.
9. Пущина Е.В., ,Вараксин А.А., Обухов Д.К. Репаративный нейрогенез в мозге и изменения в зрительном нерве взрослой форели после механического повреждения глаза // Онтогенез. – 2016. – Т. 47, № 1. – С. 1–24.
10. Семченко В.В., Еринеев С.И., Степанов С.С. Сергиенко Г.Г. Трансплантация незрелой нервной ткани в экспериментальной и клинической неврологии. – Омск: Омский дом печати, 2000. – 340 с.
11. Семченко В.В.. и др., Регенеративная биология и медицина. Книга I. Генные технологии и клонирование / под. ред, В.П. Пузырева и др. – Омск. 2012. – 296 с.
12. Яковлев А.В., Ситдикова Г.Ф. Физиологическая роль сероводорода в нервной системе // Гены и клетки. – 2014. – Т.9, № 3. – С. 34–44.
13. Ярыгин К.Н., Ярыгин В.Н.. Нейрогенез в центральной нервной системе и перспективы регенеративной неврологии // Журнал неврологии и психиатрии им. С. С. Корсакова. – 2012. – Т. 112, № 1. – С. 4–13.
14. Ярыгин К.Н. и др., Регенеративная биология и медицина Книга II. Клеточные технологии в терапии болезней нервной системы / под ред. В.Н. Ярыгина и др. – Екатеринбург-Омск, 2015. – 360 с.
15. Cameron HA, McKay RD. Adult neurogenesis produces a large pool of new granule cells in the dentate gyrus // J Comp Neurol. – 2001. – Vol. 435. – P. 406–417.
16. Grandel H , Brand M. Comparative aspects of adult neural stem cell activity in vertebrates // Dev. Genes Evol. – 2013. – Vol. 223. – P. 131–147.
17. Pinto L., Götz M. Radial glial cell heterogeneity–The source of diverse progeny in the CNS // Progress in Neurobiology. – 2007. – Vol. 83. – P. 2–23.
18. Pushchina E.V., Obukhov D.K., Varaksin A.A., Shukla S. Neurochemical signaling and participation of H2S and NO in fishes adult neurogenesis // Nitric Oxide. – 2014. – Vol. 39 (Suppl). – P. 41–43.
19. Pushchina E.V., Obukhov D.K., Varaksin A.A. Structure, сhemoarchitectonics and postembryonic histogenesis of a central nervous system in a teleost fish // In book:Teleosts: Evolutionary Development, Diversity and Behavioral Ecology / Ed. Carone S. New York: – Nova Science Publishers Inc. – USA, 2014. – Ch. 5. – P. 97–152.
20. Pushchina E. V., Varaksin A. A., Obukhov D. K. Participation of neurochemical signaling in adult neurogenesis and differentiation // In book: Neurochemistry (edt. Th.Heinboocken). 2014. – Intech Corp. USA. Ch.8. – P. 225–255.
21. Pushchina E. V., Varaksin A. A., Obukhov D. K. Cystathionine β-Synthase in the CNS of Masu Salmon Oncorhynchus masou (Salmonidae) and Carp Cyprinus carpio (Cyprinidae) // Neurochemical Journal. – 2011. – Vol. 5. – P. 24–34.
22. Pushchina E.V., Obukhov D.K. Is the brain of cherri salmon a new model for investigation of postembryonic neurogenesis? // Engineering. Supplement. – 2012. – P. 76–79.
24. Zupanc G Towards brain repair: insights from teleost fish // Seminars in Cell & Developmental Biology. – 2009. – Vol. 20. – P. 683–690.
25. Zupanc G.K.H., Sîrbulescu R.F. Teleost Fish as a Model System to Study Successful Regeneration of the Central Nervous System // Current Topics in Microbiology and Immunology. – 2013. – Vol. 367. – P. 193–233.
Введение. Проблема физиологической и репаративной регенерации нервной системы всегда была в центре внимания нейробиологов и неврологов. В конце ХХ века большое количество исследований было посвящено исследованию трансплантации нервной ткани. (Полежаев и др., 1993; Семченко и др., 2000). Однако, несмотря на определенные достижения, полноценного приживления нервной ткани и восстановления функциональных связей при разного видах алло- и ксенотрансплантациях достигнуть не удалось.
Открытие нейрональных стволовых клеток (НСК), их обнаружение во взрослой нервной системе позвоночных животных и человека и развитие клеточных технологий позволило по новому взглянуть на эту проблему (Семченко и др. 2012; К.Н. Ярыгин, В.Н. Ярыгин, 2012; Ярыгин и др., 2015). В данной работе приводится краткий обзор собственных и имеющихся в литературе данных по регенерации нервной ткани в норме и в условиях эксперимента.
Нейрональные стволовые клетки (НСК) относятся к группе тканеспецифичных или региональных стволовых клеток. Они обладают характеристиками самоподдерживающейся популяции клеток, которые при дифференцировке способны давать нейроны, астроциты и олигодендроциты в развивающемся и взрослом мозге. Впервые они были обнаружены в ЦНС человека в 1995 году при анализе посмертных срезов мозга, окрашенных иммунногистохимически на BrdU (бромдезоксиуридин) (Gage et al., 1995). В настоящее время найден целый ряд нейрональных маркеров, которые позволяют более или менее надежно идентифицировать НСК и их потомки. Среди них следует отметить: ядерный антиген нервных клеток – NeuN; маркер нейробластов – даблкортин (DCX); нейрон-специфическую энолазу – NSE; молекулы адгезии нервных клеток – PSA-NCAM; цитоскелетные белки – нестин, β-тубулин III; транскрипционные факторы – Sox-1, Sox-2, Dlx2, Pax 6 и ряд других. Часть из этих маркеров специфична для клеток нервной ткани, другие направлены на выявление свойств, характерных для разных популяций стволовых клеток. (Гомазков, 2014; Коржевский и др., 2010, 2015).
Обнаружение НСК как в развивающемся, так и во взрослом мозге поставило вопрос об их происхождении. В ранний период эмбрионального развития НСК происходят из клеток нейроэпителия, которые путем симметричного и асимметричного деления дают начало нейронам, глиальным клеткам и клеткам-предшественникам, которые включаются в процессы нейрогенеза на более поздних этапах развития, включая постнатальный период. Характер деления клеток – один из механизмов выбора НСК путей развития. В случае симметричного митоза образуются две одинаковые дочерние клетки, которые либо сохраняют пролиферативный потенциал – т.е. остаются стволовыми, либо могут уйти на путь нейрогенеза или глиогенеза – опять же обе. При втором варианте симметричного деления популяция стволовых клеток может потерять способность к самообновлению и истощится. При ассиметричном делении одна клетка остается пролиферативной (стволовой), другая выходит в дифференцировку. При этом пул НСК сохраняется.
Таким образом, во взрослом мозге позвоночных животных и человека сохраняются группы клеток-предшественников, которые обладают свойствами НСК и способны в течение длительного периода обновлять популяции нейронов и глии.
Особо следует отметить, что сами НСК способны синтезировать и секретировать подобные вещества, действующие в данном случае по типу пара- или аутокринной регуляции.
Организация пролиферативных зон в мозге млекопитающих. Зоны взрослого нейрогенеза у млекопитающих, включая приматов, обнаружены в субвентрикулярной зоне (SVZ) латеральных мозговых желудочков конечного мозга и в субгранулярной зоне (SGZ) зубчатой фасции гиппокампа. Наличие подобных зон в других отделах ЦНС млекопитающих в настоящее время не доказано, а имеющиеся данные носят крайне противоречивый характер. (Ярыгин и др., 2014; Ярыгин, Ярыгин, 2012). Субвентрикулярная зона (SVZ) образована несколькими слоями клеток (от двух до пяти), в составе которых выделяют несколько типов клеток. Скорость увеличения числа новых клеток в зубчатой извилине гиппокампа (SGZ) взрослого мозга определяется как 9000 единиц в течение суток, что составляет примерно 6 % от ощего количества нейронов в зубчатой фасции гиппокампа крысы.или около 250 тысяч в месяц. (Cameron, McKay, 2001). Вновь образованные нервные клетки мигрируют на места своей локализации в данной структуре мозга, формируют систему отростков и синапсов и встраиваются в функциональные нейронные сети. Cледует отметить, что, хотя факт интеграции новых нейронов в существующие нейронные сети доказан, функциональные аспекты этого процесса во многом еще неясны.
В этом плане весьма интересным является обнаружение подобных пролиферативных зон в разных отделах головного мозга у представителей других групп позвоночных животных (рыб, амфибий, птиц). Взрослый нейрогенез у этих животных идет более интенсивно и дольше, чем у млекопитающих. (Обухов и др., 2015; Puschina et al., 2014; Grandel, Brand, 2013).
Взрослый нейрогенез и перспективы репаративной регенерации нервной ткани. Исследование последствий ишемии мозга показали, что она сопровождается усилением нейрогенеза в пролиферативных зонах и миграцией молодых клеток в зону повреждения. (Гомазков, 2014; Solway et al., 1998). Эти данные вызвали целую серию работ, направленных на изучение возможности использования НСК и их потомков для трансплантации в поврежденный мозг, а также поиска модельных объектов для экспериментальных работ (Григорьян, Кругляков, 2008; Семченко и др., 2012). Одной из удачных моделей явились рыбы разных видов. В серии работ с помощью иммуногистохимического маркирования PCNA (пролиферативного ядерного антигена), ядерного маркера нейрональной дифференцировки (HuCD), транскриптационного фактора Pax6 и серии других маркеров, в разных отделах мозга рыб был идентифицирован ряд пролиферативных зон (ПВЗ), свидетельствующих о наличии постоянного постнатального нейрогенеза в ЦНС рыб. (Обухов и др., 2015; Zupanc, 2009; Zupanc, Sîrbulescu, 2013; Puschina, Obukhov, 2012; Pushchina et al., 2014 a, b). Однако, в настоящее время неизвестно как этот процесс связан с нейрогенезом во взрослом мозге, и какие элементы матричных зон мозга рыб участвуют в репаративном нейрогенезе.
Были поставлены эксперименты на молоди нескольких видов рыб, которым наносили механическую травму в разные структуры мозга (зрительный нерв, крыша среднего мозга, полушария конечного мозга). При механическом повреждении разных отделов мозга молоди рыб (сетчатки, среднего мозга и мозжечка) было выявлено усиление пролиферативной активности как в традиционных пролиферативных зонах нейрогенеза (перивентрикулярные области), так зафиксировано появление новых нейрогенных участков. Процесс репарации после нанесения механической травмы глаза начинается с апоптоза поврежденных элементов. Апоптотический ответ наблюдается уже через полчаса после нанесения повреждающего воздействия и продолжается до 21 дня после нанесения травмы. Эти данные подтверждены результатами маркирования TUNEL-позитивных фрагментов ДНК в зоне повреждения (зрительного нерва), а также данными электронно-микроскопического анализа. Ультраструктурные изменения ядра свидетельствуют о различных стадиях процесса апоптоза в поврежденных клетках. Апоптоз, как механизм элиминации поврежденных в результате травмы клеток мозга рыб существенно отличается от такового у млекопитающих. У последних, основным способом элиминации поврежденных клеток в зоне травмы является некроз. Апоптоз же затрагивает незначительный объем клеток в прилегающих к травме областях. Наличие некроза в зоне травмы млекопитающих является одной из причин развития последующего вторичного воспаления в зоне повреждения, что в свою очередь вызывает дальнейшее нарастание некротического ответа в области травмы, в результате которого формируются большие полости, лишённые клеток. Эти полости, как правило, ограничены зоной реактивных астроцитов, создающих как механический, так и биохимический барьеры, затрудняющие рост нервных волокон и миграцию клеток в зону повреждения. В отличие от некроза при апоптозе отсутствуют признаки воспалительной реакции, а сами клетки впоследствии уничтожаются с помощью макрофагов/микроглии. Прижизненный мониторинг клеток в зоне повреждения с помощью мультифотонной конфокальной микроскопии показал, что уже через час после повреждающего воздействия наблюдается физиологический ответ со стороны макрофагов и микроглии, которые мигрируют в область нанесения механической травмы и активно участвуют в элиминации поврежденных клеток с помощью фагоцитоза. Дифференцировка клеток в нейрональном направлении, обнаруженная при помощи маркирования клеток антителами против белка HuC/D, происходила в пролиферативных зонах теленцефалона, зрительного тектума, мозжечка и продолговатого мозга форели уже через 2 дня после травмы (Пущина и др., 2016; Puschina et al., 2014).
Таким образом, показано, что после механической травмы в мозге экспериментальных животных источником новых нейронов являются появляющиеся в пролифератиных областях мозга новые зоны индуцированного нейрогенеза: нейрогенные ниши и участки вторичного нейрогенеза. (Пущина и др., 2016). Полученные данные послужат основой для дальнейших исследований особенностей постнатального нейрогенеза в ЦНС животных и человека в норме и при патологии.
Травматические повреждения периферических нервов впекут за собой развитие дегенеративных процессов с последующим усилением активности шванновских элементов периферического отрезка и ростом осевых цилиндров центрального отрезка поврежденного нерва.
Дегенеративные изменения в периферическом отрезке происходят на всем его протяжении. Они выражаются распадом миэлиновой оболочки на отдельные глыбки и осевых цилиндров — на отдельные фрагменты, осколки и зерна. Глыбки миэлиновой оболочки рассасываются миэлофагами, а продукты распада осевых цилиндров — клетками ре-тикуло-эндотелиальной системы. Шванновская оболочка сохраняется, поэтому периферических отрезок нерва макроскопически остается как бы неизмененным (валлеровское перерождение).
В центральном отрезке нерва дегенеративные изменения происходят на ограниченном участке и выражены слабее. Грубая травма центрального отрезка вызывает ретроградное перерождение его культи на значительно большем протяжении, чем при простой перерезке, поэтому количество вновь вырастающих нервных волокон в этих случаях резко уменьшено.
Дегенерация миэлиновой оболочки и осевых цилиндров подготовляют пути для продвижения молодых нервных волокон и способствует созданию активной клеточной среды, необходимой для дальнейшей регенерации. Без предварительной дегенерации нервных элементов не может быть успешной регенерации. Скорость и степень дегенерации нерва зависят от интенсивности обмена веществ, состояния организма как целого. В процессе регенерации принимают активное участие как центральный, так и периферический отрезки нерва
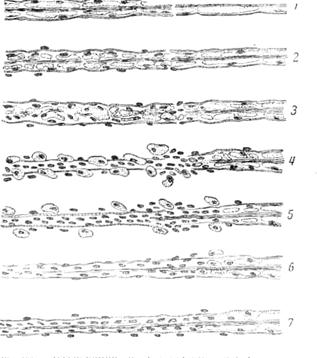
Рис. 60.Дегенерация и регенерация перерезанного нервного волокна:
1 — разволокнение осевого цилиндра и вздутие миэлина; 2 — сегментация осевого цилиндра, вздутие и смещение миэлина; пролиферация клеток шванновской оболочки; 3 — исчезновение осевого цилиндра; миэлиновые шарики; пролиферация клеток соединительной ткани неврилеммы(оболочки нерва); короткая ретроградная дегенерация центрального конца; 4 — образование зернистых телец; удаление дегенерирующего миялина фагоцитами; соединение отдельных частей посредством разрастающихся соединительнотканных клеток; ретроградная дегенерация; 5 — начало регенерации в центральной части; 6 — продвижение регенерирующегоосевого цилиндра в периферической части пустой шванновской оболочке; 7 — регенерация периферической части; начало восстановления миэлина.
Существовавшее долгое время убеждение, что периферический отрезок нерва играет в процессе восстановления пассивную роль, опровергнуто исследованиями советских ученых.
Установлено, что наличие шванновского синцития периферического отрезка и непрерывной связи его с центральным отрезком так же необходимо, как сохранность связи нервного центра с центральным отрезком нерва.
Срастание нервных волокон по первичному натяжению после перерезки нерва, даже в случаях немедленного наложения нервного шва, невозможно. Рана нервных стволов заживает посредством прорастания на периферию отростков нервной клетки.
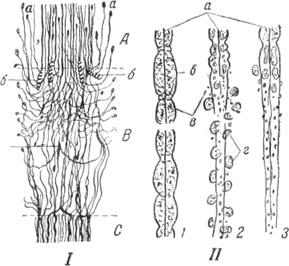
Рис. 61.Схема регенерации и перерождения нерва:
I — регенерация нерва после его перерыва: А — центральный отрезок нерва; С — периферический отрезок нерва, в который проникло небольшое количество молодых нервных волокон, располагающихся прямолинейно среди пшанновского синцития; В — область между обоими отрезками, и которой вновь образованныенервные волокна идут в разных направлениях: а — окончания растущих подокон (колбы роста); 6 — нервные спирали, наталкивающиеся на своем пути на препятствия; е — нервное волокно, разветвляющееся на Солее тонкие ветви. II — перерождение и регенерация нервного волокна: 1 — начало перерождения (набухание волокна и пролиферация клеток шванновской оболочки); 2 — исчезновение миэлина и фибриллярных волокон (видны фагоцитарные элементы, заполненные распавшимсямиалипом); 3 — врастание осевого цилиндра из центрального отрезка в шванновский синцитий периферического отрезка (стадия регенерации): а — аксон; б — миалиновая оболочка; в — ядра шванновских клеток; г. — фагоцитарные элементы (макрофаги).

После возобновления контакта между нервной клеткой и периферическими разветвлениями функция нерва восстанавливается лишь при условии нейрофибриллизации указанной выше соединительной ткани. Срок,
необходимый для восстановления утраченной функции, определяется характером повреждения культи центрального отрезка нерва, степенью расхождения концов и отчасти длиной нерва от места повреждения до периферических разветвлений. Установлено, что нервное волокно при благоприятных условиях растет в среднем со скоростью 1—1,5 мм в сутки. Нервные волокна растут значительно быстрее при непосредственном сближении отрезков нерва. Чем моложе и крепче животное, тем скорее и полнее регенерация. При большом расхождении концов нерва регенерация замедляется или совсем прекращается.
Вновь возникшие нервные волокна центрального отрезка нерва, при наличии рубцовой соединительной ткани, переплетаются между собой и образуют клубки нейрофибриллей; последние, вследствие невозможности проникнуть в периферический отрезок, утолщаются и служат в дальнейшем источником развития невромы на центральном конце нерва.
Важнейшими моментами, затрудняющими развитие нервных волокон и процесс нейрофибриллизации, являются: интоксикация нерва продуктами жизнедеятельности бактерий и распада тканевого белка, дегенеративные изменения осевых цилиндров, наличие восходящих невритов и большого количества плотной соединительной ткани между концами поврежденного нерва и окружающей тканью. Инфекция задерживает рост осевых цилиндров и пролиферацию шванновского синцития, извращает вегетативную иннервацию, в результате чего возникают вазомоторные и трофические расстройства. Плотный соединительно-тканный рубец на месте дефекта нередко оказывается совершенно непроницаемым для молодых отростков и влечет за собой образование на центральном конце нерва травматической невромы. Она представляет мощное образование нервных волокон, которые, переплетаясь между собой, окутывают центральную культю и дают побеги в окружающие ткани.
Почти полная утрата регенеративной способности нерва наблюдается при ретроградной дегенерации его центрального отрезка. Когда дегенерация распространяется на большие участки, то восстановление функции поврежденного нерва невозможно даже после иссечения рубцовой ткани и наложения нервного шва.
Синдром регенерации нерва. Признаками прорастания нервных волокон периферического отрезка и восстановления контакта между нервной клеткой и периферическим разветвлением являются: 1) постепенное исчезновение зоны анестезии и появление болевой чувствительности у животного ниже места повреждения; 2) постепенное ослабление и прекращение вазомоторных, секреторных и трофических расстройств; 3) восстановление мышечного тонуса и активных сокращений, уменьшение атрофии и, наконец, улучшение электровозбудимости.
Травматические повреждения периферических нервов впекут за собой развитие дегенеративных процессов с последующим усилением активности шванновских элементов периферического отрезка и ростом осевых цилиндров центрального отрезка поврежденного нерва.
Дегенеративные изменения в периферическом отрезке происходят на всем его протяжении. Они выражаются распадом миэлиновой оболочки на отдельные глыбки и осевых цилиндров — на отдельные фрагменты, осколки и зерна. Глыбки миэлиновой оболочки рассасываются миэлофагами, а продукты распада осевых цилиндров — клетками ре-тикуло-эндотелиальной системы. Шванновская оболочка сохраняется, поэтому периферических отрезок нерва макроскопически остается как бы неизмененным (валлеровское перерождение).
В центральном отрезке нерва дегенеративные изменения происходят на ограниченном участке и выражены слабее. Грубая травма центрального отрезка вызывает ретроградное перерождение его культи на значительно большем протяжении, чем при простой перерезке, поэтому количество вновь вырастающих нервных волокон в этих случаях резко уменьшено.
Дегенерация миэлиновой оболочки и осевых цилиндров подготовляют пути для продвижения молодых нервных волокон и способствует созданию активной клеточной среды, необходимой для дальнейшей регенерации. Без предварительной дегенерации нервных элементов не может быть успешной регенерации. Скорость и степень дегенерации нерва зависят от интенсивности обмена веществ, состояния организма как целого. В процессе регенерации принимают активное участие как центральный, так и периферический отрезки нерва

Рис. 60.Дегенерация и регенерация перерезанного нервного волокна:
1 — разволокнение осевого цилиндра и вздутие миэлина; 2 — сегментация осевого цилиндра, вздутие и смещение миэлина; пролиферация клеток шванновской оболочки; 3 — исчезновение осевого цилиндра; миэлиновые шарики; пролиферация клеток соединительной ткани неврилеммы(оболочки нерва); короткая ретроградная дегенерация центрального конца; 4 — образование зернистых телец; удаление дегенерирующего миялина фагоцитами; соединение отдельных частей посредством разрастающихся соединительнотканных клеток; ретроградная дегенерация; 5 — начало регенерации в центральной части; 6 — продвижение регенерирующегоосевого цилиндра в периферической части пустой шванновской оболочке; 7 — регенерация периферической части; начало восстановления миэлина.
Существовавшее долгое время убеждение, что периферический отрезок нерва играет в процессе восстановления пассивную роль, опровергнуто исследованиями советских ученых.
Установлено, что наличие шванновского синцития периферического отрезка и непрерывной связи его с центральным отрезком так же необходимо, как сохранность связи нервного центра с центральным отрезком нерва.
Срастание нервных волокон по первичному натяжению после перерезки нерва, даже в случаях немедленного наложения нервного шва, невозможно. Рана нервных стволов заживает посредством прорастания на периферию отростков нервной клетки.

Рис. 61.Схема регенерации и перерождения нерва:
I — регенерация нерва после его перерыва: А — центральный отрезок нерва; С — периферический отрезок нерва, в который проникло небольшое количество молодых нервных волокон, располагающихся прямолинейно среди пшанновского синцития; В — область между обоими отрезками, и которой вновь образованныенервные волокна идут в разных направлениях: а — окончания растущих подокон (колбы роста); 6 — нервные спирали, наталкивающиеся на своем пути на препятствия; е — нервное волокно, разветвляющееся на Солее тонкие ветви. II — перерождение и регенерация нервного волокна: 1 — начало перерождения (набухание волокна и пролиферация клеток шванновской оболочки); 2 — исчезновение миэлина и фибриллярных волокон (видны фагоцитарные элементы, заполненные распавшимсямиалипом); 3 — врастание осевого цилиндра из центрального отрезка в шванновский синцитий периферического отрезка (стадия регенерации): а — аксон; б — миалиновая оболочка; в — ядра шванновских клеток; г. — фагоцитарные элементы (макрофаги).
После возобновления контакта между нервной клеткой и периферическими разветвлениями функция нерва восстанавливается лишь при условии нейрофибриллизации указанной выше соединительной ткани. Срок,
необходимый для восстановления утраченной функции, определяется характером повреждения культи центрального отрезка нерва, степенью расхождения концов и отчасти длиной нерва от места повреждения до периферических разветвлений. Установлено, что нервное волокно при благоприятных условиях растет в среднем со скоростью 1—1,5 мм в сутки. Нервные волокна растут значительно быстрее при непосредственном сближении отрезков нерва. Чем моложе и крепче животное, тем скорее и полнее регенерация. При большом расхождении концов нерва регенерация замедляется или совсем прекращается.
Вновь возникшие нервные волокна центрального отрезка нерва, при наличии рубцовой соединительной ткани, переплетаются между собой и образуют клубки нейрофибриллей; последние, вследствие невозможности проникнуть в периферический отрезок, утолщаются и служат в дальнейшем источником развития невромы на центральном конце нерва.
Важнейшими моментами, затрудняющими развитие нервных волокон и процесс нейрофибриллизации, являются: интоксикация нерва продуктами жизнедеятельности бактерий и распада тканевого белка, дегенеративные изменения осевых цилиндров, наличие восходящих невритов и большого количества плотной соединительной ткани между концами поврежденного нерва и окружающей тканью. Инфекция задерживает рост осевых цилиндров и пролиферацию шванновского синцития, извращает вегетативную иннервацию, в результате чего возникают вазомоторные и трофические расстройства. Плотный соединительно-тканный рубец на месте дефекта нередко оказывается совершенно непроницаемым для молодых отростков и влечет за собой образование на центральном конце нерва травматической невромы. Она представляет мощное образование нервных волокон, которые, переплетаясь между собой, окутывают центральную культю и дают побеги в окружающие ткани.
Почти полная утрата регенеративной способности нерва наблюдается при ретроградной дегенерации его центрального отрезка. Когда дегенерация распространяется на большие участки, то восстановление функции поврежденного нерва невозможно даже после иссечения рубцовой ткани и наложения нервного шва.
Синдром регенерации нерва. Признаками прорастания нервных волокон периферического отрезка и восстановления контакта между нервной клеткой и периферическим разветвлением являются: 1) постепенное исчезновение зоны анестезии и появление болевой чувствительности у животного ниже места повреждения; 2) постепенное ослабление и прекращение вазомоторных, секреторных и трофических расстройств; 3) восстановление мышечного тонуса и активных сокращений, уменьшение атрофии и, наконец, улучшение электровозбудимости.
А,а. Миелиновое волокно. Б,б. Безмиелиновое волокно. 1. Осевые цилиндры. 2. Миелиновый слой. 3. Соединительная ткань. 4. Насечка миелина. 5. Ядро нейролеммоцита. 6. Узловой перехват. 7. Микротрубочки. 8. Нейрофиламенты. 9. Митохондрии. 10. Мезаксон. 11. Базальная мембрана. (По Т. Н. Радостиной).
он хорошо импрегнируется осмиевой кислотой. Остатки цитоплазмы леммоцитов сохраняются между витками мезаксона, образуя насечки миелина. Они не окрашиваются осмиевой кислотой и поэтому видны на фоне миелина в виде косых светлых полос. Поскольку в процессе образования миелиновой оболочки осевой цилиндр и леммоциты продолжают расти, то каждый последующий, наружный виток мезаксона шире предыдущего. Участки волокна, не покрытые миелином, называются узловыми перехватами. Они находятся на границе между двумя соседними леммоцитами. Соответственно, участок волокна образованный одной глиальной клеткой именуется межузловым сегментом. Снаружи всё волокно, включая узловые перехваты, покрыто базальной мембраной. По миелиновым волокнам нервный импульс передается с большой скоростью, до 120 м/сек.
Регенерация нейронов и нервных волокон
Нейроны взрослых человека и животных не способны к делению, клеточной регенерации. Однако у них хорошо развита внутриклеточная регенерация: обновление макромолекул и органелл. При гибели одних нейронов, сохранившиеся нейроны гипертрофируются и берут на себя функции погибших. Возможно также восстановление повреждённых отростков нейронов и, соответственно, регенерация периферических нервов.
После перерезки нервного волокна, наступает дегенерация осевого цилиндра дистальней места повреждения. Леммоциты и макрофаги фагоцитируют продукты распада, очищают место провреждения, а затем размножаются и образуют тяжи – ленты Бюнгера. На проксимальном отрезке осевого цилиндра образуется наплыв аксоплазмы - формируется колба роста (как в эмбриогенезе). Осевой цилиндр растёт по дорожке из леммоцитов со скоростью 2-4 мм в сутки до тех пор, пока не достигает иннервируемого органа. После этого вокруг новообразованного осевого цилиндра леммоциты образуют миелиновую оболочку, а в рабочем органе вновь формируется (восстанавливается) нервное окончание. Эти процессы завершаются в течение нескольких месяцев от момента повреждения. Однако, если возникает препятствие на пути роста осевых цилиндров, они начинают расти беспорядочно и образуют клубок, называемый ампутационной невромой. При её раздражении возникает сильная боль, которая воспринимается как происходящая из первоначально иннервируемой области, например как боль в удалённой конечности (фантомные боли). Нервные окончания
Все нервные волокна заканчиваются концевыми аппаратами, называемых нервными окончаниями. По функции они делятся на эффекторные, рецепторные и межнейрональные синапсы.
Нервный импульс в организме человека обычно передаётся с одной нервной клетки на другую или с нейрона на рабочий орган через медиатор, химический посредник. Медиатор взаимодействует со специфическими рецепторами другого нейрона или клетками рабочего органа и через целый каскад вторичных внутриклеточных посредников, меняет функцию рабочего органа или другого нейрона.
Нейробласты — клетки с большим округлым ядром, плотным ядрышком и бледной цитоплазмой — дают начало всем нейронам ЦНС. Нейроны — классический пример клеток, относящихся к статической популяции. Ни при каких условиях они in vivo не способны к пролиферации и обновлению. Обонятельные нейроны (происходят из обонятельных плакод) эпителиальной выстилки носовых ходов — единственное известное исключение.
Глиобласты — предшественники макроглии [астроциты и олигодендро(глио)циты]. Все типы макроглии способны к пролиферации.
Генез клеток микроглии спорен. Согласно наиболее распространённой точке зрения, клетки микроглии относят к системе мононуклеарных фагоцитов. Достаточно вероятным представляется их нейроэктодермальный генез. В этом случае подразумевается гетерогенность популяции клеток микроглии.
Раннее развитие мозга
Морфогенетические процессы — индукция, адресная миграция клеток, направленный рост аксонов, гибель клеток, так называемые нейротрофические взаимодействия — хорошо выражены в развивающейся нервной системе. Жёсткость организации мозга определяют два момента: адресная миграция клеток и направленный рост их отростков.
Адресная миграция клеток
Направленный рост аксонов
Направленный рост аксонов, как и адресная миграция клеток, осуществляется в рамках концепции “сигнал–ответ”. Эта концепция объясняет, как нейрон узнаёт свою область иннервации и находит своего клеточного партнёра, и как в развивающемся мозге многочисленные переплетающиеся отростки нейронов устанавливают связи с высокой точностью. Отросток нейрона — аксон — сразу и без ошибок находит свои мишени. Направленный рост аксонов осуществляет конус роста.
Конус роста — мобильная терминаль отростка нейрона, специализированная на удлинение и навигацию этого отростка, впервые детально описан Сантъяго Рамон-и-Кахалем. Конус имеет на конце булавовидное утолщение (ламеллоподия), от которого отходят тонкие пальцевидные отростки — филоподии. Они растут в различных направлениях и исследуют потенциальное пространство роста аксона. Согласно представлению С. Рамон-и-Кахаля о хемотропизме, рост аксонов происходит по градиенту концентрации специфических химических факторов, вырабатываемых в мишенях. Действительно, in vitro градиенты фактора роста нервов (NGF) и других веществ (например, ацетилхолина) влияют на направление роста аксонов. Наиболее разработано представление о меченых путях, которые образованы молекулярными метками (своего рода знаками навигационной обстановки), закономерно распределёнными в потенциальном пространстве роста аксонов. По мере роста пионерский аксон последовательно считывает одну за другой метки, расположенные в межклеточном пространстве или на поверхности клеток, и растёт в нужном направлении. Вслед за ним мигрируют отростки других аксонов, совокупность которых формирует тракты в ЦНС и нервы на периферии. Примером клеток, направляющих рост аксонов, могут служить временно живущие нейроны Кахаля–Ретциуса. Ключевой момент представления о заранее размеченных путях — узнавание — обеспечивают молекулы адгезии, которые встроены в плазмолемму ламеллоподии и филоподий и взаимодействуют с комплементарными молекулами (ламинин, фибронектин, коллаген, тенасцин и др.) во внеклеточном матриксе. Это обеспечивают фиксацию конуса роста на поверхности мишени в нужном месте и в нужное время.
Характеристика
Молекул внеклеточного матрикса
Ламинин, тенасцины, коллаген, фибронектин, иммуноглобулины, аносмин‑1 ( KAL ), хондроитин/гепарансульфат протеогликаны, тромбоспондин‑1
HomA , протеогликаны, интегрины
Многие из них важны для нейроонтогенеза. Все продолжают экспрессироваться в зрелом мозге
Sema 3A‑F, Sema 4A‑G, Sema 5A и B, Sema 6A‑C, Sema 7A
Плексин A, нейропилин
Хеморепелленты, вызывают коллапс конуса роста сенсорных аксонов in vivo . Некоторые разновидности могут выступать в роли аттрактантов. Могут быть интегральными мембранными белками или секретироваться
N – CAM , PSA - N – CAM , L 1, TAG -1/аксонин‑1, DM - Grasp , кадгерины
Интегральные и мембраносвязанные гликопротеины, участвуют в прикреплении аксонов к субстрату, фасцикуляции, направленном росте, в гомофильных и гетерофильных взаимодействиях
Миелин-ассоциированный гликопротеин ( MAG ), nogo
Интегральные мембранные белки экспрессируются в зрелом миелине, ингибиторы роста аксонов in vitro и in vivo . Могут выступать в роли рецепторов для некоторых молекул внеклеточного матрикса
Рецепторов, связанных с тирозинкиназам
Ephrin A1-A5, Ephrin B1-B3
Лиганды и рецепторы, связаны с мембраной или являются трансмембранными белками, участвуют в процессах миграции клеток и роста аксонов в нейроонтогенезе
DCC, нейрогенин, Unc ‑ 5
Важны для миграции нейробластов и направленного роста аксонов в развивающемся мозге. Связывание с рецептором DCC прослежено как при позитивном, так и негативном регулировании
NGF, NT-3, BDNF, CNTF, GDNF
Trk A,B,C, p75, Lifrb, GFRa1
Нейротропная и нейротрофичекая активность
FGF, IGF, PDGF, VEGFa
FGFr1-4, flk-1, IGFr1, PDGFr, EGFr
Нейротрофическая активность, контроль пролиферации, дифференцировки и гибели клеток
TGF b , LIF, TNF, EGF
TGF b тип I; TGF b , тип II; LIFrb, gp130, TNFr1-2
Нейротрофичекая активность, поддержание дифференцировки нейронов
Возможно, участвуют в синаптогенезе. Изменяют направление роста аксонов чувствительных нейронов
Репелленты для различных аксонов и мигрирующих клеток, но и стимуляторы ветвления и удлинения аксонов
Механизм роста аксона
Перемещение конуса роста осуществляется при помощи молекулярного мотора. В конусе роста различают центральный и периферический домен. Периферический домен объединяет филоподии и часть ламеллоподии. Здесь актин полимеризуется на ведущем конце нити, что поддерживает рост аксона в ортоградном направлении, но тянется в обратном (ретроградном) направлении за счет работы миозинового мотора. Ретроградное перемещение актина сдерживает проникновение микротрубочек в периферический домен. Сигналы взаимодействия поверхностных рецепторов с лигандами угнетают ретроградное перемещение актиновых нитей и равновесие между сборкой и перемещением актиновых нитей в ортоградном направлении, с одной стороны, и ретроградным перемещением актиновых нитей за счет работы мотора, с другой стороны, нарушается в пользу первого и в итоге обеспечивает перемещение (рост) всей структуры конуса роста в ортоградном направлении. Остановка ретроградного перемещения актина позволяет микротрубочкам проникать в периферический домен. Этот рост микротрубочек осуществляется путём полимеризации тубулина. В результате аксон удлиняется.
Реакции актина на ведущем конце ламеллоподии . Сеть цитоскелета на ведущем конце ламеллоподии содержит интенсивно ветвящиеся актиновые нити с (+)–концом, направленным в сторону роста, и (–)–концом, образующим угол ~70º с другими нитями. В состоянии покоя (+)-конец актиновой нити обычно покрыт кэппинг–белком. Под действием стимула происходит полимеризация актина на свободном (+)–конце нити, расположенной в ведущей части конуса роста. Нить удлиняется и возникает усилие в направлении поверхностной мембраны. В диссоциации кэппинг–белка и освобождении (+)–конца актиновой нити имеют значение увеличение уровня инозитолдифосфата, разрезание нити ADF/кофилином и нуклеация актина, зависимая от комплекса Arp2/3. Этот комплекс активируется при связывании с белком N – WASP ( W iskott - A ldrich S yndrome P rotein , тяжелая врожденная нейтропения, тромбоцитопения), одна из форм которого, в свою очередь, активируется при участии Cdc42.
Физиологическая гибель клеток
Запрограммированная массовая смерть нейронов происходит на строго определённых этапах онтогенеза. Естественная гибель нейронов прослежена как в ЦНС, так и в периферической нервной системе. Объём субпопуляции гибнущих нейронов оценивают в широком интервале, от 25 до 75%. Иногда в популяции погибают все нейроны (например, несущие метку для направленного роста аксонов). Выраженная гибель нейронов в сформированной нервной ткани наблюдается при дегенеративных заболеваниях нервной системы, таких как болезнь Альцхаймера, Паркинсона, Хантингтона, Кройтцфельдта–Якоба, боковой амиотрофический склероз и др.
Эта концепция предусматривает информационный обмен между нейронами, отличающийся от химической передачи возбуждения в синапсах. Согласно концепции, такой обмен поддерживает фенотип взаимодействующих клеток на уровне, адекватном выполнению их функции. Нейротрофические взаимодействия реализуются через нейротрофические факторы. Эти химические факторы вырабатываются в одних нейронах или в ненервных клетках и воздействуют на другие нейроны. Нейротрофические факторы поддерживают выживание и дифференцировку нейронов в нейроонтогенезе и при регенерации. Наиболее изученным нейротрофическим фактором является фактор роста нервов ( NGF ).
Нейроны относят к статической клеточной популяции. Это означает, что в постнатальном онтогенезе не происходит образования новых нейронов. Следовательно, погибающие нейроны не восстанавливаются. Но из этого не следует, что в нервной системе отсутствует регенерация. Она осуществляется за счёт восстановления целостности повреждённых нейронов, роста их отростков, размножения глиальных и шванновских клеток. Всё это, а также изменение связей между регенерирующими и интактными клетками при благоприятных условиях, может привести к восстановлению функции в нервной системе.
Нейроны (термин предложил Вильгельм фон Вальдейер) — главные клеточные типы нервной ткани. Эти возбудимые клетки осуществляют передачу электрических сигналов (между собой при помощи нейромедиаторов в синапсах) и обеспечивают способность мозга к переработке информации.
Перикарион содержит ядро, комплекс Гольджи, гранулярную эндоплазматическую сеть, митохондрии, лизосомы, элементы цитоскелета.
Ядро нейрона имеет мелкодисперсный хроматин и ядрышко. В силу относительно большого диаметра ядро в световом микроскопе выглядит (особенно в крупных нейронах) как оптически пустое. Ядрышко крупное и резко базофильное.
Комплекс Гольджи хорошо развит, особенно в крупных нейронах. Его особенность — расположение между ядром и местом отхождения аксона, что отражает мощный транспорт белков, синтезированных в гранулярной эндоплазматической сети перикариона, в аксон.
Аксонный холмик — свободная от гранулярной эндоплазматической сети и рибосом область перикариона, содержащая много микротрубочек и нейрофиламентов, место, где начинается аксон и генерируется потенциал действия.
Гранулярная эндоплазматическая сеть. В перикарионе и дендритах развита гранулярная эндоплазматическая сеть. Она соответствует глыбкам хроматофильного вещества, которые впервые обнаружил Франц Ниссль при окраске метиленовым синим, почему её в нейронах иногда называют веществом Ниссля (тигроид). Тигролиз — распыление хроматофильного (тигроидного) вещества, отражающее глубокие дистрофические изменения при нарушении целостности нейрона ( например , при сдавлении или перерезке аксона).
Митохондрии многочисленны. Значительные энергетические потребности нервных клеток обеспечива ет преимущественно аэробный метаболизм, почему нейроны крайне чувствительны к гипоксии.
Пигменты . В нейронах (особенно с возрастом) накапливается липофусцин. Нейроны некоторых ядер мозга нормально содержат иные пигменты, почему эти образования и получили своё название (substantia nigra, locus coeruleus).
Отростки, отходящие от перикариона, — аксон и дендриты (рис. 8–13). Отростки нейрона участвуют в образовании синапсов.
Аксон (нейрит) — длинный отросток, как правило, не ветвящийся, но образующий концевые разветвления, содержащие синаптические пузырьки; проводит пачки импульсов (спайки) от перикариона. Объём аксона может достигать 99% суммарного объёма нейрона. Длина аксона может быть весьма значительной — десятки сантиметров.
Синтез белка в аксоне . Считается общепринятым, что синтез белка в нейроне происходит только в перикарионе и дендритах. Однако в последнее время появились достаточно убедительные доказательства синтеза белка в аксоне. Многочисленные белки аксоплазмы синтезируются в перикарионе и перемещаются в составе медленного аксонного транспорта. Длина аксона варьирует от нескольких микрон до метра, и транспортировка белковых молекул по аксону может занять дни, недели и даже месяцы. Следовательно, при срочном ответе нейрона на изменившиеся условия функционирования локальный синтез белка экономит время и энергию, необходимые для транспортировки вновь синтезированного белка в нужный компартмент аксона. Учитывая тот факт, что белки имеют определённый период полураспада и во время медленного транспорта по аксону постоянно подвергаются деградации можно предположить, что внутриаксонный синтез белка также необходим для поддержания белкового состава аксоплазмы и массы аксона в целом.
Цитоскелет нейронов состоит из микротрубочек, промежуточных филаментов (нейрофиламенты) и микрофиламентов.
Читайте также: