Разница между кислородом и озоном кратко
Обновлено: 04.07.2024
Сравните свойства кислорода и озона. На основе этих примеров поясните сущность аллотропии.
| Кислород | Озон | |
|---|---|---|
| Физические свойства | Бесцветный газ, без вкуса и запаха. Малорастворим в воде. | Голубой газ с характерным запахом. Плотность в 1,5 раза больше, чем у кислорода. Намного лучше растворяется в воде, чем кислород. |
| Химические свойства | Взаимодействует с многими веществами при нагревании с выделением тепла и света. | Значительно более активен, чем кислород. Это связано с тем, что молекула озона распадается на 1 атом и 1 молекулу кислорода: O3 = O2 + O. В атмосфере озона некоторые вещества (спирт, фосфор) воспламеняются. Каучук становится хрупким, а красители обесцвечиваются. |
Сущность аллотропии заключается в способности химического элемента образовывать несколько простых веществ, которые различаются между собой физическими и химическими свойствами.

Исторически так сложилось, что химический элемент и одно из простых веществ, образованных атомами этого элемента, имеют общее название — кислород. Поскольку между этими понятиями существует принципиальная разница, следует четко различать, о чем идет речь — о кислороде как о химическом элементе или о простом веществе.
Кислород как химический элемент
Самым первым химическим элементом, к изучению которого мы приступаем, является кислород. Как вы уже знаете, химический знак кислорода — О. Относительная атомная масса кислорода равна 16:
Позднее вы узнаете, какое строение имеет атом кислорода и чем он отличается от атомов других химических элементов.
Кислород как простое вещество
Простое вещество кислород существует в виде молекул. Молекула кислорода состоит из двух атомов химического элемента кислорода (рис. 73), поэтому химическая формула кислорода как простого вещества — O2.
Поскольку относительная атомная масса кислорода равна 16, то относительная молекулярная масса простого вещества кислорода равна:
![]()
Следовательно, молярная масса кислорода равна:
![]()
Как у всех газов, молярный объем кислорода при нормальных условиях равен:
![]()
История открытия кислорода
Кроме кислорода, существует еще одно простое вещество, молекулы которого состоят только из атомов кислорода. Это озон, молекула которого содержит три атома кислорода (рис. 74), его формула — О3.
При нормальных условиях озон представляет собой газ с резким раздражающим запахом. Он очень токсичен для всех живых организмов и поэтому используется вместо хлора для обеззараживания воды.
Небольшие количества озона образуются в воздухе во время грозы, а также в результате взаимодействия смолы хвойных деревьев с кислородом. Озон оказывает губительное действие на бактерии, поэтому лесной воздух (особенно в хвойных лесах) обладает целебным действием.
В небольших количествах озон образуется также при работе копировальных аппаратов и лазерных принтеров. Использовать такие приборы следует только в хорошо проветриваемых помещениях.
В верхних слоях атмосферы Земли (на высоте примерно 30—40 км) существует озоновый слой. Содержащийся в нем озон образуется из кислорода под воздействием солнечного излучения. Некоторые компоненты этого излучения губительны для живых организмов и растений на нашей планете, а озоновый слой поглощает их. Если бы не было озонового слоя, то жизнь на Земле постепенно бы прекратилась.
Многие ученые считают, что вещества, образующиеся в процессе производственной деятельности человека, разрушают озоновый слой. Это прежде всего фреоны — соединения, использующиеся в холодильных установках и дезодорантах, выбросы реактивных самолетов и ракет. Попадая в озоновый слой, эти вещества приводят к уменьшению его толщины или даже разрыву этого слоя — образованию так называемых озоновых дыр. В результате образования и увеличения размеров озоновых дыр могут наступить серьезные экологические катастрофы.
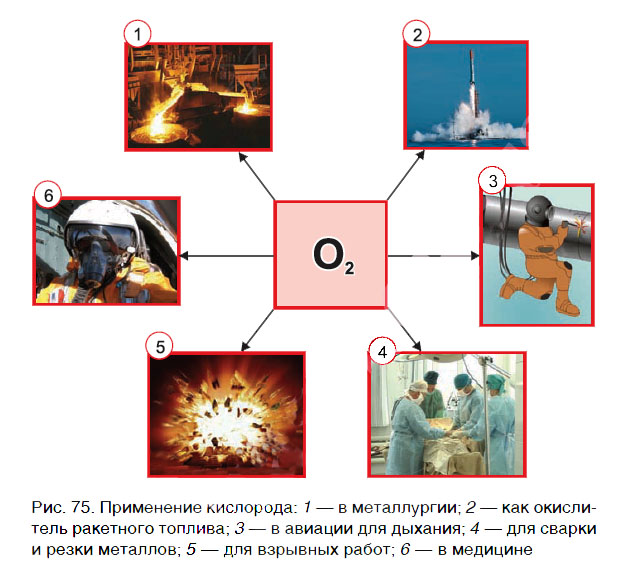
Применение кислорода
Кислород очень широко применяется в народном хозяйстве. На рисунке 75 приведены основные области применения кислорода. Главными потребителями кислорода являются металлургическая промышленность (выплавка стали), космическая техника (окислитель ракетного топлива), процессы обработки металлов (сварка и резка металлов).
Краткие выводы урока:
- Химический элемент кислород образует два простых вещества — кислород О2 и озон О3.
- Когда говорят о кислороде как о химическом элементе, подразумевают атомы кислорода О.
- Когда говорят о кислороде как о простом веществе, подразумевают вещество, состоящее из молекул и имеющее формулу О2.
Газообразный кислород и озон - самые известные аллотропы кислородного элемента. Кислород - чрезвычайно важный газ для живых организмов; для их дыхания. Озон также защищает жизнь на Земле, когда она находится в верхних слоях атмосферы, но в нижних слоях атмосферы он вреден.
1. Обзор и основные отличия
2. Что такое кислород
3. Что такое озон
4. Параллельное сравнение - кислород и озон в табличной форме
5. Резюме
Что такое кислород?
Кислород - это химический элемент с атомным номером 8, который присутствует в группе 16 Периодической таблицы. Имеет электронную конфигурацию 1s 2 2 с 2 2p 4 . Кислород имеет три основных изотопа; 16 О, 17 О, 18 О. Среди них 16 О - самый распространенный изотоп. Более того, у атома кислорода восемь электронов, и он может получить еще два электрона от другого атома, чтобы сформировать -2 заряженный анион. В качестве альтернативы два атома кислорода могут совместно использовать четыре электрона для образования ковалентной связи, которая дает двухатомную молекулу (O2).
Молекулярная масса O2 составляет 32 г моль -1 . Это бесцветный газ без запаха и вкуса. В земной атмосфере около 21% кислорода. Кроме того, он плохо растворяется в воде и немного тяжелее воздуха. Кислород тоже обладает магнитными свойствами. Когда газообразный кислород конденсируется при -183 ° C, он становится жидкостью голубоватого цвета.
Кроме того, этот газ реагирует со всеми элементами с образованием оксидов, кроме инертных газов. Следовательно, это хороший окислитель. Кислород необходим для дыхания живых организмов. Мы используем этот газ в больницах, сварке и во многих других отраслях промышленности.
Что такое озон?
Однако озон вреден при более низких уровнях атмосферы. Он действует как загрязнитель воздуха (ответственный за фотохимический смог) и может вызывать респираторные заболевания у людей и животных. Кроме того, он повреждает и растения. Следовательно, озон менее стабилен, чем газообразный кислород; превратиться в более стабильный газообразный кислород.
Озон представляет собой газ бледно-голубого цвета с резким запахом. Он более растворим в неполярных растворителях и менее растворим в воде. Более того, два атома кислорода в озоне связаны двойной связью, и между одним атомом кислорода и другим атомом кислорода существует дативная связь.
Однако он показывает стабилизацию резонанса; таким образом, реальная структура этой молекулы представляет собой гибридную структуру. Там длина связи O-O одинакова между тремя атомами. Центральный атом кислорода имеет sp 2 гибридизация с одной неподеленной парой. Кроме того, озон имеет искривленную геометрию. Кроме того, это полярная молекула. И, поскольку это сильный окислитель, озон очень реактивен. Кроме того, этот газ образуется из кислорода при солнечном свете.
В чем разница между кислородом и озоном?
Кислород - это химический элемент с атомным номером 8 и символом O, а озон - это газообразное соединение с химической формулой O.3. Обычно, когда мы говорим о кислороде, мы имеем в виду газообразный кислород. Следовательно, ключевое различие между кислородом и озоном состоит в том, что газообразный кислород представляет собой двухатомную газообразную молекулу кислородного элемента, тогда как озон представляет собой трехатомную газообразную молекулу кислорода. Более того, кислород и озон различаются по цвету. То есть; кислород - бесцветный газ, а озон - бледно-голубой газ.
Кроме того, еще одно существенное различие между кислородом и озоном состоит в том, что газообразный озон может быть вредным при более низких уровнях атмосферы, но кислород не является вредным газом. Кроме того, в атмосфере газообразный кислород присутствует в гораздо больших количествах, чем озон. Кроме того, озон менее стабилен, чем кислород. Следовательно, окислительная способность озона выше, чем у кислорода.
Приведенная ниже инфографика о разнице между кислородом и озоном показывает различия в табличной форме.
Резюме - кислород против озона
Кислород и озон - два основных газообразных соединения кислорода химического элемента. Ключевое различие между кислородом и озоном состоит в том, что кислород представляет собой двухатомную газообразную молекулу кислородного элемента, тогда как озон представляет собой трехатомную молекулу кислорода.
Кислород – элемент VIA группы. Для него свойственны две аллотропные модификации с разными химическими формулами – кислород О2 и озон О3. Они отличаются не только составом молекул, но и различными характеристиками.
В конце XVIII века ученый Мартин Ван Марум провел эксперимент, в результате которого получил озон. Он через воздушное пространство пропускал электричество. Таким образом, образовался озон – это голубоватый газ с необычным запахом. Ученый предполагал, что полученный газ представляет собой электрическую материю.
Получение озона
Существует несколько способов получения молекул озона.
- Из кислорода воздуха при электрическом разряде
- 3О2 = 2О3 – 284 кДж
В промышленных условиях газ получают в озонаторах и отделяют фракционной перегонкой.
- 3О2 = 2О3 – 284 кДж
- Взаимодействие охлажденной концентрированной серной кислоты и пероксида бария
- 3H2SO4 + 3BaO2 = 3BaSO4 + O3 + 3H2O
Данной реакцией синтезируют озон в лабораториях.
- 3H2SO4 + 3BaO2 = 3BaSO4 + O3 + 3H2O
Физические свойства озона
Озон – бесцветный (в толстых слоях голубоватый) газ. Он почти в два раза тяжелее воздуха. Озон обладает специфическим запахом свежести.
- Температура сжижения -112˚С (газ приобретает оттенок индиго).
- Температура плавления -197˚С.
- Молярная масса озона – 48 г/моль.
Озон растворим в воде. Примеси позволяют растворяться еще быстрее. Если озон находится в состоянии газа, то он выступает в роли диамагнетика. Если озон – это жидкость, то проявляет свойства слабого парамагнетика.
Озон ядовит и губителен для бактерий. Его используют при обеззараживании воздуха и воды.
Химические свойства озона
Озон обладает сильными окислительными свойствами по сравнению с кислородом. Он реагирует с рядом веществ.
Если озон находится в состоянии газа, то реакция с сероводородом выглядит следующим образом:
H2S + O3 = SO2 + H2O
Озон способен взаимодействовать со ртутью при обычных условиях. В результате металл теряет блеск и способность липнуть к стеклу.
Токсичность озона
При умеренных концентрациях озон безвреден. Реакции с озоном характеризуются формированием свободных радикалов кислорода, которые губительны для организма при высоком содержании. Чрезмерное воздействие озона часто приводит к гибели. Озон особенно губителен для органов дыхания.
Озоновый слой в верхних слоях атмосферы
Озоновый слой – слой в верхней части атмосфера Земли, который состоит из бесцветного нестабильного газа. Он располагается на высоте 15-20 км над поверхностью планеты. Стратосфера – слой атмосферы, в котором содержится много озона.
Озон образуется в результате воздействия ультрафиолета на кислород. Слой газа задерживает все формы поступающей ультрафиолетовой коротковолновой радиации.
Озоновый экран защищает от вредного излучения, длина волн которого 290-320 нм. Это излучение может спровоцировать рак кожи. Озоновый слой появился на Земле около 600 млн лет назад в результате процесс фотосинтеза. Благодаря озоновому слою первые живые организмы смогли выйти из океана на сушу.
Дыры в озоновом слое
Озоновые дыры – локальное истощение озонового слоя. Самая большая озоновая дыра находится над Антарктидой. Если озоновый слой полностью исчезнет, то все живое на планете погибнет.
Озоновые дыры возникают по многим причинам, главная из которых – загрязнение окружающей среды. Озоновый слой разрушается под воздействием хлора, водорода, кислорода, брома и других продуктов сгорания. Выбросы фабрик, заводов и различных производств негативно влияют на выработку озона в верхних слоях атмосферы.
Озоновый слой может разрушить война. При испытании ядерного оружия выделяется огромное количество энергии и образуются окислы азота, которые разрушают озон. В период с 1952 по 1971 года при ядерных взрывах в атмосферу попало около 3 млн т окислов азота.
Реактивные самолеты выбрасывают окислы азота. Чем выше мощность турбореактивного двигателя, тем больше разрушающего вещества попадает в атмосферу. Ежегодно в воздух выбрасывается более 1 млн т соединений азота, из которых треть выбрасывают самолеты.
Защита озонового слоя
До 1989 года на производствах часто применялись галогенированные углеводороды, которые разрушают озоновый слой. Монреальская конвенция разработала программу по сокращению использования хлорфторуглеродов, которые быстро испарялись и достигали стратосферы. Они разлагаются на компоненты и разрушают озоновый слой. Из этих соединений раньше изготавливали аэрозоли, растворители и др.
Озоновые дыры произвольно создаются и исчезают. Это связано с некоторыми природными явлениями и даже климатическими особенностями. Газ озон образуется в результате воздействия ультрафиолета на кислород. Во время полярной ночи дыры образуются из-за того, что солнце не заходит несколько недель и ультрафиолет постоянно влияет на кислород. Во время полярного дня озоновый слой восстанавливается и воздействие ультрафиолета на живые организмы снижается.
Дыры могут формироваться в период активности Солнца. В результате этого они появляются и пропадают. Иногда это занимает несколько дней, реже растягивается на несколько месяцев.
Озон (O3) представляет собой трехатомную молекулу, состоящую из трех атомов кислорода. Это аллотроп кислород который намного менее стабилен, чем двухатомный O2 (газообразный кислород).
Сравнительная таблица
Различия в свойствах
Оба двухатомного озона (O2) и трехатомный озон (O3) состоят из атомов кислорода, но имеют разные химические и физические свойства.
- Кислород не имеет запаха, а озон имеет резкий резкий запах.
- Озон сжижается при -112 градусах Цельсия, а кислород сжижается при гораздо более низкой температуре - -183 ° C.
- Озон химически менее стабилен по сравнению с кислородом. Таким образом, озон легче и при более низких температурах вступает в реакцию с другими молекулами. Например, озон может реагировать с соединениями углерода при комнатной температуре, но кислород требует больше тепла, прежде чем он вступит в реакцию.
Польза кислорода и озона
В то время как животным нужен кислород для дыхания, приземный озон является загрязнителем воздуха, оказывающим вредное воздействие на дыхательную систему животных. Озоновый слой в верхних слоях атмосферы фильтрует потенциально опасный ультрафиолетовый свет, достигающий поверхности Земли.
Наличие озона и кислорода на Земле
Озон присутствует в низких концентрациях в атмосфере Земли. В верхних слоях атмосферы есть слой озона. Кислород, с другой стороны, в основном находится в нижних слоях атмосферы. Около 20% атмосферы составляет кислород.
Читайте также:

