Радиоактивные изотопы это кратко и понятно
Обновлено: 02.07.2024
А радионуклид (радиоактивный нуклид, радиоизотоп или же радиоактивный изотоп) является атом который имеет избыток ядерной энергии, что делает его нестабильным. Эту избыточную энергию можно использовать одним из трех способов: излучать из ядра в виде гамма-излучение; передан одному из электроны выпустить его как конверсионный электрон; или используется для создания и выпуска нового частица (альфа-частица или же бета-частица) из ядра. Считается, что во время этих процессов радионуклид подвергается радиоактивный распад. [1] Эти выбросы считаются ионизирующего излучения потому что они достаточно мощны, чтобы освободить электрон от другого атома. В результате радиоактивного распада может образоваться стабильный нуклид, а иногда - новый нестабильный радионуклид, который может подвергнуться дальнейшему распаду. Радиоактивный распад - это случайный процесс на уровне отдельных атомов: невозможно предсказать, когда один конкретный атом распадется. [2] [3] [4] [5] Однако для совокупности атомов одного элемента скорость распада и, следовательно, период полураспада (т1/2) для этой коллекции можно рассчитать по их измеренным константы распада. Диапазон периодов полураспада радиоактивных атомов не имеет известных ограничений и охватывает временной диапазон более 55 порядков.
Радионуклиды встречаются в природе или искусственно производятся в ядерные реакторы, циклотроны, ускорители частиц или же генераторы радионуклидов. Существует около 730 радионуклидов с периодом полураспада более 60 минут (см. список нуклидов). Тридцать два из них первичные радионуклиды которые были созданы до образования Земли. По крайней мере еще 60 радионуклидов обнаруживаются в природе либо в виде дочерних элементов первичных радионуклидов, либо в виде радионуклидов, образующихся в результате естественного образования на Земле космического излучения. Более 2400 радионуклидов имеют период полураспада менее 60 минут. Большинство из них производятся только искусственно и имеют очень короткий период полураспада. Для сравнения, их около 252 стабильные нуклиды. (Теоретически только 146 из них стабильны, а остальные 106, как полагают, распадаются через альфа-распад, бета-распад, двойной бета-распад, захват электронов, или же двойной захват электронов.)
Все химические элементы могут существовать в виде радионуклидов. Даже самый легкий элемент, водород, имеет хорошо известный радионуклид, тритий. Элементы тяжелее, чем вести, а элементы технеций и прометий, существуют только в виде радионуклидов. (Теоретически элементы тяжелее диспрозий существуют только в виде радионуклидов, но некоторые такие элементы, как золото и платина, находятся наблюдательно стабильный и их период полураспада не определен).
Незапланированное воздействие радионуклидов обычно оказывает вредное воздействие на живые организмы, включая людей, хотя низкие уровни воздействия происходят естественным образом без вреда. Степень вреда будет зависеть от характера и степени произведенного излучения, количества и характера воздействия (тесный контакт, вдыхание или проглатывание) и биохимических свойств элемента; с повышенным риском рака - самое обычное последствие. Однако радионуклиды с подходящими свойствами используются в ядерная медицина как для диагностики, так и для лечения. Измерительный прибор для визуализации, сделанный с использованием радионуклидов, называется радиоактивный индикатор. А фармацевтический препарат сделанный с радионуклидами называется радиофармпрепарат.
Содержание
Источник
Естественный
На Земле естественные радионуклиды делятся на три категории: первичные радионуклиды, вторичные радионуклиды и космогенный радионуклиды.
- Радионуклиды производятся в звездный нуклеосинтез и взрывы сверхновых наряду со стабильными нуклидами. Большинство из них быстро распадаются, но их все еще можно наблюдать астрономически и они могут сыграть роль в понимании астрономических процессов. Первичные радионуклиды, такие как уран и торий, существуют в настоящее время, потому что их период полураспада настолько велики (> 100 миллионов лет), что еще не полностью распались. У некоторых радионуклидов период полураспада настолько велик (во много раз превышает возраст Вселенной), что распад был обнаружен совсем недавно, и для большинства практических целей они могут считаться стабильными, в первую очередь висмут-209: обнаружение этого распада означало, что висмут больше не считалось стабильным. Не исключено, что распад может наблюдаться и в других нуклидах, пополняющих этот список первичных радионуклидов.
- Вторичные радионуклиды - это радиогенные изотопы, полученные в результате распада первичных радионуклидов. У них более короткий период полураспада, чем у первичных радионуклидов. Они возникают в цепочка распада первичных изотопов торий-232, уран-238, и уран-235. Примеры включают природные изотопы полоний и радий. , Такие как углерод-14, присутствуют, потому что они постоянно образуются в атмосфере из-за космические лучи. [6]
Многие из этих радионуклидов существуют в природе только в следовых количествах, включая все космогенные нуклиды. Вторичные радионуклиды будут появляться пропорционально их периоду полураспада, поэтому короткоживущие радионуклиды будут очень редкими. Например, полоний можно найти в уран руды примерно 0,1 мг на метрическая тонна (1 часть из 10 10 ). [7] [8] Другие радионуклиды могут встречаться в природе в практически не обнаруживаемых количествах в результате редких событий, таких как спонтанное деление или необычные взаимодействия космических лучей.
Ядерное деление
Радионуклиды образуются как неизбежный результат ядерное деление и термоядерные взрывы. Процесс ядерного деления создает широкий спектр продукты деления, большинство из которых являются радионуклидами. Дальнейшие радионуклиды могут быть образованы при облучении ядерного топлива (создавая диапазон актиниды) и окружающих структур, давая продукты активации. Эта сложная смесь радионуклидов с различным химическим составом и радиоактивностью делает обращение с ядерные отходы и имея дело с радиоактивные осадки особенно проблематично.
Синтетический

Синтетические радионуклиды сознательно синтезируются с использованием ядерные реакторы, ускорители частиц или генераторы радионуклидов:
- Радиоизотопы можно не только извлекать из ядерных отходов, но и намеренно производить с помощью ядерных реакторов, используя высокий поток нейтроны настоящее время. Эти нейтроны активируют элементы, размещенные внутри реактора. Типичный продукт ядерного реактора иридий-192. Элементы, которые имеют большую склонность к поглощению нейтронов в реакторе, как говорят, имеют высокую нейтронное сечение.
- Ускорители частиц, такие как циклотроны ускорять частицы, чтобы бомбардировать цель с образованием радионуклидов. Циклотроны ускоряют протоны в мишени с образованием излучающих позитрон радионуклидов, например фтор-18.
- Генераторы радионуклидов содержат родительский радионуклид, который распадается с образованием дочернего радиоактивного вещества. Родитель обычно производится в ядерном реакторе. Типичным примером является генератор технеция-99m используется в ядерная медицина. Родитель, произведенный в реакторе, является молибден-99.
Использует
Радионуклиды используются двумя основными способами: либо только для радиации (облучение, ядерные батареи) или для комбинации химических свойств и их излучения (индикаторы, биофармацевтические препараты).
- В биология, радионуклиды углерод может служить радиоактивные индикаторы потому что они химически очень похожи на нерадиоактивные нуклиды, поэтому большинство химических, биологических и экологических процессов обрабатывают их почти одинаково. Затем можно проверить результат с помощью детектора излучения, такого как счетчик Гейгера, чтобы определить, где были включены указанные атомы. Например, можно выращивать растения в среде, в которой углекислый газ содержал радиоактивный углерод; тогда части растения, которые содержат атмосферный углерод, будут радиоактивными. Радионуклиды можно использовать для мониторинга таких процессов, как Репликация ДНК или же аминокислота транспорт.
- В ядерная медицина, радиоизотопы используются для диагностики, лечения и исследований. Радиоактивные химические индикаторы, излучающие гамма-лучи или позитроны, могут предоставить диагностическую информацию о внутренней анатомии и функционировании конкретных органов, включая человеческий мозг. [9][10][11] Это используется в некоторых формах томографии: однофотонная эмиссионная компьютерная томография и позитронно-эмиссионная томография (ПЭТ) сканирование и Черенковская люминесцентная визуализация. Радиоизотопы также являются методом лечения в кроветворный формы опухолей; Успех лечения солидных опухолей был ограничен. Более мощные источники гаммы стерилизовать шприцы и другое медицинское оборудование.
- В консервирование продуктов питания, радиация используется для остановки прорастания корнеплодов после сбора урожая, для уничтожения паразитов и вредителей, а также для контроля созревания хранящихся фруктов и овощей.
- В промышленность, И в добыча полезных ископаемыхрадионуклиды используются для исследования сварных швов, обнаружения утечек, изучения скорости износа, эрозии и коррозии металлов, а также для оперативного анализа широкого диапазона минералов и топлива.
- В космический корабль, радионуклиды используются для выработки электроэнергии и тепла, в частности радиоизотопные термоэлектрические генераторы (РИТЭГи) и радиоизотопные нагреватели (RHU).
- В астрономия и космология, радионуклиды играют роль в понимании звездных и планетных процессов.
- В физика элементарных частиц, радионуклиды помогают открыть новую физику (физика за пределами Стандартной модели) путем измерения энергии и импульса продуктов их бета-распада. [12]
- В экология, радионуклиды используются для отслеживания и анализа загрязняющих веществ, для изучения движения поверхностных вод и для измерения стока воды в результате дождя и снега, а также расхода ручьев и рек.
- В геология, археология, и палеонтология, природные радионуклиды используются для измерения возраста горных пород, минералов и ископаемых материалов.
Примеры
В следующей таблице перечислены свойства выбранных радионуклидов с указанием диапазона свойств и применения.
Ключ: Z = атомный номер; N = число нейтронов; DM = режим распада; DE = энергия распада; EC =захват электронов
Детекторы дыма бытовые

Капсула Америций-241, обнаруженная в дымовом извещателе. Круг из более темного металла в центре - это америций-241; окружающий корпус из алюминия.
Радионуклиды присутствуют во многих домах, поскольку они используются в самых обычных домашних хозяйствах. детекторы дыма. Используемый радионуклид америций-241, который создается при бомбардировке плутония нейтронами в ядерном реакторе. Он распадается, испуская альфа-частицы и гамма-излучение стать нептуний-237. Детекторы дыма используют очень небольшое количество 241 Am (около 0,29 мкг на детектор дыма) в виде диоксид америция. 241 Am используется, поскольку он испускает альфа-частицы, которые ионизируют воздух в детекторе. ионизационная камера. К ионизированному воздуху прикладывается небольшое электрическое напряжение, которое вызывает небольшой электрический ток. В присутствии дыма некоторые ионы нейтрализуются, тем самым уменьшая ток, что активирует сигнализацию извещателя. [13] [14]
Воздействие на организмы
Ниже приводится сводная таблица для общего список нуклидов с периодом полураспада более одного часа. Девяносто из этих 989 нуклидов теоретически стабильны, за исключением протонного распада (который никогда не наблюдался). Около 252 нуклидов никогда не наблюдались распада и классически считаются стабильными.
Остальные радионуклиды в таблице имеют период полураспада более 1 часа и хорошо охарактеризованы (см. список нуклидов для полной таблицы). Они включают 30 нуклидов с измеренными периодами полураспада, превышающими предполагаемый возраст Вселенной (13,8 миллиарда лет). [16] ), и еще 4 нуклида с достаточно длительным периодом полураспада (> 100 миллионов лет), чтобы они были радиоактивными. первичные нуклиды, и могут быть обнаружены на Земле, поскольку они выжили благодаря своему присутствию в межзвездной пыли еще до образования Солнечной системы, примерно 4,6 миллиарда лет назад. Еще 60+ короткоживущих нуклидов могут быть обнаружены естественным путем как дочери долгоживущих нуклидов или продуктов космических лучей. Остальные известные нуклиды известны исключительно из искусственных источников. ядерная трансмутация.
Это сводная таблица [17] для 989 нуклидов с периодом полураспада более одного часа (включая стабильные), приведенные в список нуклидов.
Список коммерчески доступных радионуклидов
Этот список охватывает распространенные изотопы, большинство из которых доступны в очень небольших количествах для широкой публики в большинстве стран. Другие, которые не являются общедоступными, продаются в промышленных, медицинских и научных областях и подлежат государственному регулированию.
Определение
Чтобы разобраться с понятием радиоактивных элементов, необходимо для начала сказать, что изотопы – это образцы одного и тот же химического элемента, но с разной массой. Что это значит? Вопросы исчезнут, если для начала мы вспомним строение атома. Состоит он из электронов, протонов и нейтронов. Число первых двух элементарных частиц в ядре атома всегда постоянно, тогда как нейтроны, имеющие собственную массу, могут встречаться в одном и том же веществе в разных количествах. Это обстоятельство и порождает разнообразие химических элементов с разными физическими свойствами.
Теперь мы можем дать научное определение исследуемому понятию. Итак, изотопы – это совокупный набор похожих по свойствам химических элементов, но имеющих разную массу и физические свойства. Согласно более современной терминологии, они носят название плеяды нуклеотидов химического элемента.
Немного истории
В начале прошлого века ученые обнаружили, что у одного и того же химического соединения в разных условиях могут наблюдаться разные массы ядер электронов. С чисто теоретической точки зрения, такие элементы можно было посчитать новыми и начать заполнять ими пустые клеточки в периодической таблице Д. Менделеева. Но свободных ячеек в ней всего девять, а новые элементы ученые открывали десятками. К тому же и математические подсчеты показали, что обнаруженные соединения не могут считаться ранее не известными, ведь их химические свойства полностью соответствовали характеристикам уже существующих.
После длительных обсуждений было решено назвать эти элементы изотопами и помещать их в одну клеточку с теми, ядра которых содержат с ними одинаковое количество электронов. Ученым удалось определить, что изотопы – это всего лишь некоторые вариации химических элементов. Однако причины их возникновения и длительность жизни изучались еще почти целое столетие. Даже в начале XXI века утверждать, что человечество знает абсолютно все об изотопах, нельзя.
Стойкие и нестойкие вариации
Каждый химический элемент имеет несколько изотопов. Из-за того, что в их ядрах есть свободные нейтроны, они не всегда вступают в стабильные связи с остальными составляющими атома. Через некоторое время свободные частицы покидают ядро, из-за чего меняется его масса и физические свойства. Так образуются другие изотопы, что ведет в конце концов к образованию вещества с равным количеством протонов, нейтронов и электронов.
Те вещества, которые распадаются очень быстро, называются радиоактивными изотопами. Они выпускают в пространство большое количество нейтронов, образующих мощное ионизирующее гамма-излучение, известное своей сильной проникающей способностью, которая негативно влияет на живые организмы.
Более стойкие изотопы не являются радиоактивными, поскольку количество выделяемых ими свободных нейтронов не способно образовывать излучения и существенно влиять на другие атомы.
Достаточно давно учеными была установлена одна важная закономерность: у каждого химического элемента есть свои изотопы, стойкие или радиоактивные. Интересно, что многие из них были получены в лабораторных условиях, а их присутствие в естественном виде невелико и не всегда фиксируется приборами.
Распространение в природе
В естественных условиях чаще всего встречаются вещества, масса изотопа которых напрямую определяется его порядковым числом в таблице Д. Менделеева. К примеру, водород, обозначаемый символом Н, имеет порядковый номер 1, а его масса равна единице. Изотопы его, 2Н и 3Н, в природе встречаются крайне редко.
Даже человеческий организм имеет некоторое количество радиоактивных изотопов. Попадают они внутрь через пищу в виде изотопов углерода, который, в свою очередь, впитывается растениями из почвы или воздуха и переходит в состав органических веществ в процессе фотосинтеза. Поэтому и человек, и животные, и растения излучают определенный радиационный фон. Только он настолько низкий, что не мешает нормальному функционированию и росту.
Источниками, которые способствуют образованию изотопов, выступают внутренние слои земного ядра и излучения из космоса.
Как известно, температура на планете во многом зависит от ее горячего ядра. Но только совсем недавно стало понятно, что источником этого тепла выступает сложная термоядерная реакция, в которой участвуют радиоактивные изотопы.
Распад изотопов
Поскольку изотопы – это нестойкие образования, можно предположить, что они по прошествии времени всегда распадаются на более постоянные ядра химических элементов. Это утверждение верно, поскольку ученым не удалось обнаружить в природе огромного количества радиоактивных изотопов. Да и большинство из тех, которые были добыты в лабораториях, просуществовали от пары минут до нескольких дней, а потом снова превратились в обычные химические элементы.
Но есть в природе и такие изотопы, которые оказываются очень устойчивыми к распаду. Они могут существовать миллиарды лет. Образовались такие элементы в те далекие времена, когда земля еще формировалась, а на ее поверхности не было даже твердой коры.
Радиоактивные изотопы распадаются и вновь образуются очень быстро. Поэтому с той целью, чтобы облегчить оценку стойкости изотопа, учеными было принято решение рассматривать категорию периода его полураспада.
Период полураспада
Не всем читателям может быть сразу понятно, что имеется в виду под этим понятием. Определим же его. Период полураспада изотопа – это время, за которое перестанет существовать условная половина взятого вещества.

Это не означает, что оставшаяся часть соединения будет уничтожена за такое же количество времени. Применительно к этой половине необходимо рассматривать иную категорию – период времени, за который исчезнет ее вторая часть, то есть четверть изначального количества вещества. И такое рассмотрение продолжается до бесконечности. Можно предположить, что время полного распада изначального количества вещества посчитать просто невозможно, поскольку этот процесс практически бесконечен.
Однако ученые, зная период полураспада, могут определить, какое количество вещества существовало вначале. Эти данные успешно используются в смежных науках.
В современном научном мире понятие полного распада практически не используется. Относительно каждого изотопа принято указывать время его полураспада, которое варьирует от нескольких секунд до многих миллиардов лет. Чем меньше показатель полураспада, там большее излучение исходит от вещества и тем выше его радиоактивность.
Обогащение ископаемых
В некоторых отраслях науки и техники использование относительно большого количества радиоактивных веществ считается обязательным. Но при этом в естественных условиях таких соединений совсем немного.
Известно, что изотопы – это нераспространенные варианты химических элементов. Количество их измеряется несколькими процентами от самой стойкой разновидности. Именно поэтому ученым необходимо проводить искусственное обогащение ископаемых материалов.
За годы исследований удалось узнать, что распад изотопа сопровождается цепной реакцией. Освобожденные нейтроны одного вещества начинают влиять на другое. В результате этого тяжелые ядра распадаются на более легкие и получаются новые химические элементы.

Это явление получило название цепной реакции, в результате которой можно получить более стойкие, но менее распространенные изотопы, которые в дальнейшем используются в народном хозяйстве.
Применение энергии распада
Также учеными было выяснено, что в ходе распада радиоактивного изотопа выделяется огромное количество свободной энергии. Ее количество принято измерять единицей Кюри, равной времени деления 1 г радона-222 за 1 секунду. Чем выше этот показатель, тем больше энергии выделяется.
Это стало поводом для разработки способов использования свободной энергии. Так появились атомные реакторы, в которые помещается радиоактивный изотоп. Большая часть энергии, выделяемой им, собирается и превращается в электричество. На основании этих реакторов создаются атомные станции, которые дают самое дешевое электричество. Уменьшенные варианты таких реакторов ставят на самоходные механизмы. Учитывая опасность аварий, чаще всего такими машинами выступают подводные лодки. В случае отказа реактора количество жертв на подлодке будет легче свести к минимуму.

Еще один очень страшный вариант использования энергии полураспада – атомные бомбы. Во время Второй мировой войны они были испытаны на человечестве в японских городах Хиросима и Нагасаки. Последствия оказались очень печальными. Поэтому в мире действует соглашение о неиспользовании этого опасного оружия. В месте с тем большие государства с ориентацией на милитаризацию и сегодня продолжают исследования в этой отрасли. Кроме того, многие из них втайне от мирового сообщества изготавливают атомные бомбы, которые в тысячи раз опаснее тех, которые использовались в Японии.
Изотопы в медицине
В мирных целях распад радиоактивных изотопов научились использовать в медицине. Направив излучение на пораженный участок организма, можно приостановить течение болезни или помочь пациенту полностью излечиться.
Но чаще радиоактивные изотопы используют для диагностики. Все дело в том, что их движение и характер скопления проще всего зафиксировать по излучению, которое они производят. Так, в организм человека вводится определенное неопасное количество радиоактивного вещества, а по приборам медики наблюдают, как и куда оно попадет.
Таким образом проводят диагностику работы головного мозга, характера раковых опухолей, особенности работы желез внутренней и внешней секреции.
Применение в археологии
Известно, что в живых организмах всегда есть радиоактивный углерод-14, полураспад изотопа которого равен 5570 лет. Кроме того, ученные знают, какое количество этого элемента содержится в организме до момента его смерти. Это значит, что все спиленные деревья излучают одинаковое количество радиации. Со временем интенсивность излучения падает.
Это помогает археологам определить, как давно умерло дерево, из которого построили галеру или любой другой корабль, а значит, и само время строительства. Этот метод исследования получил название радиоактивного углеродного анализа. Благодаря ему ученым легче установить хронологию исторических событий.
Радиоакти́вные изото́пы — изотопы, ядра которых нестабильны и испытывают радиоактивный распад. Большинство известных изотопов радиоактивны (стабильными являются лишь около 300 из более чем 3000 нуклидов, известных науке). У любого химического элемента есть хотя бы несколько радиоактивных изотопов, в то же время далеко не у всех элементов есть хотя бы один стабильный изотоп; так, все известные изотопы всех элементов, которые в таблице Менделеева идут после свинца, радиоактивны.


Поскольку бета-распад любого типа не изменяет массовое число A изотопа, среди изотопов с одинаковым значением массового числа (изобаров) существует как минимум один бета-стабильный изотоп, отвечающий минимуму на зависимости избытка массы атома от заряда ядра Z при данном A (изобарической цепочке); бета-распады происходят по направлению к этому минимуму. Обычно для изотопов с нечётным A такой минимум один, тогда как для чётных значений A бета-стабильных изотопов может быть 2 и даже 3. Лёгкие бета-стабильные изотопы стабильны также и по отношению к другим видам радиоактивного распада и, таким образом, являются абсолютно стабильными (если не принимать во внимание до сих пор никем не обнаруженный распад протона, предсказываемый многими современными теориями-расширениями Стандартной Модели). Начиная с А=36 на чётных изобарических цепочках появляется второй минимум. Бета-стабильные ядра в локальных минимумах изобарических цепочек способны испытывать двойной бета-распад в глобальный минимум цепочки, хотя периоды полураспада по этому каналу очень велики (10 19 лет и более). Тяжёлые бета-стабильные ядра могут испытывать альфа-распад (начиная с A≈140), кластерный распад и спонтанное деление.
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Радиоактивные изотопы" в других словарях:
Радиоактивные изотопы — см. Изотопы радиоактивные EdwART. Словарь терминов МЧС, 2010 … Словарь черезвычайных ситуаций
РАДИОАКТИВНЫЕ ИЗОТОПЫ — нестабильные (см.) хим. элементов, обладающие различными видами радиоактивности. Широко используются в научных исследованиях, в промышленности, измерительных и контрольных приборах, индикаторах, сельском хозяйстве, медицине и т. д … Большая политехническая энциклопедия
радиоактивные изотопы — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN radioactive species … Справочник технического переводчика
Радиоактивные изотопы — неустойчивые изотопы химических элементов, которые в процессе радиоактивного распада, сопровождающегося ионизирующим излучением, самопроизвольно превращаются в другие изотопы (обычно другого элемента). Различают Р. и. природные и искусственные,… … Словарь военных терминов
РАДИОАКТИВНЫЕ ИЗОТОПЫ — неустойчивые изотопы хим. элементов, к рые самопроизвольно превращаются в другие нуклиды. Различают Р. и. природные (ок. 300) и искусственные (св. 1500), получаемые в лабораторных условиях в результате разл. ядерных реакций. Р. и. используются в… … Большой энциклопедический политехнический словарь
ИЗОТОПЫ — (от изо. и греческого topos место), разновидности химических элементов, у которых ядра атомов (нуклидов) отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе химических … Современная энциклопедия
Изотопы — (от изо. и греческого topos место), разновидности химических элементов, у которых ядра атомов (нуклидов) отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе химических … Иллюстрированный энциклопедический словарь
ИЗОТОПЫ — (от изо. и греч. topos место) разновидности химических элементов, у которых ядра атомов отличаются числом нейтронов, но содержат одинаковое число протонов и поэтому занимают одно и то же место в периодической системе элементов. Различают… … Большой Энциклопедический словарь
ИЗОТОПЫ КОС МОГЕНН ЫЕ — стабильные и радиоактивные изотопы, образующиеся в природных объектах под действием космического излучения, напр., по схеме: XАz + Р → YAZ + an + bр, в которой А = A1+ an + (b 1)р; Z = Z1.+ (b 1)p, где ХAz исходное ядро, Р быстрый… … Геологическая энциклопедия
изотопы — ов; мн. (ед. изотоп, а; м.). [от греч. isos равный и topos место] Спец. Разновидности одного и того же химического элемента, различающиеся массой атомов. Радиоактивные изотопы. Изотопы урана. ◁ Изотопный, ая, ое. И. индикатор. * * * изотопы (от… … Энциклопедический словарь
Ясное дело, химикам и физикам это лучше не читать. Объяснения в статье примитивные, со множеством допущений, рассчитанные на людей, далеких от науки.
Итак, изотоп. Лучше всего рассматривать его на примере водорода – самого распространенного во Вселенной элемента, занимающего первый атомный номер в периодической таблице.
Протоны имеют положительный заряд, электроны – отрицательный, а нейтроны – нейтральны. Поэтому атом электрически нейтрален тогда, когда число протонов и электронов совпадает. В противном случае этот атом будет называться ионом. Протоны и нейтроны в ядре связаны сильным взаимодействием – одним из самых сильных в природе.
Мы договорились рассматривать изотопы на примере водорода. Водород выглядит намного проще, чем верхний рисунок: он имеет один-единственный протон, вокруг которого по орбите движется электрон (даже нейтрона у него нет):
Изотопы – это те вещества, у которых атомы имеют одинаковое число протонов и электронов, а отличаются лишь числом нейтронов. Атомный номер элемента при этом не меняется, ведь число протонов остается то же самое. Но меняется массовое число – так как нейтроны добавляют массу атому.
Давайте добавим к нашему простейшему водороду один нейтрон. Теперь водород выглядит так:
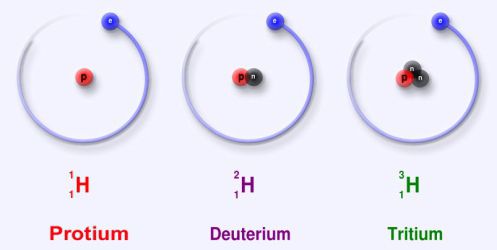
С точки зрения химика ничего не изменилось, остался прежний водород с его химическими свойствами. И остался этот наш водород по-прежнему в первой ячейки периодической системы. А вот с физической точки зрения есть большая разница: это самый настоящий изотоп. С точки зрения изотопов простейший водород (без нейтрона) также является изотопом и называется протием. Водород с одним нейтроном называется дейтерием, а с двумя нейтронами – тритием:
Тритий нестабилен и распадается в течение 12,3 лет. Изотопы водорода с большим количеством нейтронов (квадий, пентий и пр.) в природе устойчиво не существуют, так как распадаются за мельчайшие доли секунды.
Кроме водорода множество других химических элементов имеют изотопы. Они бывают радиоактивные (в которых ядра атомов крайне нестабильны и распадаются с испусканием частиц), а бывают стабильные, которые распадаются миллионы лет. На сегодня известно более 2000 нестабильных изотопов и около 270 стабильных. Атомное ядро не может содержать произвольное количество нейтронов, делающих вещество изотопом, поэтому количество изотопов не бесконечно.
Для чего нам нужны изотопы? Для огромного количества самых разных задач, в том числе биологических, агрохимических, медицинских, научных. Так, например, наверняка все слышали про радиоуглеродный анализ, позволяющий определить возраст биологических останков. Дело в том, что один из изотопов углерода 14С содержится в большом количестве в атмосфере, имеет период полураспада 5600 лет и активно участвует в углеродном обмене со всеми живыми организмами. После гибели организма данный изотоп начинает постепенно распадаться. Зная примерное содержание изотопа в организме и измерив его активность можно с большой точностью определить время смерти организма.
Широко применяются изотопы и в медицинских средствах инструментальной диагностики.
Разумеется, изотопы применяются в ядерном оружии. Например, в водородной бомбе происходит практически мгновенная реакция синтеза уже упомянутых дейтерия и трития в более тяжелые элементы.
Итак, что необходимо запомнить? Что изотопы – это вещества, в атомном ядре которого находится различное количество нейтронов.
- Радионукли́ды, радиоакти́вные нукли́ды (менее точно — радиоакти́вные изото́пы, радиоизото́пы) — нуклиды, ядра которых нестабильны и испытывают радиоактивный распад. Большинство известных нуклидов радиоактивны (стабильными являются лишь около 300 из более чем 3000 нуклидов, известных науке). Радиоактивны все нуклиды, имеющие зарядовое число Z, равное 43 (технеций) или 61 (прометий) или большее 82 (свинец); соответствующие элементы называются радиоактивными элементами. Радионуклиды (главным образом бета-неустойчивые) существуют у любого элемента (то есть для любого зарядового числа), причём у любого элемента радионуклидов существенно больше, чем стабильных нуклидов.
Поскольку бета-распад любого типа не изменяет массовое число A нуклида, среди нуклидов с одинаковым значением массового числа (изобаров) существует как минимум один бета-стабильный нуклид, отвечающий минимуму на зависимости избытка массы атома от заряда ядра Z при данном A (изобарической цепочке); бета-распады происходят по направлению к этому минимуму (β−-распад — с увеличением Z, β+-распад и электронный захват — с уменьшением Z), спонтанные переходы в обратном направлении запрещены законом сохранения энергии. Для нечётных A такой минимум один, тогда как для чётных значений A бета-стабильных нуклидов может быть 2 и даже 3. Большинство лёгких бета-стабильных нуклидов стабильны также и по отношению к другим видам радиоактивного распада и, таким образом, являются абсолютно стабильными (если не принимать во внимание до сих пор никем не обнаруженный распад протона, предсказываемый многими современными теориями-расширениями Стандартной Модели).
Начиная с А = 36 на чётных изобарических цепочках появляется второй минимум. Бета-стабильные ядра в локальных минимумах изобарических цепочек способны испытывать двойной бета-распад в глобальный минимум цепочки, хотя периоды полураспада по этому каналу очень велики (1019 лет и более) и в большинстве случаев, когда такой процесс возможен, он экспериментально не наблюдался. Тяжёлые бета-стабильные ядра могут испытывать альфа-распад (начиная с A ≈ 140), кластерный распад и спонтанное деление.
Большинство радионуклидов получаются искусственным путём, однако существуют и природные радионуклиды, к которым относятся:
радионуклиды с большими периодами полураспада (>5·107 лет, например уран-238, торий-232, калий-40), которые не успели распасться с момента нуклеосинтеза за время существования Земли, 4,5 млрд лет;
* радиогенные радионуклиды — продукты распада вышеуказанных долгоживущих радионуклидов (например, радон-222 и другие радионуклиды из рядов радия, тория и актиния);
Связанные понятия
Радиоакти́вный элеме́нт — химический элемент, все изотопы которого радиоактивны. На практике этим термином часто называют всякий элемент, в природной смеси которого присутствует хотя бы один радиоактивный изотоп, то есть если элемент проявляет радиоактивность в природе. Кроме того, радиоактивными являются все синтезированные на сегодняшний день искусственные элементы, так как все их изотопы радиоактивны.
Ионизи́рующее излуче́ние (неточный синоним с более широким значением — радиа́ция) — потоки фотонов, элементарных частиц или атомных ядер, способные ионизировать вещество.
Изотопы кобальта — разновидности химического элемента кобальта, имеющие разное количество нейтронов в ядре.
Упоминания в литературе
Число нерадиоактивных (стабильных) и радиоактивных соединений с H2O достигает 18: собственно H2O, 8 стабильных и 9 радиоактивных тяжелых молекулярных форм. Если учитывать все известные изотопы элементов воды (кислорода и водорода), то можно говорить о существовании 476 форм воды. Но распад радиоактивных изотопов водорода (за исключением трития) продолжается от долей секунд до нескольких секунд, что делает невозможным образование химических связей и длительное существование молекул воды с такими изотопами. Что касается тяжелых радиоизотопов кислорода, их полураспад происходит в течение наносекунд или нескольких секунд, поэтому воду с ними получить нереально. Можно выявить лишь микрообразцы.
Радиоактивные излучения возникают лишь в момент самопроизвольного превращения неустойчивого радионуклида в другой изотоп. Одни радиоактивные изотопы изменяются быстро, превращаясь в обычные стабильные. Другие – очень медленно (живут долго, излучая постоянно). Скорость распада принято описывать периодом полураспада (Т 1/2) – таким промежутком, в течение которого из всех имеющихся в наличии ядер половина подвергается самопроизвольному превращению. Чем интенсивнее идет радиоактивный распад, тем короче период полураспада. Например, период полураспада плутония-239 равен 24 410 лет, радия-226 – 1617 лет, радона-222 – 3,82 дня, некоторых элементарных частиц – миллионные доли секунды.
Подходим к сути. Все нестабильные изотопы распадаются с постоянной, хорошо известной скоростью. Более того, скорость распада некоторых изотопов существенно меньше, чем у других. Распад во всех случаях описывается экспонентой. Это значит, что если в начале эксперимента есть 100 г радиоактивного изотопа , то за единицу времени в другой химический элемент будет превращаться не фиксированное количество изотопа (скажем, 10 г), а строго определенная доля оставшегося количества. Здесь следует сказать о так называемом периоде полураспада – времени, за которое распадается половина атомов радиоактивного изотопа. Период полураспада не изменяется в зависимости от того, сколько атомов распалось прежде – это и означает, что процесс идет экспоненциально. Естественно, что при таком последовательном “ополовинивании” мы никогда не узнаем наверняка, что атомов начального элемента не осталось. Тем не менее, мы можем сказать, что спустя некоторое достаточно долгое время – например, десять периодов полураспада – останется так мало атомов исходного элемента, что в практических целях этим количеством можно пренебречь. Например, период полураспада углерода-14 составляет 5730?40 лет. Следовательно, для ископаемых образцов старше 50–60 тысяч лет радиоуглеродное датирование не подходит, и необходимо пользоваться более медленными “часами”.
В отличие от радиоактивного изотопа (14С) доля стабильных изотопов углерода в современном мире постоянна (12С/13С = 98,89/1,11). Поэтому любые отклонения от стандартной пропорции определимы и значимы, а в случае углерода практически всегда опосредованы деятельностью живых существ.
Период полураспада – время, за которое распадается половина радиоактивного изотопа и соответственно наполовину уменьшается его опасность. Изотопы с коротким периодом полураспада, измеряемым секундами, часами или днями, считаются менее опасными для среды (радиоактивные йод, фосфор, сера и др.). Sr90 и Cs137 являются наиболее опасными продуктами в отходах ядерных реакторов и при взрывах атомных бомб, так как эти изотопы имеют периоды полураспада около 30 лет. Поэтому при загрязнении среды этими изотопами опасность сохраняется сотни лет. C14 имеет период полураспада более 5 тысяч лет, но поскольку он выделяется в газообразной форме (углекислый газ), то опасность от радиоактивного углерода считается меньшей.
Связанные понятия (продолжение)
Изотопы стронция — разновидности химического элемента стронция, имеющие разное количество нейтронов в ядре.
Изото́пы иода — разновидности химического элемента иода, имеющие разное количество нейтронов в ядре. Известны 37 изотопов иода с массовыми числами от 108 до 144.
Изотопы технеция — разновидности атомов (и ядер) химического элемента технеция, имеющие разное содержание нейтронов в ядре.
Изото́пы ура́на — разновидности атомов (и ядер) химического элемента урана, имеющие разное содержание нейтронов в ядре. На данный момент известны 26 изотопов урана и еще 6 возбуждённых изомерных состояний некоторых его нуклидов. В природе встречаются три изотопа урана: 234U (изотопная распространенность 0,0055 %), 235U (0,7200 %), 238U (99,2745 %).
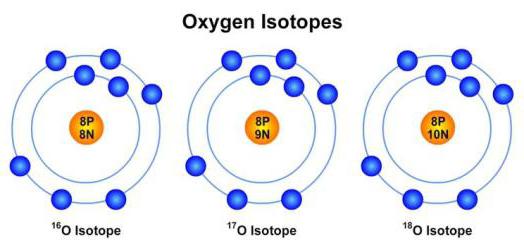
Изотопы кислорода — разновидности атомов (и ядер) химического элемента кислорода, имеющие разное содержание нейтронов в ядре.
Быстрые нейтроны — свободные нейтроны, кинетическая энергия которых больше некоторой величины, конкретное значение которой зависит от контекста, в котором используется термин.
Трансура́новые элеме́нты (заурановые элементы, трансураны) — радиоактивные химические элементы, расположенные в периодической системе элементов Д. И. Менделеева за ураном, то есть с атомным номером выше 92.
Тепловые нейтроны или медленные нейтроны — свободные нейтроны, кинетическая энергия которых близка к средней энергии теплового движения молекул газа при комнатной температуре (примерно 0,025 эВ).
Изотопы висмута — разновидности химического элемента висмута, имеющие разное количество нейтронов в ядре.
А́льфа-распа́д — вид радиоактивного распада ядра, в результате которого происходит испускание дважды магического ядра гелия 4He — альфа-частицы. При этом массовое число ядра уменьшается на 4, а атомный номер — на 2.
Акти́вность радиоакти́вного исто́чника — число элементарных радиоактивных распадов в единицу времени.
Изотопы никеля — разновидности химического элемента никеля, имеющие разное количество нейтронов в ядре.
Бета-частица (β-частица) — заряженная частица (электрон или позитрон), испускаемая в результате бета-распада . Поток бета-частиц называется бета-лучами или бета-излучением.
Изотопы железа — разновидности химического элемента железа, имеющие разное количество нейтронов в ядре.
Разделе́ние изото́пов — технологический процесс изменения изотопного состава вещества, состоящего из смеси различных изотопов одного химического элемента. Из одной смеси изотопов или химических соединений на выходе процесса получают две смеси: одна с повышенным содержанием требуемого изотопа (обогащенная смесь), другая с пониженным (обедненная смесь).
Изото́пы лития — разновидности атомов (и ядер) химического элемента лития, имеющие разное содержание нейтронов в ядре. На данный момент известны 9 изотопов лития и ещё 2 возбуждённых изомерных состояний некоторых его нуклидов, 10m1Li − 10m2Li.
Изото́пы углеро́да — разновидности атомов (и ядер) химического элемента углерода, имеющие разное содержание нейтронов в ядре. Углерод имеет два стабильных изотопа — 12C и 13C. Содержание этих изотопов в природном углероде равно соответственно 98,93 % и 1,07 %. Известны также 13 радиоактивных изотопов углерода (от 8C до 22C), из которых один — 14C — встречается в природе (его содержание в атмосферном углероде около 10−12). Углерод — лёгкий элемент, и его изотопы значительно различаются по массе, а.
Изото́пы свинца́ — разновидности химического элемента свинца, имеющие разное количество нейтронов в ядре.
Замедле́ние нейтро́нов — процесс уменьшения кинетической энергии свободных нейтронов в результате их многократных столкновений с атомными ядрами вещества. Вещество, в котором происходит процесс замедления нейтронов, называется замедли́телем. Замедление нейтронов применяется, например, в ядерных реакторах на тепловых нейтронах.
Изотопная распространённость (или распространённость изотопов) — относительное количество атомов разных изотопов одного химического элемента; обычно выражается в % к сумме атомов всех долгоживущих (с периодом полураспада Т > 3⋅108 лет) изотопов данного элемента в среднем в природе (либо с отнесением к той или иной природной среде, планете, региону и т. п.). Точное измерение изотопной распространённости имеет большое значение для определения атомных масс элементов.
Наведённая радиоактивность — это радиоактивность веществ, возникающая под действием облучения их ионизирующим излучением, особенно нейтронами.
Я́дерная реа́кция — это процесс взаимодействия атомного ядра с другим ядром или элементарной частицей, который может сопровождаться изменением состава и строения ядра. Последствием взаимодействия может стать деление ядра, испускание элементарных частиц или фотонов. Кинетическая энергия вновь образованных частиц может быть гораздо выше первоначальной, при этом говорят о выделении энергии ядерной реакцией.
Бе́та-распа́д (β-распад) — тип радиоактивного распада, обусловленный слабым взаимодействием и изменяющий заряд ядра на единицу без изменения массового числа. При этом распаде ядро излучает бета-частицу (электрон или позитрон), а также нейтральную частицу с полуцелым спином (электронное антинейтрино или электронное нейтрино)
Ядерная химия — часть химии высоких энергий, раздел физической химии — изучает ядерные реакции и сопутствующие им физико-химические процессы, устанавливает взаимосвязь между физико-химическими и ядерными свойствами вещества. Часто под ядерной химией подразумевают области исследования радиохимии (иногда как её раздел) и радиационной химии. Это разные науки, но ядерная химия является для них теоретическим фундаментом. Термин ядерная химия даже в настоящее время не является общепринятым по причине того.
Тяжёлая вода́ — обычно этот термин применяется для обозначения тяжёловодородной воды, известной также как оксид дейтерия. Тяжёловодородная вода имеет ту же химическую формулу, что и обычная вода, но вместо двух атомов обычного лёгкого изотопа водорода (протия) содержит два атома тяжёлого изотопа водорода — дейтерия, а её кислород по изотопному составу соответствует кислороду воздуха. Формула тяжёловодородной воды обычно записывается как D2O или 2H2O. Внешне тяжёлая вода выглядит как обычная — бесцветная.
Калифо́рний — радиоактивный химический элемент седьмого периода таблицы Менделеева, актиноид, один из самых дорогих металлов на Земле.
Беккере́ль (русское обозначение: Бк; международное: Bq) — единица измерения активности радиоактивного источника в Международной системе единиц (СИ). Один беккерель определяется как активность источника, в котором за одну секунду происходит в среднем один радиоактивный распад.
Атомно-эмиссионная спектроскопия (спектрометрия), АЭС или атомно-эмиссионный спектральный анализ — совокупность методов элементного анализа, основанных на изучении спектров испускания свободных атомов и ионов в газовой фазе (см. группу методов оптической спектроскопии). Обычно эмиссионные спектры регистрируют в наиболее удобной оптической области длин волн от ~200 до ~1000 нм. (Для регистрации спектров в области радиоактивный изотоп аргона 37Аг и испускается электрон. По причине исключительно слабого взаимодействия нейтрино с веществом такие процессы будут происходить чрезвычайно редко. Поэтому установка для обнаружения солнечных нейтрино выглядит весьма необычно. Представьте себе большое количество специальных цистерн, наполненных прозрачной жидкостью перхлорэтиленом (С2С14). Количества этой жидкости достаточно, чтобы, например, заполнить большой бассейн для плавания. В таком гигантском количестве перхлорэтилена можно ожидать образования около десятка изотопов аргона ежедневно из-за захвата солнечных нейтрино ядрами 37С1, входящими в состав жидкости. Оказывается, что средства современной экспериментальной физики позволяют обнаружить это ничтожно малое количество вновь образовавшихся изотопов аргона.
1) вызванную воздействием общего внешнего излучения или радиоактивных изотопов с равномерным распределением их в организме (Н3, Na24, Cs27 и др.);
К физическим канцерогенам относятся различные виды ионизирующей радиации (рентгеновские, g-лучи, элементарные частицы – протоны, нейтроны, a-, b-частицы), а также ультрафиолетовое излучение. Чаще всего под влиянием радиации возникают лейкозы, опухоли легких, кожи и костей, а также эндокриннозависимые опухоли (молочной железы, репродуктивной системы, щитовидной железы). Введение в организм радиоактивных изотопов может вызвать развитие опухолей в различных органах, в первую очередь в тех, где накапливаются радиоактивные вещества.
Читайте также:


