Радий история открытия кратко
Обновлено: 30.06.2024
Радий в природе и его свойства.
Несмотря на сравнительно малое время жизни по сравнению с возрастом Земли (около пяти миллиардов лет), некоторые изотопы радия, хотя и в очень малых количествах, встречаются в природе. Происходит это благодаря существованию в природе трех радиоактивных рядов, в которых изотопы радия непрерывно образуются при распаде долгоживущих (так называемых материнских) радионуклидов: урана-238 (из него получается 226 Ra), урана-235 (он дает 223 Ra, t1/2 = 11,4 суток) и тория-232 (дает 228 Ra и 224 Ra, t1/2 = 3,7 суток). Очевидно, что чем меньше период полураспада данного радионуклида, тем меньше его содержание в минералах, даже самый долгоживущий, 226 Ra, содержится в земной коре в количестве всего одной десятимиллиардной доли процента, обычно в тех же породах, в которых содержится уран.
Чистый радий – блестящий серебристо-белый металл, быстро тускнеющий на воздухе из-за образования на его поверхности оксида и нитрида. С водой реагирует более энергично, чем барий, выделяя водород. Плавится радий при 969° С, кипит при 1507° С, плотность – около 6 г/см 3 . Любые физические и химические свойства радия изучать трудно из-за его очень высокой радиоактивности. Радий непрерывно выделяет теплоту, и если нет условий для теплоотвода, металл быстро нагревается и может даже расплавиться. Продукт распада радия – радиоактивный газ радон. Радий вместе с продуктами своего распада излучает все три вида радиации – a-, b- и g-лучи. Из-за высокой радиоактивности радий и его соединения светятся в темноте, его бесцветные соли быстро желтеют, а затем приобретают коричневую, вплоть до черной, окраску; их водные растворы разлагают воду, выделяя из нее водород и кислород.
Если не считать сильной радиоактивности, химические свойства радия и его соединений мало отличаются от аналогичных свойств бария. Как и у бария, легко растворимы хлорид, бромид, иодид, нитрат радия, а фторид, карбонат и сульфат почти нерастворимы. Гидроксид Ra(OH)2 – сильная щелочь.
В поисках новых радиоактивных элементов.

Используя этот метод, Кюри начала тестировать одно вещество за другим – все, которые она только могла достать, одолжить в химических лабораториях, выпросить в минералогических музеях (она не только аккуратно возвратила образцы владельцам, но и выразила им благодарность в своей публикации). Из всех веществ, не содержащих уран, активность проявили только соединения тория.
Неожиданными оказались количественные результаты измерений. Так, взятый у Муассана металлический уран (он был получен восстановлением оксида углем и содержал примесь углерода) дал ток 23–24 пА; природный монацит (смешанный фосфат редких земель и тория) – 5 пА; чрезвычайно редкий минерал самарскит (смесь оксидов редкоземельных элементов, U, Fe, Nb, Ta и Ti) – 11 пА; черный торит ThSiO4 (обычно содержит примесь урана) – 14 пА, а прозрачные оранжевые кристаллы оранжита (невыветренный силикат тория) – 20 пА; черный оксид урана U2O5 – 27 пА; урановая смоляная руда (урановая смолка) из разных источников (она образует минералы уранинит или настуран примерного состава UO2) – от 16 до 83 пА; желтый минерал отенит Ca(UO2)2(PO4)2·(10–12)H2O – 27 пА; редкий природный минерал хальколит (торбернит) красивого зеленого цвета Cu(UO2)2(PO4)2·(8–12)H2O – 52 пА; желтый минерал карнотит K2(UO2)2V2O8·3H2O – 62 пА.
Все известные элементы были уже изучены и не обладали нужным свойством. Химический анализ радиоактивных минералов соответствовал их формуле, это означало, что нового элемента в этих минералах исключительно мало, поэтому этот элемент (возможно, не он один) быть очень активным! Как только стало ясно, что в урановых и ториевых рудах содержится неизвестное вещество с очень высокой радиоактивностью, началась работа по его выделению. Завершилась она выдающимся открытием новых химических элементов – полония и радия.
Стало ясно, что в урановой смолке присутствует неизвестный радиоактивный элемент (или несколько элементов). Тщательный химический анализ этого вещества привел в 1898 к открытию нового радиоактивного элемента – полония.
В первом исследовании урановой смолки супруги Кюри упустили важное обстоятельство. Оказалось, что если из азотнокислого раствора осадить сульфат бария (потом его перевели в растворимый хлорид), он обнаруживает радиоактивность. Стало очевидным, что это еще один радиоактивный элемент – на этот раз аналог не висмута, а бария. Для того чтобы сконцентрировать этот элемент, был использован метод многократной перекристаллизации – тот самый, с помощью которого были разделены очень близкие по свойствам редкоземельные элементы. В данном случае он был основан на разной растворимости солей бария и радия. Так, в 100 г воды при 20° С растворяется 35,7 г хлорида бария, а хлорида радия – почти в два раза меньше, поэтому если из раствора выделить в осадок 1/3 хлорида бария, то хлорида радия выделится 2/3. По этому методу (он называется фракционной кристаллизацией) раствор хлоридов частично выпаривают до образования кристаллов, в которых доля радия выше, чем в растворе. Эти кристаллы снова растворяют и повторяют все сначала. Таким образом, доля радия в выпадающих кристаллах постепенно растет. Раствор, обедненный радием, не выбрасывают, а подвергают дробной кристаллизации. Кроме бария и радия (и урана) исходный минерал содержал довольно много свинца, кремния, тантала, протактиния, железа, тория, актиния, полония, и все эти элементы следовало предварительно отделить от бария (с ничтожной примесью радия). Этот метод требует очень большого числа операций, но другого способа выделить новый элемент не было. На каждой стадии соответствующую фракцию с помощью электрометра проверяли на радиоактивность и таким образом контролировали степень обогащения.
Постепенно супруги Кюри (с помощью Бемона) получили препарат бария, который был в 60 раз активнее, чем чистый уран, после еще нескольких перекристаллизаций – уже в 900 раз более активный, Но опыты пришлось прекратить: последняя, самая активная, фракция была такой маленькой, что дальше работать с ней было уже невозможно – для выделения нового элемента нужны были не граммы, и даже не килограммы руды, а тонны.
С этой радиоактивностью не все было в порядке. Так, 13 июля 1899 П.Кюри отметил в лабораторном журнале непонятный факт – препарат сульфата радия, активность которого в начале года составляла от 150 до 200 единиц, в середине июля показывал уже 600. На той же странице – аналогичная запись М.Кюри – карбонат радия с активностью 1200 вдруг через полгода показал активность 3000. Объяснить это супруги не могли, лишь впоследствии из работ Резерфорда стало известно, что из радия образуются другие короткоживущие радиоактивные элементы, так что только a-активность радия должна примерно через три недели увеличиться вчетверо. Но при одном условии: препарат должен находиться в закрытом сосуде, так как первый продукт превращения радия – газообразный радон.
Как выяснилось, и 100 кг было мало. Урановую смолку добывали в Богемии (латинизированное название Чехии), вблизи знаменитых шахт Иоахимсталя (ныне – город в Чехии Яхимов). Урановую руду сплавляли с содой при доступе воздуха. Плав обрабатывали сначала водой – уран при этом переходил в раствор в виде карбонатного комплекса, затем разбавленной серной кислотой – получался сульфатный комплекс урана. Соединения урана использовали для производства дорогого богемского уранового стекла и глазури по фарфору. Остаток руды после извлечения урана, который содержал весь радий, выбрасывали, и постепенно скопились целые горы отходов, которые сваливали в ближайшем сосновом лесу. Супруги Кюри в конечном счете получили не 100 кг, а более 10 тонн.
Выделение радия.
Работа предстояла огромная – химическая переработка (вручную) многих тонн материала; она заняла четыре года. Вначале остатки кипятили с большим избытком концентрированного раствора соды – при этом содержащиеся в них не растворимые ни в воде, ни в кислотах сульфаты бария и радия (и частично кальция) переходили в карбонаты: Ba(Ra)SO4 + Na2CO3 ® Ba(Ra)CO3 + Na2SO4. Раствор Na2SO4 сливали, а осадок карбонатов бария и радия уже легко растворялся в разбавленной соляной кислоте: Ba(Ra)CO3 + 2HCl ® Ba(Ra)Cl2 + CO2 + H2O. Раствор отфильтровывали от примесей и добавлением серной кислоты из него снова выделяли сульфаты кальция, бария и радия – их получалось от 10 до 20 кг из тонны исходного вещества. Затем весь цикл повторяли, пока не получались чистые соли бария и радия (примерно 8 кг из тонны), отделенные от более растворимого кальция. Использовали и другие химические приемы, необходимые для отделения радия от следов других радиоактивных элементов. Так, свинец, висмут и сопровождающий его полоний осаждали сероводородом в виде нерастворимых сульфидов. Актиний осаждался вместе с железом, алюминием и редкоземельными элементами с помощью раствора аммиака. Затем методом дробной кристаллизации выделяли все более чистую соль радия. По мере увеличения доли радия выпадающие вначале бесцветные кристаллы со временем под действием собственного излучения желтели, затем становились оранжевыми или розовыми, а после растворения снова дали бесцветный раствор.
Сама Кюри много лет спустя призналась, что не уверена, проявила ли бы она такую настойчивость, если бы знала, как мало радия содержится в руде и какая титаническая работа предстоит для получения хотя бы мизерного его количества. Для работы директор Школы выделил им старый сарай с застекленной крышей, где раньше была прозекторская. По подсчетам австрийского физика Стефана Мейера (1872–1950) М.Кюри пришлось переработать вручную свыше 11 тонн отходов, неудивительно, что к вечеру она буквально падала от усталости. Тем не менее, впоследствии она признавалась, что именно в этом сарае провела свои лучшие и счастливейшие годы.
Затем появились помощники и работа пошла быстрее.Весной 1902, после переработки тонны урановых отходов, масса радия (в виде RaCl2) достигла 0,1 г. Позднее подсчитали, что тонна урановой смолки теоретически содержит 0,17 г радия в виде хлорида. Таким образом, потери оказались сравнительно невелики, если учесть колоссальный объем работы в неподходящих условиях и исключительно малое содержание радия в руде: 34 миллионные доли процента. Это и позволило В.Маяковскому написать известные строчки:
та же добыча радия.
единого слова ради,
Чистота препарата была подтверждена Демарсе с помощью спектрального анализа. Полученного вещества было достаточно, чтобы определить атомную массу радия традиционным методом: точную навеску RaCl2 растворяли, осаждали нитратом серебра нерастворимый AgCl, который высушивали и взвешивали. Получилось 225 – именно это значение стояло на месте предполагаемого, еще не открытого элемента в таблице, помещенной Менделеевым в первом издании своего учебника Основы химии.
По мере увеличения количества добытого радия стало возможным более подробно исследовать его свойства, а также свойства его соединений. Оказалось, что под влиянием собственного излучения как сами бесцветные соединения радия, так и стеклянные сосуды, в которых они хранятся, со временем темнеют. Все соединения радия в темноте испускают голубоватое свечение (светятся возбужденные атомы азота).
Пьер и Мария Кюри обнаружили потемнение стекла под влиянием излучения радия (сейчас стекла для очков тонируются тоже с помощью радиации). Немецкий физик Ф.О.Гизель обнаружил, что лучи радия окрашивают и природные кристаллы каменной соли (NaCl) и плавикового шпата (CaF2). Он же показал, что RaBr2 окрашивает пламя в карминовый цвет (как стронций), а в спектре радия есть линии в красной, сине-зеленой и фиолетовой областях спектра.
В 1910 М.Кюри и Дебьерн впервые получили металлический радий. Они использовали метод, примененный ранее для выделения бария. Для этого водный раствор RaCl2 был подвергнут электролизу с ртутным катодом и платино-иридиевым анодом. Образовавшуюся на катоде амальгаму радия нагревали в потоке водорода, постепенно повышая температуру до 700° С (почти до плавления радия), чтобы отогнать ртуть (она кипит при 357° С).
Отказ супругов Кюри на извлечение материальных выгод из своего открытия открыл дорогу к получению и применению радия для ученых всех стран. Начали выходить специальные журналы, посвященные радию и радиоактивности. В 1913 осуществилась мечта Пьера Кюри – в Париже был организован Институт радия. Руководителем одной из двух его лабораторий была Мария Кюри. В том же году был основан Национальный институт радия в США. Еще раньше, в 1910, Институт радия открылся в Вене, его директором был назначен Стефан Мейер. В 1913 лаборатория по радиоактивности открылась в Варшаве. В 1932 при активной помощи сестры Марии Брониславы был создан варшавский Институт радия (ныне – Онкологический институт имени Марии Склодовской-Кюри). В 1922 Радиевый институт был основан в Петрограде; его директором стал В.И.Вернадский (1863–1945). За год до этого в нашей стране первые препараты радия из отечественной ферганской руды получили радиохимик Виталий Григорьевич Хлопин (в будущем – академик и директор Института) и физикохимик и металлург Иван Яковлевич Башилов (1892–1953), предложивший технологию извлечения радия, урана и ванадия (эти элементы содержатся в минерале карнотите).
Цена на радий начала стремительно расти и вскоре значительно превысила стоимость алмазов (в середине 1910-х – почти 180 тыс. долл. за грамм). При тогдашней цене золота (35 долл. за унцию) 1 г радия стоил столько же, сколько 160 кг золота.
Резкое подорожание радия в начале века было связано также с тем, что в конце 1903 австрийское правительство наложило эмбарго на вывоз из Иоахимсталя как самой урановой руды, так и остатков от ее переработки и вскоре само построило там завод по добыче радия. К 1910 на нем получили уже 13 граммов радия, и до 1922 этот завод оставался европейским лидером по производству радия. Огромная цена радия стимулировала поиск его руд и добычу на всех континентах. В 1920–1930-е один за другим открывались новые предприятия по переработке урановых руд и добыче радия – как на своем сырье, так и на привозном. Завод в Ножане, организованный еще Пьером Кюри, работал на разнообразном сырье: урановую смолку ввозили из Венгрии, Швеции, Канады и Колорадо, отенит добывался в самой Франции, а также привозился из Португалии, хальколит – из Богемии, карнотит – из Португалии и Юты (США), а торианит (содержащий уран ThO2) – даже из Цейлона. Добывали торианит и в Японии. В Лондоне перерабатывали руду, добываемую на шахтах юго-западной оконечности Англии (полуостров Корнуолл), часть этой руды перевозили также на переработку во Францию. На заводе близ Стокгольма радий добывали из собственных урансодержащих сланцев и урановой смолки из Норвегии (которая в 1905 стала независимой). В Австралии радий получали из руд, найденных в южных пустынях.
Россия включилась в гонку в 1910, переработку вела частная компания в Фергане, хотя руда оказалась довольно бедной. Во время войны работа прекратилась, но после революции был построен уже государственный завод на Каме, а в 1931 – еще один в Москве. Есть и позорные страницы в отечественной истории радия. Еще в 1930-е малограмотный горнорабочий И.Г.Прохоров начал рассказывать и писать в высокие партийные инстанции о своей мифической встрече в 1914 в Восточной Сибири с Марией Кюри, которая якобы лично подтвердила наличие богатых радиево-урановых месторождений в Минусинском уезде Енисейской губернии. Этот рассказ (вошедший даже в серьезные научные сборники) впоследствии был использован органами госбезопасности СССР для массовых репрессий против советских геологов в 1949 под предлогом сокрытия ими радиево-урановых месторождений.
Но вскоре радиевая промышленность США пришла в упадок: с 1921 начали разрабатываться месторождения в Бельгийском Конго (провинция Катанга), и в 1922 в Бельгии заработал завод близ Антверпена. Африканская руда оказалась очень богатой: она содержала в среднем 50% оксида урана, и если для получения 1 грамма радия в США надо было переработать 300–400 тонн карнотитовой руды, то заводу в Бельгии для того же требовалось всего 10 тонн. С 1922 по 1933 там было выделено 326 г радия. Пик добычи пришелся на конец 1920-х – 60 г радия в год. Но и бельгийцам пришлось сократить производство ввиду сильной конкуренции со стороны Канады. Руду там добывали с 1932 на побережье Большого Медвежьего озера, добыча радия в 1938 достигла 75 г. Данные за последующие годы были засекречены, так как отражали добычу нового стратегического сырья – урана, известно только, что производство радия в Канаде продолжалось до 1954, а в Бельгии – до 1960. С 1930-х весь рынок радия был под контролем бельгийских и канадских компаний. В небольшом количестве радий производили также в Англии, Франции, СССР. В Чехословакии его добывали (в Яхимове) вплоть до 1937.
Общее количество добытого радия увеличивалось быстрыми темпами. Если к 1916 во всем мире было получено 48 г радия, то через 10 лет его было уже 340 г. Постепенное накопление мировых запасов радия, который практически не расходуется (за 10 лет его количество уменьшается за счет распада менее чем на 0,5%), привело к быстрому снижению цены более чем вдвое к началу 1920-х, а затем еще в несколько раз в последующие десятилетия.
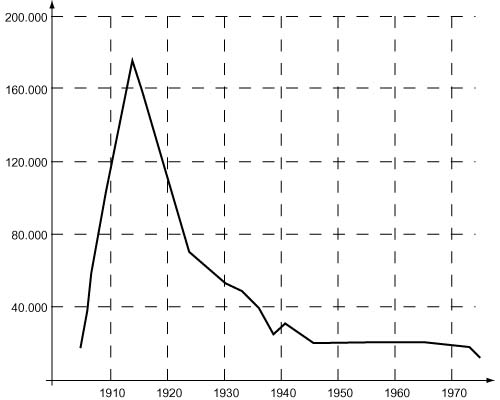
Тем не менее, радий оставался очень дорогим элементом. В настоящее время радия накоплено около 3 кг, и больше его практически не добывают. Более того, при переработке урановых руд радий считается вредным побочным продуктом, требующим безопасного захоронения!
Применение радия.
Сейчас радий находит лишь ограниченное применение и для этого его накопленных запасов более чем достаточно. В медицине радий иногда используют для кратковременного облучения при лечении злокачественных заболеваний кожи, слизистой оболочки носа, мочеполового тракта. Радий используют и как источник радона для приготовления радоновых ванн. Радий можно использовать и в компактных источниках нейтронов, для этого небольшие его количества помещают в ампулу вместе с бериллием, под действием альфа-излучения (ядер гелия) из бериллия выбиваются нейтроны: 9 Be + 4 He ® 12 C + 1 n. Однако сейчас есть множество более дешевых радионуклидов с нужными свойствами, которые получают на ускорителях или ядерных реакторах, например, 60 Co (с периодом полураспада t1/2 = 5,3 года), 137 Cs (t1/2 = 30,2 года), 182 Ta (t1/2 = 115 сут), 192 Ir (t1/2 = 74 сут), 198 Au (t1/2 = 2,7 сут). В приборах постоянного свечения радий также заменяют теперь тритием (t1/2 = 12,3 года) или 147 Pm (t1/2 = 2,6 года).
Радий сильно токсичен; допустимая его концентрация в воздухе исчезающе мала – не более 10 мг/км 3 или 10 –11 г/м 3 . При такой концентрации в 1 м 3 происходит чуть больше двух распадов атомов радия в секунду. Работа с радием и его препаратами, как и с другими радиоактивными веществами, требует строгого соблюдения защитных мер.
На рубеже веков — точнее, в конце декабря 1898 г. — мир узнал об открытии новых химических элементов, способных распадаться с мощным выбросом энергии. Это были радий и полоний, а нашли их супруги Мария и Пьер Кюри.
Началось все за два года до того с подготовки диссертации. Выбирая тему, Мария наткнулась на информацию об эксперименте французского физика Антуана Анри Беккереля, который покрыл солью урана (сульфатом уранила калия) стеклянную светочувствительную пластинку, обернутую черной плотной бумагой, и положил материал на солнце. Через пару часов ученый развернул пластинку и увидел, что она засвечена. Это натолкнуло Беккереля на мысль, что солнечные лучи возбуждают в урановой соли рентгеновское излучение, однако последующие опыты показали: вещество воздействует на пластинку и без света. Так была открыта естественная радиация, не нуждающаяся во внешних возбудителях, — лучи Беккереля.

Продолжая исследования, Мария заметила, что минералы настуран и хальколит, содержащие уран, вчетверо радиоактивнее, нежели чистый уран. Ученая провела химический анализ этих соединений и, не выявив там тория, решила, что в минералах есть еще какой-то неизвестный элемент с очень сильной радиоактивностью.
За последующие полгода супруги исследовали еще одно соединение с высокой радиоактивностью. В соединении присутствовала ничтожная доля бария — и неизвестный элемент (Кюри назвали его радием), испускающий очень мощный лучевой поток. Рассказав о своем открытии членам Французской академии наук, супруги поставили себе цель извлечь радий и полоний из соединений, но для этого им требовались материалы, специально оборудованное помещение и ассистенты, а денег катастрофически не хватало. Минералы, содержащие данные два элемента, можно было найти только в Богемии, и стоили они слишком дорого. Поэтому ученым пришлось довольствоваться отходами производства урана, которые им согласилась поставлять почти даром Академия наук Вены.
Полуразваленный сарай, принадлежавший Школе физиков, был превращен в лабораторию. Протекающая кровля, несколько грубо сколоченных деревянных столов, старая чугунная печка, котлы — вот и все, чем располагали физики-экспериментаторы. Полы и вытяжки в сарае отсутствовали, так что в дождь приходилось работать с распахнутыми настежь окнами, а в солнечную погоду переносить все примитивное оборудование на улицу.
Из-за сложностей с выделением солей полония Мария решила оставить эту затею и полностью сконцентрироваться на радии. Добытое соединение Кюри досконально изучили и разослали для исследования всем заинтересованным физикам, в том числе Беккерелю. Результаты своих экспериментов они изложили в статьях, поведав, какие эффекты вызывают испускаемые солями лучи (в том числе передачу радиоактивности предметам посредством облучения), как на них действует магнитное поле и из чего состоит поток. Так, было определено, что лучи подразделяются на несколько видов: положительно заряженные альфа, отрицательные P и коротковолновые гамма. Кроме того, дабы пронаблюдать влияние радия на организм, Пьер облучил собственную руку, а затем детально описал процесс образования ожога и последующего продолжительного лечения.
После доклада Кюри радий стали добывать чуть ли не во всех странах Европы, причем именно тем способом, что придумали супруги. Это побудило одного крупного промышленника финансировать их дальнейшие исследования и даже выделить им под лабораторию часть своего завода. Теперь Кюри могли брать рабочий материал прямо на заводе и сразу же очищать его в лаборатории, добывая соли радия. За два года Марии удалось выделить 0,1 г хлорида радия, что было непросто, ведь в минерале соотношение этого элемента и урана составляет 0,3 г на тонну. Попутно ученая приблизительно вычислила атомный вес радия — 225, что означало: атом данного элемента в 225 раз тяжелее¹⁄₁₂ эталонного атома изотопа углерода.
В 1903 г. состоялась защита диссертации Марии — профессорá Сорбонны признали, что из всех диссертационных работ труд Кюри стал самым значимым вкладом в науку. В том же году супруги разделили с Беккерелем Нобелевскую премию по физике, и Мария оказалась первой женщиной, которой дали эту награду.
В 1910 г., уже после гибели мужа, Мария наконец-то выделила чистый металлический радий, чем доказала, что это самостоятельный элемент. Такого достижения вполне хватило бы для того, чтобы ученую приняли во Французскую академию наук, однако консервативное большинство академиков воспротивилось присутствию женщины в стенах учреждения.
В 1911 г. Марии вручили еще одну Нобелевскую премию — теперь уже по химии, и она стала первой среди ученых, кто удостоился этой награды дважды.

Радий (лат. Radium), Ra, радиоактивный химический элемент II группы периодической системы (самый тяжёлый элемент главной подгруппы), атомный номер 88, атомная масса 226,0254, аналог бария; относится к щелочноземельным элементам.
Выделен в 1898 г в виде солей М. Кюри, П.Кюри и Г.Бемоном из урановой смолки. Эти исследователи идентифицировали новый элемент в бариевой фракции, получаемой при переработке урановой смоляной руды. Методом дробной кристаллизации хлоридов радия и бария, выделенных из 1 т остатков урановой обманки, было получено 90 мг хлорида радия высокой чистоты. Это позволило определить атомную массу радия и изучить его оптический спектр. Установленная аналогия спектров радия и бария, близость атомной массы элемента к значению, предсказанному Д. И. Менделеевым, а также сходство химических форм этих элементов определило положение радия в периодической системе. В ходе выделения радия за поведением нового элемента следили по его излучению, поэтому и назвали элемент от лат. radius — луч .
Ознакомимся с историей открытия радия, развития производства радия, его физическими и химическими свойствами, а также с существующими соединениями радия, и какую роль он играет в жизни человека.
Открытие радия
История радия начинается с открытия Анри Беккерелем явления радиоактивности (1896 г.).
Три года упорного труда увенчались успехом. Марии Кюри удалось выделить новый химический элемент — радий, обладавший странными, почти волшебными свойствами. Она назвала эти свойства радиоактивностью. Без ее работ не было бы ни рентгеновских снимков, ни радиационных методов лечения рака, ни атомной энергетики, ни новых научных данных о зарождении Вселенной.
Факты и события:
— Супругам Кюри необходимо было переработать более 500 кг уранинита, чтобы получить около 0,1 г чистого радия.
— Мария Кюри не получала никакой финансовой поддержки и не имела собственной лаборатории вплоть до 1904 года, когда она уже завоевала широкое признание и известность в научном мире.
— Мария Кюри была первой женщиной — доктором наук в Европе; первой женщиной, получившей Нобелевскую премию; первым человеком, получившим Нобелевскую премию дважды; первой женщиной, преподававшей в Сорбонне; первой женщиной, избранной во французскую Академию медицины.
— В 1935 году старшая дочь Марии Кюри — Ирен Жолио-Кюри также получила Нобелевскую премию по физике вместе со своим мужем Фредериком Жолио-Кюри за получение первого искусственного радиоактивного элемента.
Она обнаружила, что минерал под названием уранинит обладает значительно большей радиоактивностью, чем можно было ожидать, учитывая содержащееся в нем количество урана. Это натолкнуло ее на мысль, что в руде могут содержаться другие радиоактивные элементы. В 1898 году ей удалось выделить два таких элемента — полоний и радий, который, как оказалось, в миллионы раз радиоактивнее урана.
Теперь было необходимо получить достаточное количество радия для дальнейших экспериментов. Супруги Кюри арендовали у Института физики заброшенный деревянный сарай, и там в тяжелых и опасных условиях они переработали тонны уранинита, пока наконец к 1902 году у них не накопилась крошечная пробирка радия.
Великий ученый в 1903 году Марии Кюри была присвоена степень доктора наук, но к тому времени ее работы уже получили международное признание. Она продолжала исследования свойств радия и после смерти Пьера Кюри. Но другие ученые уже думали над тем, как найти этим свойствам практическое применение. Впоследствии Мария Кюри умерла от лучевой болезни: в течение тридцати лет она постоянно получала большие дозы радиации. В 1903 году французские врачи экспериментировали с радиоактивным излучением, с его помощью они хотели разрушить раковые клетки. В то же время в Канаде Эрнест Резерфорд начал работы, которые привели впоследствии к созданию атомной бомбы .
А что же радий?
Можно сказать, что после 1910 г. для него начались будни. Его стали использовать довольно широко. Радиевые препараты применяли для лечения злокачественных опухолей и других тяжелых заболеваний. Соли радия вводили в состав светящихся красок. Немногим позже гамма-излучение радия впервые попытались применить для дефектоскопии металлических изделий. Делались радиевые эталоны единиц радиоактивности. Позже, после открытия нейтрона (1932 г., Д. Чедвик), появились радий-бериллиевые источники нейтронов. Продолжались исследования свойств самого радия и его соединений.
Но с годами, по мере развития ядерной физики и атомной техники, радий постепенно был отодвинут на второй план. Другие радиоактивные элементы и изотопы оказались более приемлемыми и для гамма-дефектоскопии, и для радиотерапии. (Кобальт-60, применяемый ныне для этих целей, намного дешевле и доступнее радия.)
Другие менее опасные излучатели пришли и в производство светящихся красок. Радий-бериллиевые и радон-бери ллиевые источники нейтронов тоже постепенно сошли со сцены: появились более совершенные.
Лишь в качестве эталонов радиоактивности соли радия не утратили своих позиций. И еще — как источник радона.
Последнее большое событие в истории элемента № 88 произошло в 1967 г. Практически одновременно в знаменитых лабораториях Дубны и Беркли были получены нейтронодефицитные изотопы радия с массовыми числами от 206 до 214. До этого времени были известны лишь изотопы с массовыми числами 213 и от 218 до 230.
Все эти изотопы оказались короткоживугцими альфа-излучателями с периодами полураспада от 0,4 до 15 секунд. А самый долгоживущий изотоп радия — тот самый радий-226, который открыли супруги Кюри, — имеет период полураспада 1600 лет.
Итак, радий отошел на второй план. Тем не менее и в наши дни в мире активно работает несколько радиевых институтов.
Пьер Кюри до конца своих дней мечтал об организации и Париже Института радия. Такой институт был организован лишь в 1913 г. Он состоял из двух отделений — радиоактивной лаборатории под руководством Марии Склодовской-Кюри и лаборатории биологических исследований и радиотерапии, первым руководителем которого был видный французский медик Клод Рего. Этот институт существует и поныне.
В 1922 г. был основан Радиевый институт в Ленинграде, его первым директором был академик В.И. Вернадский. В этом институте, в отличие от парижского, наряду с физикохимическими отделениями и лабораторией, ведущей медико-биологические исследования, есть отдел, занимающийся геохимией радиоактивных элементов и минералов.
Третий радиевый институт — преимущественно медицинского, радиологического профиля — был основан в Варшаве в 1932 г. Сейчас он называется Онкологическим институтом и носит имя Марии Склодовской-Кюри. Еще один радиевый институт работает в Вене.
Нахождение в природе
Радий довольно редок. За прошедшее с момента его открытия время — более столетия — во всём мире удалось добыть всего только 1,5 кг чистого радия. Одна тонна урановой смолки, из которой супруги Кюри получили радий, содержит лишь около 0,1 г радия-226. Весь природный радий является радиогенным — возникает при распаде урана-238, урана-235 или тория-232; из четырёх найденных в природе наиболее распространённым и долгоживущим изотопом (период полураспада 1602 года) является радий-226, входящий в радиоактивный ряд урана-238. В равновесии отношение содержания урана-238 и радия-226 в руде равно отношению их периодов полураспада: (4,468⋅109 лет)/(1602 года)=2,789⋅106. Таким образом, на каждые три миллиона атомов урана в природе приходится лишь один атом радия; кларковое число радия (содержание в земной коре) составляет ~1 мкг/т.
Все природные изотопы радия сведены в таблицу:
Геохимия радия во многом определяется особенностями миграции и концентрации урана, а также химическими свойствами самого радия — активного щёлочноземельного металла. Среди процессов, способствующих концентрированию радия, следует указать в первую очередь на формирование на небольших глубинах геохимических барьеров, в которых концентрируется радий. Такими барьерами могут быть, например, сульфатные барьеры в зоне окисления. Поднимающиеся снизу хлоридные сероводородные радийсодержащие воды в зоне окисления становятся сульфатными, сульфат радия соосаждается с BaSO4 и CaSО4, где он становится практически нерастворимым постоянным источником радона. Из-за высокой миграционной способности урана и способности его к концентрированию формируются многие типы урановых рудообразований в гидротермах, углях, битумах, углистых сланцах, песчаниках, торфяниках, фосфоритах, бурых железняках, глинах с костными остатками рыб (литофациями). При сжигании углей зола и шлаки обогащаются 226Ra. Также содержание радия повышено в фосфатных породах.
В результате распада урана и тория и выщелачивания из вмещающих пород в нефти постоянно образуются радионуклиды радия. В статическом состоянии нефть находится в природных ловушках, обмена радием между нефтью и подпирающими её водами нет (кроме зоны контакта вода—нефть) и в результате имеется избыток радия в нефти. При разработке месторождения пластовые и закачиваемые воды интенсивно поступают в нефтяные пласты, поверхность раздела вода—нефть резко увеличивается, и в результате радий уходит в поток фильтрующихся вод. При повышенном содержании сульфат-ионов растворенные в воде радий и барий осаждаются в виде радиобарита Ва(Ra)SО4, который выпадает на поверхности труб, арматуры, резервуаров. Типичная объёмная активность поступающей на поверхность водонефтяной смеси по 226Rа и 228Rа может быть порядка 10 Бк/л (соответствует жидким радиоактивным отходам).
Получение
Получить чистый радий в начале XX века стоило огромного труда. Мария Кюри трудилась 12 лет, чтобы получить крупинку чистого радия. Чтобы получить всего 1 г чистого радия, нужно было несколько вагонов урановой руды, 100 вагонов угля, 100 цистерн воды и 5 вагонов разных химических веществ. Поэтому на начало XX века в мире не было более дорогого металла. За 1 г радия нужно было заплатить больше 200 кг золота.
Обычно радий добывается из урановых руд. В рудах, достаточно старых для установления векового радиоактивного равновесия в ряду урана-238, на тонну урана приходится 333 миллиграмма радия-226.
Физические и химические свойства
Радий при нормальных условиях представляет собой блестящий белый металл, на воздухе темнеет (вероятно, вследствие образования нитрида радия). Реагирует с водой. Ведёт себя подобно барию и стронцию, но более химически активен. Обычная степень окисления — +2. Гидроксид радия Ra(OH)2 — сильное, коррозионное основание.
Ввиду сильной радиоактивности все соединения радия светятся голубоватым светом (радиохемилюминесценция), что хорошо заметно в темноте, а в водных растворах его солей происходит радиолиз.
Применение
В настоящее время радий иногда используют в компактных источниках нейтронов, для этого небольшие его количества сплавляются с бериллием. Под действием альфа-излучения (ядер гелия-4) из бериллия выбиваются нейтроны:
В медицине радий используют как источник радона для приготовления радоновых ванн (хотя в настоящее время их полезность оспаривается). Кроме того, радий применяют для кратковременного облучения при лечении злокачественных заболеваний кожи, слизистой оболочки носа, мочеполового тракта.
Однако в настоящее время существует множество более подходящих для этих целей радионуклидов с нужными свойствами, которые получают на ускорителях или в ядерных реакторах, например, 60Co (T1/2 = 5,3 года), 137Cs (T1/2 = 30,2 года), 182Ta (T1/2 = 115 сут), 192Ir (T1/2 = 74 сут), 198Au (T1/2 = 2,7 сут) и т. д.

До 1970-х годов радий часто использовался для изготовления светящихся красок постоянного свечения (для разметки циферблатов авиационных и морских приборов, специальных часов и других приборов), однако сейчас его обычно заменяют менее опасными изотопами: тритием (T1/2 = 12,3 года) или 147Pm (T1/2 = 2,6 года). Иногда часы с радиевым светосоставом выпускались и в гражданском исполнении, в том числе наручные. Также радиевую светомассу в быту можно встретить в некоторых старых ёлочных игрушках, тумблерах с подсветкой кончика рычажка, на шкалах некоторых старых радиоприёмников и прочее. Характерный признак светосостава постоянного действия советского производства — краска горчично-жёлтого цвета, хотя иногда цвет бывает и другим (белым, зеленоватым, тёмно-оранжевым и прочее). Опасность таких приборов состоит в том, что они не содержали предупреждающей маркировки, выявить их можно только дозиметрами. Также люминофор с годами деградирует и краска к нашему времени зачастую перестаёт светиться, что, разумеется, не делает её менее опасной, так как радий никуда не девается. Ещё одна опасная особенность радиевой светомассы в том, что со временем краска деградирует и может начать осыпаться, и пылинка такой краски, попавшая внутрь организма с едой или при вдохе, способна причинить большой вред за счёт альфа-излучения.
Биологическая роль
Радий чрезвычайно радиотоксичен. В организме он ведёт себя подобно кальцию — около 80 % поступившего в организм радия накапливается в костной ткани. Большие концентрации радия вызывают остеопороз, самопроизвольные переломы костей и злокачественные опухоли костей и кроветворной ткани. Опасность представляет также радон — газообразный радиоактивный продукт распада радия.
Преждевременная смерть Марии Кюри произошла вследствие хронического отравления радием, так как в то время опасность облучения ещё не была осознана.
В начале XX века радий даже считался полезным и включался в состав многих продуктов и бытовых предметов: хлеб, шоколад, питьевая вода, зубная паста, пудры и кремы для лица, краска циферблатов наручных часов, средства для повышения тонуса и потенции.
Изотопы
Известны 35 изотопов радия в диапазоне массовых чисел от 201 до 235. Изотопы 223Ra, 224Ra, 226Ra, 228Ra встречаются в природе, являясь членами радиоактивных рядов урана-238, урана-235 и тория-232. Остальные изотопы могут быть получены искусственным путём. Большинство известных изотопов радия претерпевают альфа-распад в изотопы радона с массовым числом, на 4 меньшим, чем у материнского ядра. Нейтронодефицитные изотопы радия имеют также дополнительный канал бета-распада с эмиссией позитрона или захватом орбитального электрона; при этом образуется изотоп франция с тем же массовым числом, что и у материнского ядра. У нейтронно-избыточных изотопов радия (диапазон массовых чисел от 227 до 235) обнаружен только бета-минус-распад; он происходит с образованием ядер актиния с тем же массовым числом, что и у материнского ядра. Некоторые изотопы радия (221Ra, 222Ra, 223Ra, 224Ra, 226Ra) вблизи линии бета-стабильности обнаруживают, помимо альфа-распада, кластерную активность с испусканием ядра углерода-14 и образованием ядра свинца с массовым числом, на 14 меньшим, чем у материнского ядра (например, 222Ra → 208Pb+14C), хотя вероятность этого процесса составляет лишь 10−8…10−10% относительно альфа-распада. Радиоактивные свойства некоторых изотопов радия:

Репродукции продуктов, содержащих радий, выпускавшихся в начале XX века, на витрине в Музее Марии Кюри, Париж.
Кол-во блоков: 13 | Общее кол-во символов: 18273
Количество использованных доноров: 3
Информация по каждому донору:
Ключевые слова: урановые минералы, полоний, радий, цезий-137, патент, талисман, сыскная полиция.

Пьер и Мария Кюри
Посетители ЭКСПО-1958 — Брюссельской Всемирной выставки с волнением рассматривали внешне мало примечательный экспонат. Под стеклом в коленкоровом переплете демонстрировался лабораторный дневник Марии и Пьера Кюри. Рядом с ним находился счетчик радиоактивности, соединенный с громкоговорителем. Он ритмично пощелкивал, свидетельствуя о том, что раскрытая на случайной странице небольшая записная книжка ни на секунду не прекращает испускать радио активные лучи: более полувека назад капли раствора, содержавшего соли радия, случайно упали на бумагу.
Уже давно нет в живых тех, кто тщательно вел когда-то этот дневник, пожелтели и стали ветхими его листки, но мы слышим сигналы именно того радия, что был рожден в старом сарае одного из парижских дворов на улице Ломон. Пройдет еще много столетий, и рано или поздно эти следы радия перестанут существовать, но даже время не в силах будет стереть в памяти благодарного человечества имена замечательных ученых, совершивших одно из величайших научных открытий [1].
Изучая лучи, испускаемые ураном, французские ученые П. Кюри и М. Склодовская-Кюри обнаружили, что некоторые урановые минералы более активны, чем сам металл или его соединения. Возникло предположение: в минералах содержатся еще не известные радиоактивные элементы. Этому предположению суждено было дважды подтвердиться в 1898 г. 18 июля супруги Кюри сообщили об открытии полония, а 26 декабря стало днем рождения радия (от лат. radium — излучающий) — одного из самых замечательных элементов в истории человечества.
Радий образуется через многие промежуточные стадии при радиоактивном распаде изотопа урана-238 и поэтому находится в небольших количествах в урановой руде. Открытие радия положило начало целой области медицины, получившей название радиология, которая использует X-лучи в лечении раковых опухолей. Кюри обнаружили сложный характер излучения радия, изучили его действие на вещество и предложили методы получения радия. К 1902 г. у Кюри накопилась крошечная пробирка радия. Получить чистый радий в начале ХХ в. стоило огромного труда. Мария Кюри трудилась 12 лет, чтобы получить крупинку чистого радия. Для того, чтобы получить всего 1 г чистого радия, нужно несколько вагонов урановой руды, 100 вагонов угля, 100 цистерн воды и 5 вагонов разных химических веществ. Поэтому на начало ХХ века не было в мире более дорогого металла. За 1 г радия нужно было заплатить больше 200 кг золота.
В 1910 г. Склодовская-Кюри совместно с французским физиком А. Дебьерном получила металлический радий и вторично, с большей точностью, определила его атомный вес. В 1911 г. впервые изготовила эталон радия, который в течение 24 лет оставался единственным в мире [1].
С тех пор как стали известны лечебные свойства радия, повсюду начались поиски радиоактивных веществ. В нескольких странах возникают проекты промышленного производства радия. В 1904 г. вблизи Парижа появился первый радиевый завод, производивший препараты радия для врачей, занимающихся лечением злокачественных опухолей.
В России радий впервые был получен в 1921 г. в экспериментах радиохимика Виталия Григорьевича Хлопина, одного из основоположников советской радиохимии и радиевой промышленности [2].
Правда, на территории России радий появился раньше, в 1913 г. Об этом факте рассказывает в своих воспоминаниях начальник Московской сыскной полиции и заведующий всем уголовным розыском Российской империи Аркадий Кошко.
Жертва радия
В России, по давно заведенной практике, в апреле месяце формировались отряды из агентов Петербургской и Московской сыскной полиции, возглавляемые чиновниками для поручений из Петербурга и Москвы, и направлялись на минеральные воды Кавказа. Района ми их действия были Пятигорск, Кисло водск, Ессентуки и Железноводск. Эта особая мера охраны была решительно необходима, так как ежегодно в лечащуюся праздношатающуюся толпу этих курортов внедрялись элементы, чающие легкой наживы.
Дело происходило в Пятигорске в 1913 г. В этом сезоне наши соединенные отряды отправились на минеральные воды под начальством моего чиновника Михайлова.
Случилось так, что группа русских профессоров и ученых, проводивших это лето в Пятигорске, уговорила немецкого профессора Р. приехать в Пятигорск и полечиться серными ваннами. Профессор Р. приехал на курорт вместе со своей дочерью Эммой. Еще профессор привез с собой некоторое количество драгоценного радия, купленного им по пути в Вене. Крупинки этого драгоценного металла были заключены в свинцовый капсюль с вделанной в верхнюю крышку слюдой, позволяющей видеть его содержимое. Весь этот капсюль помещался в небольшом свинцовом ларце, ключик от которого профессор всегда носил при себе. Самый же ларчик он прятал в своем чемодане.
Узнав об увлечении дочери, профессор решил ближе познакомиться с прошлым будущего зятя. Он обратился к Михайлову, прося навести справки и последить за Александровым. Справка ему была дана тотчас же, так как Михайлов знал прекрасно о художественных проделках Александрова в Москве. Р. поделился с дочерью полученными сведениями, и после долгих уговоров влюбленной Эммы авантюрист получил от невесты отказ.
Несколько дней, симулируя отчаяние, Александров тенью слонялся по Пятигорску, после чего бесследно исчез.
Через месяц примерно после его отъезда профессору понадобилось показать кому-то радий, но его не оказалось. Р. поднял тревогу и обратился за помощью к Михайлову. Начались розыски, но профессор, видимо, под влиянием дочери заявил, что считает Александрова вне подозрений.
Я срочно выслал карточку последнего в Харьков, и университетская комиссия признала в нем продавца радия. После этого я немедленно же отправил агентов по московскому адресу Александрова для его ареста. Оказалось, что Александров находится в клинике, где ему недавно была произведена операция. Дня через три я лично приехал в больницу, Но Александрова уже там не застал. Профессор, делавший ему операцию, не мог точно определить характер его недуга.
Я отправился в квартиру Александрова. Он грустно на меня взглянул, узнал и, горько улыбнувшись, промолвил:
- А, Кошко! Вы, конечно, за мной по делу радия. Увы, Вы опоздали. Правосудие небес опередило людей. Дни мои сочтены.
- Что же с вами произошло после Пятигорска и Харькова?
- А нечто совершенно невероятное и неожиданное. Получив от Эммы радий, я не расставался с ним, все время носил его в правом жилетном кармане. Месяца полтора тому назад я заметил на правой стороне живота красное пятно величиной с гривенник. Я особого внимания на него не обратил, но вскоре пятно уже удвоилось, потом утроилось и появилось какое-то затвердение. Я обратился за врачебной помощью, и хирург вырезал эту опухоль.
Едва рана затянулась, как снова появилась краснота, снова опухоль, и на этот раз образовалась страшная язва. Две недели тому назад мне сделали вторичную операцию, и вот я третий день как дома. Из общего тона профессоров я понял, что дело мое плохо.
Вас интересует, конечно, где радий, — вот там, в туалете, в правом ящике в серебряной пудренице. Видите, я облегчаю вам вашу задачу и прошу за это у вас одного: не трогайте меня — дайте мне спокойно умереть.
Через две недели Александров скончался от страшных изъязвлений в желудке. Злополучный радий был вскоре возвращен его владельцу.
В Институте биологии Коми разработан метод концентрирования радионуклидов радия из воды (пат. № 2215798). Он может быть использован для выделения радионуклидов из больших объемов воды в природных условиях.
В ядерной медицине применяется препарат на основе радия-224. Способ получения препарата (пат. №2441687), предложенный учеными Физико-энергетического института имени
А.И. Лейпунского, позволяет уменьшить содержание тория-228 в конечном продукте радия-224.
Криминальные радиодетали
В современных условиях атомная промышленность по праву считается одной из ключевых, стратегически важных отраслей отечественной экономики, развитию которой уделяется приоритетное государственное значение. По уровню научно-технических разработок в области проектирования реакторов, ядерного топлива и опыту эксплуатации АЭС российская атомная отрасль является одной из передовых в мире.
__________________________________________________________________________________________
1. Химическая энциклопедия. — М.: Советская энциклопедия, 1988.
2. Погодин С.А., Либман Э.П. Как добыли советский радий. — М.: Атомиздат, 1971.
3. Ерофеев В. Чернобыль заводского масштаба // Загадки истории, 2016, № 9.
Читайте также:


