Происхождение атомных спектров кратко
Обновлено: 02.07.2024
АТОМНЫЕ СПЕКТРЫ
АТОМНЫЕ СПЕКТРЫ, оптич. спектры, получающиеся при испускании или поглощении электромагн. излучения свободными или слабо связанными атомами (напр., в газах или парах). Являются линейчатыми, т.е. состоят из отдельных спектральных линий, характеризуемых частотой излучения v, к-рая соответствует квантовому переходу между уровнями энергии Ei и Ek атома согласно соотношению: hv = Ei-Ek где h-постоянная Планка. Спектральные линии можно характеризовать также длиной волны= c/v (с - скорость света), волновым числом= v/c и энергией фотона hv. Частоты спектральных линий выражают в с -1 , длины волн-в нм и мкм, а также в А, волновые числа - в см -1, энергии фотонов - в эВ. Типичные атомные спектры наблюдаются в видимой, УФ- и ближней ИК-областях спектра. Спектры испускания, или эмиссионные, получают при возбуждении атомов разл. способами (фотонами, электронным ударом и т.д.), спектры поглощения, или абсорбционные, - при прохождении электромагн. излучения, обладающего непрерывным спектром, через атомарные газы или пары. Для наблюдения атомных спектров применяют приборы с фотографич. или фотоэлектрич. регистрацией.
Атомные спектры обладают ярко выраженной индивидуальностью: каждому элементу соответствует свой спектр нейтрального атома (т. наз. дуговой спектр) и свои спектры последовательно образующихся положит. ионов (т.наз. искровые спектры). Линии в этих спектрах обозначают римскими цифрами, напр. линии PeI, FeII, FeIII в спектрах железа соответствуют спектрам Fe, Fe + , Fe 2+ .
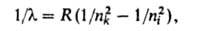
Вид спектра зависит как от электронного строения данного атома, так и от внеш. условий - т-ры, давления, напря-женностей электрич. и магн. полей и т. п. В зависимости от способа возбуждения атома могут возникать отдельные линии спектра, нек-рые его участки, весь спектр нейтрального атома или его иона определенной кратности. Положение линий в таких спектрах подчиняется определенным закономерностям, к-рые наиб. просты для атомов с одним внеш. электроном, т.е. для атома Н и нейтральных атомов щелочных металлов, а также изоэлектронных с ними ионов. В спектрах таких атомов наблюдаются спектральные серии, каждая из к-рых (в случае спектров испускания) получается при возможных квантовых переходах с последовательных вышележащих уровней энергии на один и тот же нижележащий (в спектрах поглощения - при обратных переходах). Промежутки между линиями одной серии убывают в сторону больших частот, т.е. линии сходятся к границе серии - максимальной для данной серии частоте, соответствующей ионизации атома. Для атома Н волновые числа линий всех серий (см. рис. 1 в ст. Атом) с большой точностью определяются обобщенной ф-лой Бальмера:
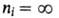
где пk и ni - значения главного квантового числа для уровней энергии, между к-рыми происходит квантовый переход, причем nk, характеризующее нижний уровень энергии, определяет серию, а ni - ее отдельные линии (при получается граница серии); R-постоянная Ридберга. Аналогичные серии наблюдаются и в спектрах водородоподобных атомов, однако значения волновых чисел для спектральных линий ионов Не + , Li 2+ , . в Z 2 раз (Z - пoрядковый номер элемента) больше, чем для соответствующих линий атома Н.
Спектры атомов щелочных металлов, имеющих один электрон на внеш. электронной оболочке, схожи со спектром Н, но смещены в область меньших частот; число спектральных линий в них увеличивается, а закономерности в расположении линий усложняются. Пример - спектр Na, атом к-рого имеет электронную конфигурацию Is 2 2s 2 2p 6 3s с легковозбуждаемым внеш. электроном 3s. Переходу этого электрона из состояния Зр в состояние 35 соответствует желтая линия Na (дублет= 589,0 нм и= 589,6 нм); это - наиб. яркая линия, с к-рой начинается т.наз, главная серия Na. Линии этой серии в спектре испускания соответствуют переходам из состояний Зр, 4р, 5р> . в состояние 35.
Для атомов послед. групп элементов в периодич. системе, обладающих двумя или неск. внеш. электронами, спектры еще более усложняются, что обусловлено взаимод. электронов. Особенно сложны спектры атомов с заполняющимися d- и f-оболочками; число линий в таких спектрах достигает мн. тысяч, простых закономерностей в них не обнаруживается. Однако и для сложных спектров можно произвести систематику оптич. квантовых переходов и определить схему уровней энергии. Систематика спектров атомов с двумя и более внеш. электронами основана на приближенной характеристике отдельных электронов при помощи квантовых чисел n и l с учетом взаимод. этих электронов друг с другом. При этом приходится учитывать как их электростатич. взаимод., так и спин-орбитальное, что приводит к расщеплению уровней энергии (т. наз. тонкая структура). В результате этого взаимод. у большинства атомов каждая спектральная линия представляет собой более или менее тесную группу линий - мультиплет. Так, у всех щелочных металлов наблюдаются двойные линии (дублеты), причем расстояния между линиями увеличиваются с увеличением порядкового номера элемента. Для щел.-зем. элементов наблюдаются одиночные линии (синглеты) и тройные (триплеты). В спектрах атомов послед. групп периодич. системы элементов наблюдаются еще более сложные мультиплеты, причем атомам с нечетным числом электронов соответствуют четные мультиплеты (дублеты, квартеты), а с четным числом - нечетные (триплеты, квинтеты). Кроме тонкой структуры в атомных спектрах наблюдается также сверхтонкая структура линий (примерно в 1000 раз уже, чем мультиплетная), обусловленная взаимод. электронов с магн. и электрическими моментами ядра.
В атомных спектрах проявляются не все возможные квантовые переходы, а лишь разрешенные правилами отбора. Так, в случае атома с одним внеш. электроном разрешены лишь переходы между уровнями, для к-рых орбитальное квантовое число / изменяется на 1 , т. е. s-уровни (l = 0) комбинируют с р-уровнями (l=1), р-уровни - с d-уровнями (l = 2) и т.д. Количеств. характеристика разрешенного оптич. квантового перехода - его вероятность, определяющая интенсивность спектральной линии, соответствующей этому переходу. Вероятности переходов в простейших случаях м.б. рассчитаны методами квантовой механики.
Под влиянием внеш. электрич. и магн. полей происходит расщепление спектральных линий. Возмущающие факторы, существующие в излучающей среде, вызывают уширение и сдвиг спектральных линий.
Методы, основанные на измерении частот и интенсивно" стей линий в спектре, применяют для решения разл. задач спектроскопии: проведения общей систематики спектров многоэлектронных атомов; определения уровней энергии таких атомов (это существенно, в частности, при квантово-хим расчетах); нахождения вероятностей переходов и времен жизни возбужденных состояний; изучения механизмов возбуждения атомов; измерения ядерных моментов и т. п. Индивидуальность атомных спектров используют для качеств. определения элементного состава в-ва, а зависимость интенсивности линий от концентрации излучающих атомов - для количеств. анализа (см. Спектральный анализ).
Исследования атомных спектров сыграли важнейшую роль в развитии представлений о строении атома.
При изменении хотя бы одного квантового числа (главное n, побочное – l; магнитное – m; спиновое - ms) атом получает или отдает энергию. Это может произойти при взаимодействии атома с электромагнитным полем, при непосредственном обмене энергией с другими атомами или молекулами, например при столкновениях или при химических реакциях. В отсутствии внешних воздействий атом находится в основном состоянии, т. е. обладает наименьшей энергией. При получении энергии извне скорость электронов увеличивается— атом возбуждается.
Рис.3. Энергетические переходы в атоме

Атом не может получить или отдать любое количество энергии; энергетический обмен осуществляется только конечными порциями, в частности квантами электромагнитного излучения (фотонами). Иными словами, атом может находиться только в определенных энергетических состояниях, отличающихся друг от друга на конечную величину. На рис. 3 энергетические состояния изображены горизонтальными линиями, из которых нижняя отвечает основному уровню, а остальные — возбужденным; переходы из одного состояния в другое обозначены стрелками.
Один атом за один акт поглощает или испускает только один фотон с определенной энергией (частотой). Вещество состоит из множества одинаковых атомов, способных переходить на разные энергетические уровни, испуская или поглощая фотоны разных частот. Совокупность всех фотонов одной и той же частоты составляет спектральную линию, при поглощении ее называют абсорбционной, при испускании—эмиссионной. Совокупность всех абсорбционных или всех эмиссионных линий называют абсорбционным (поглощение) или эмиссионным (испускание) спектром вещества.
Спектр поглощения получают, помещая исследуемое вещество в поле электромагнитного излучения (например, на пути светового потока), а для получения спектра испускания предварительно переводят атомы вещества в возбужденное состояние, что достигается подведением какого-либо вида энергии (тепловой, химической, электроразряда, электромагнитного излучения и т. п.); после возбуждения атомы через 10 – 9 –10 – 7 с возвращаются в основное состояние, испуская фотоны либо теплоту. В последнем случае переход будет безызлучательным; на рис. 3 он изображен волнистой стрелкой.
Частота испускаемого или поглощаемого излучения определяется разностью энергии между электронными орбиталями ∆Е:
, где h – постоянная Планка
Абсолютная энергия квантовых состояний неизвестна, поэтому ее отсчитывают от некоторого уровня, условно принятого за нулевой, а именно от энергии ионизации, т. е. полного отрыва электрона от атома.
Энергия атомных орбиталей сильно различается. Так, для возбуждения электрона с ближайшей к ядру орбитали (главное квантовое число n=1) требуется более 6∙10 4 кДж моль – 1 (испускаемые фотоны имеют частоту рентгеновского излучения), а для возбуждения внешних электронов достаточно 150— 600 кДж моль -1 (излучение ультрафиолетовой и видимой областей). С увеличением главного квантового числа энергия возбуждения ∆Е и частота излучения уменьшаются (рис. 2.).
Наиболее вероятны переходы с первого возбужденного уровня на основной Е0; соответствующие им спектральные линии называют резонансными. Электрон может перейти и в более высокое энергетическое состояние (Е2, Е3 и т. д.). Возвращение его на уровень Е0 может проходить через ряд промежуточных ступеней.

Рис. 4. Относительное расположение энергетических уровней различных квантовых состояний и изменение энергии при электронных переходах
Внешние легко возбудимые электроны называют оптическими, переходы с их участием дают оптический спектр. Энергия возбуждения внешних электронов разных элементов неодинакова. Например, для получения резонансной линии щелочных металлов (переход Е1→Е0) требуется сравнительно невысокая энергия (~2эВ, длины волн лежат в видимой области), для неметаллов эта энергия существенно больше (~ 5 эВ, длины волн лежат в УФ-области). Чем больше внешних электронов, тем больше возможностей имеет атом для энергетических переходов, поэтому спектры металлов типа железа состоят из тысяч линий, а спектры щелочных элементов бедны ими.
Атомно-спектроскопические методы анализа.
Все многочисленные энергетические переходы электронов по орбиталям атома могут быть использованы в аналитических целях. Методы анализа, основанные на изменениях энергетического состояния атомов веществ, входят в группу атомно- спектроскопических методов, различающихся по способу получения и регистрации сигнала.
Оптические методы используют энергетические переходы внешних (валентных) электронов, общим для них является необходимость предварительной атомизации (разложение на атомы) вещества.
Атомно-эмиссионная спектрометрия основана на испускании излучения атомами, возбужденными кинетической энергией плазмы, дугового или искрового разряда и т. п.
Атомно-флуоресцентная спектроскопия использует испускание излучения атомами, возбужденными электромагнитным излучением от внешнего источника.
Атомно-абсорбционная спектроскопия основана на поглощении атомами излучения от внешнего источника.
Рентгеновские методы основаны на энергетических переходах внутренних электронов атомов. В зависимости от способа получения и регистрации сигнала различают рентгеноэмиссионную, рентгеноабсорбционную и рентгенофлуоресцентную спектроскопию. Разновидности этих методов — оже-спектроскопию, рентгеновский электронно-зондовый анализ, электронную спектроскопию — используют в основном для исследования строения веществ. Рентгеновские методы не требуют атомизации вещества и позволяют исследовать твердые пробы без предварительной подготовки.
Ядерные методы основаны на возбуждении ядер атомов.
На рис. 5. приведены разные методы, основанные на атомной эмиссии или абсорбции. Эти методы широко применяют, и они отличаются высокой избирательностью, исключительной чувствительностью, скоростью и удобством; они относятся к наиболее селективным аналитическим методам. Этими методами можно определять около 70 элементов. Чувствительность обычно лежит в интервале 10 -4 —10 –10 %. Атомный спектральный анализ часто можно выполнить за несколько минут.
1. Основы Атомно-эмиссионного спектрального анализа. Происхождение атомных спектров
2. Атомно-эмиссионный спектральный анализ
АТОМНО-ЭМИССИОННЫЙ
СПЕКТРАЛЬНЫЙ АНАЛИЗ
• ОСНОВАН НА ТЕРМИЧЕСКОМ ВОЗБУЖДЕНИИ СВОБОДНЫХ
АТОМОВ ИЛИ ИОНОВ И РЕГИСТРАЦИИ СПЕКТРА ИСПУСКАНИЯ В У.
Ф. И ВИДИМОЙ ЧАСТИ СПЕКТРА.
• КАЖДАЯ СПЕКТРАЛЬНАЯ ЛИНИЯ СООТВЕТСТВУЕТ ПЕРЕХОДУ
МЕЖДУ ОТДЕЛЬНЫМИ СТАЦИОНАРНЫМ ЭНЕРГЕТИЧЕСКИМ
СОСТОЯНИЕМ АТОМОВ.
• ΔЕ = ЕВ – ЕО = hυ
3. Интенсивность спектральных линий
ИНТЕНСИВНОСТЬ СПЕКТРАЛЬНЫХ ЛИНИЙ
• ОПИСЫВАЕТСЯ ЗАКОНОМ РАСПРЕДЕЛЕНИЯ БОЛЬЦМАНА.
• Y = A· N (1 - X) · L-Е ⁄ КТ
• ГДЕ: Y – ИНТЕНСИВНОСТЬ,
• А – КОЭФФИЦИЕНТ ПРОПОРЦИОНАЛЬНОСТИ (ЗАВИСИТ ОТ ВЕРОЯТНОСТИ
СПОНТАННОГО ПЕРЕХОДА),
• N – ЧИСЛО ВОЗБУЖДЕННЫХ АТОМОВ,
• Х – СТЕПЕНЬ ИОНИЗАЦИИ,
• L – ЧИСЛО 2,7 ИЛИ ОСНОВАНИЕ НАТУРАЛЬНОГО ЛОГАРИФМА LN,
• Е – ЭНЕРГИЯ ВОЗБУЖДЕНИЯ,
• К – КОНСТАНТА БОЛЬЦМАНА,
• Т – ТЕМПЕРАТУРНЫЙ ИСТОЧНИК ВОЗБУЖДЕНИЯ В К0.
4. Интенсивность спектральных линий
ИНТЕНСИВНОСТЬ СПЕКТРАЛЬНЫХ
ЛИНИЙ
• ИНТЕНСИВНОСТЬ ЗАВИСИТ:
• 1. ОТ ЧИСЛА ВОЗБУЖДЕННЫХ АТОМОВ
• 2. ОТ ЭНЕРГИИ ВОЗБУЖДЕНИЯ
5. Резонансные линии
РЕЗОНАНСНЫЕ ЛИНИИ
• РЕЗОНАНСНЫЕ ЛИНИИ – САМЫЕ ИНТЕНСИВНЫЕ ЛИНИИ,
СВЯЗАННЫЕ С НИЖНИМ ЭНЕРГЕТИЧЕСКИМ СОСТОЯНИЕМ
АТОМОВ.
• 1. ЧАСТО НАХОДЯТСЯ В ТРУДНО ДОСТУПНОЙ ОБЛАСТИ СПЕКТРА
(ДАЛЕКИЙ У. Ф.)
• 2. ПРИ БОЛЬШОЙ КОНЦЕНТРАЦИИ МОЖЕТ НАБЛЮДАТЬСЯ
ВЫСОКОЕ ПОЧЕРНЕНИЕ ФОТОПЛАСТИНКИ, ПРЕВЫШАЮЩЕЕ
ОБЛАСТЬ НОРМАЛЬНОГО ПОЧЕРНЕНИЯ ЭМУЛЬСИИ.
6. Последние линии
ПОСЛЕДНИЕ ЛИНИИ
• ПОСЛЕДНИЕ ЛИНИИ – ИНТЕНСИВНЫЕ ЛИНИИ, РАСПОЛОЖЕННЫЕ
В ДОСТУПНОЙ ДЛЯ ИССЛЕДОВАНИЯ ОБЛАСТИ СПЕКТРА. ПРИ
УМЕНЬШЕНИИ КОНЦЕНТРАЦИИ ВЕЩЕСТВА ОНИ ИСЧЕЗАЮТ
ПОСЛЕДНИЕ. ТАКИЕ ЛИНИИ ЧАСТО ИСПОЛЬЗУЮТСЯ ДЛЯ
ОБНАРУЖЕНИЯ ПРЕДЕЛЬНО МАЛЫХ КОНЦЕНТРАЦИЙ. В КАЧЕСТВЕ
ПОСЛЕДНИХ ЛИНИЙ МОГУТ БЫТЬ ИСПОЛЬЗОВАНЫ РЕЗОНАНСНЫЕ
ЛИНИИ ИЛИ ДРУГИЕ ИНТЕНСИВНЫЕ ЛИНИИ ДОСТУПНЫЕ ДЛЯ
ИССЛЕДОВАНИЯ.
7. Происхождение атомных спектров
ПРОИСХОЖДЕНИЕ АТОМНЫХ
СПЕКТРОВ
• ЛЕГЧЕ ВСЕГО ВОЗБУЖДАЮТСЯ ЭЛЕКТРОНЫ, КОТОРЫЕ НАХОДЯТСЯ
ДАЛЕКО ОТ ЯДРА, (ЛИНИИ ПОЯВЛЯЮТСЯ В ВИДИМОМ
ДИАПАЗОНЕ).
• ЕСЛИ ЭЛЕКТРОНЫ НАХОДЯТСЯ БЛИЖЕ К ЯДРУ, ТО ЛИНИИ
ПОЯВЛЯЮТСЯ В РЕНТГЕНОВСКОЙ ОБЛАСТИ.
• ПРОМЕЖУТОЧНЫЕ ЭЛЕКТРОНЫ В У.Ф. ОБЛАСТИ.
8. Происхождение атомных спектров
9. Связь спектров элементов с периодической системой Д.И. Менделеева.
СВЯЗЬ СПЕКТРОВ ЭЛЕМЕНТОВ С ПЕРИОДИЧЕСКОЙ
СИСТЕМОЙ
Д.И. МЕНДЕЛЕЕВА.
• ПОТЕНЦИАЛ ВОЗБУЖДЕНИЯ ИОНИЗАЦИИ НАХОДИТСЯ В ПЕРИОДИЧЕСКОЙ
ЗАВИСИМОСТИ ОТ ВЕЛИЧИНЫ ЗАРЯДА АТОМНЫХ ЯДЕР (ПОРЯДКОВЫЙ
НОМЕР).
• ДЛЯ ЭЛЕМЕНТОВ ОДНОГО ПЕРИОДА РАЗНОСТЬ ЭНЕРГИЙ МЕЖДУ УРОВНЯМИ
РАСТЕТ С УВЕЛИЧЕНИЕМ ЗАРЯДА ЯДРА, СЛЕДОВАТЕЛЬНО, ПОТЕНЦИАЛ
ВОЗБУЖДЕНИЯ ПОСЛЕДНИХ ЛИНИЙ УВЕЛИЧИВАЕТСЯ, А ДЛИНА ВОЛНЫ
УМЕНЬШАЕТСЯ.
• 1. ВСЕ МЕТАЛЛЫ ЛЕГКО ВОЗБУЖДАЮТСЯ. ПОЭТОМУ ПОСЛЕДНИЕ ЛИНИИ
ИМЕЮТ ВЫСОКУЮ ДЛИНУ ВОЛНЫ. ЦВЕТНЫЕ МЕТАЛЛЫ ИМЕЮТ ПРОСТОЙ
СПЕКТР, ЧЕРНЫЕ – СЛОЖНЫЙ.
• 2. ВСЕ ИНЕРТНЫЕ ГАЗЫ ТРУДНОВОЗБУДИМЫ.
• 3. ЭЛЕМЕНТЫ 1 ГРУППЫ ИМЕЮТ ОДИН ВНЕШНИЙ ЭЛЕКТРОН НА S
УРОВНЕ СЛАБО СВЯЗАННЫЙ С ЯДРОМ, СЛЕДОВАТЕЛЬНО,
ПОТЕНЦИАЛ ВОЗБУЖДЕНИЯ ИЛИ ИОНИЗАЦИИ НИЗКИЙ.
ПОТЕНЦИАЛ ВОЗБУЖДЕНИЯ ОТ ЛИТИЯ К ЦЕЗИЮ СВЯЗЬ БУДЕТ
УМЕНЬШАТЬСЯ.
• 4. ЭЛЕМЕНТЫ 2 ГРУППЫ ИМЕЮТ НИЖНИЙ ТЕРМ ИЛИ УРОВЕНЬ S И
ПОТЕНЦИАЛ ВОЗБУЖДЕНИЯ БОЛЬШЕ ЧЕМ ДЛЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ.
• ЭЛЕМЕНТЫ ПОБОЧНЫХ ГРУПП ИМЕЮТ ВНЕШНИЕ ЭЛЕКТРОНЫ НА D
УРОВНИ, ЛАНТАНОИДЫ И АКТИНОИДЫ НА F УРОВНЕ, СЛЕДОВАТЕЛЬНО
ПОТЕНЦИАЛ ВОЗБУЖДЕНИЯ ПОСЛЕДНИХ ЛИНИЙ, КОТОРЫЕ НАХОДЯТСЯ В
У.Ф. И ВИДИМОЙ ОБЛАСТИ.
• ЭЛЕМЕНТЫ НАХОДЯТСЯ В КОНЦЕ КАЖДОГО ПЕРИОДА И ИМЕЮТ
ВЫСОКИЙ ПОТЕНЦИАЛ ВОЗБУЖДЕНИЯ, ПОЭТОМУ ПОСЛЕДНИЕ
ЛИНИИ ИМЕЮТ НИЗКУЮ ДЛИНУ ВОЛНЫ И НАХОДЯТСЯ В
ДАЛЕКОЙ У. Ф. ОБЛАСТИ. ПОЭТОМУ ДЛЯ АНАЛИЗА
ИСПОЛЬЗУЮТСЯ ДРУГИЕ ДОСТУПНЫЕ ИНТЕНСИВНЫЕ ЛИНИИ.
• ДЛЯ ЭЛЕМЕНТОВ НАХОДЯЩИХСЯ В ОДНОЙ ГРУППЕ РАССТОЯНИЕ
МЕЖДУ УРОВНЯМИ УМЕНЬШАЕТСЯ ПРИ ПЕРЕХОДЕ К ТЯЖЕЛЫМ
МЕТАЛЛАМ, Т.К. ОСЛАБЛЯЮТСЯ СВЯЗИ ЭЛЕКТРОНОВ С ЯДРОМ,
СЛЕДОВАТЕЛЬНО, ПОТЕНЦИАЛ ВОЗБУЖДЕНИЯ ПОСЛЕДНИХ
ЛИНИЙ УВЕЛИЧИВАЕТСЯ, А ДЛИНА ВОЛНЫ УМЕНЬШАЕТСЯ.
13. Источники излучения и атомизации в АЭСА
ИСТОЧНИКИ ИЗЛУЧЕНИЯ И
АТОМИЗАЦИИ В АЭСА
• ФУНКЦИИ ИСТОЧНИКОВ
• ПЕРЕВОД ПРОБЫ ИЗ ЖИДКОГО ИЛИ ТВЕРДОГО СОСТОЯНИЯ В
ГАЗООБРАЗНОЕ.
• ТЕРМИЧЕСКАЯ ДИССОЦИАЦИЯ (АТОМИЗАЦИЯ).
• ВОЗБУЖДЕНИЕ АТОМОВ.
• ОТ ТЕМПЕРАТУРЫ ИСТОЧНИКА ЗАВИСИТ ХИМИЧЕСКОЕ СОСТОЯНИЕ
АНАЛИЗИРУЕМОГО ВЕЩЕСТВА И ИНТЕНСИВНОСТЬ ИЗЛУЧЕНИЯ, Т.Е.
• 1.ПОЛНОТА АТОМИЗАЦИИ ПРОБЫ
• 2.ДОЛЯ ВОЗБУЖДЕННЫХ ЧАСТИЦ.
lg J
t, C
17. Пламя
ПЛАМЯ
• – САМЫЙ НИЗКИЙ ТЕМПЕРАТУРНЫЙ ИСТОЧНИК (ОТКРЫТ КИРХГОФОМ И
БУНЗЕНОМ).
• 1. В ВОССТАНОВИТЕЛЬНОЙ ЗОНЕ НАБЛЮДАЕТСЯ ТЕРМИЧЕСКАЯ
ДИССОЦИАЦИЯ (АТОМИЗАЦИЯ) И НЕПОЛНОЕ СГОРАНИЕ ГОРЮЧЕЙ СМЕСИ (
ГОРЮЧИЙ ГАЗ + ОКИСЛИТЕЛЬ ВХОДИТ В ПЛАМЯ).
• 2. ВНУТРЕННИЙ КОНУС ОТДЕЛЯЕТ ЗОНУ 1 ОТ ЗОНЫ 3. ВНУТРЕННИЙ КОНУС И
ВОССТАНОВИТЕЛЬНАЯ ЗОНА СОДЕРЖИТ МНОГО ВОЗБУЖДЕННЫХ МОЛЕКУЛ И
СВОБОДНЫХ РАДИКАЛОВ ИЗЛУЧЕНИЕ НАКЛАДЫВАЕТСЯ НА ЭМИССИОННЫЕ
ЛИНИИ АТОМОВ. В АНАЛИЗЕ ЗОНА 1 НЕ ИСПОЛЬЗУЕТСЯ.
• 3. В ОКИСЛИТЕЛЬНОЙ ЗОНЕ НАБЛЮДАЕТСЯ ПОЛНОЕ СГОРАНИЕ ГОРЮЧЕЙ
СМЕСИ. ЗОНА III ИНТЕНСИВНО ИЗЛУЧАЕТ В ИК ОБЛАСТИ И МАЛО ИЗЛУЧАЕТ В
УФ И ВИДИМОЙ ОБЛАСТИ Т.О. ДЛЯ АНАЛИЗА ИСПОЛЬЗУЕТСЯ ЗОНА III В У.Ф.
ОБЛАСТИ И ВИДИМОЙ ОБЛАСТИ.
19. Характеристика пламени
ХАРАКТЕРИСТИКА ПЛАМЕНИ
Горючий газ
Горючий
окислитель
Температура
Объекты анализа
Природный газ
(пропан + бутан)
Воздух
1800 0С
Щелочные металлы
Ацетилен С2Н2
Воздух
2200 0С
Щелочные и
щелочноземельные
Ме
Водород Н2
О2
2800 0С
Тяжелые Ме,
щелочные и
щелочноземельные
Ме
Ацетилен
О2
3100 0С
Тоже самое и Ag, Cи,
Мn
Ацетилен
N2О
3200 0С
То же самое и Pb, Cr,
Cd, Fe, Sn.
20. Физические явления и процессы, происходящие в пламени
21. Физические явления и процессы, происходящие в пламени
ФИЗИЧЕСКИЕ ЯВЛЕНИЯ И ПРОЦЕССЫ,
ПРОИСХОДЯЩИЕ В ПЛАМЕНИ
• ПРИ ПЕРЕХОДЕ АТОМА ИЗ ВОЗБУЖДЕННОГО В НОРМАЛЬНОЕ
НАБЛЮДАЕТСЯ ЭМИССИЯ. КРОМЕ ТОГО МОЖЕТ ПРОИСХОДИТЬ
ИОНИЗАЦИЯ АТОМОВ (УМЕНЬШАЕТСЯ ЧИСЛО ВОЗБУЖДЕННЫХ
АТОМОВ), А ТАКЖЕ ЗАНИЖАЕТСЯ РЕЗУЛЬТАТ; САМОПОГЛОЩЕНИЕ
• ДОСТОИНСТВО ПЛАМЕНИ.
• 1. ВЫСОКАЯ СТАБИЛЬНОСТЬ ПЛАМЕНИ, ОБЕСПЕЧИВАЕТ ХОРОШУЮ
ВОСПРОИЗВОДИМОСТЬ РЕЗУЛЬТАТОВ.
• 2.ВЫБОР СОСТАВА ГОРЮЧЕЙ СМЕСИ, СЛЕДОВАТЕЛЬНО, ТЕМПЕРАТУРА
ПОЗВОЛЯЕТ ОПТИМИЗИРОВАТЬ УСЛОВИЯ АТОМИЗАЦИИ И УСТРАНИТЬ ФИЗИКОХИМИЧЕСКИЕ ПОМЕХИ (ИОНИЗАЦИЯ И САМОПОГЛОЩЕНИЕ).
• НЕДОСТАТКИ.
• 1. БОЛЬШОЙ РАСХОД МАТЕРИАЛА (НЕПРОДОЛЖИТЕЛЬНОЕ ПРЕБЫВАНИЕ
ЧАСТИЦ К ИСТОЧНИКУ).
• 2.НЕ ЭКОНОМИЧЕСКИЙ ИСТОЧНИК.
• 3. ВЫСОКАЯ НЕОДНОРОДНОСТЬ АНАЛИЗИРУЕМОЙ ПРОБЫ (МНОЖЕСТВО
МОЛЕКУЛ, АТОМОВ И ИОНОВ С РАЗНОЙ КИНЕТИЧЕСКОЙ ЭНЕРГИЕЙ ИЛИ
ТЕМПЕРАТУРОЙ), СЛЕДОВАТЕЛЬНО, ОБУСЛАВЛИВАЕТ ПРОЦЕССЫ
САМОПОГЛОЩЕНИЯ И САМООБРАЩЕНИЯ – ВОЗБУЖДЕНИЕ ЧАСТИЦЫ НЕ
ИЗЛУЧАЮТ, А ПЕРЕДАЮТ СВОЮ ЭНЕРГИЮ НЕ ВОЗБУЖДЕННЫМ АТОМАМ.
• ТЕОРЕТИЧЕСКИЕ ПУТИ ПОВЫШЕНИЯ ИНТЕНСИВНОСТИ.
• 1. УВЕЛИЧЕНИЕ ТЕМПЕРАТУРЫ ПЛАМЕНИ (ЗАМЕНА ГОРЮЧЕЙ
СМЕСИ).
• 2. УВЕЛИЧЕНИЕ ПРОДОЛЖИТЕЛЬНОСТИ ПРЕБЫВАНИЯ АТОМОВ В
ЗОНЕ III ( ОКИСЛИТЕЛЬНАЯ ЗОНА, СКОРОСТЬ ИСТЕЧЕНИЯ ГАЗА).
• 3. СНИЖЕНИЕ ЗАТРАТ ЭНЕРГИИ НА АТОМИЗАЦИЮ ПРОБЫ
(УМЕНЬШЕНИЕ РАЗМЕРОВ КАПЕЛЬ АЭРОЗОЛЯ).
27. Электрическая дуга
ЭЛЕКТРИЧЕСКАЯ ДУГА
• РАБОТА ВСЕХ ЭЛЕКТРИЧЕСКИХ ИСТОЧНИКОВ СВЕТА (ИСКРА, ДУГА)
ОСНОВАНА НА ГАЗОВОМ РАЗРЯДЕ – ПРОХОЖДЕНИЕ ТОКА ЧЕРЕЗ
ВОЗДУХ ИЛИ ДРУГОЙ ГАЗ. В ОБЫЧНЫХ УСЛОВИЯХ ГАЗ НЕ
ПРОВОДИТ ЭЛЕКТРИЧЕСКИЙ ТОК (ИЗОЛЯТОР). ЕСЛИ ПОДКЛЮЧИТЬ
2 ЭЛЕКТРОДА К ВНЕШНЕМУ ИСТОЧНИКУ ТОКА И В ВОЗДУШНОМ
ПРОМЕЖУТКЕ СОЗДАТЬ ЗАРЯЖЕННЫЕ ЧАСТИЦЫ, ТО ВОЗДУХ
НАЧИНАЕТ ПРОВОДИТЬ ТОК.
• ПО ВИДУ ОБРАЗОВАНИЯ ЗАРЯЖЕННЫХ ЧАСТИЦ РАЗРЯД ДЕЛИТСЯ НА 2
ГРУППЫ:
• 1. САМОСТОЯТЕЛЬНЫЙ – ПРИ ПОВЫШЕНИИ НАПРЯЖЕНИЯ
ЗАРЯЖЕННЫЕ ЧАСТИЦЫ В ВОЗДУХЕ ПРИОБРЕТАЮТ ВЫСОКУЮ
КИНЕТИЧЕСКУЮ ЭНЕРГИЮ И ПЕРЕДАЮТ ЕЕ МОЛЕКУЛАМ ГАЗА ИЛИ
ЭЛЕКТРОДАМ. ПОЭТОМУ ВОЗРАСТАЕТ КОЛИЧЕСТВО ЗАРЯЖЕННЫХ
ЧАСТИЦ В ВОЗДУШНОМ ПРОМЕЖУТКЕ ЗА СЧЕТ ИОНИЗАЦИИ АТОМОВ
И МОЛЕКУЛ И ЭМИССИЯ ЧАСТИЦ ЭЛЕКТРОДОВ. ПРИ
САМОСТОЯТЕЛЬНОМ ГАЗОВОМ РАЗРЯДЕ МЕЖДУ ЭЛЕКТРОДАМИ
ОБРАЗУЕТСЯ ПЛАЗМА – ЭТО ГАЗ, ИМЕЮЩИЙ ВЫСОКУЮ T И
СОСТОЯЩУЮ ИЗ ЗАРЯЖЕННЫХ И НЕЙТРАЛЬНЫХ ЧАСТИЦ.
• 2.НЕ САМОСТОЯТЕЛЬНЫЙ РАЗРЯД ВОЗНИКАЕТ ПРИ ОСВЕЩЕНИИ
ЭЛЕКТРОДОВ В У. Ф. И РЕНТГЕНОВСКОМ ИЗЛУЧЕНИИ.
• ЭЛЕКТРИЧЕСКАЯ ДУГА СОЗДАЕТ
ПРОДОЛЖИТЕЛЬНЫЙ РАЗРЯД ПРИ ВЫСОКОЙ
СИЛЕ ТОКА (5-7 АМПЕР) И НЕ ВЫСОКИМ
НАПРЯЖЕНИЕМ (50-80 ВОЛЬТ). РАЗРЯД
ПРОПУСКАЮТ МЕЖДУ ДВУМЯ ЭЛЕКТРОДАМИ,
КОТОРЫЕ ИЗГОТАВЛИВАЮТ ИЗ
АНАЛИЗИРУЕМОГО ОБРАЗЦА.
• СПОСОБЫ ВВЕДЕНИЯ ПРОБЫ В ЗОНУ
ЭЛЕКТРИЧЕСКОГО РАЗРЯДА:
• АНАЛИЗИРУЕМЫЙ МЕТАЛЛ САМ СЛУЖИТ
ЭЛЕКТРОДОМ
• РАСТВОРЫ ВВОДЯТ С ПОМОЩЬЮ
РАСПЫЛИТЕЛЕЙ.
• ПОРОШКООБРАЗНЫЕ ПРОБЫ ПОМЕЩАЮТ В
СПЕЦИАЛЬНЫЕ УГЛУБЛЕНИЯ В ЭЛЕКТРОДАХ

На данном видеоуроке мы с вами поговорим о типах оптических спектров. Рассмотрим, как происходит поглощение и испускание света атомами. А также поговорим о происхождение линейчатых спектров. Рассмотрим два постулата Бора и узнаем, где и зачем применяется спектральный анализ.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Типы оптических спектров. Поглощение и испускание света атомами. Происхождение линейчатых спектров"
Мирозданье постигая, все познай, не отбирая:
Что — внутри, во внешнем сыщешь.
Так примите ж без оглядки
Мира внятные загадки.
В данной теме речь пойдёт о типах оптических спектров. Рассмотрим, как происходит поглощение и испускание света атомами. А также поговорим о происхождение линейчатых спектров.
В прошлой теме говорилось о дисперсии света. Дисперсия света — это зависимость показателя преломления среды и скорости света в нем от частоты световой волны.
В 1664–1668 гг. Исаак Ньютон провел серию опытов по изучению солнечного света и причин возникновения цветов с помощью стеклянной призмы. При разложении с помощью трёхгранной призмы белого света, т.е. света в видимом диапазоне, содержащего длины волн в диапазоне 380—760 нм, возникает радужная полоска, которую Ньютон назвал спектром.
В настоящее время для точного исследования спектров такие простые приспособления, как узкая щель, ограничивающая световой пучок, и призма (которые использовал Ньютон), уже недостаточны. Необходимы приборы, дающие четкий спектр, т. е. приборы, хорошо разделяющие волны различной длины и не допускающие перекрытия отдельных участков спектра. Такие приборы называют спектральными аппаратами. Чаще всего основной частью спектрального аппарата является призма. Рассмотрим схему устройства призменного спектрального аппарата.
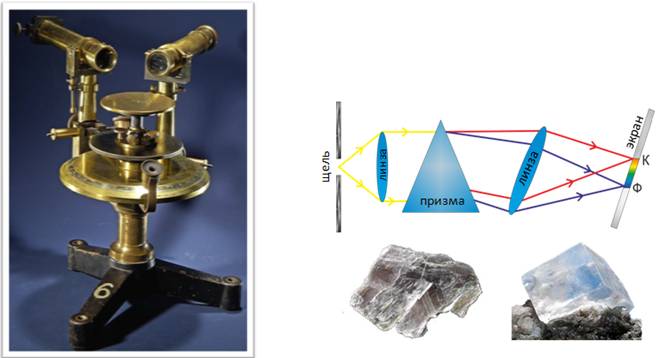
Исследуемое излучение поступает вначале в часть прибора, называемую коллиматором. Коллиматор представляет собой трубу, на одном конце которой имеется ширма с узкой щелью, а на другом - собирающая линза. Щель находится на фокусном расстоянии от линзы. Поэтому расходящийся световой пучок, попадающий на линзу из щели, выходит из нее параллельным пучком и падает на призму, которая может быть изготовлена не только из стекла, но и кварца, соли и т.п.
Так как разным частотам соответствуют различные показатели преломления, то из призмы выходят параллельные пучки, не совпадающие по направлению. Они падают на линзу. На фокусном расстоянии этой линзы располагается экран — матовое стекло или фотопластинка. Линза фокусирует параллельные пучки лучей на экране, и вместо одного изображения щели получается целый ряд изображений. Каждой частоте (узкому спектральному интервалу) соответствует свое изображение. Все эти изображения вместе и образуют спектр. Описанный прибор называется спектрографом.
Если вместо второй линзы и экрана используется зрительная труба для визуального наблюдения спектров, то прибор называется спектроскопом.
Спектральный состав излучений различных веществ весьма различен. Но многочисленные наблюдения и фотографии спектров показывают, что все спектры можно разделить на три сильно отличающихся друг от друга типа, которые определяются состоянием светящегося объекта.
В опыте Ньютона, при пропускании солнечного света через призму, получали спектр в виде сплошной полосы. В ней были представлены все цвета, плавно переходящие один в другой. Такой спектр называется сплошным или непрерывным спектром.
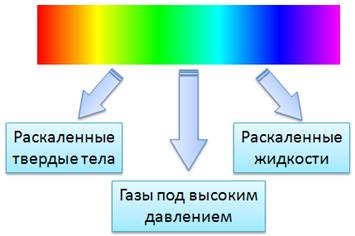
Сплошные спектры излучаются раскаленными твердыми и жидкими веществами, а также газами, находящимися под большим давлением. Это указывает на то, что вид непрерывного спектра и сам факт его существования определяются не только свойствами отдельных излучающих атомов, но и в сильной степени зависят от взаимодействия атомов друг с другом. Основную роль в излучении играет возбуждение атомов и молекул при хаотическом движении этих частиц, обусловленное высокой температурой. Солнце дает сплошной спектр, так как его оболочка состоит из плазмы высокой плотности.
Второй тип спектров — это линейчатые спектры.

Линейчатым называют спектр, состоящий из отдельных резко очерченных цветных линий, отделенных друг от друга широкими темными промежутками.
Например, если внести в пламя газовой горелки кусочек поваренной соли, то пламя окрасится в желтый цвет, а в спектре будут видны две близко расположенные желтые линии, характерные для спектра паров натрия.

Наличие линейчатого спектра означает, что вещество излучает свет только вполне определенных длин волн (точнее, в определенных очень узких спектральных интервалах). Каждая из линий имеет конечную ширину.
Такие спектры получаются от светящихся атомарных газов или паров. В этом случае свет излучают атомы, которые практически не взаимодействуют друг с другом. Это самый фундаментальный, основной тип спектров.
Линейчатые спектры различных химических элементов отличаются цветом, положением и числом отдельных светящихся линий.
И последний тип спектров — это полосатые спектры.

Они состоят из отдельных полос, разделенных темными промежутками. С помощью очень хорошего спектрального аппарата можно обнаружить, что каждая полоса представляет собой совокупность большого числа очень тесно расположенных линий.
Полосатые спектры излучаются отдельными возбужденными молекулами (молекулярный газ). Излучение вызвано как электронными переходами в атомах, так и колебательными движениями самих атомов в молекуле.
Все описанные выше спектры называются спектрами испускания, т.е. спектрами, получаемыми при разложении света, излученного самосветящимися телами.
Однако, кроме спектров испускания, существуют еще так называемые спектры поглощения.
Спектры поглощения получают, пропуская свет от источника, дающего сплошной спектр, через вещество, атомы и молекулы которого находятся в невозбужденном состоянии.

Спектры поглощения твердых и жидких тел обычно имеют вид широких темных полос, закрывающих часть сплошного спектра источника, а в случае атомарных газов или паров они состоят из отдельных черных линий, видимых на фоне сплошного спектра. Пропустив, например, свет от электрической лампы через сосуд с парами натрия, мы получим на сплошном спектре лампы две узкие черные линии в желтой области спектра как раз в том месте, где располагаются желтые линии в спектре испускания натрия. Другими словами, линии поглощения атомов натрия точно соответствуют его линиям испускания.
Совпадение частот линий испускания и поглощения можно наблюдать и в спектрах других элементов, например водорода и гелия.
В 1859 году на основе экспериментальных данных немецкий ученый Густав Роберт Кирхгоф сформулировал закон обратимости спектральных линий: линии поглощения соответствуют линиям испускания, т.е. атомы менее нагретого вещества поглощают из сплошного спектра как раз те частоты, которые они в других условиях испускают.
Спектр атомов каждого химического элемента уникален. Как не бывает двух людей с одинаковым дактилоскопическим узором, или окраской радужной оболочки глаз, или двух китов с одинаковой окраской хвостового плавника, так и не существует двух химических элементов, атомы которых излучали бы одинаковый набор спектральных линий.
Благодаря этому стало возможным появление метода спектрального анализа, разработанного в 1859 году Кирхгофом и его соотечественником немецким физиком Бунзеном. Спектральным анализом называют метод исследования химического состава различных веществ по их спектрам.
Анализ, проводимый по спектрам испускания, называют эмиссионным, а по спектрам поглощения — абсорбционным спектральным анализом.

В основе эмиссионного спектрального анализе лежат следующие факты:
1) Каждый элемент имеет свой спектр (отличается числом линий, их расположением и длинами волн), который не зависит от способов возбуждения.
2) Интенсивность спектральных линий зависит от концентрации элемента в данном веществе.
Для выполнения спектрального анализа вещества с неизвестным химическим составом необходимо осуществить две операции: заставить каким-то образом атомы этого вещества излучать свет с линейчатым спектром, затем разложить этот свет в спектр и определить длины волн наблюдаемых в нем линий. Сравнивая полученный линейчатый спектр с известными спектрами химических элементов таблицы Менделеева, можно определить, какие химические элементы имеются в составе исследуемого вещества. Путем сравнения интенсивности различных линий спектра можно определить и относительное содержание различных элементов в этом веществе.
Спектральный анализ выгодно отличается от химического анализа своей простотой, высокой чувствительностью, а также возможностью определять химический состав отдаленных тел, например звезд. Он используется для контроля состава вещества в металлургии, машиностроении и атомной индустрии. Этот метод применяется также в геологии, археологии, криминалистике и многих других сферах деятельности.В астрономии методом спектрального анализа определяют химический состав атмосфер планет и звезд, температуру звезд и магнитную индукцию их полей.

В процессе изучения и применения линейчатых спектров возникли различные вопросы, которые нельзя было объяснить в рамках классической механики Ньютона. Как, например, объяснить, почему атомы каждого химического элемента имеют свой строго индивидуальный набор спектральных линий? Почему совпадают линии излучения и поглощения в спектре данного элементы? Чем обусловлены различия в спектрах атомов разных элементов? Ответы на эти и многие другие вопросы удалось найти только в начале ХХ в. благодаря возникновению новой физической теории — квантовой механики. Одним из основоположником этой теории был датский физик Нильс Бор. Бор пришел к заключению, что свет излучается атомами вещества. В связи с этим в 1913 г. он сформулировал два постулата:
Первый постулат (его еще называют постулатом стационарных состояний) гласит, что атомная система может находиться только в особых стационарных (квантовых) состояниях, каждому из которых соответствует определенная энергия, находясь на которых атом не излучает и не поглощает энергии.
Стационарным состояниям соответствуют стационарные орбиты, по которым движутся электроны. При движении по стационарным орбитам электроны не излучают электромагнитные волны, несмотря на ускоренное движение. В каждом стационарном состоянии атом обладает определенным квантовым значением энергии.
Второй постулат (или правило частот) гласит, что при переходе атома из одного стационарного состояния в другое излучается или поглощается квант энергии.

Атомы излучают и поглощают энергию дискретными порциями — квантами, значение которых равно разности энергии тех стационарных состояний, между которыми происходит данный переход.
Состояние атома, в котором все электроны находятся на стационарных орбитах с наименьшей возможной энергией, называется основным. Все другие состояния атома называются возбужденными. У атомов каждого химического элемента имеется свой характерный набор энергетических уровней. Поэтому переходу с более высокого энергетического уровня на более низкий будут соответствовать характерные линии в спектре испускания, отличные от линий в спектре другого элемента.
Совпадение линий излучения и поглощения в спектрах атомов данного химического элемента объясняется тем, что частоты волн, соответствующих этим линиям, а спектре, определяются одними и теми же энергетическими уровнями. Поэтому атомы могут поглощатьсвет только тех частот, которые они способны излучать.
Основные выводы:
– Все спектры испускания можно разделить на три сильно отличающихся друг от друга типа, которые определяются состоянием светящегося объекта.
– Сплошной спектр. Сплошной спектр представляет собойсплошную полосу, в которой все цвета, плавно переходят один в другой.
– Линейчатый спектр. Линейчатым называют спектр, состоящий из отдельных резко очерченных цветных линий, отделенных друг от друга широкими темными промежутками.
– Полосатый спектр. Полосатый спектр состоит из отдельных полос, разделенных темными промежутками.
– Для изучения спектров использую специальные приборы, которые называются спектральными — это приборы, хорошо разделяющие волны различной длины и не допускающие перекрытия отдельных участков спектра.
– Из опыта следует, что атомы могут поглощать свет только тех частот, которые они способны излучать. Это утверждение носит название закона обратимости спектральных линий.
– Спектральный анализ — это метод исследования химического состава различных веществ по их спектрам.
– В процессе изучения и применения линейчатых спектров возникли различные вопросы, ответы на которые дал Нильс Бор в 1913 году, сформулировав два постулата.
– Первый постулат (постулат стационарных состояний) гласит, что атомная система может находиться только в особых стационарных состояниях, каждому из которых соответствует определенная энергия, находясь на которых атом не излучает и не поглощает энергии.
– Второй постулат (или правило частот) гласит, что при переходе атома из одного стационарного состояния в другое излучается или поглощается квант энергии.
Читайте также:

