Применение сульфохлоридов жирного ряда кратко
Обновлено: 06.07.2024
СЕРАОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ – класс органических соединений (см. ХИМИЯ ОРГАНИЧЕСКАЯ), содержащих фрагмент C–S. К этому же классу причисляют и соединения, в которых атом S соединен с С не непосредственно, а через О или N. Многообразие этих соединений увеличивается, т.к. сера может проявлять в соединениях различную степень окисления: S(II), S(IV), S(VI).
Наиболее многочисленны соединения S(II), где сера выступает как аналог кислорода. Тиолы или тиоспирты R–S–H представляют собой серосодержащие аналоги спиртов. Тиоэфиры R–S–R соответствуют простым эфирам. Существуют и тиофенолы Ph–S–H, тиокарбонильные соединения: тиоальдегиды RC(=S)H, тиокетоны R2C=S), тиокарбоновые кислоты RC(=S)OH.
В сераорганических соединениях встречается фрагмент –S–S–, аналогичный пероксидному –О–О– в органических соединениях, например, диалкилдисульфиды R–S–S–R. Среди соединений с высокой степенью окисления серы распространены сульфоксиды R2S=O, а также сульфоновые кислоты R–SO2–OH, представляющие собой, по существу, серную кислоту с одним органическим заместителем, и сульфоны – серная кислота с двумя органическими заместителями R–SO2–R. Многие химические превращения с участием сераорганических соединений сопровождается изменением степени окисления серы.
Номенклатура сераорганических соединений.
Словосочетание сульфоновые кислоты (R–SO2–OH) входит в название соединения, при этом дополнительно указывают название углеводорода (но не радикала), связанного с S, например, СН3–SO2–OH – метансульфоновая кислота (но не метилсульфоновая), СН3С6Н4–SO2–OH – толуолсульфоновая кислота. Часто сульфоновые кислоты именуют сокращенно сульфокислотами, поэтому последнее указанное соединение обычно называют толуолсульфокислотой.
Правила составления названий, несмотря на их кажущуюся сложность, весьма прозрачны: в тех случаях, когда c атомом S связана одна органическая группа (тиолы и сульфоновые кислоты), в названии упоминают углеводород – алкан, если же c атомом S связаны две группы (тиоэфиры, сульфоксиды, сульфоны), то название строят, исходя из радикала – алкила.
Химические свойства сераорганических соединений,
в основном, тех, что содержат S(II), напоминают свойства кислородсодержащих органических соединений.
Тиолы – слабые кислоты и, подобно спиртам, могут реагировать с активными металлами, образуя тиоляты (рис. 1А). При действии мягких окислителей, например, пероксида водорода, они образуют дисульфиды (аналоги пероксидов) (рис. 1Б). Более сильные окислители (перманганаты) переводят их в алкилсульфоновые кислоты, в которых степень окисления серы VI (рис. 1В). В присутствии каталитических количеств кислоты тиолы присоединяются к олефинам по двойной связи (рис. 1Г). При взаимодействии тиолов с альдегидами или кетонами (катализатор – кислота) образуются тиоацетали или тиокетали (рис. 1Д) – аналоги соответствующих кислородных соединений. Подобно спиртам, тиолы реагируют с хлорангидридами карбоновых кислот (в присутствии оснований, связывающих образующийся HCl), образуя тиоэфиры карбоновых кислот (рис.1Ж) – близкие к органическим сложным эфирам.
Рис.1. РЕАКЦИИ С УЧАСТИЕМ ТИОЛОВ.
Метантиол при обычных условиях – газообразный, остальные, вплоть до додекантиола, – жидкости. Алифатические тиолы токсичны и обладают резким неприятным запахом, который можно почувствовать при очень низких концентрациях, менее 10 –8 мг/л, поэтому их (метантиол или бутантиол) добавляют в очень незначительных количествах к бытовому газу, не имеющему запаха, что позволяет вовремя заметить утечку газа. Скунс, животное семейства куньих, распространенное от Южной Канады до Центральной Америки, выделяет вещество с неприятным отпугивающим запахом тиолов, разбрызгивая в сторону нападающего бутантиол CH3CH2CH2CH2SH, вырабатываемый специальными железами.
Тиоэфиры подобно своим аналогам простым эфирам, могут образовывать донорно-акцепторные связи за счет неподеленных пар электронов у атома S, при этом получаются комплексные соединения, например, в результате присоединения к тиоэфирам алкилхлоидов (рис. 2А) или солей тяжелых металлов (рис. 2Б). При действии слабых окислителей (пероксид водорода) тиоэфиры окисляются до сульфоксидов (соединений, содержащих группировку >S=O, рис. 2В), взаимодействие с более сильными окислителями (KMnO4, HNO3) переводит их в сульфоны, представляющие собой серную кислоту с двумя органическим заместителями (рис. 2Г).
Рис. 2. ХИМИЧЕСКИЕ СВОЙСТВА ТИОЭФИРОВ
В отличие от тиолов, хорошо очищенные тиоэфиры не обладают запахом и не токсичны, но некоторые их галогенпроизводные ядовиты, например, отравляющее вещество иприт (ClCH2CH2)2S.
Сульфоксиды R2S=O – промежуточные структуры между тиоэфирами и сульфонами: при окислении сульфоксидов образуются сульфоны (рис. 3А), а при их восстановлении – тиоэфиры (рис. 3Б). В то же время по свойствам они немного похожи на органические карбонильные соединения: при взаимодействии с аминами образуют сульфимиды (рис. 3В) – соединения, напоминающие имиды (точнее, основания Шиффа), у которых отличительный признак – фрагмент >C=NR. Сравнивая с органическими аналогами, можно видеть, что атом S как бы заменяет собой атом С. Несмотря на то, что сульфоксиды R2S=O можно формально рассматривать как аналоги кетонов R2С=O, их химическое поведение все же заметно отличается, прежде всего, из-за способности S легко менять степень окисления. Например, если то же присоединение аминов, что и на рис. 3В, проводить с одновременным окислением, получаются сульфоксимиды (рис. 3Г) – сера переходит в состояние S(VI).
Рис. 3. ХИМИЧЕСКИЕ СВОЙСТВА СУЛЬФОКСИДОВ
Сульфоновые кислоты представляют собой сильные кислоты, сравнимые с серной, они реагируют с неорганическими основаниями, образуя водорастворимые соли сульфоновых кислот – сульфонаты (рис. 4А). При действии хлорирующих реагентов (PCl5) образуются сульфохлориды, напоминающие хлорангидриды карбоновых кислот (рис. 4Б), а восстановление сульфоновых кислот приводит к тиолам (рис. 4В). Когда сульфогруппа присоединена к бензольному ядру, она подвижна и может быть заменена другими функциональными группами: при действии амида натрия образуется анилин (рис. 4Г), сплавление со щелочью приводит к фенолу (рис. 4Д), а взаимодействие с HNO3 – к нитробензолу (рис. 4Е). При взаимодействии сульфокислот с простыми эфирами (рис. Ж) образуются эфиры сульфоновых кислот RS(O)2–OR. Они представляют собой аналоги сложных эфиров. Намного легче такие же соединения получаются при взаимодействии сульфохлорида со спиртами (рис. З) – типичный способ получения сложных эфиров.
Рис.4. РЕАКЦИИ С УЧАСТИЕМ СУЛЬФОНОВЫХ КИСЛОТ.
Получение сераорганических соединений.
Тиолы получают взаимодействием кислых неорганических сульфидов с галогеналкилами (рис. 5А), взаимодействием в газовой фазе спиртов с H2S при 300–350° в присутствии катализаторов Al2O3 или ThO2 (рис. 5Б), или каталитическим присоединением H2S к двойной связи олефинов, катализаторы – сульфидов металлов (рис. 5В).
Рис. 5. ПОЛУЧЕНИЕ ТИОЛОВ
Тиоэфиры получают взаимодействием галогеналкилов с неорганическими сульфидами (рис. 6А). Когда нужно получить тиоэфиры с различающимися органическими группами, проводят взаимодействие галогеналкилов с тиолятами щелочных металлов (рис. 6Б), либо присоединением тиолов к олефинам (рис. 6В). О В некоторых простых эфирах, имеющих циклическое строение, можно заменить атом О атомом S, при этом образуется циклический тиоэфир, например, тиофен, который относят к гетероциклическим соединениям (рис. 6Г).
Рис 6. СПОСОБЫ ПОЛУЧЕНИЯ ТИОЭФИРОВ
Наиболее распространенный способ получения сульфоксидов – окисление тиоэфиров (рис. 2В).
Сульфоновые кислоты получают окислением тиолов (рис. 1В) и взаимодействием углеводородов с серной кислотой (рис. 7А) или неорганических сульфитов с алкилгалогенидами (рис. 7Б).
Рис. 7. ПОЛУЧЕНИЕ СУЛЬФОНОВЫХ КИСЛОТ
Два способа получения сульфонов – окислением тиоэфиров и окислением сульфоксидов – были показаны ранее (рис. 2Г и 3А). Кроме того, сульфоны получают присоединением сульфохлоридов к двойной связи олефина, при этом одна из органических групп в получившемся сульфоне содержит галоген (рис. 8А). При взаимодействии сульфохлорида с бензолом образуется фенилсодержащий сульфон (рис. 8Б).
Рис. 8. ПОЛУЧЕНИЕ СУЛЬФОНОВ
Сераорганические соединения в нефти. Наряду с углеводородами, нефть включает заметное количество серосодержащих соединений. В некоторых сортах нефти содержание серы достигает 6–8%, то тиолы и тиоэфиры, среди которых заметное место занимает циклический тиоэфир тиофен (рис. 6). В процессе переработки нефти эти соединения попадают в моторное топливо и моторные масла. При сжигании в двигателях полученного из нефти моторного топлива образуется диоксид серы, загрязняющий атмосферу и выпадающий в виде кислотных дождей, губительно действующих на живые организмы и приводящих к коррозии технических сооружений. Моторные масла, содержащие сераорганические соединения, также вызывают ускоренную коррозию оборудования, поэтому в процесс переработки нефти включают стадию, позволяющую снизить (до нескольких долей процента) содержание neS-органических соединений в нефтепродуктах. При обработке водородом под давлением при температуре 380–420° C и в присутствии катализаторов (оксиды и сульфиды Со, Мо, W) S-органические соединения распадаются с образованием углеводородов и сероводорода Н2S (процесс гидроочистки, иногда используют более информативный термин – гидрообессеривание). Затем Н2S превращают в элементную серу или серную кислоту. Разработаны способы удаления соединений серы, содержащихся в нефти, с превращением их в технически важные сераорганические соединения, например, сульфоксиды, при этом проводят окисление по схеме, аналогичной той, что на рис. 2В).
Сераорганические соединения биологического происхождения.
Аминокислота метионин CH3SCH2CH2CH(NH2)COOH (тиоэфир) R-S-R) играет важную роль во многих биологических процессах. Она относится к группе незаменимых аминокислот, которые организм млекопитающих должен получать с продуктами питания (см. БЕЛКИ), суточная потребность этой аминокислоты для человека 2,5–3 г, в природе ее синтезируют некоторые микроорганизмы и растения, далее метионин с продуктами питания попадает в организм млекопитающих. Метионин входит в состав многих белковых молекул и участвует в биохимических процессах, приводящих к синтезу адреналина. Недостаток метионина в пище животных и человека приводит к нарушению биосинтеза белков, замедлению роста и развития организма. Кроме того, метионин – главный источник, поставляющий в организм атомы S, необходимые для биосинтеза другой аминокислоты – цистеина HSCH2CH(NH2)COOH (тиол, содержит фрагмент –SH). Цистеин составляет основную часть белковых молекул, из которых образуются кожные и волосяные покровы млекопитающих. Помимо этого, на основе цистеина кишечная флора млекопитающих синтезирует ферменты (биологические катализаторы), участвующие в переработке углеводов и жиров. Биологически важное соединение биотин (витамин Н, бициклический тиоэфир, рис. 9), участвующий в процессах переноса углекислоты, при его недостатке развивается кожное заболевание себорея.
Рис. 9. БИОТИН (витамин Н)
Летучие компоненты, определяющие запах чеснока, содержат соединение класса сульфоксидов – алиин CH2=CHCH2S(O)CH2CH(NH2)COOH (производное цистеина), а также тиоэфир диаллилсульфид (CH2=CHCH2)2S и ряд других S-содержащих соединений, В целом, запах чеснока определяется сочетанием почти десяти соединений этого класса. Чесночный запах изо рта определяется веществами, которых в чесноке нет. Установлено, что под действием биологических катализаторов (ферментов) эти соединения частично превращаются в организме в диаллилдисульфид CH2=CHCH2S–SCHCH2=CH2 и сульфоксид-сульфид – аллицин CH2=CHCH2S(О)–SCHCH2=CH2, которые из пищеварительного тракта всасываются в кровь, попадают в легкие и затем выдыхаются. Установлено, например, что S-содержащие компоненты чеснока снижают уровень холестерина в крови, тормозят протекание онкологических процессов, защищают печень от токсинов.
Запах лука обусловлен, в основном, присутствием аллилпропилдисульфида CH2=CHCH2S–SCH2CH2CH3.
Применение сераорганических соединений.
При автоокислении многих органических соединений возникают свободные радикалы (соединения, содержащие неспаренный электрон у атома углерода), которые далее ведут цепной процесс окисления. Тиолы и тиоэфиры используют как эффективные ловушки свободных радикалов, при этом они окисляются подобно тому, как показано на рис. 1Б и 2В. Это свойство позволяет использовать ихв качестве стабилизаторов, защищающих моторные топлива и масла от окисления. Для стабилизации каучуков используют трудно испаряющиеся соединения, например, додекантиол С12Н23SH.
Радиопротекторы вводят в организм до облучения перед радиотерапевтическим лечением в медицине при долговременных космических полетах для защиты от солнечных вспышек. В результате заметно снижается доза полученной радиации.
На основе сераорганических соединений, содержащих дисульфидные группировки –S–S–, созданы полимеры – полисульфидные каучуки (промышленное название – тиоколы), которые получают поликонденсацией дигалогенпроизводных алифатических соединений Cl–R–Cl [R = (CH2)2, (CH2)3] и дисульфида натрия Na2S2, в результате образуются полисульфиды [–R–S–S–]n. Такие каучуки при добавлении окислителей (например, бихроматов) образуют сшитые резиноподобные материалы – вулканизаты, которые по прочности уступают обычным каучукам, но превосходят их по бензо- и маслостойкости, а также по атмосферостойкости, они не теряют механических свойств при действии влаги, смене температур и воздействии солнечной радиации. Это позволяет применять их при изготовлении бензо- и маслопроводов как внутренние покрытия резервуаров для хранения топлива, для герметизации швов между бетонными панелями при строительстве домов и как надежную шпатлевку для лодок и яхт.
Среди сульфоксидов наиболее распространен получил диметилсульфоксид (CH3)2S=O – соединение с высокими растворяющими способностями, кроме того, он легко образует растворимые комплексы с неорганическими соединениями большинства металлов. Его широко применяют для экстракции металлов, органических кислот и фенолов, кроме того, в производстве синтетических волокон и в качестве пластификаторов полимерных материалов.
Из щелочных солей сульфоновых кислот – сульфонатов (рис. 4А) изготавливают все современные порошкообразные и жидкие синтетические моющие средства. Они легко растворяются в воде и обладают высокой пенообразующей способностью. Наиболее эффективны для этих целей соединения, в которых атом S соединен с крупной алифатической (С14–18) или арилалифатической (R–C6H4–) группой.
Механизм действия стрептоцида и сходных с ним препаратов своеобразен. Стрептоцид близок по строению к п-аминобензойной кислоте (рис. 10), необходимой для роста микроорганизмов, без этой кислоты бактерии не могут размножаться. Стрептоцид как бы обманывает бактерии, он начинает конкурировать с п-аминобензойной кислотой, участвуя в биохимических процессах и приводя к образованию нежизнеспособных бактерий. Чтобы такая конкуренция была успешной, в организме больного человека нужно поддерживать в течение определенного времени повышенную концентрацию лекарства.
Сейчас разработано около 40 типов сульфаниламидных препаратов с широким спектром лечебного действия, они отличаются от стрептоцида наличием различных замещающих, как правило, гетероциклических групп у атомов азота, основной сульфаниламидный фрагмент сохраняется во всех препаратах неизменным. Сульфадимезин и этазол (рис. 10) активны против стрептококков, пневмококков, стафилококков и некоторых других бактерий. Эти препараты хорошо всасывается из желудочно-кишечного тракта и быстро накапливается в крови в необходимых концентрациях.
Для лечения желудочно-кишечных заболеваний (например, дизентерия) разработаны препараты фталазол, сульгин (рис. 10). Для всех лекарственных препаратов обычно используют их торговые наименования, а названия, составленные по правилам номенклатуры, применяют редко.
Известны и S-содержащие лекарственные препараты, которые не относятся к группе сульфаниламидов, например, производное сульфанилмочевины – бутамид (рис. 11) стимулирует работу поджелудочной железы, и потому его применяют при лечении диабета. Иную помощь оказывает больным диабетом имид сульфобензойной кислоты – сахарин (рис. 11), его используют как заменитель сахара, противопоказанного при диабете. Сахарин в 400 раз слаще сахара, он не усваивается организмом и выводится с мочой. Производное группы сульфонов 4,4'-диаминодифенилсульфон (торговое название – диафенилсульфон, рис. 11) – средство для лечения проказы.
Рис.11. НЕКОТОРЫЕ СЕРАОРГАНИЧЕСКИЕ ПРЕПАРАТЫ, не относящиеся к группе сульфаниламидов
Полиариленсульфоны – полимеры, в цепи которых чередуются фениленовые –С6Н4– (либо дифениленовые –С6Н4–С6Н4–) фрагменты и сульфогруппы SO2. Эти полимеры устойчивы до 400° С, обладают высокой механической прочностью, хорошими диэлектрическими свойствами и химической инертностью. Их используют для изготовления электротехнических изделий (корпуса индукционных катушек, переключателей), как конструкционные материалы (некоторые детали станков и автомобилей), а также в виде пленки для упаковки пищевых продуктов.
Алканы при обычных условиях устойчивы к действию серной кислоты. При нагревании серная кислота выступает как окислитель. Только "дымящаяся" серная кислота (олеум) способна сульфировать алканы, но эту реакцию трудно реализовать в промышленных условиях с необходимой эффективностью.

Поэтому перспективным методом получения сульфоппроизводных является сульфохлорированиеи сульфоокисления.
Метод сульфохлорирования
Реакция сульфохлорирования (К. Род, 1936 г.) заключается в действии на алкан молекул хлора и диоксида серы в газообразном состоянии:

Рисунок 2. Сульфохлорирование алканов. Автор24 — интернет-биржа студенческих работ
Реакция происходит по цепному радикальному механизму на свету или в присутствии веществ, которые образуют свободные радикалы (диазосоединения, пероксиды, тетраэтилсвинец и т.д.):

Рисунок 3. Сульфохлорирование алканов. Автор24 — интернет-биржа студенческих работ
Кроме $RSO_2Cl$ в этих реакциях должны получаться и хлорпроизводные в результате цепного процесса хлорирования. Ключевой стадией для этих конкурирующих процессов хлорирования и сульфохлорирования является взаимодействие алкил-радикала с $Cl_2$ или $SO_2$:
Готовые работы на аналогичную тему

Рисунок 4. Сульфохлорирование алканов. Автор24 — интернет-биржа студенческих работ
Для подавления реакций хлорирования, сульфохлорирование алканов проводят при больших избытках $SO_2$, который выполняет роль интерцептора (перехватчика) алкил-радикалов с развитием новых радикальных цепей. Селективность этого процесса невелика и подобна селективности при радикальном галогенировании. Из пропана образуется примерно в равных количествах оба возможных изомера:

Рисунок 5. Сульфохлорирование алканов. Автор24 — интернет-биржа студенческих работ
В реакцию фотохимического сульфирования при комнатной температуре вступают все алканы, начиная с метана. Атомы водорода у вторичных углеродных атомов замещаются легче, чем первичные. У третичного атома углерода атом водорода сульфонилхлоридною группа не замещается, пожалуй, вследствие пространственных препятствий.
Еще одними агентами хлорирования являются сульфурилхлорид $SO_2Cl_2$ с активатором - бензоил пероксид $(C_6H_5COO)_2$ и тионилхлорид $SOCl_2$:

Рисунок 6. Сульфохлорирование алканов. Автор24 — интернет-биржа студенческих работ
Проведение сульфохлорирования в присутствии сульфурилхлорида или тионилхлорида не только увеличивает выходы целевых продуктов, но и вызывает увеличение скорости реакции.
Алкансульфохлориды
Алкансульфонилхлориды при щелочном гидролизе образуют соли индиговидних сульфокислот, которые применяются как моющие (прачечные) средства, поверхностно-активные вещества (ПАВ):

Рисунок 7. Сульфохлорирование алканов. Автор24 — интернет-биржа студенческих работ
Важное промышленное значение приобрел процесс сульфохлорирования тяжелых фракций синтина $(C12-C18)$ с последующим щелочным гидролизом алкилсульфохлоридив действием щелочей или соды. Алкильные группы сообщают этим соединениям липофильные свойства, а ионные сульфонатные группы $SO_$ - гидрофильные свойства. У солей с алкильными группами, содержащие 8 - 16 атомов углерода, гидрофильные и липофильные свойства сбалансированы таким образом, что они способны эмульгировать в воде масла и жиры. Синтетические детергенты получают в промышленности в огромных количествах сульфохлорированием керосиновых фракций нефти без деления на компоненты. Главным недостатком этого метода является загрязнение окружающей среды детергентами, которые применяются при флотации и в бытовых условиях. Бактерии разлагают соль алкан сульфокислот с неразветвленными углеродными цепями, но они не эффективны для алкан сульфокислот с разветвленными цепями.
Получение п-фенилуретилансульфохлорида
Еще одним важным продуктом который получаеться сульфохлорированием является фенилуретилансульфохлорид. Данное вещество являеться полупродуктом, который используется для получения стрептоцида -- важного лекарственного средства.
Процесс получения стрептоцида состоит из трех основных химических стадий и одной физико-химической очистки (белого стрептоцида) по общему химическому превращению фенилуретилана, который в свою очередь получают из анилина и метилхлорформиата.
Для проведения реакции необходимо используется ациланилид, потому что в растворе хлорсульфоновой кислоты, в отличие от раствора в апротонном растворителе, анилин протонованн на 100\%, так же как и в серной кислоте. Выбор защитной ацильной группы обусловлен экономическими факторами: по сравнению с фенилуретаном существенно дешевле использовать фенилуретилан.
Первой стадией получения стрептоцида является получение п-фенилуретилансульфохлорида (ПФУСХ) путем сульфо-хлорирования фенилуестилана (ФУ), разложение избыточной хлорсульфоновой (ХПК) кислоты водой и выделения целевого промежуточного продукта:

Рисунок 8. Сульфохлорирование алканов. Автор24 — интернет-биржа студенческих работ
Тепловой эффект невысок и составляет 43 кДж / моль.
В аппарат для сульфохлорирования заливают ХПК из расчета 5,37 кмоль кислоты на 1 кмоль ФУ. При включенной мешалке кислоту нагревают до 30 $<>^\circ$С. Затем в кожух реактора подают охлаждающую воду и одновременно шнековым дозировочным устройством - измельченный ФУ. Скорость загрузки ФУ регулируется автоматически в зависимости от температуры реакционной массы включением и выключением дозатора. Температура реакционной массы должна быть 32 . 35 $<>^\circ$С. НСl, который выделяется в процессе, по стеклянному трубопроводу направляется в поглотительную систему с целью получения 25 . 30\% -ной соляной кислоты.
После загрузки ФУ реакционную массу нагревают паром через оболочку до 42 . 44 $<>^\circ$ С и при этой температуре выдерживают в течение 2 ч. После этого реакционную массу охлаждают до 30 $<>^\circ$С. Охлажденную сульфомасу после анализа в цеховой лаборатории пережимают в сборник.
Самым сложным процессом является выделение ПФУСХ. Сульфохлориды нерастворимы в разбавленных кислотах. Поэтому для их выделения реакционную массу после проведения сульфохлорирования выливают в воду:

Рисунок 9. Сульфохлорирование алканов. Автор24 — интернет-биржа студенческих работ
Сульфоокисление
Сульфоокисление применяется для получения алкансульфонових кислот. Механизм этой реакции также свободнорадикальный, и действие УФ-излучения или применения радикальных инициаторов способствуют процессу:

Рисунок 10. Сульфохлорирование алканов. Автор24 — интернет-биржа студенческих работ
При облучении или применении радикальных инициаторов в системе возникают алкильные радикалы R, которые участвуют в таких преобразованиях:

Рисунок 11. Сульфохлорирование алканов. Автор24 — интернет-биржа студенческих работ
Приведенный механизм включает стадию образования промежуточных пероксидных соединений, что характерно для большинства реакций окисления органических соединений молекулярным кислородом.
СУЛЬФОХЛОРИДЫ (сульфонилхлориды, хлорангидриды сульфокислот), соединения общей формулы RSO 2 Cl, где R-opг. остаток. Жидкие или твердые в-ва (см. табл.); низшие алифатические и ароматические сульфохлориды обладают неприятным резким запахом, не раств. или трудно раств. в воде, раств. в диэтиловом эфире, ацетоне, СНСl 3 , ССl 4 , спиртах, бензоле.
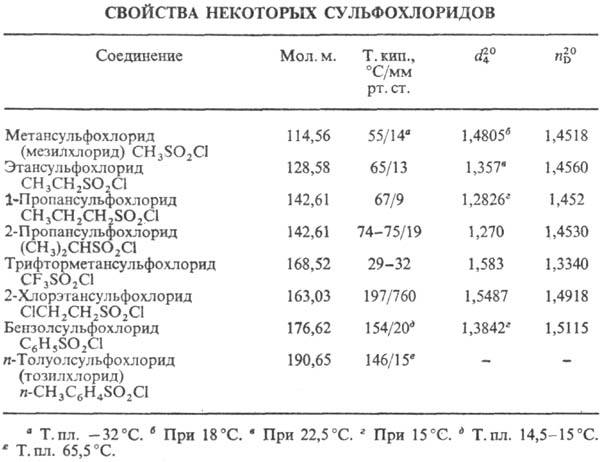
С ульфохлориды называют, добавляя к назв. соединения-основы окончание "сульфохлорид", напр. бензолсульфохлорид.
Атом S в сульфохлоридах имеет тетраэдрич. конфигурацию; связи S—О почти двойные, напр. длины связей для C 6 H 5 SO 2 Cl 0,1417 нм (S—О), 0,176 нм (С—S), 0,2047 нм (S—Cl), углы CSCl 100,4°, CSO 110°, OSO 122,5°. Группа SO 2 Cl обладает отрицательными индукционным и мезомерным эффектами.
В ИК спектрах сульфохлоридов присутствуют две характеристич. полосы в области 1375-1340 и 1190-1160 см -1 , соответствующие асимметрическим и симметрическим валентным колебаниям группы SO 2 .
При нагревании выше температуры кипения сульфохлориды, особенно ароматические, разлагаются с выделением SO 2 ; в воде и в к-тах довольно устойчивы, в присут. оснований легко гидролизуются до сульфокислот. Р-ция сульфохлоридов с нуклеоф. реагентами приводит к продуктам замещения атома С1, в присут. третичных аминов промежуточно генерируются сульфены, напр.:
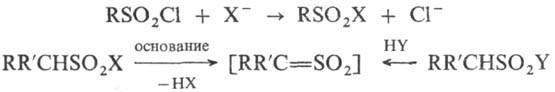
R, R' = Н, Alk, Ar, Ac и др. X и Y = ОН, OR, SR, Hal, NH 2 , NR 2 , N 3 и др.
При присоединении сульфохлоридов к ацетиленам в присут. солей Си образуются ненасыщенные b -хлорсульфоны; при восстановлении металлами в нейтральной среде-соли суль-финовых к-т; в кислой среде или под действием LiAlH 4 -тиолы; с ароматич. соединениями в условиях реакции Фриделя-Крафтса-сульфоны либо, если при отрыве SO 2 образуется стабильный карбкатион, продукты алкилиро-вания, напр.:
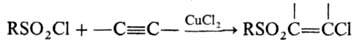
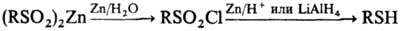
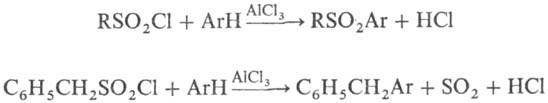
В промышленности сульфохлориды получают взаимод. алифатич. углеводородов с SO 2 Cl 2 или смесью SO 2 и Сl 2 в газовой или жидкой фазе под действием света либо в присутствии инициаторов радикальных р-ций; ароматические сульфохлориды-обработкой соответствующих углеводородов хлорсульфоно-вой кислотой.
С ульфохлориды могут быть получены окислит. хлорированием тйолов, сульфидов, дисульфидов, ксантогенатов и др.; окислением сульфенилхлоридов; взаимод. сульфокислот и их производных (солей, эфиров, амидов, гидразидов) с РСl 5 , СОСl 2 , SOCl 2 , Cl 2 , ClSO 2 OH. Сульфохлориды образуются также при р-ции магнийорг. соединений с SO 2 Cl 2 или диазониевых солей с SO 2 и CuCl 2 .
Применяют сульфохлориды в произ-ве моющих ср-в, ионообменных смол, эластомеров, лек. ср-в, красителей, инсектицидов и гербицидов; в качестве полупродуктов в синтезе эфиров сульфокислот; как мягкие алкилирующие агенты в орг. синтезе.
С ульфохлориды раздражают слизистые оболочки глаз и верхних дыхательных путей, при попадании на кожу или при нахождении в атмосфере, содержащей пары или аэрозоли, сульфохлориды вызывают дерматиты. Лакриматоры (особенно ненасыщенные сульфохлориды). Вдыхание паров может привести к отеку легких. С увеличением мол. массы раздражающее действие сульфохлоридов ослабевает,
Лит.: Джильберт Э. Е., Сульфирование органических соединений, пер. с англ., М., 1969; Общая органическая химия, пер. с англ., т. 5, М., 1983. с. 519-22; Houben-Weyl, Methoden der organischen Chemie, Bd 9, Stuttg., 1955; "Methodicum Chimicura", v. 7, pt B, Stuttg., 1977. Я. И. Крылов.
СУЛЬФОХЛОРИ́ДЫ, хлорангидриды сульфокислот ; общая формула RSO2 Cl, где R – алкил, арил и др.; простейшие представители – метансульфохлорид CH3 SO 2 Cl, бензолсульфохлорид C6 H 5 SO 2 Cl. Жидкие или твёрдые вещества, некоторые с резким запахом; растворимы в эфире, ацетоне, СНСl3, ССl4, спирте, бензоле; при нагревании выше t кип разлагаются с выделением SO2 ; устойчивы в воде и в кислотах; со щелочами образуют сульфокислоты, с нуклеофилами – продукты замещения атома Сl, с NH3 и аминами – сульфамиды, с аренами – сульфоны ( Фриделя – Крафтса реакция ), при восстановлении – тиолы. Получают в осн. взаимодействием алифатич. углеводородов с SO2 Cl 2 и аренов с хлорсульфоновой кислотой. Используют в произ-ве моющих средств, ионообменных мембран и смол, пестицидов, эластомеров, лекарств, красителей и др. Лакриматоры, при попадании на кожу вызывают дерматиты.
Читайте также:

