Получение применение муравьиного и уксусного альдегидов кратко
Обновлено: 30.06.2024
Номером (1) нумеруется всегда атом углерода карбонильной группы.
СН3-СН -СН2-С 3-метилбутаналь
В молекулах альдегидов между углеродом и кислородом образуется двойная связь. Одна сигма и одна пи-связь.
1. гидрирование – восстановление альдегидов до спиртов.
II. Окисление альдегидов до карбоновых кислот.
Н –СОН +Ag2O → Н –СОOН+2Ag
2. окисление гидроксидом меди (II).
в ходе реакции меняется цвет от голубого (2Cu(OH)2) до жёлтого (2CuOH) и до красного (Cu2O).
Метаналь – бесцветный газ с резким запахом. Раствор метаналя в воде (40%) называется формалином. Остальные представители изучаемого списка жидкости, высшие альдегиды – твёрдые вещества.
- Общий способ получения альдегидов – это окисление спиртов.
ацетальдегид или уксусный альдегид
- Каталитическое окисление предельных углеводородов.
- Этаналь можно получать гидратацией ацетилена (реакция Кучерова).
НС≡СН+НОН → СН3―С ацетальдегид (уксусный альдегид)
- В последнее время разработан способ получение этаналя каталитическим окислением этилена.
Формальдегид применяется как дезинфицирующее средство, в кожевенном производстве, при синтезе лекарственных веществ, получение пластмасс.
Уксусный альдегид используется для получения уксусной кислоты.
Предельные одноосновные карбоновые кислоты, их строение и свойства на примере уксусной кислоты.
- Определение.
- Общая формула, гомологический ряд.
- Изомерия, номенклатура.
- Строение.
- Химические свойства.
- Физические свойства.
- Нахождение в природе.
- Получение.
- Применение.
Карбоновые кислоты – это органические вещества, молекулы которых содержат одну или несколько карбоксильных групп, соединённых с углеводородным радикалом или атомом водорода.
Предельные одноосновные карбоновые кислоты – это органические вещества, в молекулах которых одна карбоксильная группа связана с предельным углеводородным радикалом или атомом водорода.
О
R-С или СnH2n+1COОH
ОН
Н -С метановая или муравьиная кислота (Н –СООН)
СН3 -С этановая или уксусная кислота (СН3-СООН)
СН3-СН2-С пропановая или пропионовая кислота (С2Н5СООН) и т.д.
Изомерия и номенклатура
Номером (1) нумеруется всегда атом углерода карбоксильной группы.
СН3-СН -СН2-С 3-метилбутановая кислота.
В молекулах предельных одноосновных карбоновых кислот различают четыре реакционных центра, вследствие образования ковалентных сильно полярных связей.

1. Атом водорода в карбоксильной группе более подвижен, чем у альдегидов, т.к. кислород сильно смещает на себя общую электронную пару.
О-Н
2. ОН группа в составе карбоксильной группы, также обладает подвижностью.
ОН
3. Наличие слабой Пи-связи между атомами углерода и кислорода карбоксильной группы.
4. Атомы водорода в радикале так же обладают определённой степенью подвижности т.к., атомы кислорода карбоксильной группы вызывают общее смещение электронных пар в свою сторону.
I. Реакции идущие с участием первой реакционной зоны (свойства аналогичные свойствам неорганических кислот).
1. Реагируют с активными металлами.
2. Реагируют с основными и амфотерными оксидами.
3. Взаимодействуют с основными и амфотерными гидроксидами.
4. Взаимодействуют с солями более слабых и летучих кислот.
5. Образуют кислотные оксиды или ангидриды.
О ангидрид уксусной кислоты.
6. Взаимодействуют со спиртами с образованием сложных эфиров.
СН3-СООН + НО-СН3→СН3-СОО-СН3+НОН
метил эфир этановой (уксусной) кислоты
II. Реакции по углеводородному радикалу.
III. Муравьиная кислота из-за особенности своего строения обладает некоторыми свойствами альдегидов.
О O
Н -С +Ag2O → HO-C + 2Ag
ОН ОН
угольная кислота (Н2СО3)
Низшие карбоновые кислоты – это жидкости с острым запахом, хорошо растворимые в воде. Высшие кислоты, начиная с нонановой – твёрдые вещества.
Нахождение в природе
Муравьиная кислота содержится в муравьях, крапиве, хвое ели. Масляная или бутановая входит в состав прогорклого масла, пентановая или валериановая кислота содержится в корнях валерианы.
- Каталитическое окисление предельных углеводородов.
2Н –СОН +O2 → 2Н –СОOН
Муравьиная кислота используется как восстановитель при синтезе органических веществ, раствор муравьиной кислоты в спирте применяют в медицине, сложные эфира муравьиной кислоты используют в качестве растворителей и душистых веществ.
Уксусная кислота используется для синтеза красителей, медикаментов, сложных эфиров, ацетатного волокна, негорючей киноплёнки, органического стекла, широко применяют соли уксусной кислоты.
- Определение.
- Общая формула, гомологический ряд.
- Изомерия, номенклатура.
- Строение.
- Химические свойства.
- Физические свойства.
- Получение.
- Применение.
Альдегиды – это органические вещества, содержащие карбонильную (альдегидную) функциональную группу
Н -С метаналь, муравьиный или формальдегид (Н –СОН)
СН3 -С этаналь, уксусный или ацетальдегид(СН3-СОН)
Изомерия и номенклатура
Номером (1) нумеруется всегда атом углерода карбонильной группы.
СН3-СН -СН2-С 3-метилбутаналь
В молекулах альдегидов между углеродом и кислородом образуется двойная связь. Одна сигма и одна пи-связь.
1. гидрирование – восстановление альдегидов до спиртов.
II. Окисление альдегидов до карбоновых кислот.
Н –СОН +Ag2O → Н –СОOН+2Ag
2. окисление гидроксидом меди (II).
в ходе реакции меняется цвет от голубого (2Cu(OH)2) до жёлтого (2CuOH) и до красного (Cu2O).
Метаналь – бесцветный газ с резким запахом. Раствор метаналя в воде (40%) называется формалином. Остальные представители изучаемого списка жидкости, высшие альдегиды – твёрдые вещества.
- Общий способ получения альдегидов – это окисление спиртов.
ацетальдегид или уксусный альдегид
- Каталитическое окисление предельных углеводородов.
- Этаналь можно получать гидратацией ацетилена (реакция Кучерова).
НС≡СН+НОН → СН3―С ацетальдегид (уксусный альдегид)
- В последнее время разработан способ получение этаналя каталитическим окислением этилена.
Формальдегид применяется как дезинфицирующее средство, в кожевенном производстве, при синтезе лекарственных веществ, получение пластмасс.
Уксусный альдегид используется для получения уксусной кислоты.
Предельные одноосновные карбоновые кислоты, их строение и свойства на примере уксусной кислоты.
- Определение.
- Общая формула, гомологический ряд.
- Изомерия, номенклатура.
- Строение.
- Химические свойства.
- Физические свойства.
- Нахождение в природе.
- Получение.
- Применение.
Карбоновые кислоты – это органические вещества, молекулы которых содержат одну или несколько карбоксильных групп, соединённых с углеводородным радикалом или атомом водорода.
Предельные одноосновные карбоновые кислоты – это органические вещества, в молекулах которых одна карбоксильная группа связана с предельным углеводородным радикалом или атомом водорода.
О
R-С или СnH2n+1COОH
ОН
Н -С метановая или муравьиная кислота (Н –СООН)
СН3 -С этановая или уксусная кислота (СН3-СООН)
СН3-СН2-С пропановая или пропионовая кислота (С2Н5СООН) и т.д.
Изомерия и номенклатура
Номером (1) нумеруется всегда атом углерода карбоксильной группы.
СН3-СН -СН2-С 3-метилбутановая кислота.
В молекулах предельных одноосновных карбоновых кислот различают четыре реакционных центра, вследствие образования ковалентных сильно полярных связей.
1. Атом водорода в карбоксильной группе более подвижен, чем у альдегидов, т.к. кислород сильно смещает на себя общую электронную пару.
О-Н
2. ОН группа в составе карбоксильной группы, также обладает подвижностью.
ОН
3. Наличие слабой Пи-связи между атомами углерода и кислорода карбоксильной группы.
4. Атомы водорода в радикале так же обладают определённой степенью подвижности т.к., атомы кислорода карбоксильной группы вызывают общее смещение электронных пар в свою сторону.
I. Реакции идущие с участием первой реакционной зоны (свойства аналогичные свойствам неорганических кислот).
Альдегиды – это органические соединения, в состав молекулы которых входит карбонильная группа, соединённая с водородом и углеводородным радикалом.

Этаналь
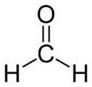
Метаналь (муравьиный альдегид)
Физические свойства
Метаналь – газообразное вещество, водный раствор – формалинь
Химические свойства
 |
Реактивом на альдегиды является Cu(OH)2
Применение
Наибольшее применение имеют метаналь и этаналь. Большое количество метаналя используется для получения фенолформальдегидной смолы, которую получают при взаимодействии метаналя с фенолом. Эта смола необходима для производства различных пластмасс. Пластмассы изготовлены для из фенолформальдегидной смолы в сочетании с различными наполнителями, называются фенопластами. При растворении фенолформальдегидной смолы в ацетоне или спирту получают различные лаки. При взаимодействии метаналя с карбамидом CO(NH2)2 получают карбидную смолу, а из нее – аминопласты. Из этих пластмасс изготавливают микропористые материалы для нужд электротехники.Метаналь идёт так же на производство некоторых лекарственных веществ и красителей. Широко применяется водный раствор, содержащий в массовых долях 40% метаналя. Он называетсяформалином. Его использование основано на свойстве свёртывать белок.
Получение
Альдегиды получают окислением алканов и спиртов. Этаналь получают гидротациейэтина и окислением этена.
Электрохимический ряд напряжений металлов
Li, K, Ca, Na, Mg, Al, Zn, Cr, Fe, Pb, H2, Cu, Ag, Hg, Au
Чем левее стоит металл в ряду стандартных электродных потенциалов, тем более сильным восстановителем он является, самый сильный восстановитель – металлический литий, золото – самый слабый, и, наоборот, ион золото (III) – самый сильный окислитель, литий (I) – самый слабый.
Каждый металл способен восстанавливать из солей в растворе те металлы, которые стоят в ряду напряжений после него, например, железо может вытеснять медь из растворов ее солей. Однако следует помнить, что металлы щелочных и щелочно-земельных металлов будут взаимодействовать непосредственно с водой.
Металлы, стоящее в ряду напряжений левее водорода, способны вытеснять его из растворов разбавленных кислот, при этом растворяться в них.
Восстановительная активность металла не всегда соответствует его положению в периодической системе, потому что при определении места металла в ряду учитывается не только его способность отдавать электроны, но и энергия, которая затрачивается на разрушение кристаллической решетки металла, а также энергия, затрачиваемая на гидратацию ионов.
© 2014-2022 — Студопедия.Нет — Информационный студенческий ресурс. Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав (0.002)
§ 30. Химические свойства, получение и применение альдегидов
Химические свойства альдегидов
Химические свойства альдегидов прежде всего обусловлены наличием в их молекулах альдегидной группы. По месту двойной связи альдегидной группы могут протекать реакции присоединения.
1. Гидрирование. Присоединение водорода
Молекула альдегида может присоединить по двойной связи молекулу водорода. Такая реакция сопровождаются разрывом π-связи в молекуле альдегида, так как она менее прочная, чем σ-связь:
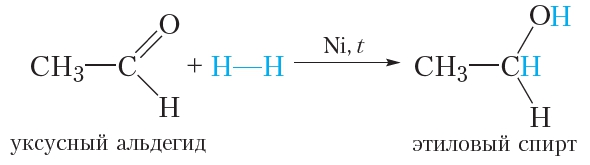
Условия протекания данной реакции схожи с реакцией гидрирования алкенов: смесь водорода с парами альдегида пропускают над нагретым никелевым катализатором.
Продуктом присоединения водорода к альдегиду является первичный спирт.
В результате присоединения водорода молекула альдегида восстанавливается, поэтому реакцию с водородом также называют реакцией восстановления альдегидов.
2. Окисление
Альдегидная группа легко окисляется. В качестве окислителей могут выступать ионы металлов, расположенных в ряду активности правее водорода — ионы серебра (Ag + ) и меди (Cu 2+ ).
Окисление альдегидов аммиачным раствором оксида серебра
Если к разбавленному раствору нитрата серебра приливать раствор аммиака, то выпадает белый осадок оксида серебра:
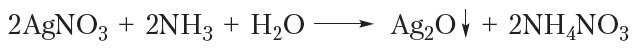
В протекающей реакции уксусный альдегид окисляется до уксусной кислоты, а оксид серебра восстанавливается с образованием металлического серебра:
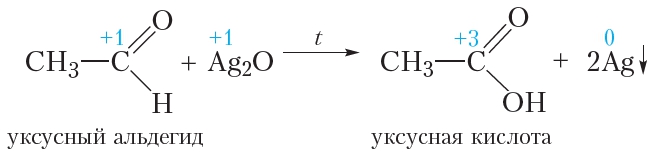
Окисление альдегидов гидроксидом меди(II)
В качестве окислителя альдегидов до соответствующих кислот может быть использован также гидроксид меди(II). Для проведения такой реакции в пробирку помещают раствор сульфата меди(II), затем прибавляют раствор щёлочи. При этом выпадает голубой осадок гидроксида меди(II):
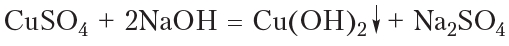
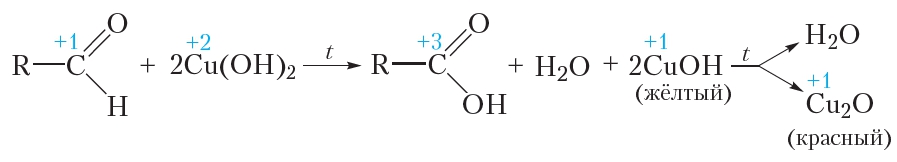
Затем в пробирку с осадком добавляют водный раствор альдегида и смесь нагревают. В процессе нагревания изначально голубой осадок становится жёлтым, а при дальнейшем нагревании — красным. Уравнение протекающей реакции:
Как видно из приведённого уравнения реакции, в результате восстановления гидроксида меди(II) образуется жёлтый осадок гидроксида меди(I), который при нагревании разлагается с образованием красного оксида меди(I).
Способность альдегидов окисляться до карбоновых кислот и восстанавливаться до спиртов особенно наглядно демонстрирует взаимосвязь между классами органических соединений, благодаря которой вещества одного класса могут быть получены из представителей других классов.
Муравьиный альдегид, или формальдегид, – это бесцветный газ, обладающий резким, неприятным, специфическим запахом. Он хорошо растворяется в воде, а также в спиртах. Формальдегид очень токсичен и способен вызвать в организме человека патологические изменения. Кроме того, его считают канцерогеном.
Формальдегид – первый член целого гомологического ряда, в который входит алифатический муравьиный альдегид. Муравьиная кислота также проявляет свойства этой группы.
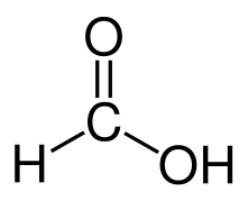
Химические свойства
Формальдегид способен вступать во все реакции, которые свойственны гомологическому ряду алифатических альдегидов. В том числе и с нуклеофилами. Также он связывается с восстановительными реагентами. Это происходит главным образом по причине того, что у формальдегида низкая электронная плотность на атомах углерода. Благодаря этой особенности строения он очень легко вступает в химические реакции даже с самыми слабыми нуклеофилами. Этим объясняет тот факт, что в водных растворах муравьиный альдегид обнаруживается в гидратированном состоянии.
Производственное получение

У этого вещества довольно простая формула. Муравьиный альдегид на химическом языке выглядит так: HCHO. Основной промышленный метод его получения - это окисление метанола. Эта реакция осуществляется с применением серебряного катализатора. Необходимая температура - 650 градусов. Окисление метанола происходит при атмосферном давлении.
Этот технологический процесс уже достаточно длительное время используется повсеместно. Он хорошо освоен. Примерно 80% формальдегида получают благодаря окислительной реакции метанола. Однако это не единственный способ. Недавно был разработан еще более перспективный метод. Он основывается на применении железо-молибденовых катализаторов. В этом случае снижается уровень необходимой температуры до 300 градусов, а это практически вдвое меньше.
Также известен еще один промышленный способ – окисление метана. У реакции этой довольно простая формула: муравьиный альдегид получается при давлении 1-2 МПа при температуре 450 градусов. В качестве катализатора берется фосфат алюминия.

Применение
В настоящее время получение муравьиного альдегида выгодно деревообрабатывающей и, конечно, мебельной промышленности. Его используют для производства меламинокарбамидоформальдегидных смол. Они применяются при изготовлении ДСП, фанеры и прочих строительных материалов.
При хранении муравьиного альдегида следует учитывать, что при температуре ниже 10 градусов раствор мутнеет и появляется белый осадок. Также формальдегид взаимодействует с кислородом. В результате образуются по причине вырожденного разветвления дополнительные инициаторы цепи.
Токсические свойства
Итак, формальдегид получают методом окисления метанола и метана. Несомненно, он обладает достаточно высокой степенью токсичности. Муравьиный альдегид в первую очередь воздействует на генетический материал. От этого вещества страдают и репродуктивные органы. Но, конечно, чаще отмечается поражение дыхательных путей, кожных покровов и слизистой глаз.

Опасен формальдегид еще и тем, что он оказывает негативное действие на ЦНС.
Муравьиный альдегид не просто токсичен - 60-90 мл вещества (в зависимости от массы тела), попавшие внутрь, вызовут смерть. Симптомы отравления следующие:
- общий упадок сил; покровов;
- бессознательное состояние;
- угнетение ЦНС;
- затрудненное дыхание;
- сильная головная боль;
- судороги, особенно в ночное время.
Воздействие муравьиного альдегида на организм человека

Применение муравьиного альдегида в производстве нередко вызывает разные степени отравления у работников предприятия. При сильном ингаляционном поражении, то есть при вдыхании вещества, наблюдаются конъюнктивит и острая форма бронхита, которая иногда приводит к отеку легкого. Симптоматика при длительном воздействии формальдегида будет только нарастать. Спустя непродолжительное время появятся признаки поражения и угнетения ЦНС. Это будет выражаться в постоянном головокружении, возникнет чувство страха, походка станет шаткой, а в ночное время у человека могут быть даже судороги.
Если отравление произошло через рот, то первым симптомом будет ожог слизистой оболочки пищеварительного тракта. Он будет проявляться в виде боли, жжения в горле и по ходу пищевода. Человек ощущает сильные рвотные позывы, масса, отторгаемая желудком, будет содержать кровь. В тяжелых случаях развивается отек гортани и наблюдается рефлекторная остановка дыхания.
При хроническом отравлении малыми концентрациями у человека отмечаются сильная потеря веса, психическое возбуждение, расстройство зрения, бессонница и постоянные головные боли.
Отравление парами формальдегида
Муравьиный альдегид чаще всего обнаруживается в воздухе. У работников предприятий, занятых в работе, связанной с изготовлением искусственных смол, при наличии постоянного и длительного контакта с парами формальдегида возможно отравление. Нередко уже в первые рабочие дни у человека появляются заметные дерматиты на лице, руках. Присутствие формальдегида в организме видно по ухудшению состояния ногтей - они размягчаются и становятся ломкими.
Экземы и дерматиты могут носить аллергический характер. После того как человек перенес отравление, у него формируется к муравьиному альдегиду сильная чувствительность. Имеются сведения о том, что формальдегид неблагоприятно влияет на функционирование репродуктивной системы женского организма.
Использование формальдегида в косметических средствах

Содержание формальдегида допускается в качестве консерванта в косметических средствах, но его концентрация не должна превышать 0,1%. Муравьиный альдегид может присутствовать в зубной пасте, кремах для тела, лица и рук.
Также в фармакологии, в некоторых средствах, препятствующих обильному потоотделению, может находится формальдегид. Его допустимая концентрация - 0,5%. Это вещество - хороший антисептик, даже в столь малых количествах он способен уничтожать микроорганизмы. Строго запрещается наносить на лицо любую мазь, если в ее составе находится 5% формальдегида. Это чревато появлением дерматитов и аллергических реакций. Также муравьиный альдегид не используют для консервации косметических средств, если они будут продаваться в качестве аэрозолей и спреев.
Вся продукция на своей этикетке должна содержать информацию относительно содержания этого опасного вещества, даже если его количество 0,05%. В действительности до сегодняшнего дня не выяснено, как влияет раствор формальдегида на кожу, но известно, что у животных она краснеет и шелушится.
Канцерогенность муравьиного альдегида
Известно, что формальдегид взаимодействует с селеном при участии высококонцентрированной серной кислоты. В результате образуется сульфоэфир-4-тетрадецилидиоксан. Это вещество со сложным названием после обработки гидратом окиси бария становится прекрасным моющим средством. Казалось бы, в чем опасность? Но формальдегид внесен в список веществ, обладающих канцерогенными качествами. Хотя степень его опасности пока не установлена, нельзя не принимать во внимание тот факт, что муравьиный альдегид смертельно опасен для животных. По официальным данным многих научных центров мира, связь между применением формальдегида при производстве красок, смол, текстиля, пластика и возникновением онкологических новообразований у человека доказана. Особенно высок риск развития рака носоглотки.

Определение. Гомологический ряд, номенклатура, изомерия
Альдегиды — это производные углеводородов, которые содержат альдегидную группу:

Альдегидная группа состоит из карбонильной группы С=О, соединённой с атомом водорода. Карбонильная группа в молекулах альдегидов всегда находится на конце углеродной цепи.
Предельные альдегиды образуют гомологический ряд с общей формулой:

Если использовать эту общую формулу, то следует помнить, что минимальное значение n (числа атомов углерода) равно нулю.
Если n = 0 получаем

метанАЛЬ, муравьиный альдегид, формальдегид;
Если n = 1 получаем

этанАЛЬ, уксусный альдегид, ацетальдегид.
Вопрос. Какой суффикс обозначает наличие в молекуле альдегидной группы?
Задание 23.1. Составьте формулу и название альдегида с n = 3. Имеет ли он изомеры?
Начиная с n = 3 у альдегидов появляются изомеры положения карбонильной группы:

Задание 23.2. Допишите атомы водорода к этим цепочкам и убедитесь, что это — изомеры. Является ли вещество (2) альдегидом?
Но при перемещении карбонильной группы в середину молекулы исчезает альдегидная группа: вещество (2) не альдегид, это — кетон:

По номенклатуре ИЮПАК кетоны называют, добавляя суффикс ОН к названию соответствующего углеводорода.
Задание 23.3. Составьте формулы и названия альдегидов с n = 4. Дайте им названия.
Изомерия альдегидов связана со строением углеводородного радикала:


Строение молекул
Отличительным признаком альдегидов является наличие в их молекуле альдегидной группы. В её состав входят атомы углерода и кислорода, связанные двойной связью.
Вопрос. Какой тип реакций характерен для соединений с двойной связью?
Поэтому альдегиды легко вступают в реакции присоединения по месту разрыва π-связи карбонильной группы.
Кроме того, в состав альдегидной группы входит атом водорода, соединённый с карбонильной группой.
Вопрос. Является ли эта связь полярной?
За счёт разрыва полярной С–Н связи альдегидной группы альдегиды очень легко окисляются. Атом кислорода альдегидной группы делает эту группу в целом сильно полярной. Поэтому альдегидная группа влияет на углеводородный радикал, и в радикале возможны реакции замещения.

Свойства альдегидов
Физические свойства
В альдегидах отсутствует гидроксогруппа, за счёт которой между молекулами спиртов возникали водородные связи.
Вопрос. Какие соединения (спирты или альдегиды) имеют бОльшую температуру кипения?
Поэтому альдегиды, в отличие от спиртов, легче испаряются, имеют меньшие температуры кипения. Например, формальдегид — газ с резким запахом, а метанол — жидкость. Низшие альдегиды могут растворяться в воде. Раствор формальдегида в воде (формалин) применяется в медицине, кожевенной промышленности. Его применение основано на том, что формальдегид активно реагирует с белками, вызывая в них необратимые изменения (денатурацию). Следовательно, формальдегид сильно ядовит.
Химические свойства
При рассмотрении строения молекулы альдегидов были сделаны выводы, что для них должны быть характерны реакции присоединения, замещения (в углеводородном радикале), и окисления.
Примером реакции присоединения к карбонильной группе может служить реакция гидрирования, т. е. присоединения водорода:

Вопрос. К какому классу относится полученное соединение? Назовите его.
При окислении альдегидов образуются кислоты:

Окисление альдегидов происходит даже при их хранении, т. е. в обычных условиях. Реакции окисления альдегидов используют для того, чтобы обнаружить их в растворах. Например, если к раствору альдегида добавить аммиачный раствор оксида серебра и нагреть, то на стенках сосуда появится зеркало. Это выделилось чистое серебро, которое блестящим тонким слоем покрыло стекло:

Альдегид можно превратить в кислоту (окислить) и при помощи гидроксида меди (II). Если к осадку Сu(ОН)2 добавить раствор альдегида и нагреть, то образуется жёлтый осадок СuОН, переходящий в красный оксид меди (I). В результате образуется оранжевый осадок:

Задание 23.4. Составьте уравнения качественных реакций для формальдегида.
Вопрос. Можно ли при помощи гидроксида меди (II) различить растворы глицерина и уксусного альдегида? Укажите условия и эффекты обеих реакций.

Получение и применение альдегидов на примере уксусного альдегида
Уксусный альдегид получают в больших количествах при помощи реакции Кучерова*:

* Кучеров Михаил Григорьевич (3.06.1850–26.06.1911) — русский химик-органик, открыл (1881) реакцию каталитической гидратации ацетиленовых углеводородов с образованием карбонилсодержащих соединений.
В небольших количествах этот альдегид можно получить окислением этанола:

Задание 23.5. В уроках 20.3 и 22.4 посмотрите на соответствующие уравнения реакций; обратите внимание, за счёт каких атомов они происходят, и попробуйте составить аналогичные уравнения реакций:
- пропин + вода →
- пропанол-1 + СuО →
- пропанол-2 + СuО →
Сделайте вывод: всегда ли в этих реакциях получаются альдегиды?
Если Вы всё сделали правильно, в реакциях 1 и 3 получается ацетон (кетон), а в реакции 2 — пропаналь.
Уксусный альдегид применяют для получения уксусной кислоты, этилового спирта, лекарств и других веществ.

Выводы
Альдегиды — это производные углеводородов, содержащие альдегидную группу. Для них должны быть характерны реакции
Читайте также:

