Получение инсулина в биотехнологии кратко
Обновлено: 05.07.2024
Инсулин — гормон поджелудочной железы, регулирующий углеводный обмен и поддерживающий нормальный уровень сахара в крови. Недостаток этого гормона в организме приводит к одному из тяжелейших заболеваний — сахарному диабету, который как причина смерти стоит на третьем месте после сердечно-сосудистых заболеваний и рака. Инсулин — небольшой глобулярный белок, содержащий 51 аминокислотный остаток и состоящий из двух полипептидных цепей, связанных между собой двумя дисульфидными мостиками. Синтезируется он в виде одноцепочечного предшественника — препроинсулина, содержащего концевой сигнальный пептид (23 аминокислотных остатка) и 35-звенный соединительный пептид (С-пептид). При удалении сигнального пептида в клетке образуется проинсулин из 86 аминокислотных остатков, в котором А и В-цепи инсулина соединены С-пептидом, обеспечивающим им необходимую ориентацию при замыкании дисульфидных связей. После протеолитического отщепления С-пептида образуется инсулин.
Известно несколько форм сахарного диабета. Самая тяжелая форма, для лечения которой больному необходим инсулин (инсулин зависимая форма заболевания), вызвана избирательной гибелью клеток, синтезирующих этот гормон (клетки островков Лангерганса в поджелудочной железе). Форма сахарного диабета, для лечения которой инсулин не требуется, распространена чаще, с ней удается справляться с помощью соответствующих диет и режима. Обычно поджелудочная железа крупного рогатого скота и свиней не используется в мясной и консервной промышленности и поставляется в вагонах-рефрижераторах на фармацевтические предприятия, где проводят экстракцию гормона. Для получения 100 г кристаллического инсулина необходимо 800— 1000 кг исходного сырья.

В 1981 г. синтезирован ген-аналог проинсулина — мини-С- проинсулин, в котором 35-звенный С-пептид был заменен на сегмент из шести аминокислот: арг-арг-гли-сер-лиз-арг и показана его экспрессия в Е. coli.
В 1980 г. У.Гилберт с сотрудниками выделили мРНК инсулина из опухоли бета-клеток поджелудочной железы крысы и с помощью обратной транскриптазы получили с нее кДНК Полученную кДНК встроили в плазмиду pBR322 Е. coli, в среднюю часть гена пенициллиназы. Рекомбинантная плазмида содержала информацию о структуре проинсулина. В результате трансляции мРНК в клетках синтезировался гибридный белок, содержащий последовательности пенициллиназы и проинсулина, который выщепляли из такого белка трипсином.

Полученный синтетический ген был встроен вместе с фрагментом природной ДНК, содержащим промотор и проксимальную часть гена белка бета-галактозидазы кишечной палочки Е. coli, в плазмиду-вектор pBR322 и обработан смесью рестриктаз — EcoRI и BamHI. Полученная рекомбинантная плазмида рЕк была трансформирована в клетки Е. coli. В результате экспрессии встроенного ген бактерия начала продуцировать гибридный (химерный) белок, cодержащий на N-конце участок бета-галактозидазы, а на С-конце последовательность нейропептида. С помощью бромциана химерный белок расщепляли in vitro и получали активный лейцин-энкефалин. На рис. 5.12 представлены схема клонирования синтетиче| кого гена лейцин-энкефалина и его экспрессия в клетках кишечной палочки.

СИНТЕЗ СОМАТОСТАТИНА

Основные этапы генно-инженерного синтеза соматостатина показаны на рис. 5.14. Синтетический ген соматостатина был встроен в плазмиду pBR322 Е. coli вблизи конца гена, кодирующего фермент бета-галактозидазу. Между двумя генами был помещен кодон метионина. После выделения рекомбинантной плазмиды в бактериальную клетку кишечная палочка стала синтезировать гибридный белок. Часть его (соматостатин) затем отщепляли от бета-галактозидазы BrCN. Такой сложный способ получения гормона был необходим, так как соматостатин, синтезированный в виде свободных молекул, быстро деградирует под действием бактериальных протеаз. Первый синтез соматостатина генно-инженерным способом был осуществлен в 1977 г. Бойером. Выход гормона составил 10000 молекул на одну клетку. Из 100 г биомассы Е.coli, выращенной в ферментере объемом 8 л, удалось выделить 5 мг соматостатина, т.е. столько, сколько можно его выделить из 100 г овечьих мозгов.

5.8. СИНТЕЗ СОМАТОТРОПИНА
Соматотропин (или гормон роста человека ГРЧ) секретируется передней долей гипофиза. Впервые он был выделен и очищен в 1963 г. из гипофиза. Его недостаток приводит к заболеванию — гипофизарной карликовости (1 случай на 5000 человек). Гормон обладает видовой специфичностью. Обычно его получают из гипофиза трупов, но в недостаточном количестве. Гормона хватает лишь для лечения 1/3 случаев гипофизарной карликовости в развитых странах. Основные производители — Швеция, Италия, Швейцария и США. Молекула ГРЧ состоит из 191 аминокислотного остатка.
Препарат из трупного материала представляет собой смесь из нескольких форм, из которых пять имеют 22 кДа, другие являются димерами, а остальные — фрагментами, образующимися при протеолизе. Это приводило к тому, что у 30 % больных, получавших препарат, против гормона вырабатывались антитела, сводившие на нет его биологическую активность.
ГРЧ в клетках Е. coli и в культуре клеток животных был получен в 1982 г. одновременно в Институте Пастера (Париж) и в Институте молекулярной биологии (Москва). Оказалось, что в бактериальных клетках возможен синтез аналогов ГРЧ, с помощью которых изучались участки молекулы, важные для стимулирования роста и процесса неоглюкогенеза на молекулярном уровне.
Огромный интерес представляют выделение и синтез полипептида, обладающего полной биологической активностью гипоталамического рилизинг-фактора соматотропина (СТГ-РФ). Введение этого фактора способно компенсировать недостаток соматотропина. Таким образом, наличие СТГ-РФ и самого гормона, полученных в генетически сконструированных бактериальных клетках, очень важно для успешного лечения заболеваний, обусловленных недостатком этого гормона, и ряда патологических заболеваний, таких, как некоторые формы диабета, регенерация тканей после ожогов и др. Предполагаем, что СТГ-РФ можно использовать и для увеличения массы и роста домашних животных, так как он, не обладая видовой специфичностью, способен стимулировать освобождение гормона роста у ряда животных.
бета-Эндорфин — опиат мозга, состоящий из 31 аминокислотного остатка, был синтезирован в генетически сконструированных клетках в 1980 г. группой ученых из Австралии и США. Бета-эндорфин получен в клетках Е. coli в виде гибридного белка с бета-галактозидазой. Процедура синтеза бета-эндорфина включала: получение путем обратной транскрипции мРНК — кДНК, кодирующей белок- предшественник, содержащий помимо последовательности бета-эндорфина последовательность АКТГ и бета-липотропина (Р-ЛТГ), в дальнейшем удаляемые. Бета-эндорфин, полученный из гибридного белка и тщательно очищенный, обладал значительной биологической активностью. Он специфически взаимодействовал с антисывороткой против бета-эндорфина. От бета-эндорфина человека генно-инженерный бета-эндорфин отличался по двум аминокислотам, и эти отличия можно было легко устранить на нуклеотидном уровне путем замены двух кодонов в ДНК бактериальной плазмиды.
Инсулин - гормон поджелудочной железы, регулирующий углеводный обмен и поддерживающий нормальный уровень сахара в крови. Недостаток этого гормона в организме приводит к одному из тяжелейших заболеваний - сахарному диабету, который как причина смерти стоит на третьем месте после сердечнососудистых заболеваний и рака. Инсулин - небольшой глобулярный белок, содержащий 51 аминокислотный остаток и состоящий из двух полипептидных цепей, связанных между собой двумя дисульфидными мостиками. Синтезируется он в виде одноцепочечного предшественника - препроинсулина, содержащего концевой сигнальный пептид (23 аминокислотных остатка) и 35-звенный соединительный пептид (С-пептид). При удалении сигнального пептида в клетке образуется проинсулин из 86 аминокислотных остатков, в котором А и В-цепи инсулина соединены С-пептидом, обеспечивающим им необходимую пространственную ориентацию при замыкании дисульфидных связей. После протеолитического отщепления С-пептида образуется инсулин.
Со времени открытия инсулина в 1921 году Бантингом и Бестом, которые выделили гормон из поджелудочной железы новорожденного теленка и показали снижение уровня глюкозы в сыворотке крови экспериментального животного после введения препарата, прошло больше 80 лет. За это время была создана индустрия производства инсулина.
Обычно поджелудочная железа крупного рогатого скота и свиней не используется в мясной и консервной промышленности и поставляется в вагонах-рефрижераторах на фармацевтические предприятия, где проводят экстракцию гормона. Для получения 100 г кристаллического инсулина необходимо 800 -1000 кг исходного сырья. Однако такой инсулин отличается по строению (аминокислотной последовательности) от инсулина человека и его использование напрямую малоэффективно. Например свиной инсулин отличается от человеческого на одну аминокислоту у С-конца В-цепи (аланин вместо треонина- на) Поэтому предварительно проводят химическую модификацию животного инсулина с целью придания ему структуры человеческого инсулина. Замену аланина на треонин осуществляют путем катализируемого ферментом отщепления аланина и присоединение вместо него защищенного по карбоксильной группе остатка треонина, присутствуещего в реакционной смеси в большом избытке. После отщепления защитной О-трет-бутильной группы получают инсулин человека.
Развитие с середины 1970-х годов технологии получения рекомбинантных ДНК значительно изменило характер исследований, проводимых в области генетики, молекулярной биологии и биотехнологии. Разработка методов изменения генетического аппарата клеток, позволяющих вводить в них чужеродные гены, клонировать их, экспрессировать и получать биосинтетические белки в необходимом количестве обеспечила возможность создания новой отрасли фармацевтической промышленности и обеспечения здравоохранения различными белковыми препаратами (инсулином, эритропоэтином, интерферонами и др.)
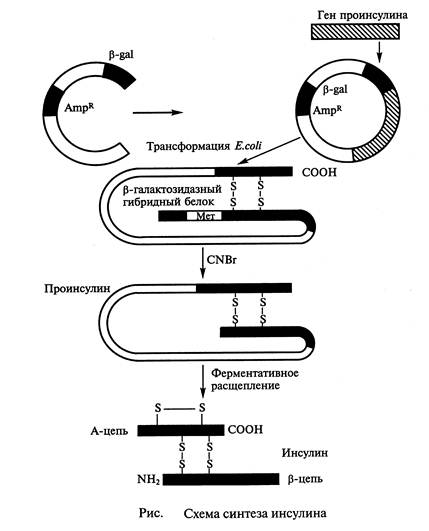
Поэтому в дальнейшем был разработан метод получения проинсулина человека целиком, с последующей его трансформацией в инсулин in vitro. Для этого искусственно была синтезирована нуклеотидная последовательность кодирующая структуру проинсулина, которая затем была встроена в плазмиду к 3 '-концу гена β-галактозидазы. Трансформированные такими плазмидами клетки Е. coli синтезировали химерный белок, состоящий из фрагментов проинсулина и β-галактозидазы, который далее in vitro последовательно превращали в инсулин человека (рис.1.).

Инсулин - гормон поджелудочной железы, регулирующий углеводный обмен и поддерживающий нормальный уровень сахара в крови. Недостаток этого гормона в организме приводит к одному из тяжелейших заболеваний - сахарному диабету, который как причина смерти стоит на третьем месте после сердечнососудистых заболеваний и рака. Инсулин - небольшой глобулярный белок, содержащий 51 аминокислотный остаток и состоящий из двух полипептидных цепей, связанных между собой двумя дисульфидными мостиками. Синтезируется он в виде одноцепочечного предшественника - препроинсулина, содержащего концевой сигнальный пептид (23 аминокислотных остатка) и 35-звенный соединительный пептид (С-пептид). При удалении сигнального пептида в клетке образуется проинсулин из 86 аминокислотных остатков, в котором А и В-цепи инсулина соединены С-пептидом, обеспечивающим им необходимую пространственную ориентацию при замыкании дисульфидных связей. После протеолитического отщепления С-пептида образуется инсулин.
Со времени открытия инсулина в 1921 году Бантингом и Бестом, которые выделили гормон из поджелудочной железы новорожденного теленка и показали снижение уровня глюкозы в сыворотке крови экспериментального животного после введения препарата, прошло больше 80 лет. За это время была создана индустрия производства инсулина.
Обычно поджелудочная железа крупного рогатого скота и свиней не используется в мясной и консервной промышленности и поставляется в вагонах-рефрижераторах на фармацевтические предприятия, где проводят экстракцию гормона. Для получения 100 г кристаллического инсулина необходимо 800 -1000 кг исходного сырья. Однако такой инсулин отличается по строению (аминокислотной последовательности) от инсулина человека и его использование напрямую малоэффективно. Например свиной инсулин отличается от человеческого на одну аминокислоту у С-конца В-цепи (аланин вместо треонина- на) Поэтому предварительно проводят химическую модификацию животного инсулина с целью придания ему структуры человеческого инсулина. Замену аланина на треонин осуществляют путем катализируемого ферментом отщепления аланина и присоединение вместо него защищенного по карбоксильной группе остатка треонина, присутствуещего в реакционной смеси в большом избытке. После отщепления защитной О-трет-бутильной группы получают инсулин человека.
Развитие с середины 1970-х годов технологии получения рекомбинантных ДНК значительно изменило характер исследований, проводимых в области генетики, молекулярной биологии и биотехнологии. Разработка методов изменения генетического аппарата клеток, позволяющих вводить в них чужеродные гены, клонировать их, экспрессировать и получать биосинтетические белки в необходимом количестве обеспечила возможность создания новой отрасли фармацевтической промышленности и обеспечения здравоохранения различными белковыми препаратами (инсулином, эритропоэтином, интерферонами и др.)
Поэтому в дальнейшем был разработан метод получения проинсулина человека целиком, с последующей его трансформацией в инсулин in vitro. Для этого искусственно была синтезирована нуклеотидная последовательность кодирующая структуру проинсулина, которая затем была встроена в плазмиду к 3 '-концу гена β-галактозидазы. Трансформированные такими плазмидами клетки Е. coli синтезировали химерный белок, состоящий из фрагментов проинсулина и β-галактозидазы, который далее in vitro последовательно превращали в инсулин человека (рис.1.).
Сахарным диабетом в России страдает более 5 миллионов человек. Каждый год эта цифра увеличивается почти на 5 процентов. Многим пациентам необходимы инъекции инсулина. Причем каждый день. Чтобы обеспечить лекарством всех – нужно 800 000 литров в год!
Все начинается с бактерии
Процесс искусственного получения лекарства начинается в лаборатории. Тут заготавливают главный ингредиент – кишечную палочку. В каждую бактерию встраивают ДНК, необходимую для синтеза инсулина. Ювелирную работу делают с помощью электрического напряжения.

Корм для одноклеточных

В цехах почти все процессы автоматизированы. Люди здесь лишь следят за показаниями приборов. Смена – несколько человек. Большинство производственных помещений – за стеклом. Так поддерживается идеальная чистота.

Питаются и размножаются одноклеточные в реакторах объемом до 2-х тонн. Сосчитать количество бактерий – невозможно. Только в одном миллилитре жидкости их несколько миллиардов.

Коктейль из палочек
Чтобы сконцентрировать получившуюся массу, ее прогоняют через сепаратор. Объем уменьшается до 500-600 литров.

Дальше смесь отправляют в гомогенизатор. Этот прибор разрушает палочки. Дело в том, что инсулин скапливается внутри них в небольших частицах – тельцах включениях. Чтобы достать белок, нужно сломать клеточную стенку. В гомогенизаторе для этого сначала повышают давление до 1000 атмосфер. Потом резко сбрасывают. Бактерии не выдерживают перепадов и рвутся. Тельца включения смешиваются с остатками клеток.

Молекулярная точность


После массу еще раз концентрируют. Но это пока не инсулин. На белках остаются лишние элементы – C-пептиды. Их отрезают в реакторе, также под действием ферментов.
Фильтрация
Последний рывок – очистка. Жидкость с инсулином помещают в хроматограф. Там избавляются от лишних примесей и собирают белки вместе.

На выходе получается 99% инсулин. Дальше его кристаллизуют, сушат и превращают в порошок. Три тонны жидкости за 12 дней превращаются в пять килограммов концентрата. Этого хватит, чтобы обеспечить инъекциями сотни тысяч человек.
Финальная стадия
Дальше порошок отправляют на завод в подмосковный Оболенск. Там его растворяют и разливают по емкостям. Инсулином наполняют флаконы, картриджи, шприц-ручки.

Потом – обязательный этап карантина. С каждой партии берут пробы на соответствие нормам качества. Только после этого наклеивают этикетки. Здесь должны быть уверены в каждой ампуле, ведь от продукции зависят жизни людей.

Сегодня завод изготавливает треть всего инсулина в России. Через несколько лет производство сможет обеспечить лекарством всю страну. Продукцию этого предприятия уже сейчас поставляют в страны СНГ, а вскоре первые партии отправят в Венесуэлу.
Тема урока:
Производство инсулина биотехнологическим способом
Цели обучения:
-Описывает общую схему биотехнологического процесса на примере
производства инсулина.
-Описывает функции частей ферментера. Объясняет
последовательность событий, связанных с биотехнологическим
процессом.
-Определяет преимущества и недостатки производства инсулина в
генной инженерии (включая социальные и этические проблемы).
Критерии оценивания:
-Описывает общую схему биотехнологического процесса на примере
производства инсулина.
- Описывает функции частей ферментера
- Определяет преимущества и недостатки производства инсулина в генной
инженерии (включая социальные и этические проблемы).
Групповая работа
(G, f) - положительные изменения в структуре ДНК
-отрицательные изменения в структуре ДНК (например,
мутации, которые блокируют функции,
модифицированные ферменты, два белка, соединенные
вместе, евгеника)
Мутации – это изменения в ДНК клетки
Виды мутаций
Изменение в структуре
ДНК
Изменение в структуре
белка
Замена
Замена одного
нуклеотида в кодоне
Белок не изменен
Происходит замена
одной аминокислоты на
другую
Вставка
Вставка фрагмента ДНК
из 3 нуклеотидов или с
числом нуклеотидов
кратных 3
Происходит удлинение
полипептидной цепи на
одну или несколько
аминокислот
Делеция
Выпадение фрагмента
Происходит укорочение
ДНК из 3 нуклеотидов
белка на одну или
или числом нуклеотидов несколько аминокислот
кратным 3
Генная инженерия- совокупность приемов,методов и
технологий получения рекомбинативных РНК и ДНК,
выделение генов из организма (клеток), осуществления
манипуляций с генами и введения их в другие организмы
Рестриктаза-ферменты, разрезающие молекулу ДНК
Лигаза- ферменты, сшивающие молекулу ДНК
Плазмиды- внехромосмные двухцепочные
кольцевидные молекулы ДНК. они легко
выделяются из бактериальных клеток и в них
легко встроить любые гены, которые они переносят
в ДНК нового хозяина.
История получения рекомбинативной ДНК
П.Берг
1972 ж.
П. Берг и его коллеги по Стэнфордскому университету (рДНҚ)
впервые синтезировали рекомбинантную ДНК
Ферментеры, или биореакторы,
представляют собой камеры, в которых в жидкой или на
твердой среде выращивают микроорганизмы.
Процесс, происходящий в ферментере, называется
ферментацией.
Продуктом являются либо сами клетки (биомасса), либо
какой-то полезный клеточный метаболит.
В ферментере организм растет и размножается, используя
питательную среду.
Обычно ферментер изготавливают из
высококачественной нержавеющей стали, так что он не
подвержен коррозии и не выделяет в среду токсичные
соли металлов. Все используемое оборудование,
материалы и воздух должны быть стерильными.
получение гена;
получение гибридной (рекомбинантной) ДНК;
сочетание рекомбинантной ДНК с так называемой векторной
молекулой, которая способна доставлять ген в клетку хозяина и
тем самым обеспечивать репликацию чужеродного гена;
введение полученной рекомбинантной ДНК в клетку хозяина;
клонирования рекомбинантной ДНК (рекомбинантных клеток);
отбор клеток, где размножаются (клонируются) введены
чужеродные гены.
(П,G) Определите преимущества и недостатки производства
инсулина в генной инженерии
(включая социальные и этические проблемы).
Критерии оценивания:
-Перечислите преимущества производства инсулина в генной инженерии
-социальные
-этические
-медицинские
-Перечислите недостатки производства инсулина в генной инженерии
-социальные
-этические
-медицинские
-подготовка материала.
Домашнее задание:
(I,f)Напишите отчет об этапах, при помощи которых человеческий
инсулин может быть выделен методами биотехнологии.
Читайте также:

