Полиморфные превращения железа кратко
Обновлено: 02.07.2024
В металловедении под полиморфизмом понимают любые изменения в кристаллографической форме решётки материала. Поэтому аллотропическое или полиморфное превращение играет важную роль в свойствах и использовании металлов, склонных к подобным изменениям.
Суть явления
Полиморфные превращения происходят в ответ на изменения внешних факторов – температуры, давления, либо того и другого вместе.
Так, например, происходит с углеродом, который встречается в двух различных полиморфных формах- графита с гексагональной структурой и алмаза - с изометрической. Вещество FeS2 чаще всего встречается в виде пирита с изометрической структурой, но оно также может иметь ромбическое внутреннее расположение, и тогда его называют марказитом. Существуют и другие примеры.
Свойства вещества определяются не только его химическим составом, но и геометрией составляющих атомов и ионов, а также природой связывающих их электрических сил.
Большинство минералов представляют собой соединения, состоящие из двух или более элементов; их формулы получены на основе количественного химического анализа и указывают относительные пропорции составляющих элементов. Поэтому наблюдаются значительные вариации в ионах, которые занимают определенные атомные позиции в их структуре. Например, содержание железа в родохрозите (MnCO3) может варьироваться в широких пределах, поскольку двухвалентное железо (Fe 2+ ) замещает катионы марганца (Mn 2+ ) в структуре родохрозита.
Поэтому формула данного минерала может быть дана в более общих терминах, а именно (Mn, Fe) CO3. Она показывает, что, хотя количество марганца и железа меняется, но отношение катиона к отрицательно заряженной анионной группе остается фиксированным: один атом Mn 2+ или Fe 2+ к одной группе CO3. Такое изменение является результатом замены одного иона или ионной группы другим в конкретной структуре. Это явление называется ионным замещением или твердым раствором. Возможны три типа твердого раствора:
- замещающий;
- промежуточный;
- упущенный.
Замещающий твердый раствор является наиболее распространенной разновидностью: пример с родохрозитом это подтверждает. Однако на степень замещения могут влиять и другие факторы, наиболее важным из которых является размер иона. Ионы двух разных элементов могут свободно заменять друг друга, только если их ионные радиусы различаются примерно на 15 процентов или меньше.
На аллотропические превращения влияет также температура, соответствующая началу роста кристаллов. Чем выше температура, чем более обширен термический беспорядок в кристаллической структуре и тем менее требовательны требования к пространству. В результате ионное замещение, которое не могло произойти в кристаллах, выращенных при низких температурах, может присутствовать в кристаллах, выращенных при более высоких температурах. Так, высокотемпературная форма KAlSi3O8 (санидин) может содержать больше натрия вместо калия, чем низкотемпературные аналоги данного минерала.
Дополнительным фактором, влияющим на ионное замещение, является поддержание баланса между положительными и отрицательными зарядами в структуре. Замена одновалентного иона (например, Na + ) двухвалентным ионом (например, Ca 2+ ) требует дополнительных замен, чтобы структура оставалась электрически нейтральной.
Условия для полиморфного превращения
Стабильность химических связей атомов и ионов металлов определяют электрические силы. Физические и химические свойства минералов по большей части объясняются типами этих связывающих сил, среди которых:
- твёрдость:
- температура начала плавления;
- электропроводность;
- теплопроводность;
- коэффициент теплового расширения.
Твёрдость и температура плавления кристалла увеличиваются (а коэффициент теплового расширения уменьшается) пропорционально прочности такой связи. Чем сильнее электрические связи, тем большее количество тепла потребуется для их разделения.
Электрические силы, называемые химическими связями, можно разделить на пять типов:
- ионные;
- ковалентные;
- металлические;
- ван-дер-ваальсовы;
- водородные.
Такая классификация в значительной степени обусловлена целесообразностью, поскольку химические связи в данном металле могут фактически обладать характеристиками более чем одного типа связи.
Ионные связи проявляются в тенденции атомов металлов приобретать или терять электроны, пока их внешние орбитали не станут стабильными; Обычно это достигается за счет заполнения этих орбиталей максимально допустимым числом валентных электронов.
Кристаллы с ионной связью обычно обладают умеренной твёрдостью и удельным весом, довольно высокими температурами плавления и плохой теплопроводностью и электропроводностью.
Ковалентные связи образуются только между резко полярными веществами, которых среди металлов практически не встречается. В отличие от солей, металлы обладают высокой пластичностью, прочностью, пластичностью и проводимостью. Многие из них характеризуются более низкой твёрдостью и более высокими температурами плавления и кипения, чем, например, материалы с ковалентной связью. Все эти свойства являются результатом металлического механизма связи, который можно представить как набор положительно заряженных ионов, погруженных в облако валентных электронов. Притяжение между катионами и электронами удерживает кристалл вместе.
Электроны не связаны с каким-либо конкретным катионом и, таким образом, могут свободно перемещаться по структуре. У некоторых металлов (натрий, цезий, рубидий и калий) лучистая энергия света может вызвать полное удаление электронов с их поверхностей Этот результат известен как фотоэлектрический эффект. Подвижность электронов отвечает за способность металлов проводить тепло и электричество.
Самородные металлы - единственные минералы, демонстрирующие чистую металлическую связь.
Связи Ван-дер-Ваальса и водородные связи характерны для газов, органических жидкостей и некоторых твёрдых тел, поэтому здесь не рассматриваются.
Механизм превращения
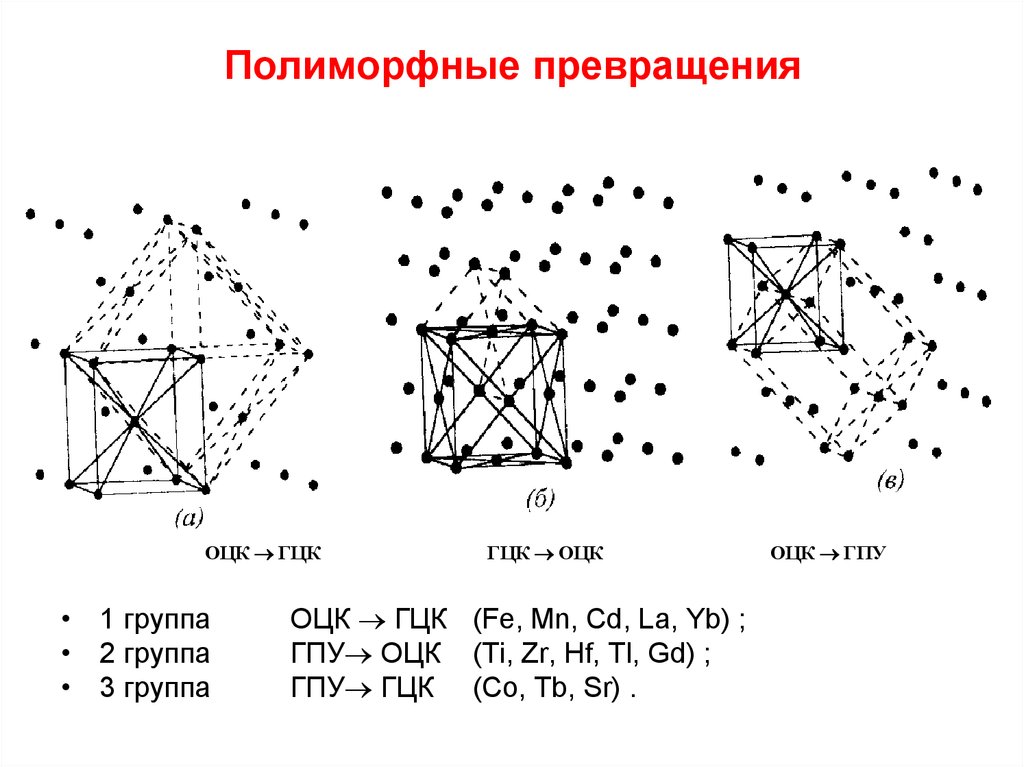
Наибольшей интенсивностью полиморфных превращений обладают самородные металлы, которые объединяются в три группы:
- Группа золота, состоящая из золота, серебра, меди и свинца;
- Платиновая группа, состоящая из платины, палладия, иридия и осмия;
- Группа железа, содержащая железо и никель.
Гораздо слабее полиморфизм выявляется у ртути, тантала, олова и цинка.
Золото, серебро и медь являются членами одной группы (столбца) периодической таблицы элементов и, следовательно, имеют схожие химические свойства. В некомбинированном состоянии их атомы соединены довольно слабой металлической связью. поэтому атомы расположены в простом кубическом расположении с плотной упаковкой. И золото, и серебро имеют атомный радиус 1,44 × 10 –7 мм, что позволяет твёрдому раствору полностью образовываться между ними. Радиус меди значительно меньше (1,28 Å), и поэтому медь только в ограниченной степени заменяет золото и серебро. Из-за схожей кристаллической структуры металлы группы золота обладают схожими физическими свойствами, поэтому хорошо кристаллизуются в изометрической системе и имеют высокую плотность упаковки.
Аналогичен механизм аллотропного превращения у металлов платиновой группы..
Металлы группы железа изометричны и имеют простую кубическую упакованную структуру, чем объясняется лёгкость происходящих полиморфных превращений.
Почему полиморфное превращение также называют перекристаллизацией?
Полиморфизм - это способность вещества кристаллизоваться в различные кристаллические формы, которые называются кристаллическими модификациями. Полиморфы имеют одинаковое жидкое или газообразное состояние, но в твёрдом состоянии ведут себя по-разному.
Для всех металлов, испытывающих аллотропические превращения, кристаллические структуры подвижны и могут видоизменяться в нескольких разных пропорциях.
Некоторые полиморфные формы могут быть стабильными только в том случае, когда при кристаллизации присутствует небольшое количество растворителя.
Таким образом, перекристаллизация – процесс перестройки одной кристаллической решётки в другую – обязательно сопровождается и определёнными полиморфными превращениями.
Основные фазы. Превращения в железоуглеродистых сплавах при нагреве и охлаждении. Углеродистые стали. Критические точки в сталях. Влияние содержания углерода на механические свойства сталей. Влияние примесей на эксплуатационные свойства сталей. Хладноломкость сталей. Чугуны;(6ч)
Лекция 7. Диаграмма состояния с полиморфным превращением на примере системы железо-углерод, основные фазы.
Железоуглеродистые сплавы (стали и чугуны) важнейшие металлические сплавы современной техники.
Представление о строении сплавов железоуглеродистых сплавов дает диаграмма системы Fe – C, начало изучения, которой было положено работами Д.К. Чернова в 1868 году.
Железо в твердом состоянии может находиться в двух полиморфных модификациях: Feα
с ОЦК решеткой (к.ч.=8; к.к.=0,68) и Feγ с ГЦК решеткой (к.ч.=12; к.к.= 0, . Диаграмма 74).
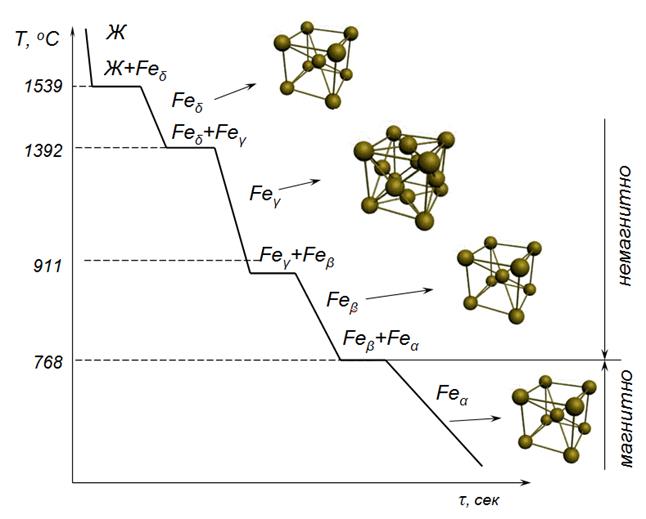
Ниже 910 ºC и выше 1392 ºC устойчиво α-железо с ОЦК решеткой. В интервале температур 910-1392 ºC устойчиво γ-железо с кристаллической решеткой ГЦК (рис.7.1).

Рис.7.1. Кривая нагрева – охлаждения железа
Железо при 768ºC испытывает магнитное превращение. Выше 768ºC железо становится немагнитным.
Углерод образует с железом твердые растворы внедрения. Растворимость углерода в железе зависит от кристаллической модификации железа.
Диаметр поры кристаллической решетки ОЦК (свободное место в середине ребер) равен 0,062нм, что значительно меньше, чем диаметр поры решетки ГЦК, равной 0,102нм, а диаметр атома ( иона) углерода-0,154нм. Поэтому α-железо способно растворять углерод в очень малом количестве, а растворимость углерода в γ-железе существенно больше.
Железо не только растворяет углерод, но и образует с ним химическое соединение цементит (Fe3C).
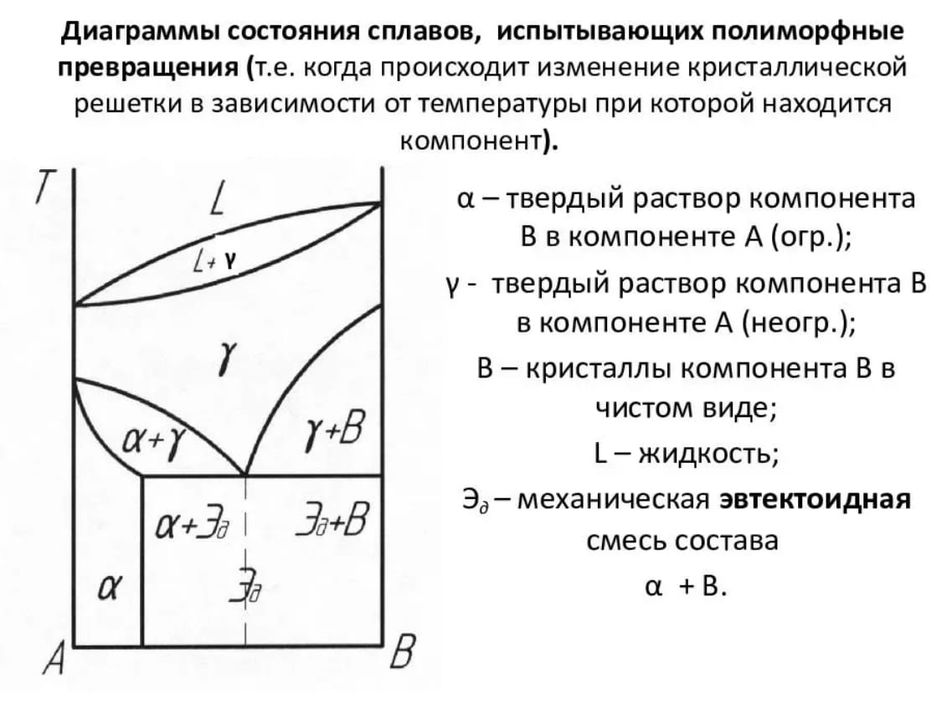
В системе железо-углерод возможно присутствие следующих фаз: жидкой фазы, твердых растворов на базе Feα (феррита) и на базе Feγ (аустенита), химического соединения Fe3C (цементита).
Феррит (Ф)- твердый раствор внедрения углерода в Feα.. При 727 ºC наблюдается максимальная растворимость углерода в феррите, составляющая 0,02%; при 20 ºC в феррите растворяется около 0,006% С. Высокотемпературная модификация Feα.( называется Feδ) с предельной растворимостью углерода 0,1 % при температуре 1499 o С (точка J). Свойства феррита близки к свойствам чистого железа. Область феррита на диаграмме состояния железо-углерод расположена левее линии GPQ и AHN.
Аустенит (А) – твердый раствор внедрения углерода в Feγ. Растворимость углерода в аустените зависит от температуры. При 1147 ºC аустенит может растворять до 2,14 %С, при 727 ºC – 0,8%С. Область аустенита на диаграмме – NJESGN.
Цементит (Ц) – карбид железа Fe3C, в котором содержится 6,67 %С. Температура плавления цементита 1252 ºC. Обладает высокой твердостью ( 8000 МПа НВ ), легко царапает стекло. Цементит очень хрупок, имеет практически нулевую пластичность, сложную орторомбическую решетку с плотной упаковкой атомов.
Диаграмма состояния железо-углерод приведена на рис.3.2.

Линия ABCD- линия ликвидус, линия AHJECF – солидус. Точка А соответствует температуре плавления железа (1539 ºC), точка D – температуре плавления цементита (1252ºC). Точки N и G соответствуют температурам полиморфного превращения железа.
Рис. 7.2. Диаграмма состояния системы Fe – C
Три горизонтальные линии на диаграмме Fe – C (рис.2) – HJB, ECF и PSK указывают на протекание нонвариантных реакций.
При 1499ºC (линия HJB) протекает перитектическая реакция:
По линии ECF при 1147 ºC происходит эвтектическое превращение:
Образующая эвтектика называется ледебуритом.
Ледебурит (Л)- механическая смесь аустенита и цементита, содержащая 4,3%С.
По линии PSK при 727 ºC происходит эвтектоидное превращение:
В результате которого из аустенита, содержащего 0,8%С, образуется механическая смесь феррита и цементита. Эвтектоидное превращение происходит аналогично кристаллизации эвтектики, но не из жидкости, а из твердого раствора. Образующийся эвтектоид называется перлитом.
Перлит (П) – механическая смесь феррита и цементита, содержащая 0,8%С. Зерно перлита состоит из параллельных пластинок цементита и феррита, на травленом шлифе напоминает перламутр, отсюда и называется – перлит.

Аустенит, входящий в состав ледебурита, при 727 ºC также испытывает эвтектоидное превращение. Поэтому ниже 727 ºC ледебурит состоит из механической смеси перлита и цементита.
На рис.7.3 приведены кривые охлаждения сплавов: 0,02; 0,5; 0,8; 1,7; 3,5; 4,3; 5,5%С.
Сплав 1, содержащий менее 0,02%С, фактически, представляет собой технически чистое железо. Точка 1 соответствует началу кристаллизации аустенита, точка 2 – окончанию кристаллизации. При охлаждении от точки 2 до точки 3 никаких превращений в образовавшемся аустените не происходит.
В точке 3 начинается, а в точке 4 заканчивается перестройка кристаллической решетки аустенита (ГЦК) в кристаллическую решетку феррита (ОЦК). При охлаждении в интервале температур 3-4 состав аустенита меняется по линии GS, а состав феррита – по линии GP. От точки 4 до точки 5 превращений не происходит, образовавшийся феррит просто охлаждается. Линия PQ соответствует линии переменной растворимости.
Ниже этой линии сплав пересыщен углеродом, происходит выделение избыточного углерода, образующего химическое соединение с железом, т.е. цементит. При охлаждении цементит выделяется непрерывно, и концентрация углерода в феррите уменьшается по линии PQ, составляя при комнатной температуре
Тема 6. Система сплавов Fe –C
Основные фазы. Превращения в железоуглеродистых сплавах при нагреве и охлаждении. Углеродистые стали. Критические точки в сталях. Влияние содержания углерода на механические свойства сталей. Влияние примесей на эксплуатационные свойства сталей. Хладноломкость сталей. Чугуны;(6ч)
Лекция 7. Диаграмма состояния с полиморфным превращением на примере системы железо-углерод, основные фазы.
Железоуглеродистые сплавы (стали и чугуны) важнейшие металлические сплавы современной техники.
Представление о строении сплавов железоуглеродистых сплавов дает диаграмма системы Fe – C, начало изучения, которой было положено работами Д.К. Чернова в 1868 году.
Железо в твердом состоянии может находиться в двух полиморфных модификациях: Feα
с ОЦК решеткой (к.ч.=8; к.к.=0,68) и Feγ с ГЦК решеткой (к.ч.=12; к.к.= 0, . Диаграмма 74).
Ниже 910 ºC и выше 1392 ºC устойчиво α-железо с ОЦК решеткой. В интервале температур 910-1392 ºC устойчиво γ-железо с кристаллической решеткой ГЦК (рис.7.1).

Рис.7.1. Кривая нагрева – охлаждения железа
Железо при 768ºC испытывает магнитное превращение. Выше 768ºC железо становится немагнитным.
Углерод образует с железом твердые растворы внедрения. Растворимость углерода в железе зависит от кристаллической модификации железа.
Диаметр поры кристаллической решетки ОЦК (свободное место в середине ребер) равен 0,062нм, что значительно меньше, чем диаметр поры решетки ГЦК, равной 0,102нм, а диаметр атома ( иона) углерода-0,154нм. Поэтому α-железо способно растворять углерод в очень малом количестве, а растворимость углерода в γ-железе существенно больше.
Железо не только растворяет углерод, но и образует с ним химическое соединение цементит (Fe3C).
В системе железо-углерод возможно присутствие следующих фаз: жидкой фазы, твердых растворов на базе Feα (феррита) и на базе Feγ (аустенита), химического соединения Fe3C (цементита).
Феррит (Ф)- твердый раствор внедрения углерода в Feα.. При 727 ºC наблюдается максимальная растворимость углерода в феррите, составляющая 0,02%; при 20 ºC в феррите растворяется около 0,006% С. Высокотемпературная модификация Feα.( называется Feδ) с предельной растворимостью углерода 0,1 % при температуре 1499 o С (точка J). Свойства феррита близки к свойствам чистого железа. Область феррита на диаграмме состояния железо-углерод расположена левее линии GPQ и AHN.
Аустенит (А) – твердый раствор внедрения углерода в Feγ. Растворимость углерода в аустените зависит от температуры. При 1147 ºC аустенит может растворять до 2,14 %С, при 727 ºC – 0,8%С. Область аустенита на диаграмме – NJESGN.
Цементит (Ц) – карбид железа Fe3C, в котором содержится 6,67 %С. Температура плавления цементита 1252 ºC. Обладает высокой твердостью ( 8000 МПа НВ ), легко царапает стекло. Цементит очень хрупок, имеет практически нулевую пластичность, сложную орторомбическую решетку с плотной упаковкой атомов.
Диаграмма состояния железо-углерод приведена на рис.3.2.

Линия ABCD- линия ликвидус, линия AHJECF – солидус. Точка А соответствует температуре плавления железа (1539 ºC), точка D – температуре плавления цементита (1252ºC). Точки N и G соответствуют температурам полиморфного превращения железа.
Рис. 7.2. Диаграмма состояния системы Fe – C
Три горизонтальные линии на диаграмме Fe – C (рис.2) – HJB, ECF и PSK указывают на протекание нонвариантных реакций.
При 1499ºC (линия HJB) протекает перитектическая реакция:
По линии ECF при 1147 ºC происходит эвтектическое превращение:
Образующая эвтектика называется ледебуритом.
Ледебурит (Л)- механическая смесь аустенита и цементита, содержащая 4,3%С.
По линии PSK при 727 ºC происходит эвтектоидное превращение:
В результате которого из аустенита, содержащего 0,8%С, образуется механическая смесь феррита и цементита. Эвтектоидное превращение происходит аналогично кристаллизации эвтектики, но не из жидкости, а из твердого раствора. Образующийся эвтектоид называется перлитом.
Перлит (П) – механическая смесь феррита и цементита, содержащая 0,8%С. Зерно перлита состоит из параллельных пластинок цементита и феррита, на травленом шлифе напоминает перламутр, отсюда и называется – перлит.
Аустенит, входящий в состав ледебурита, при 727 ºC также испытывает эвтектоидное превращение. Поэтому ниже 727 ºC ледебурит состоит из механической смеси перлита и цементита.
На рис.7.3 приведены кривые охлаждения сплавов: 0,02; 0,5; 0,8; 1,7; 3,5; 4,3; 5,5%С.
Сплав 1, содержащий менее 0,02%С, фактически, представляет собой технически чистое железо. Точка 1 соответствует началу кристаллизации аустенита, точка 2 – окончанию кристаллизации. При охлаждении от точки 2 до точки 3 никаких превращений в образовавшемся аустените не происходит.
В точке 3 начинается, а в точке 4 заканчивается перестройка кристаллической решетки аустенита (ГЦК) в кристаллическую решетку феррита (ОЦК). При охлаждении в интервале температур 3-4 состав аустенита меняется по линии GS, а состав феррита – по линии GP. От точки 4 до точки 5 превращений не происходит, образовавшийся феррит просто охлаждается. Линия PQ соответствует линии переменной растворимости.
Ниже этой линии сплав пересыщен углеродом, происходит выделение избыточного углерода, образующего химическое соединение с железом, т.е. цементит. При охлаждении цементит выделяется непрерывно, и концентрация углерода в феррите уменьшается по линии PQ, составляя при комнатной температуре

Некоторые элементы могут изменять свое кристаллическое строение, т.е. тип кристаллической решетки, в зависимости от внешних условий — температуры и давления.
Существование одного элемента в нескольких кристаллических формах (кристаллических модификациях) называется полиморфизмом или аллотропией.
Каждая полиморфная модификация имеет свою область температур, при которых она устойчива. Превращение одной кристаллической формы в другую происходит при постоянной температуре с выделением значительного количества тепла при охлаждении, что связано с затратой определенной энергии на перестройку кристаллической решетки и поглощением тепла при нагреве.
Перестройка кристаллической решетки в твердом состоянии называется вторичной кристаллизацией.
Как и при первичной кристаллизации для полиморфных превращений необходимы переохлаждение или перегрев относительно равновесной температуры. По своему механизму это кристаллизационный процесс, осуществляемый путем образования зародышей (как правило, на границах зерен) и последующего их роста. В результате образуются новые кристаллические зерна, имеющие другой размер и форму. Скачкообразно изменяются все свойства: удельный объем, теплоемкость, теплопроводность, механические и химические свойства.
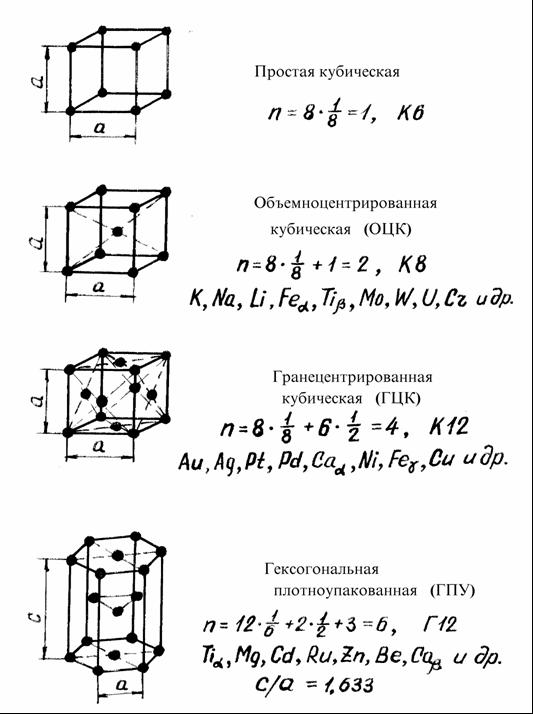
Рисунок 2 – Виды элементарных кристаллических ячеек
Полиморфные модификации обозначают буквами греческого алфавита , , , и т.д. Модификацию, устойчивую при более низких температурах, обозначают , при более высоких — , затем и т.д. Температурным полиморфизмом обладают около тридцати металлов, например: марганец (-Мn, -Мn, -Мn, -Мn), титан (-Тi, -Тi), кобальт (-Сo, -Сo), олово (-Sn, -Sn) и др. Часть металлов не имеют полиморфных превращений, например: Ni (ГЦК), Аu (ГЦК), Ag (ГЦК), Pt (ГЦК), Cu (ГЦК), Zn (ГПУ).
Железо является основным компонентом сталей, чугунов и обладает полиморфизмом. На рисунке 3 приведена кривая охлаждения железа с температурами полиморфных превращений.
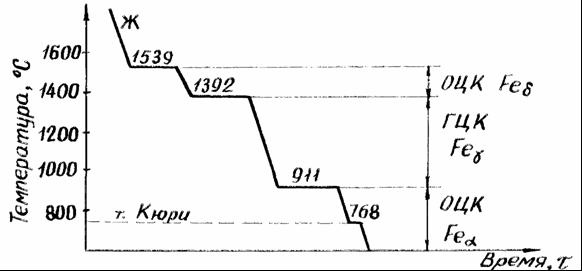
Рисунок 3 — Кривая охлаждения железа
Железо имеет две температуры полиморфного превращения 911 0 С и 1392 0 С. Ниже 911 0С железо имеет кубическую объемноцентрированную ячейку (ОЦК) и модификацию -Fe (Fe). При 911 0 С решетка перестраивается в кубическую гранецентрированную (ГЦК) и модификацию -Fe (Fe). При 1392 0 С решетка вновь перестраивается в ОЦК и модификацию -Fe (Fe). При 768 0 С (точка Кюри) на кривой охлаждения имеется площадка, связанная не с перестройкой решетки, а с изменением магнитных свойств железа. Ниже 768 0 С железо магнитно, выше — немагнитно.
Точка Кюри — это температура, соответствующая переходу из ферромагнитного состояния в парамагнитное.
Примером полиморфного превращения, обусловленного изменением температуры и давления, является изменение кристаллического строения углерода. В обычных условиях он находится в виде модификации графита, а при нагреве до 2000 0 С и давлении порядка 10 10 Па образуется модификация алмаза.
В середине восьмидесятых годов прошлого века открыта третья форма углерода в виде замкнутых сферических или сфероидальных молекул, состоящих из пяти- и шестиугольников — фуллерены. В зависимости от количества объединенных атомов углерода существуют фуллерены С28…С960. Наиболее стабильными являются молекулы С60 и С70. Полиморфные модификации углерода приведены на рисунке 4.
Читайте также:

