Полиморфизм это в генетике кратко
Обновлено: 02.07.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Аллели – (от греч. allelon друг друга, взаимно) различные формы одного и того же гена, расположенные в одинаковых участках (локусах) гомологичных (парных) хромосом, контролирующие один и тот же белок. Все гены соматических клеток, за исключением генов, расположенных в половых хромосомах, представлены двумя аллелями, один из которых унаследован от отца, а другой – от матери. Различия между аллелями обусловлены мутациями.
Аутосомно-доминантный тип наследования – мутантный аллель (вариант) доминирует над нормальным аллелем (вариантом), т.е. проявляется как в гомозиготном, так и в гетерозиготном состоянии; патологическая наследственность прослеживается в родословной "по вертикали"; по крайней мере, один из родителей имеет проявление данной мутации. При этом мутантный ген расположен в аутосоме (неполовой хромосоме) и наследование не сцеплено с полом.
Аутосомно-рецессивный тип наследования – нормальный аллель (вариант) подавляет проявление мутантного аллеля (варианта), т.е. мутация может проявиться, только находясь в гомозиготном состоянии. При этом мутантный ген расположен в аутосоме (неполовой хромосоме) и наследование не сцеплено с полом.
Ген – элементарная единица наследственности, наименьший неделимый элемент наследственного материала, который может быть передан от родителей потомству как целое и который определяет признаки, свойства или физиологическую функцию организма. На молекулярном уровне - это участок молекулы ДНК, кодирующий первичную структуру белков и РНК.
Генетический вариант полиморфизма – в широком смысле аналогичен понятию аллеля; здесь, в узком смысле – одна из двух разновидностей гена, различающихся по одному генетическому полиморфизму. Генетические варианты полиморфизма обычно отличаются аминокислотной последовательностью белкового продукта гена или уровнем экспрессии гена.
Генотип – (здесь, в узком смысле) сочетание генетических вариантов (аллелей), расположенных на гомологичных хромосомах.
Гетерозиготный – содержащий разные аллели (генетические варианты) в соответствующих локусах гомологичных хромосом.
Гомозиготный – содержащий одинаковые аллели (генетические варианты) в соответствующих локусах гомологичных хромосом.
Гомологичные хромосомы – парные хромосомы из диплоидного набора, одинаковые по форме, размерам и набору генов.
Делеция – утрата в результате мутации сегмента ДНК размером от одного нуклеотида до субхромосомного фрагмента, включающего несколько генов. В случае генных полиморфизмов рассматриваются делеции, ограниченные одним геном.
Диплоидный набор – набор хромосом в соматических клетках организма, который содержит два гомологичных набора хромосом, из которых один передается от одного родителя, а второй - от другого.
Доминантный аллель – аллель, проявляющийся в фенотипе гетерозиготных особей.
Инсерция – вставка сегмента ДНК размерами от одного нуклеотида до субхромосомного фрагмента, включающего несколько генов. В случае генных полиморфизмов рассматриваются инсерции, ограниченные одним геном.
Интрон – область гена, разделяющая экзоны и не несущая информации об аминокислотной последовательности белкового продукта.
Миссенс-мутация - мутация, приводящая к подстановке несоответствующей аминокислоты в полипептидную цепь.
Мультифакториальные заболевания – заболевания, вызываемые взаимодействием множества наследственных и внешних факторов, например, ишемическая болезнь сердца, инфаркт миокарда (ИМ), инсульт, некоторые формы рака, психические заболевания и др.
Мутантный вариант полиморфизма – вариант полиморфизма, возникший вследствие мутации из своего предшественника – нормального варианта.
Мутация – изменение нуклеотидной последовательности ДНК. Чаще всего мутации представляют собой однонуклеотидные замены – миссенс-мутации. Влияние мутации на функцию гена может варьировать от ее полного нарушения до незначительного влияния или отсутствия влияния.
Нормальный вариант полиморфизма – наиболее распространенный в популяции вариант полиморфизма, который является предшественником других вариантов, возникающих вследствие мутаций.
Нуклеотид – структурная единица нуклеиновых кислот. В состав ДНК входят 4 нуклеотида: аденин – А, тимин – Т, гуанин – G, цитозин – С.
Пенетрантность – количественный показатель фенотипической изменчивости проявления гена. Измеряется (обычно в %) отношением числа особей, у которых данный ген проявился в фенотипе, к общему числу особей, в генотипе которых этот ген присутствует в необходимом для его проявления состоянии (гомозиготном – в случае рецессивных генов или гетерозиготном – в случае доминантных генов). Проявление гена у 100% особей с соответствующим генотипом называется полной пенетрантностью, в остальных случаях – неполной пенетрантностью. Неполная пенетрантность свойственна проявлению генов, связанных с мультифакториальными заболеваниями: болезнь развивается только у части лиц, в генотипе которых присутствует аномальный ген; у остальных же наследственное предрасположение к болезни остаётся нереализованным.
Полиморфизм гена – многообразие нуклеотидных последовательностей гена, в том числе его аллельных форм.
Прогностический – понятие, характеризующее заключение о предстоящем развитии и исходе, основанное на специальном исследовании.
Промотор – участок молекулы ДНК, к которому присоединяются молекулы РНК-полимеразы, что сопровождается инициацией транскрипции соответствующих генов; как правило, промотор расположен на операторном конце оперона; каждый ген (или оперон) имеет свой промотор, контролирующий его транскрипцию.
Рецессивный аллель – аллель, не проявляющийся в фенотипе гетерозиготных особей.
Фенотип – особенности строения и жизнедеятельности организма, обусловленные взаимодействием его генотипа с условиями среды.
Хромосома – составной элемент клеточного ядра, являющийся носителем генов. В основе хромосомы лежит линейная молекула ДНК
Экзон – фрагмент гена, кодирующий аминокислотную последовательность белкового продукта данного гена.
Экспрессия гена – перенос генетической информации от ДНК через РНК к полипептидам и белкам в определенных типах клеток организма.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Поскольку 80%[1] потерь приходятся на первые три месяца беременности, только этих ситуаций мы коснемся в статье. Причины потери беременности после 12 недель – предмет отдельного обсуждения.

Непросто поверить, но риск спонтанного прерывания беременности на сроке 6-12 недель у здоровой женщины моложе 35 лет составляет не менее 10%[2], и повлиять на причины этих событий можно в меньшинстве случаев.
Итак, женщина понимает: ребенка не будет. Одно из первых желаний в такие моменты – узнать причину. И находятся желающие эту потребность удовлетворить: ошарашенной женщине назначают многочисленные обследования и анализы, и редко обходится без тестов на:
Вариантов названий у этой услуги множество. Суть одна: по материалу матери определяют ее генотип по полиморфизмам нескольких генов.

Полиморфизмы – это то, что делает нас разными. Это генетические оттенки, из-за которых один может за милую душу выпить литр молока, а другой после пары глотков будет искать туалет. Благодаря полиморфизмам у нас столько цветов глаз и волос. Из-за них у кого-то кровь сворачивается чуть быстрее среднего, а у кого-то – чуть медленнее. Удивительно, но весь этот спектр форм, цветов и особенностей задается комбинациями четырех букв-нуклеотидов, составляющих наши гены: A, G, T и C. Одну букву мы получаем от мамы, другую – от папы. Так получается наш собственный генотип: например GG, GA или TC. Результатом анализа на полиморфизмы как раз и будут пары букв.
Например, в гене фактора свертывания крови V (этот ген называется F5) буквой под номером 1691 может быть G, а может – А. Отсюда три варианта генотипов: GG, GA и AA. Вариант GG — удел большинства людей, ему не свойственны какие-то особенности. Около 2-7% людей имеют генотип GА, то есть несут полиморфизм А (так называемую Лейденскую мутацию), из-за чего склонны к повышенной свертываемости крови. Людей с генотипом АА крайне мало.
Какие полиморфизмы обычно обсуждаются в контексте потери беременности?
Назовём героев этой статьи поимённо!
Не пугайтесь того, что эти названия вам ни о чем не говорят, и пока что поверьте: они и врачу вашему в большинстве случаев ничего не скажут.
- F5: 1691 G>A (Arg506Gln) NB!
- F2: 20210 G>A NB!
- F7: 10976 G>A (Arg353Gln)
- F13: G>T (Val34Leu)
- FGB: -455 G>A
- ITGA2: 807 C>T (Phe224Phe)
- ITGB3: 1565 T>C (Leu33Pro)
- SERPINE1 (PAI-1): -675 5G>4G
- MTHFR: 677 C>T (Ala222Val)
- MTHFR: 1298 A>C (Glu429Ala)
- MTR: 2756 A>G (Asp919Gly)
- MTRR: 66 A>G (lle22Met)
NB ! Обратите внимание, что эти два полиморфизма могут играть важную роль в принятии решения о назначении КОК (комбинированных оральных контрацептивов).
Почему врачи назначают анализы на эти полиморфизмы?
Когда ученые узнали о существовании полиморфизмов, они задумались: а нельзя ли использовать это знание для выделения группы людей с предрасположенностью к определенным заболеваниям, и заблаговременно их предупреждать? Известно же: предупредить легче, чем лечить!
Вот как рассуждали эти исследователи: уже упоминавшаяся Лейденская мутация связана с повышенной свертываемостью крови. Известно, что формирование и функционирование плаценты сильно зависит от агрегатных свойств крови, а при невынашивании беременности в плацентах нередко находят очаги тромбоза. Логично предположить, что у носительниц Лейденской мутации эти нарушения могут встречаться чаще. Осталось провести исследование и проверить эту гипотезу. Такие исследования были проведены и некоторые показали наличие связи между наличием Лейденской мутации и повышенным риском потери беременности.
Когда результаты научных исследований переносятся в клиническую практику без должной оценки последствий, страдают кошельки и нервы пациентов.
Но достаточно мифов. Дальше — только факты:

1. Полиморфизмы не являются значимой причиной ранней потери беременности
Около 70% беременностей, прервавшихся в первом триместре, не могли развиваться из-за генетических аномалий ЭМБРИОНА (не матери. )[3]. Не путайте с генетическими полиморфизмами!
Полиморфизмы – это генетические особенности мамы, а приводящие к выкидышу нарушения структуры и количества хромосом – это грубые аномалии эмбриона. Возникновение таких эмбрионов – часть жизни, так же, как и их ранняя отбраковка.
Оставшиеся 30% ранних потерь беременности тоже не имеют отношения к полиморфизмам, а обусловлены антифосфолипидным синдромом, неправильным функционированием шейки матки, инфекциями и другими причинами, к которым генетические полиморфизмы матери не относятся.
2. Какие-то полиморфизмы есть у всех людей
В отличие от мутаций, вызывающих редкие генетические болезни, которые встречаются у одного из десятков тысяч людей, какие-то полиморфизмы есть у всех. Каждый день мимо вас проходят люди с такими же GG, GA и TC, как у вас. Возможно, у них есть дети, но может быть и нет. Есть вероятность, что они сталкивались с потерей беременности, а может быть их это несчастье обошло стороной. В любом случае: от вас они отличаются тем, что не тратили деньги на анализ полиморфизмов.
3. Полиморфизмы не определяют признак полностью (или на большую часть)
Например, вероятность развития венозного тромбоза хоть в некоторой степени и зависит от наличия, например, уже знакомой нам Лейденской мутации, но на львиную долю определяется весом, статусом курения, возрастом, наличием беременности, принимаемыми препаратами и другими факторами.
4. Полиморфизм – не болезнь
Пример из жизни:
Но вернемся к цифрам. Увеличение в 3,5…5,5 раз – это существенно? Конечно существенно! Если мне завтра в три с половиной раза увеличат зарплату, это будет ой как существенно…
А если посмотреть не относительный, а абсолютный риск? Когда у вас есть Лейденская мутация, ваш ежегодный риск получить венозную тромбоэмболию равен 0,05…0,2%. Иными словами:
Наличие Лейденской мутации означает,
что с вероятностью 99,95…99,80% у вас
НЕ будет венозной тромбоэмболии (ВТЭ) в течение следующего года
Абсолютный риск ВТЭ настолько мал, что даже увеличение в разы не делает его существенным для жизни отдельного конкретного человека. Беременность в совокупности с Лейденской мутацией повышает риск ВТЭ, но шанс на то, что тромбоза НЕ будет, всё равно не опускается ниже 95%.
И теперь пара слов о лечении:
2. Ни один из полиморфизмов не является прямым поводом для назначения лечения.
3. Курантил, актовегин, тромбоасс, пиявки не нужны.
Они не имеют доказанной эффективности в улучшении исходов беременности у женщин с полиморфизмами в системе свертывания.
И чтобы не оставлять неопределенности:
Анализы на генетические полиморфизмы женщинам, столкнувшимся с потерей беременности один или несколько раз, делать не нужно
[4] Scott M. Stevens et al. Guidance for the evaluation and treatment of hereditary and acquired thrombophilia. J Thromb Thrombolysis (2016) 41:154–164

Обзор
Генные полиморфизмы являются не только источником биоразнообразия и эволюционного материала, но также причиной многих заболеваний человека
Автор
Редакторы

Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Генетическое разнообразие — добро или зло?
Что нового в понимании генетической вариабельности человека и в приложении к персонифицированной медицине дают персональные геномы? Во-первых, открываются новые генетические варианты — в каждом человеческом геноме обнаруживается порядка 3 млн. SNP на 3 млрд. нуклеотидов (это примерный размер генома целиком), что дает уровень различий один нуклеотид на 1000 п.н. Геномы двух разных людей пересекаются примерно по половине SNP. Иногда замена всего одного нуклеотида может стать причиной заболевания, но чаще всего сочетание нескольких генетических полиморфизмов может либо предрасполагать, либо препятствовать проявлению различных заболеваний, и тогда из называют мультифакториальными (МФЗ).

Один ген может иметь много полиморфных вариантов. Большинство замен в них является безвредными (нейтральными). Наиболее часто встречаемый аллель называют нормальным, а редкие варианты — мутантными. Если при конкретном заболевании наблюдается более высокая частота определенного аллельного варианта (неважно — мутантного или нормального), то такой SNP называют ассоциированным с заболеванием, а полиморфный ген — геном-кандидатом предрасположенности к развитию МФЗ. Развитие МФЗ может быть запущено либо одной причиной, либо комбинацией нескольких, которые могут быть чисто генетическими (например, один или несколько аллельных вариантов комплекса генов), либо чисто средовыми (например, химические аллергены, действию которых подвергается работник лакокрасочного завода или парикмахер), либо поведенческими (например, пристрастие к определенной пище), либо социальными или психологическими. При этом индивидуальный вклад каждой причины в проявление болезни может быть незначительным, и только их сумма ведет к развитию заболевания.
Пример МФЗ, к развитию которого приводит только наличие определенных комбинаций аллельных вариантов в генах предрасположенности — невынашивание беременности (НБ) (рис. 2). Сочетание аллельных вариантов с действием факторов среды пока мало изучено, однако на данный момент в мире исследованы SNP более 90 генов, относящихся к генной сети патологии беременности. Большая часть работ посвящена исследованию генов системы детоксикации, фолатного обмена, факторов свертывания крови, HLA-системы, факторов роста, генов антиоксидантной защиты и генов, вовлеченных в воспалительные процессы.

Рисунок 2. Имплантация эмбриона и причины невынашивания. Успех беременности зависит от полноценной имплантации эмбриона в организм матери. Успешная имплантация — результат сложных взаимодействий между гормонально подготовленным эндометрием матки и зрелой бластоцистой. Имплантация бластоцисты в эндометрий включает два этапа: 1) адгезия двух клеточных систем — эндометрия и трофобласта — и 2) децидуализация стромы эндометрия. Затем начинается фаза внедрения трофобласта в стенку эндометрия и активная дифференцировка трофобласта. Активно делящиеся клетки цитотрофобласта, сливаясь, образуют путем эндоредупликации синцитиотрофобласт, напрямую контактирующий с материнской кровеносной системой. В этом процессе активно задействованы все молекулы-участники регуляции и контроля клеточного цикла. Цитотрофобласт внедряется в децидуа и изменяет кровеносные сосуды матери для обеспечения тока крови к плоду: образуются хорион и плацента. Если при формировании плаценты инвазия трофобласта будет недостаточной, то произойдет выкидыш или задержка развития плода [7].
На базе кафедры генетики и НИИ Биологии ЮФУ мы изучали ассоциацию SNP генов, отвечающих за контроль повреждений ДНК, c невынашиванием беременности [5]. Эти гены называются DDR — DNA damage response, — куда относятся гены системы репарации и контроля клеточного цикла, о которых более подробно будет сказано позже.
Большие перемены — результат накопления небольших изменений
Почему именно эти гены были выбраны для исследования? Все объясняется тем, что в начале развития эмбрион должен внедриться в стенку матки. Это ключевой момент для успешного протекания беременности. При этом клетки трофобласта и стромы эндометрия делятся не традиционным образом, а путем эндоредупликации (удвоения хромосом без деления), невозможной без участия белков, контролирующих клеточный цикл и репарацию (рис. 3).

Несмотря на то, что под воздействием неблагоприятных факторов внешней среды, а также во время процесса эндоредупликации происходит огромное количество ошибок, за год в каждой клетке накапливается очень небольшое число стабильных изменений нуклеотидной последовательности. Среди множества случайных замен оснований в ДНК лишь одна на тысячу приводит к возникновению мутации. Все остальные повреждения очень эффективно ликвидируются в процессе репарации ДНК (рис. 4).

Показано, что при различных осложнениях беременности наблюдается повышенный уровень апоптоза в трофобласте [4]. В результате происходит недостаточная подготовка стенок матки к имплантации эмбриона и изменения в маточно-плацентарных артериях, что приводит к снижению кровотока в них. Следствием этого является гипоксия, запускающая механизм окислительного стресса. Гипоксия усиливает апоптоз в трофобласте путем повышения экспрессии ТР53.
Именно поэтому для своих исследований мы выбрали гены системы репарации и контроля клеточного цикла. Исследование генов, контролирующих процесс репарации, — одна из важных задач в раскрытии патогенетических звеньев имплантации эмбриона и децидуализации эндометрия. Знание их роли в патогенезе невынашивания беременности позволяет, с одной стороны, прогнозировать риск развития патологии или тяжесть ее течения, с другой — индивидуально подобрать специфическую терапию для конкретного пациента.
История одного исследования
Участницы нашего исследования были разделены на две группы: женщины с нормально протекавшей беременностью, решившие прервать данную беременность на сроке 6–12 недель, и женщины с НБ. Из тканей матери (периферическая кровь и эндометрий) и плода (хорион, эмбрион) выделяли ДНК и изучали геном испытуемых на наличие аллельных вариантов Asp148Glu, Lys751Gln, 1100delC и Pro72Arg генов APEX1, XPD, CHEK2 и TP53, соответственно. Всё это — гены системы контроля клеточного цикла и репарации ДНК.
Анализ экспрессии этих генов позволил выявить возможные причины и механизмы нарушения процессов эмбриогенеза, приводящих к развитию патологии беременности. В ходе исследования мы обнаружили, что при одновременном наличии полиморфных аллелей изучаемых генов (как в генотипе плода, так и в генотипе матери) достоверно повышается вероятность развития патологии беременности. Большая часть полученных нами отличий в частоте полиморфных аллелей между исследуемыми группами выявлена именно при анализе фетальной ткани (хорион), что говорит о значительном вкладе отцовского генотипа в нормальное развитие беременности.

Рисунок 5. Взаимодействие белков репарации и контроля клеточного цикла. В ответ на повреждение ДНК чекпоинт-киназа активирует опухолевый супрессор, который вызывает остановку клеточного цикла и активирует хеликазу и эндонуклеазу, осуществляющие репарацию.
В результате SNP гена в молекуле его белкового продукта одна аминокислота может быть заменена на другую, что приводит к изменению конформации, размера, заряда и других свойств белка. Часто эти изменения приводят к изменению активности (как в случае с TP53, рис. 6) или потере функции (как в случае с CHEK2, рис. 7).

Рисунок 6. Повышение активности белка опухолевого супрессора TP53 в результате SNP кодирующего его гена. Полиморфизм Pro72Arg белка TP53 расположен в участке, богатом пролином и отвечающем за взаимодействие ингибитором TP53. Ингибитор связывается с Pro-формой гораздо сильнее, чем с Arg-формой, поэтому TP53/Arg72 эффективнее активирует апоптоз, чем исходная форма.

Рисунок 7. Потеря белком киназной функции в результате SNP в кодирующем его гене. Полиморфизм 1100delC гена CHEK2 приводит к экспрессии укороченного киназного домена. Это приводит к тому, что активация белка в ответ на повреждения ДНК становится невозможной (для нее необходимы 387 и 383 остатки треонина, а длина мутантного белка лишь 381 остаток из-за делеции).
При случайном одновременном наличии нескольких аллельных вариантов, продукты генов которых задействованы в выполнении схожих функций, может произойти нарушение работы всего метаболического пути и клетки в целом. Так, полиморфизм Lys751Gln гена XPD нарушает связывание с транскрипционным фактором (ТФ) IIH, действующим на ядерные рецепторы и обеспечивающим контроль активации генов гормонального ответа, необходимый для нормального развития плаценты. Вследствие этого в сыворотке крови матери повышается уровень ХГЧ (хорионического гонадотропина человека) и нарушается функция плаценты. SNP попадает в домен, богатый пролином, необходимый белку для полной индукции апоптоза. В случае неэффективной имплантации эмбриона и возникновения гипоксии будут нарушены механизмы апоптоза. Кроме того, ТР53 не сможет эффективно активировать необходимый для имплантации регулятор LIF и белок р21, запускающий процесс эндоредупликации в эндометрии, а также ХГЧ, участвующий в плацентации посредством стимуляции роста сосудов.
Полиморфные варианты генов системы репарации и контроля клеточного цикла производят менее активные белки репарации и специфические протеинкиназы, что вносит немалый вклад в развитие патологии беременности вследствие несрабатывания механизма корректировки повреждений ДНК, появления геномной нестабильности и запуска апоптоза в материнских и фетальных клетках (клетках плода), что подтвердилось в ходе нашего исследования.
По ту сторону добра и зла
Особенности спектров генетических полиморфизмов в зависимости от географических условий, диеты и этнической принадлежности говорят о невидимой руке естественного отбора. Имеются исследования, в которых было установлено, что частота аллеля Pro гена ТР53 тесно связана с географической широтой и температурой: она гораздо выше в экваториальных популяциях (рис. 8) [6].

Рисунок 8. Предполагаемый механизм отбора полиморфизма гена TP53. Под влиянием более низких температур в популяции отбирается TP53 Arg72 аллель, так как он дает более активную форму TP53, повышающего активность белков SCO2 (участвует в синтезе АТФ) и TIGAR (участвует в регуляции гликолиза и защите от окислительного стресса). TP53 Arg72 аллель участвует в регуляции метаболизма и имплантации эмбриона и повышении уровня приспособленности.
Эти факты особенно интересны в свете нейтральной теории молекулярной эволюции (НТМЭ), которая объясняет происхождение и распределение nSNV, ассоциированных с болезнями. Авторы одного из недавних исследований предполагают, что большинство аллельных вариантов, ассоциированных с заболеваниями, в современных человеческих популяциях изначально были нейтральными, а некоторые из них могли иметь адаптивное значение (например, замена глутамина на валин в одной из цепей гемоглобина — причина серповидно-клеточной анемии). В рамках этой теории nSNV, ассоциированные с МФЗ, имеют равную скорость эволюции с нейтральными nSNV. Это объясняется тем, что на них, в отличие от nSNV, приводящих к развитию моногенных болезней (например, фенилкетонурии), не действует очищающий отбор, элиминирующий заболевших индивидов [3]. Этот подход хорошо объясняет то, что исследуемый нами полиморфизм Asp148Glu гена АРЕХ1 является исключительно нейтральным для функционирования белка — он не теряет своей эндонуклеазной активности [11], — однако нами выявлена достоверная связь между наличием этого SNP в генотипе матери или плода и невынашиванием беременности.
Таким образом, НТМЭ обеспечивает клиническую генетику информативной базой для объективной оценки адаптивных событий человеческой истории как одной из основных причин заболеваний человека.
Заключение
Индивидуальный вклад каждой причины в проявление болезни может быть незначительным, и только их суммы может оказаться достаточно для развития заболевания. Именно поэтому очень сложно определить, какой именно фактор послужил сигналом для запуска патогенеза. С точки зрения индивидуального прогноза здоровья и оценки риска МФЗ каждый персональный геном дает исчерпывающую информацию о носительстве аллелей, связанных с клиническими фенотипами. Ярким примером МФЗ является невынашивание беременности (НБ). Частота невынашивания в первые три месяца беременности может достигать 80%, и, по меньшей мере, половина этих случаев происходит по непонятным причинам.
Молекулярно-генетическая диагностика позволит врачу заглянуть в индивидуальную программу жизни человека, увидеть особенности его организма, предрасположенность к одним заболеваниям и устойчивость к другим. Таким образом, диагностика заболеваний на досимптомном этапе развития [13] позволит своевременно провести адекватную профилактику заболевания (например, невынашивания беременности или сахарного диабета) и назначить индивидуальную, подходящую именно для этого пациента схему лечения.
Существование генных полиморфизмов является результатом действия факторов микроэволюции и вносит вклад в генетическое разнообразие популяции, тем самым обеспечивая их удивительной способностью изменяться в соответствии с бесконечной изменчивостью окружающего мира. Исследование и выявление генных полиморфизмов, вносящих вклад в развитие того или иного заболевания, имеет прямую прогностическую ценность. Именно такой подход к терапии позволит свести к минимуму неблагоприятные эффекты лекарственных препаратов, сохранить пациенту здоровье и даже жизнь.
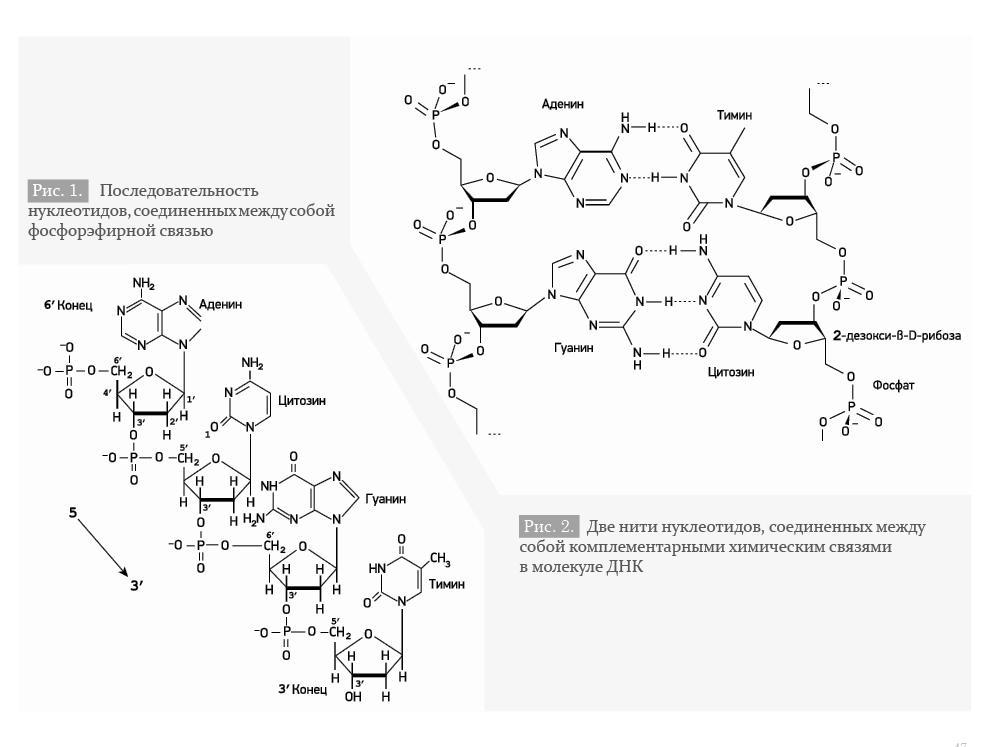
Гены могут подвергаться мутациям – случайным или целенаправленным изменениям последовательности нуклеотидов в цепи ДНК. Мутации могут приводить к изменению последовательности, а следовательно, изменению биологических характеристик белка или РНК, что, в свою очередь, может привести к их общему или локальному изменению или аномальному функционированию. Такие мутации являются патогенными, так как их результатом является заболевание, или летальными на эмбриональном уровне. Однако далеко не все изменения последовательности нуклеотидов приводят к изменению структуры белка или к существенному изменению последовательности и не являются патогенными. В частности, геном человека характеризуется такими особенностями, как однонуклеотидные полиморфизмы и вариации числа копий генов (англ. copynumbervariations), которые составляют около 1% всей ДНК человека [2].
Однонуклеотидный полиморфизм (Single nucleotide polymorphism, SNP) – отличие последовательности ДНК размером в один нуклеотид. Если две последовательности ДНК – AAGCCTA и AAGCTTA – отличаются на один нуклеотид, в таком случае говорят о существовании двух аллелей: C и T. SNP возникают в результате точечных мутаций (как правило, типа замен) и, в частности, определяют различные аллели одного гена.
Разнообразием последовательностей ДНК у людей, возможно, объясняется то, как у них происходит течение различных заболеваний, реакции в ответ на патогены, прием лекарств, вакцин и т. п. Знание об однонуклеотидном полиморфизме, вероятно, поможет в понимании фармакокинетики и фармакодинамики действия различных лекарств на человека. Этиология широкого спектра заболеваний, таких как рак, инфекционные, аутоиммунные заболевания, серповидноклеточная анемия и многие другие, включает однонуклеотидные полиморфизмы [3].
Полиморфизмы генов
Именно полиморфизмы генов в большой степени определяют индивидуальные различия в развитии тех или иных физических и психических качеств индивидума. Масштабы полиморфизмов генов у человека таковы, что между последовательностями ДНК двух людей существуют миллионы различий. Эти различия условно подразделяют на четыре основные категории: а) фенотипически не выраженные; б) вызывающие фенотипические различия; в) играющие роль в патогенезе заболевания (при полигенных болезнях); г) играющие основную роль в развитии заболевания (при моногенных болезнях).
На сегодняшний день сформированы обширные базы полиморфизмов, очень гибкие и быстро растущие.
Они постоянно обновляются за счет информации, которую поставляют в клиники и лаборатории по всему миру научные организации, в которых работает множество специалистов в области системной и молекулярной биологии, биоинформатики.
Вариантные формы некоторых генов в определенных условиях могут привести к развитию болезней. Сочетания вариантных генов предрасположенности несут в себе генетические риски множества заболеваний. Тестирование генетических предрасположенностей помогает выявить индивидуальный риск возможности заболевания и установить подверженность влиянию и воздействию негативных факторов окружающей среды.
По клиническим группам полиморфизмов различают патологии систем свертывания крови, обмена фолиевой кислоты, обмена белков костной ткани, гормонов щитовидной железы, стероидных гормонов и еще десятки других групп полиморфизмов.
В настоящее время в лаборатории CL определяются генетические полиморфизмы генов системы свертывания крови: ген F2 (20210_G>A), ген F5 (1691_G>A), ген F7 (10976_G>A), ген F13 (103_G>Т), ген FGB (455_G>A), ген ITGA 2/интегрин α-2/(807_С>Т), ген ITGВ 3/интегрин β-3/ (1565_Т>С), ген PAI-1 (675_5G>4G). Результат исследования содержит интерпретацию и описание рисков, связанных с тем или иным сочетанием. В ближайшее время планируется значительное расширение спектра определяемых полиморфизмов в CL.
Диагностика полиморфизмов генов в медицинской лаборатории CL
Результаты и интерпретация
Информация о наличии полиморфизмов, знание их влияния на определенные виды обмена и уровень чувствительности к лекарственным препаратам позволяют оценить риск развития заболевания, предупредить его развитие и назначить верное лечение.
Важным фактом является то, что генные полиморфизмы в течение жизни не меняются и определяются один раз! Результаты не изменяются в течение жизни и не зависят от физиологического состояния организма.
Генетическое тестирование позволяет в досимптомный период выявить существующие пока только в геноме наследственные тенденции к развитию болезней и наметить пути их ранней профилактики.
Для врачей важна интерпретация результатов анализа полиморфизмов: необходимо понять, как связан тот или иной полиморфизм с вероятностью развития патологического состояния. Следует учитывать, что ни один полиморфизм не является нозологией как таковой, только ее элементом, но зачастую решающим.
Наличие полиморфизмов можно учесть при назначении лекарственных средств. Так, врач-клиницист, руководствуясь рекомендациями генетика, может изменить концентрацию или дозу препарата, который будет влиять на компонент свертывания крови. Безусловно, важны также режим, диета, физиопроцедуры, но основная роль отведена медикаментозному лечению. А это – область фармакогенетики, которая изучает реакции организма на определенные препараты согласно особенностям генома человека.
Интеграция наук
Материал опубликован в специализированном издании для врачей ProTest, выпуск 2, август 2015 г. При использовании материалов ссылка на журнал обязательна.
Читайте также:

