Обратимая и необратимая диссоциация кратко
Обновлено: 07.07.2024
По способности проводить электрический ток в водном растворе или в расплаве, вещества делятся на электролиты и неэлектролиты.
Электролитами называются вещества, растворы или расплавы которых проводят электрический ток. К электролитам относятся соли, кислоты, основания. В молекулах этих веществ имеются ионные или ковалентные сильно полярные химические связи.
Неэлектролитами называются вещества, растворы или расплавы которых не проводят электрический ток. К неэлектролитам относятся, например, кислород, водород, многие органические вещества (сахар, эфир, бензол и др.). В молекулах этих веществ существуют ковалентные неполярные или малополярные связи.
Для объяснения электропроводности растворов и расплавов солей, кислот и оснований шведский ученый С. Аррениус создал теорию электролитической диссоциации (1887 г.):
1.Молекулы электролитов при растворении или расплавлении распадаются на ионы.
Процесс распада молекул электролитов на ионы в растворе или в расплаве называется электролитической диссоциацией, или ионизацией.
Ионы — это атомы или группы атомов, имеющие положительный или отрицательный заряд.

2.В растворе или расплаве электролитов ионы движутся хаотически. При пропускании через раствор или расплав электрического тока, положительно заряженные ионы движутся к отрицательно заряженному электроду (катоду), а отрицательно заряженные ионы движутся к положительно заряженному электроду (аноду). Поэтому положительные ионы называются катионами, отрицательные ионы — анионами.
К катионам относятся: ион водорода Н + , ион аммония NH4 + , ионы металлов Na + , K + , Fe 2+ , Al 3+ , катионы основных солей CuOH + , Аl(ОН)2 + , FeOH 2+ и т. д.
К анионам относятся: гидроксид-ион ОН — , ионы кислотных остатков Сl — , NO3 — , SO4 2- , Cr2O7 2- , анионы кислых солей НСО3 — , Н2РО4 — , HPO4 2- и т. д.
3.Диссоциация — процесс обратимый. Это значит, что одновременно идут два противоположных процесса: распад молекул на ионы (ионизация, или диссоциация) и соединение ионов в молекулы (ассоциация, или моляризация).
Диссоциацию молекул электролитов выражают уравнениями, в которых вместо знака равенства ставят знак обратимости. В левой части уравнения записывают формулу молекулы электролита, в правой — формулы ионов, которые образуются в процессе электролитической диссоциации. Например:

Каждая молекула нитрата магния диссоциирует на ион магния и два нитрат-иона. Следовательно, в результате диссоциации одной молекулы Mg(NO3)2 образуются три иона.
Общая сумма зарядов катионов равна общей сумме зарядов анионов и противоположна по знаку (так как растворы электролитов электронейтральны).
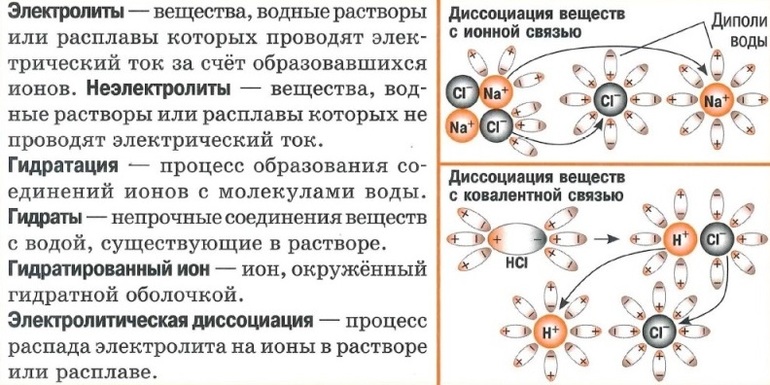
Механизм электролитической диссоциации. Гидратация ионов
Причины и механизм диссоциации электролитов объясняются химической теорией раствора Д. И. Менделеева и природой химической связи. Как известно, электролитами являются вещества с ионной или ковалентной сильно полярной связями. Растворители, в которых происходит диссоциация, состоят из полярных молекул. Например, вода — полярный растворитель. Диссоциация электролитов с ионной и полярной связями протекает различно. Рассмотрим механизм диссоциации электролитов в водных растворах.
I. Механизм диссоциации электролитов с ионной связью
При растворении в воде ионных соединений, например хлорида натрия NaCl, дипольные молекулы воды ориентируются вокруг ионов натрия и хлорид-ионов. При этом положительные полюсы молекул воды притягиваются к хлорид-ионам Сl — , отрицательные полюсы — к положительным ионам Na + .
В результате этого взаимодействия между молекулами растворителя и ионами электролита притяжение между ионами в кристаллической решетке вещества ослабевает. Кристаллическая решетка разрушается, и ионы переходят в раствор. Эти ионы в водном растворе находятся не в свободном состоянии, а связаны с молекулами воды, т. е. являются гидратированными ионами.
Диссоциация ионных соединений в водном растворе протекает полностью. Так диссоциируют соли и щелочи: KCl, LiNO3, Ba(OH)2 и др.
II. Механизм диссоциации электролитов, которые состоят из полярных молекул
При растворении в воде веществ с полярной ковалентной связью происходит взаимодействие дипольных молекул электролита с дипольными молекулами воды. Например, при растворении в воде хлороводорода происходит взаимодействие молекул НСl с молекулами Н2O. Под влиянием этого взаимодействия изменяется характер связи в молекуле HCl: сначала связь становится более полярной, а затем переходит в ионную связь. Результатом процесса является диссоциация электролита и образование в растворе гидратированных ионов.

Так диссоциируют кислородсодержащие и бескислородные кислоты: H2SO4, HNO3, НI и др. Диссоциация электролитов с полярной связью может быть полной или частичной. Это зависит от полярности связей в молекулах электролитов.
Таким образом, главной причиной диссоциации в водных растворах является гидратация ионов. В растворах электролитов все ионы находятся в гидратированном состоянии. Например, ионы водорода соединяются с молекулой воды и образуют ионы гидроксония Н3O+ по донорно-акцепторному механизму:

Для простоты в химических уравнениях ионы изображают без молекул воды: Н + , Ag + , Mg 2 + , F — , SO4 2- и т. д.
Свойства ионов
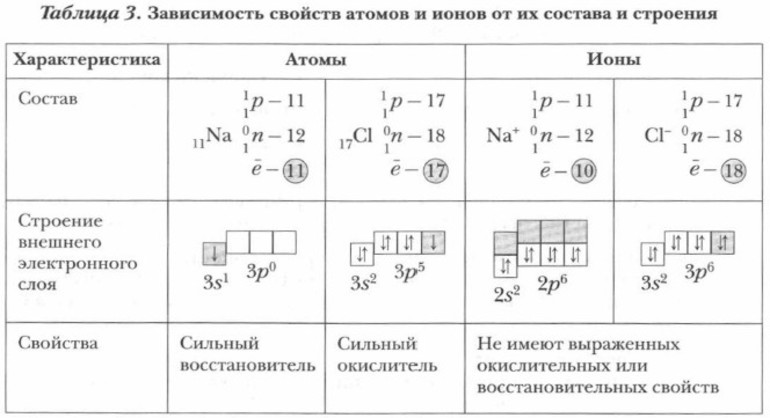
Ионы по физическим, химическим и физиологическим свойствам отличаются от нейтральных атомов, из которых они образовались. Например, ионы натрия Na + и хлорид-ионы Сl — не взаимодействуют с водой, не имеют цвета, запаха, неядовиты.
Атомы натрия Na 0 энергично взаимодействуют с водой. Вещество хлор C12 в свободном состоянии — газ желто-зеленого цвета, ядовит, сильный окислитель.
Различные свойства атомов и ионов одного и того же элемента объясняются разным электронным строением этих частиц. Химические свойства свободных атомов металлов определяются валентными электронами, которые атомы металлов легко отдают и переходят в положительно заряженные ионы. Атомы неметаллов легко присоединяют электроны и переходят в отрицательно заряженные ионы. Ионы находятся в более устойчивых электронных состояниях, чем атомы.
Ионы имеют различную окраску. Гидратированные и негидратированные ионы s- и р-элементов обычно бесцветны. Так, бесцветны ионы Н + , Na + , K + , Ва 2 + , Аl 3+ и др. Ионы некоторых d-элементов имеют окраску. Окраска гидратированных и негидратированных ионов одного и того же d-элемента может быть различной. Например, негидратированные ионы Cu 2+ — бесцветные, а гидратированные ионы меди Cu 2+ • 4Н2О — синего цвета
Степень диссоциации
В водных растворах некоторые электролиты полностью распадаются на ионы. Другие электролиты распадаются на ионы частично, часть их молекул остается в растворе в недиссоциированном виде.
Число, показывающее, какая часть молекул распалась на ионы, называется степенью электролитической диссоциации (степенью ионизации).
Степень электролитической диссоциации (α) равна отношению числа молекул, которые распались на ионы, к общему числу молекул в растворе:

где n — число молекул, распавшихся на ионы; N — общее число растворенных молекул.
Например, степень диссоциации (α) уксусной кислоты СН3СООН в 0,1 М растворе равна 1,36%. Это означает, что из 10000 молекул СН3СООН 136 молекул распадаются на ионы по уравнению:
Степень диссоциации зависит от природы растворителя и природы растворяемого вещества, концентрации раствора, температуры и других факторов.
Различные вещества диссоциируют в разной степени. Например, муравьиной кислоты НСООН при одинаковых условиях больше α уксусной кислоты СН3СООН.
При уменьшении концентрации электролита, т. е. при разбавлении раствора, степень диссоциации увеличивается, так как увеличиваются расстояния между ионами в растворе и уменьшается возможность соединения их в молекулы.
При повышении температуры степень диссоциации, как правило, увеличивается.
В зависимости от степени диссоциации электролиты делятся на сильные и слабые.
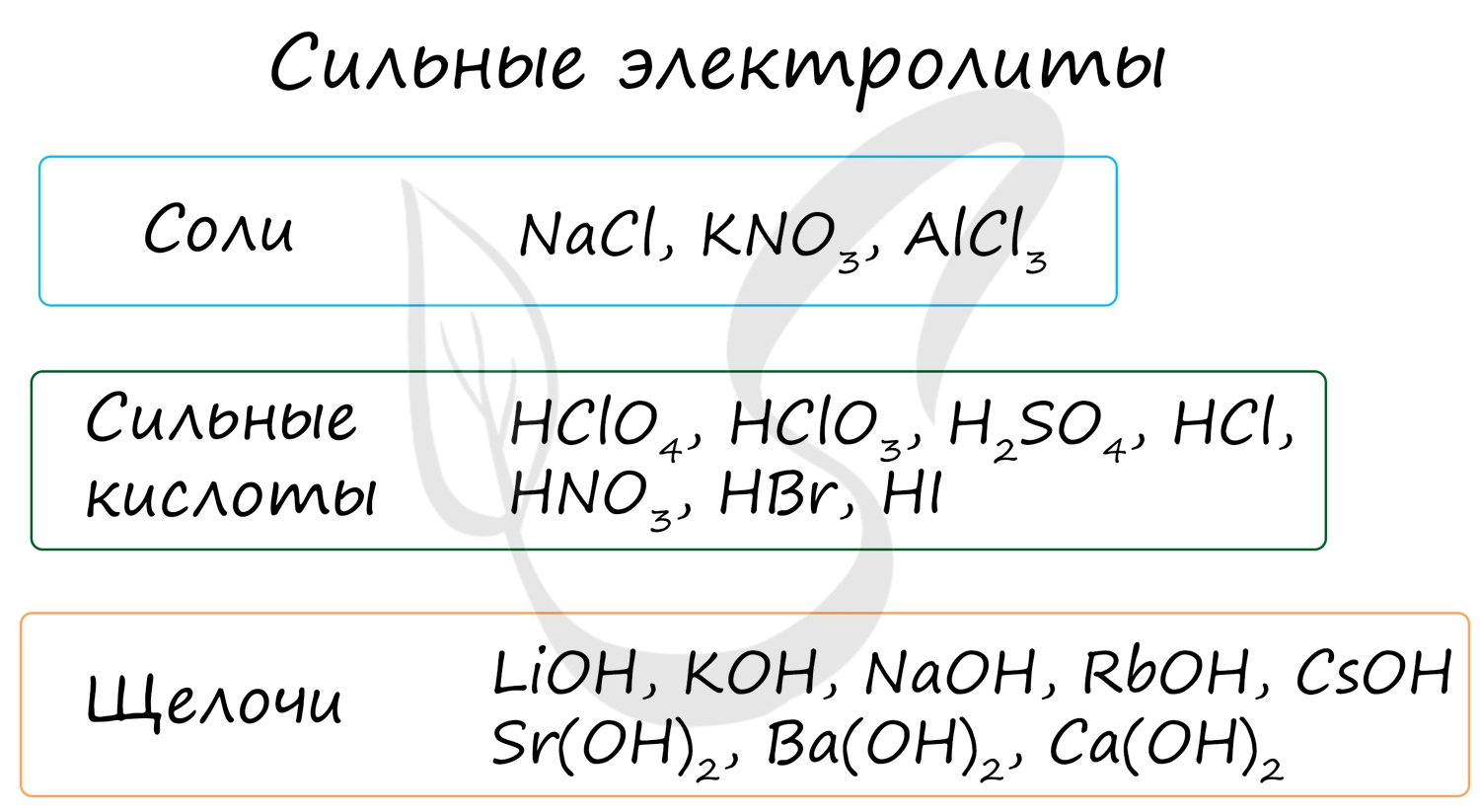
Сильные электролиты — это такие электролиты, которые в водных растворах полностью диссоциируют на ионы, т. е. их степень диссоциации равна 1 (100%). К сильным электролитам относятся: 1) соли; 2) сильные кислоты (HClO4, НСlO3, НNО3, H2SO4, HCl, НВr, HI и др.); 3) щелочи (LiОН, NaOH, КОН, RbOH, СsОН, Ca(OH)2, Sr(OH)2, Ba(OH)2.
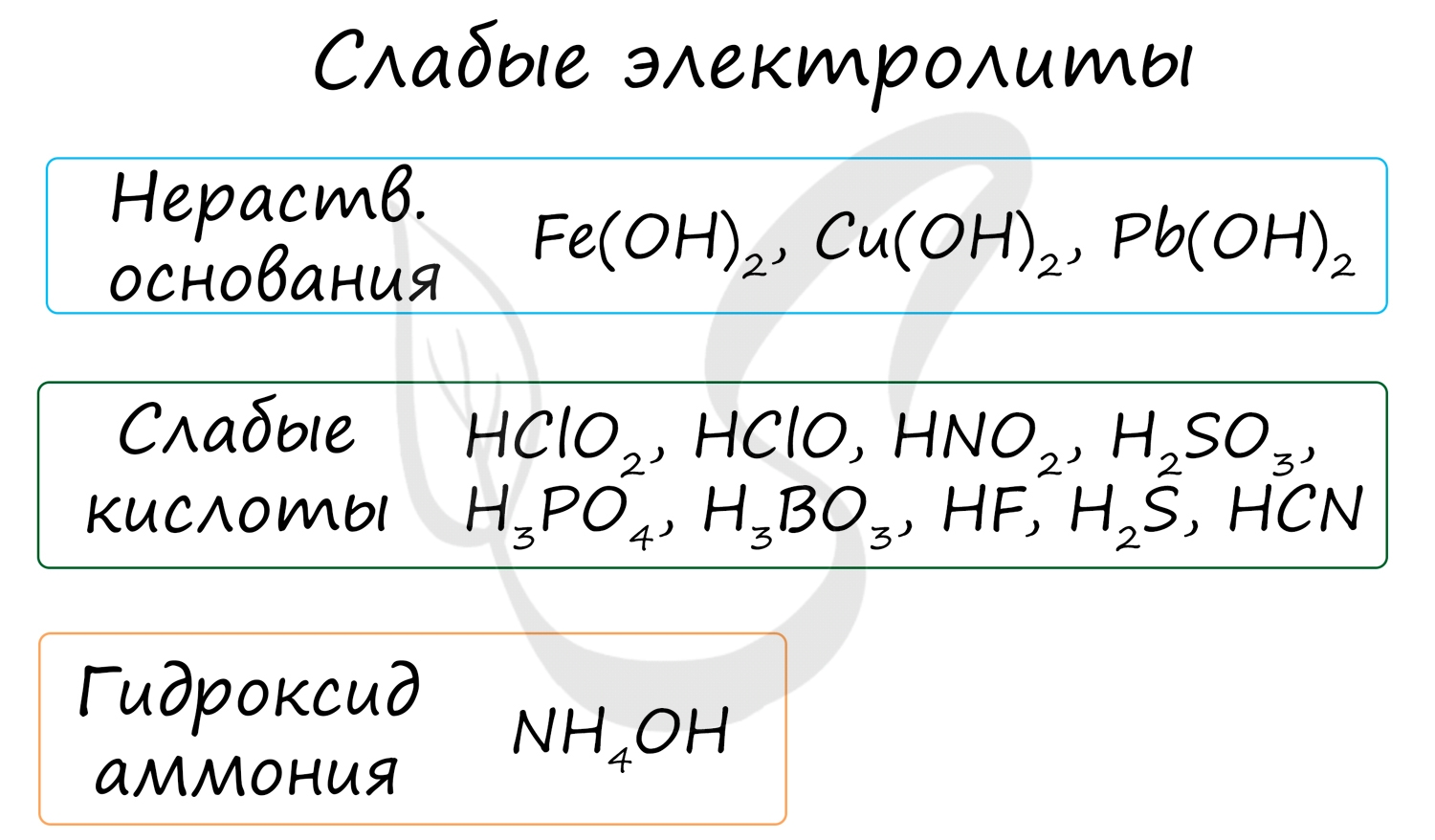
Слабые электролиты — это такие электролиты, которые в водных растворах не полностью диссоциируют на ионы, т. е. их степень диссоциации меньше 1 (100%). К слабым электролитам относятся: 1) слабые кислоты (НСlO2, HClO, HNO2, H2SO3, Н2СO3, H2SiO3, Н3РО4, H3РО3, H3BO3, СН3СООН, Н2S, HCN, HF и др.); 2) слабые нерастворимые в воде основания Fe(OH)2, Pb(OH)2, Cu(OH)2 и др.); 3) гидроксид аммония (NH4OH); 4) вода (Н2О).
Константа диссоциации (ионизации)

Для характеристики слабых электролитов применяют константу диссоциации (Kд). Вследствие того, что слабые электролиты диссоциируют на ионы не полностью, в их растворах устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. Для слабого электролита общей формулы АnВm уравнение диссоциации имеет вид:
Применяя закон действующих масс, запишем выражение константы равновесия:

где [А m + ], [B n — ] — равновесные концентрации ионов А m + и B n — , [АnВm] — равновесная концентрация недиссоциированных молекул АnВm.
Константу равновесия в этом случае называют константой диссоциации (Kд), или константой ионизации.
Константа ионизации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем легче электролит распадается на ионы, тем больше ионов в его растворе, тем сильнее электролит. Например:

Следовательно, уксусная кислота СН3СООН более сильный электролит, чем циановодородная кислота HCN.
Для слабого электролита константа диссоциации — постоянная величина при данной температуре, которая не зависит от концентрации раствора. Константа диссоциации зависит от природы электролита, природы растворителя и температуры. Константы диссоциации некоторых слабых электролитов приведены в таблице.

Значение электролитов для живых организмов
Электролиты являются составной частью жидкостей и плотных тканей живых организмов. Ионы натрия Na + , калия K + , кальция Са 2+ , магния Mg 2+ , водорода Н + , анионы ОН — , Сl — , SO4 2- , НСО3 — имеют большое значение для физиологических и биохимических процессов. Концентрации различных ионов в организме человека различны. Концентрации ионов водорода Н+ и гидроксид-ионов ОН — очень малы, но они играют большую роль в жизненных процессах. Ионы водорода Н + способствуют нормальному функционированию ферментов, обмену веществ, перевариванию пищи и т.д. Концентрации ионов натрия Na + и хлорид-ионов Cl — в организме человека весьма значительны. Эти ионы человек получает ежедневно, используя в пищу поваренную соль NaCl. В медицине применяется 0,85%-ный раствор хлорида натрия в качестве физиологического раствора при большой потере жидкости организмом.
Известно, что существуют две основные причины прохождения электрического тока через проводники: либо за счёт движения электронов в электрическом поле, либо за счет движения ионов. Электрическая проводимость присуща, прежде всего, металлам. Ионная проводимость присуща многим химическим соединения, обладающим ионным строением, например, солям в твёрдом или расплавленном состояниях, а также многим водным и неводным растворам. В связи с этим все вещества принято условно делить на две категории:
а) вещества, растворы которых обладают ионной проводимостью, называются электролитами;
б) вещества, растворы которых не обладают ионной проводимостью, называются неэлектролитами.
К электролитам относится большинство неорганических кислот, оснований и солей. К неэлектролитам относятся многие органические соединения, например, спирты, углеводы.
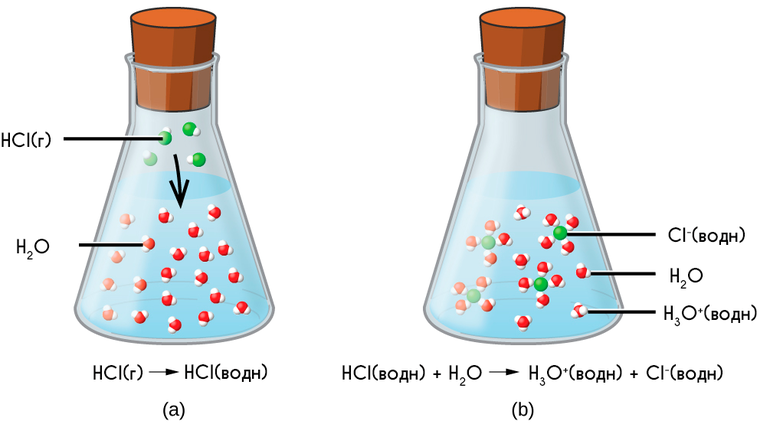
Оказалось, что, кроме хорошей электропроводности, растворы электролитов обладают более низкими значениями давлениями пара растворителя и температуры плавления и более высокими температурами кипения по сравнению с соответствующими значениями для чистого растворителя или для раствора неэлектролита в этом же растворителе. Для объяснения этих свойств, шведский ученый С. Аррениус в 1887 г. предложил теорию электролитической диссоциации.
Под электролитической диссоциацией понимается распад молекул электролита в растворе с образованием положительно и отрицательно заряженных ионов - катионов и анионов под действием растворителя. Например, молекула уксусной кислоты может диссоциировать в водном растворе следующим образом:
Сущность теории электролитической диссоциации С. Аррениуса
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы: положительные (катионы) и отрицательные (анионы).
2. Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу источника тока - катоду, и поэтому называются катионами, а отрицательно заряженные ионы движутся к положительному полюсу источника тока - аноду, и поэтому называются анионами.
3. Электролитическая диссоциация - процесс обратимый для слабых электролитов, т. е. вместе с распадом молекул на ионы (диссоциация) идет процесс соединения ионов в молекулы (ассоциация).
Электролиты подразделяются в зависимости от степени диссоциации на сильные и слабые.
вещества, которые диссоциируют полностью и необратимо, т. е. в растворе присутствуют только гидратиро-ванные ионы. Относятся все соли, сильные кислоты `"HI"`, `"HCl"`, `"HBr"`, `"HNO"_3`, `"H"_2"SO"_4`, `"HMnO"_4`, `"HClO"_4`, `"HClO"_3`, щелочи `"NaOH"`, `"LiOH"`, `"KOH"`, `"RbOH"`, `"CsOH"`, `"Ca"("OH")_2`, `"Ba"("OH")_2`, `"Sr"("OH")_2`.
С точки зрения теории электролитической диссоциации, кислотой называется соединение, образующее при диссоциации в водном растворе только ионы `"H"^+`:
Если кислота является двухосновной, то диссоциация кислоты происходит ступенчато. Количество стадий определяется основностью кислоты:
Сила бескислородных кислот возрастает в ряду однотипных соединений при переходе вниз по подгруппе кислотообразующего элемента: `"HCl"-"HBr"-"HI"`. Бромоводородная кислота `"HBr"` и йодоводородная `"HI"` кислоты сильнее хлороводородной, что объясняется увеличением межъядерных расстояний в их молекулах.
Фтороводородная (плавиковая) кислота `"HF"` растворяет стекло, но это вовсе не говорит о её силе. В ряду бескислородных галогенсодержащих кислот она относится к кислотам средней силы ввиду низкой концентрации в растворе ионов водорода из-за способности молекул `"HF"` к объединению (ассоциации), благодаря сильным водородным связям, возникающим при взаимодействии ионов `"F"^-` с молекулами `"HF"` (водородные связи) с образованием ионов `"HF"_2^-`, `"H"_2"F"_3^-` и других боле сложных частиц. В результате концентрация ионов водорода в водном растворе фтороводородной кислоты оказывается сильно пониженной.
Сила однотипных кислородных кислот изменяется в противоположном направлении, например, йодная кислота `"HIO"_4` слабее хлорной кислоты `"HClO"_4`. Если элемент образует несколько кислородных кислот, то наибольшей силой обладает кислота, в которой кислотообразующий элемент имеет самую высокую валентность.
Так, в ряду кислот `"HClO"-"HClO"_2-"HClO"_3-"HClO"_4` хлорная кислота наиболее сильная.
Схематически процесс распада (диссоциации) соляной кислоты на ионы можно представить следующим образом. Чтобы вещество в воде было электролитом, его молекула должна быть полярной.
Полярная молекула вещества окружена полярными молекулами воды, которые разрывают молекулу на две противоположно заряженные частицы – ионы.
с точки зрения теории электролитической диссоциации, представляет собой вещество, способное отдавать в растворе гидроксильную группу `"OH"^-`:
Диссоциация многокислотного гидроксида происходит ступенчато, например:
В свете теории электролитической диссоциации соли представляют собой соединения, образующие в водном растворе положительно заряженные ионы металла и отрицательно заряженные ионы кислотного остатка (для средних солей), а также кроме них ионы водорода (для кислых солей) и гидроксид-ионы (для основных солей):
вещества, которые диссоциируют частично и обратимо.
В растворе слабого электролита присутствуют гидратированные ионы и некоторая часть недиссоциированных молекул.
К слабым электролитам относятся:
3) оставшиеся кислоты, не относящиеся к сильным, например, `"HF"`, `"H"_2"S"`, `"HNO"_2`, `"H"_3"PO"_4` и другие, а также незамещённые органические кислоты. При растворении углекислого газа в воде образуется его гидрат `"CO"_2*"H"_2"O"` и в незначительном количестве угольная кислота `"H"_2"CO"_3`. Тем не менее, для диссоциации воспользуемся формулой угольной кислоты:
Практически диссоциация осуществляется лишь по первой ступени. Образующийся гидрокарбонат-ион `"HCO"_3^-` ведёт себя как слабый электролит.
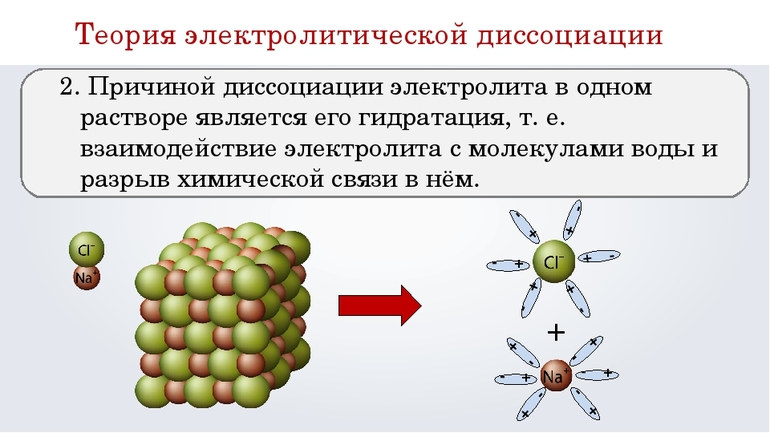
Причиной диссоциации электролита в водных растворах является его гидратация, т. е. взаимодействие электролита с молекулами воды и разрыв химической связи в нем. В результате такого взаимодействия образуются гидратированные, т. е. связанные с молекулами воды, ионы.
Диссоциации проходит благодаря тому, что при гидратации ионов выделяется больше энергии, чем требуется на разрыв связи в молекуле. Примерно также происходит растворение ионного кристалла в воде и образование ионов. У кристаллов энергия гидратации ионов выше энергии кристаллической решётки.
Следует учитывать, что в растворах электролитов хаотически движущиеся гидратированные ионы могут столкнуться и вновь объединиться между собой. Этот обратный процесс называется ассоциацией. При некоторой постоянной температуре в данной системе устанавливается химическое равновесие, при котором скорость диссоциации станет равной скорости ассоциации.
Также необходимо учитывать, что свойства гидратированных ионов отличаются от свойств негидратированных ионов. Например, негидратированный ион меди `"Cu"^(2+)` - белый в безводных кристаллах сульфата меди (II) `"СuSO"_4` и имеет голубой цвет, когда гидратирован, т. е. связан с молекулами воды `"Cu"^(2+)*"H"_2"O"`. Гидратированные ионы имеют как постоянное, так и переменное количество молекул воды.
Основные свойства гидроксидов одного и того же элемента усиливаются с уменьшением его валентности. Так, основные свойства у гидроксида железа (II) выражены сильнее, чем у гидроксида железа (III) и наоборот.
Слабым электролитом является гидроксид аммония `"NH"_4"OH"`. При растворении аммиака `"NH"_3` в воде образуется раствор, который слабо проводит электрический ток и имеет горько-мыльный вкус. Среда раствора основная. В растворе образуются гидрат аммиака `"NH"_3*"H"_2"O"` и в незначительном количестве гидроксид аммония `"NH"_4"OH"`, который диссоциирует как слабый электролит с образованием ионов аммония `"NH"_4^+` и гидроксид-иона `"OH"^-`.
К слабым электролитам относят некоторые соли, например хлорид цинка `"ZnCl"_2`, тиоцианат железа `"Fe"("NCS")_3`, цианид ртути `"Hg"("CN")_2`, которые также диссоциируют по ступеням.
Разделение электролитов на сильные, средние и слабые зависит от доли продиссоциированных молекул или степени диссоциации `alpha`, которая показывает отношение числа молекул, распавшихся на ионы `(N_"д")`, к общему числу введённых в раствор молекул `(N_"р")`:
Электролиты со степенью диссоциации `30%` и более называют сильными, со степенью диссоциации `3`-`30%` называют средними (средней силы), со степенью диссоциации менее `3%` - слабыми.
Степень диссоциации не является строгим показателем силы электролита, т. к. она зависит от концентрации раствора, природы растворителя, присутствия в растворе другие электролитов.
При понижении концентрации степень диссоциации может повышаться, и в очень разбавленных растворах слабый электролит может находиться в состоянии почти полной диссоциации, в то же время в концентрированном растворе сильный электролит может вести себя как слабый и даже как неэлектролит.
Степень диссоциации как сильных, так и слабых электролитов зависит от концентрации раствора (степень диссоциации тем выше, чем более разбавлен раствор). Более точной характеристикой диссоциации электролита является константа диссоциации, которая от концентрации раствора не зависит.
Выражение для константы диссоциации можно получить, если записать уравнение реакции диссоциации электролита АК в общем виде:
Поскольку диссоциация слабого электролита является обратимым равновесным процессом, то к данной реакции применим закон действующих масс, и можно определить константу равновесия как
где `K_"дис"` - константа диссоциации, которая зависит от температуры и природы электролита и растворителя, но не зависит от концентрации электролита;
`[AK]` – концентрация недиссоцированных молекул;
`[A^-]`, `[K^+]` - молярные концентрации анионов и катионов.
Рассчитайте количество ионов водорода в `1` л раствора серной кислоты с концентрацией `0,1` моль/л.
`0,1` моль `0,1` моль
Количество ионов водорода равно `0,1` моль.
Запишем уравнение диссоциации по второй ступени и по справочным данным определим степень диссоциации (`0,3`):
| $$ <\mathrm | `"H"^+ +"SO"_4^(2-)`. |
| `0,1` моль | `0,03` моль |
Используем формулу для нахождения степени диссоциации (при решении задачи степень диссоциации удобно выразить в долях от единицы):
`n("диссоцH"_2"SO"_4)=0,1` моль/л `*0,3=0,03` моль.
Таким образом, в растворе появилось ионов `"H"^+` :
`0,1` моль `+ 0,03` моль `= 0,13` моль.
Следовательно, концентрация ионов водорода в растворе серной кислоты равна `0,13` моль/л.
Степень диссоциации гидроксида бария по первой ступени `- 92%`, по второй ступени `- 56%`. Рассчитайте число катионов бария и число гидроксид-ионов в `0,5` л `1,5 M` растворе.
1) Запишем уравнение электролитической диссоциации гидроксида бария:
1 ступень: `"Ba(OH")_2-> "BaOH"^+ + "OH"^-`,
2) Найдём количество вещества гидроксида бария, содержащегося в данном образце раствора:
3) Зная степень диссоциации вычислим число молекул `"Ba(OH")_2` распавшихся на ионы по первой ступени диссоциации:
Согласно диссоциации по `"I"` ступени, это количество вещества равно количеству вещества гидроксид-ионов, образовавшихся по первой ступени диссоциации, и количество ионов `"Ba(OH")^+`:
4) Исходя из количества вещества гидроксокатионов бария, образовавшихся на первой стадии диссоциации, и степени диссоциации по второй ступени, вычислим количество ионов `"Ba"("OH")^+`, диссоциирующих по второй ступени:
В соответствии с диссоциацией по `"II"` ступени, это количество вещества равно количеству вещества катионов `"Ba"^(2+)` и количеству ионов `"OH"^-`, образовавшихся по `"II"` ступени диссоциации:
5) Найдём число катионов `"Ba"^(2+)`, образующихся при диссоциации:
6) Вычислим количество вещества гидроксид-ионов, образовавшихся на обеих стадиях диссоциации, и их число:

Электролиты – это вещества, растворы и расплавы которых проводят электрический ток.
Электрический ток – это упорядоченное движение заряженных частиц под действием электрического поля. Таким образом, в растворах или расплавах электролитов есть заряженные частицы. В растворах электролитов, как правило, электрическая проводимость обусловлена наличием ионов.
Ионы – это заряженные частицы (атомы или группы атомов). Разделяют положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Электролитическая диссоциация — это процесс распада электролита на ионы при его растворении или плавлении.
Разделяют вещества — электролиты и неэлектролиты. К неэлектролитам относятся вещества с прочной ковалентной неполярной связью (простые вещества), все оксиды (которые химически не взаимодействуют с водой), большинство органических веществ (кроме полярных соединений — карбоновых кислот, их солей, фенолов) — альдегиды, кетоны, углеводороды, углеводы.
К электролитам относят некоторые вещества с ковалентной полярной связью и вещества с ионной кристаллической решеткой.
В чем же суть процесса электролитической диссоциации?
Поместим в пробирку несколько кристаллов хлорида натрия и добавим воду. Через некоторое время кристаллы растворятся. Что произошло?
Хлорид натрия – вещество с ионной кристаллической решеткой. Кристалл NaCl состоит из ионов Na + и Cl — . В воде этот кристалл распадается на структурные единицы-ионы. При этом распадаются ионные химические связи и некоторые водородные связи между молекулами воды. Попавшие в воду ионы Na + и Cl — вступают во взаимодействие с молекулами воды. В случае хлорид-ионов можно говорить про электростатическое притяжение дипольных (полярных) молекул воды к аниону хлора, а в случае катионов натрия оно приближается по своей природе к донорно-акцепторному (когда электронная пара атома кислорода помещается на вакантные орбитали иона натрия). Окруженные молекулами воды ионы покрываются гидратной оболочкой. Диссоциация хлорида натрия описывается уравнением:
NaCl = Na + + Cl –

При растворении в воде соединений с ковалентной полярной связью, молекулы воды, окружив полярную молекулу, сначала растягивают связь в ней, увеличивая её полярность, затем разрывают её на ионы, которые гидратируются и равномерно распределяются в растворе. Например, соляная ксилота диссоциирует на ионы так: HCl = H + + Cl — .

При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Процесс электролитической диссоциации характеризуется величиной степени диссоциации молекул вещества:
Степень диссоциации — это отношение числа продиссоциировавших (распавшихся) молекул к общему числу молекул электролита. Т.е., какая доля молекул исходного вещества распадается в растворе или расплаве на ионы.
Nпродисс — это число продиссоциировавших молекул,
Nисх — это исходное число молекул.
По степени диссоциации электролиты делят на делят на сильные и слабые.
Сильные электролиты (α≈1):
1. Все растворимые соли (в том числе соли органических кислот — ацетат калия CH3COOK, формиат натрия HCOONa и др.)
2. Сильные кислоты: HCl, HI, HBr, HNO3, H2SO4 (по первой ступени), HClO4 и др.;
3. Щелочи: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2.
Сильные электролиты распадаются на ионы практически полностью в водных растворах, но только в ненасыщенных. В насыщенных растворах даже сильные электролиты могут распадаться только частично. Т.е. степень диссоциации сильных электролитов α приблизительно равна 1 только для ненасыщенных растворов веществ. В насыщенных или концентрированны растворах степень диссоциации сильных электролитов может быть меньше или равна 1: α≤1.
Слабые электролиты (α
1. Слабые кислоты, в т.ч. органические;
2. Нерастворимые основания и гидроксид аммония NH4OH;
3. Нерастворимые и некоторые малорастворимые соли (в зависимости от растворимости).
Неэлектролиты:
1. Оксиды, не взаимодействующие с водой (взаимодействующие с водой оксиды при растворении в воде вступают в химическую реакцию с образованием гидроксидов);
2. Простые вещества;
3. Большинство органических веществ со слабополярными или неполярными связями (альдегиды, кетоны, углеводороды и т.д.).

Как диссоциируют вещества? По степени диссоциации различают сильные и слабые электролиты.
Сильные электролиты диссоциируют полностью (в насыщенных растворах), в одну ступень, все молекулы распадаются на ионы, практически необратимо. Обратите внимание — при диссоциации в растворе образуются только устойчивые ионы. Самые распространенные ионы можно найти в таблице растворимости — это ваша официальная шпаргалка на любом экзамене. Степень диссоциации сильных электролитов примерно равна 1. Например, при диссоциации фосфата натрия образуются ионы Na + и PO4 3– :
Диссоциация слабых электролитов : многоосновных кислот и многокислотных оснований происходит ступенчато и обратимо. Т.е. при диссоциации слабых электролитов распадается на ионы только очень небольшая часть исходных частиц. Например, угольная кислота:
HCO3 – ↔ H + + CO3 2–
Гидроксид магния диссоциирует также в 2 ступени:
Mg(OH)2 ⇄ Mg(OH) + OH –
Mg(OH) + ⇄ Mg 2+ + OH –
Кислые соли диссоциируют также ступенчато, сначала разрываются ионные связи, затем — ковалентные полярные. Например, гидрокабонат калия и гидроксохлорид магния:
KHCO3 ⇄ K + + HCO3 – (α=1)
HCO3 – ⇄ H + + CO3 2– (α + + Cl – (α=1)
MgOH + ⇄ Mg 2+ + OH – (α 1. При растворении в воде электролиты диссоциируют (распадаются) на ионы.
2. Причина диссоциации электролиты в воде – это его гидратация, т.е. взаимодействие с молекулами воды и разрыв химической связи в нем.
3. Под действием внешнего электрического поля положительно заряженные ионы двигаюися к положительно заряженному электроду — катоду, их называют катионами. Отрицательно заряженные электроны двигаются к отрицательному электроду – аноду. Их называют анионами.
4. Электролитическая диссоциация происходит обратимо для слабых электролитов, и практически необратимо для сильных электролитов.
5. Электролиты могут в разной степени диссоциировать на ионы — в зависимости от внешних условий, концентрации и природы электролита.
6. Химические свойства ионов отличаются от свойств простых веществ. Химические свойства растворов электролитов определяются свойствами тех ионов, которые из него образуются при диссоциации.
Примеры .
1. При неполной диссоциации 1 моль соли общее количество положительных и отрицательных ионов в растворе составило 3,4 моль. Формула соли – а) K2S б) Ba(ClO3)2 в) NH4NO3 г) Fe(NO3)3
Решение: для начала определим силу электролитов. Это легко можно сделать по таблице растворимости. Все соли, приведенные в ответах — растворимые, т.е. сильные электролиты. Далее, запишем уравнения электролитической диссоциации и по уравнению определим максимально число ионов в каждом растворе:
а) K2S ⇄ 2K + + S 2– , при полном распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не получится никак;
б) Ba(ClO3)2 ⇄ Ba 2+ + 2ClO3 – , опять при распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не образуется никак;
в) NH4NO3 ⇄ NH4 + + NO3 – , при распаде 1 моль нитрата аммония образуется 2 моль ионов максимально, больше 2 моль ионов не образуется никак;
г) Fe(NO3)3 ⇄ Fe 3+ + 3NO3 – , при полном распаде 1 моль нитрата железа (III) образуется 4 моль ионов. Следовательно, при неполном распаде 1 моль нитрата железа возможно образование меньшего числа ионов (неполный распад возможен в насыщенном растворе соли). Следовательно, вариант 4 нам подходит.
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A - (анион)
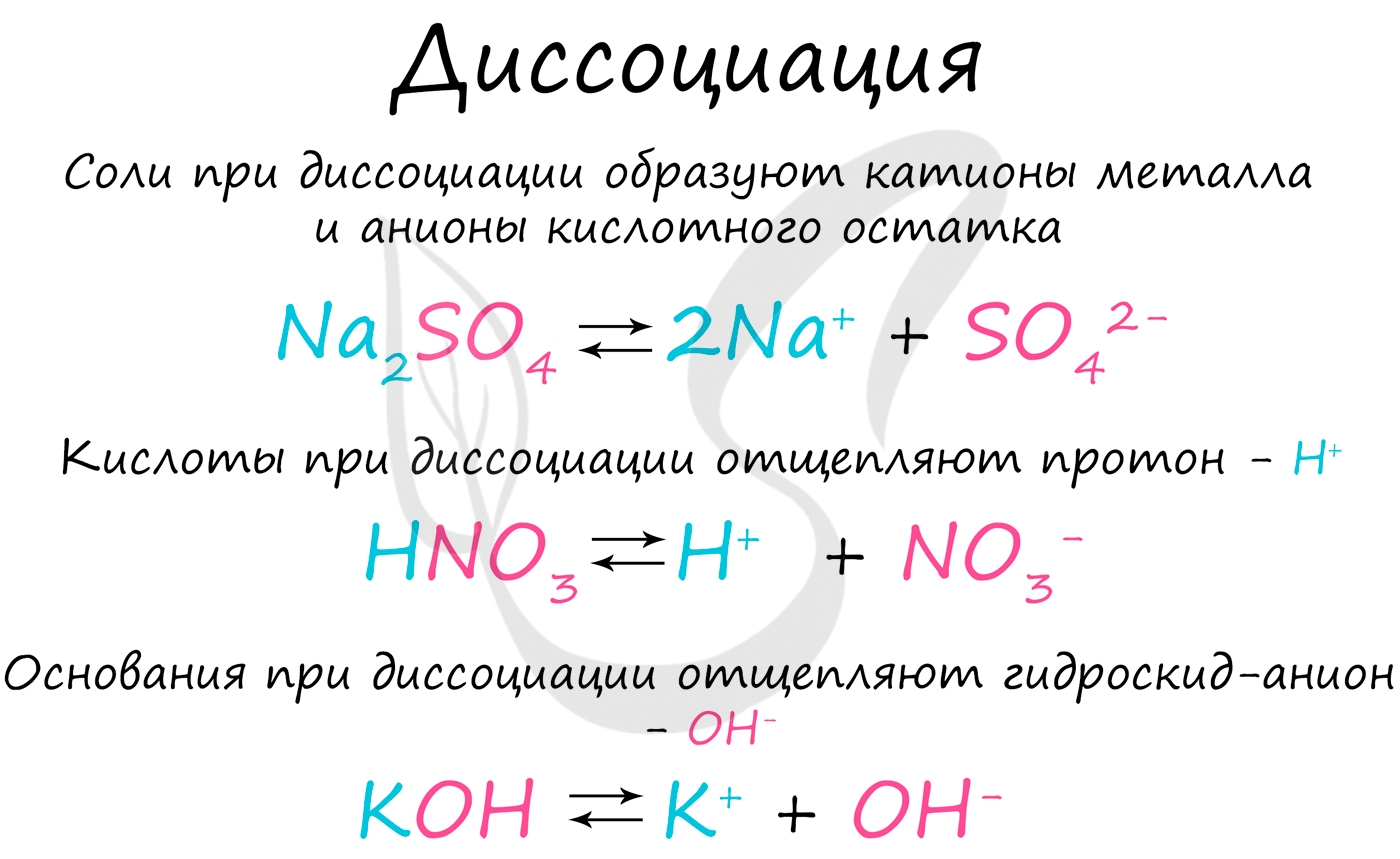
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
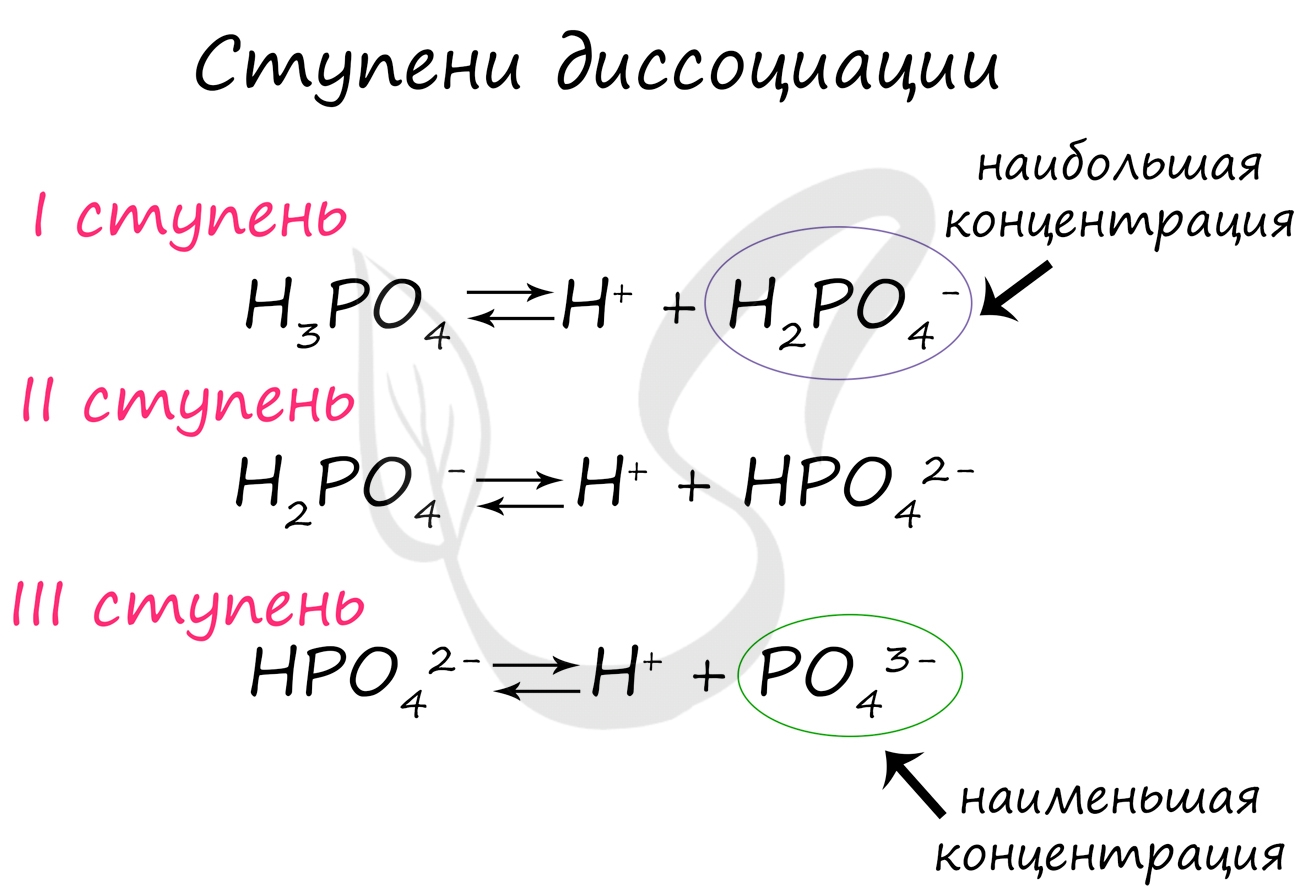
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
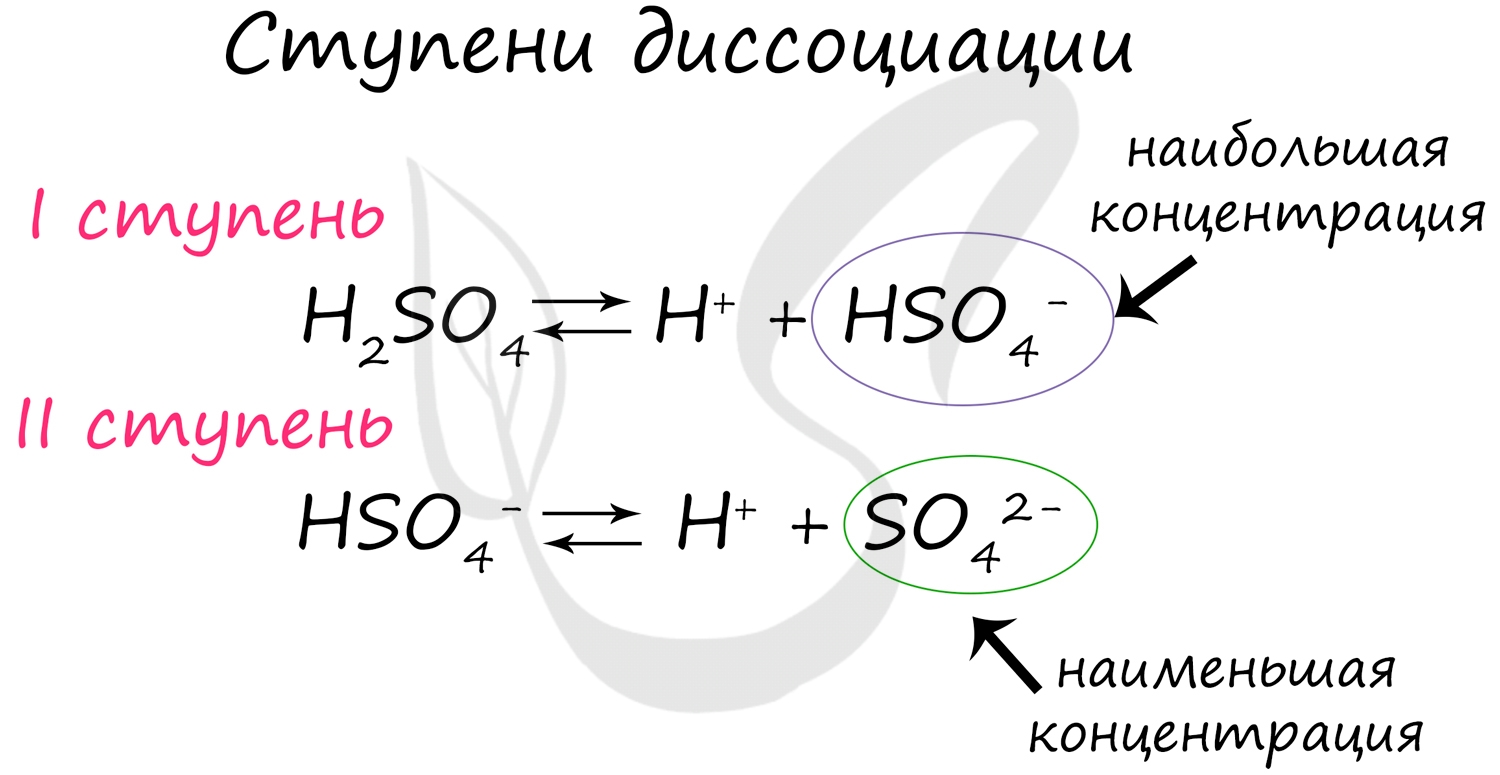
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.

Электролиты - жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
Неэлектролиты - вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
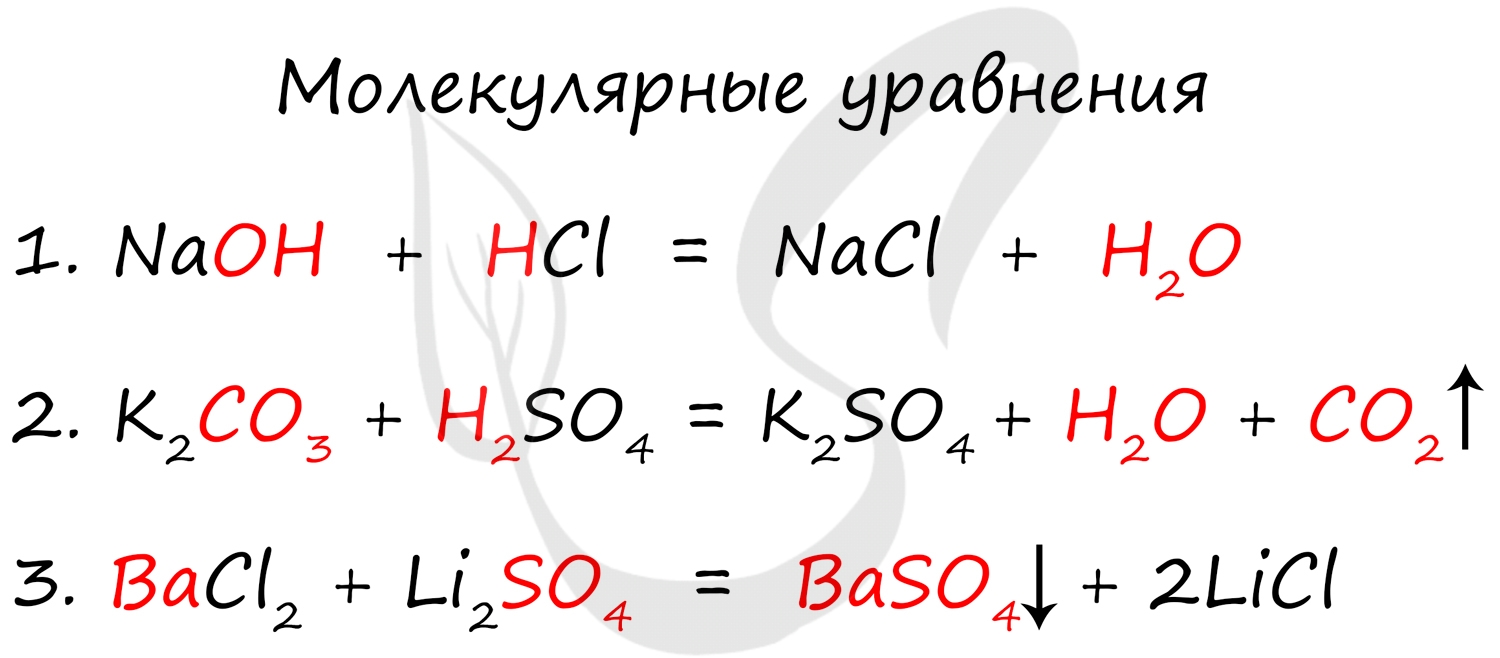
- Слабые электролиты (в их числе вода)
- Осадки
- Газы

Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике - остается только то, что сократить нельзя.
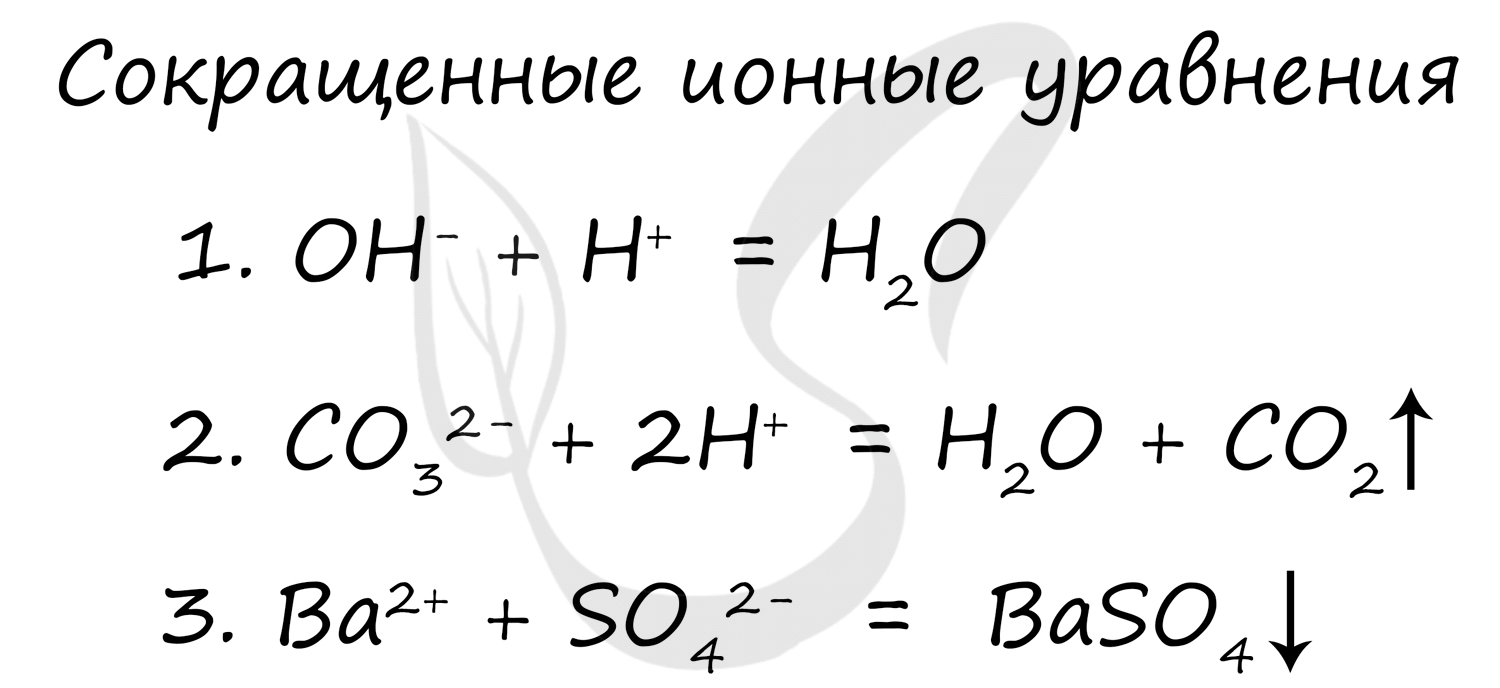
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Из школьного курса учащиеся знают, что соединения веществ с водой классифицируются на электролиты и неэлектролиты. Первые могут пропускать ток, а вторые не обладают такой способностью. Электролитической диссоциацией именуют такое явление, когда наблюдается распад жидкости, проводящей электроток, на отдельные ионы. Подобное изменение протекает при растворении или плавлении химического элемента.
- Электролитическая диссоциация
- Обратимость реакции
- Определение степени
- Типы электролитов
- Динамическое равновесие
- Основные положения теории
- Ионный обмен
Электролитическая диссоциация
К соединениям, что отлично пропускают через себя ток, причисляют сильные кислоты, основания и соли, способные активно растворяться в H2O. Примеры веществ, водные соединения которых не в состоянии проводить электрический ток:

Причина электропроводности открыта в 1877 году шведским учёным С. Аррениусом. Он долго изучал свойства разнообразных соединений и наконец обнаружил, что в некоторых из них наличествуют ионы. Именно они проводят электрический ток. Частицы образуются, когда в воде растворяются определённые ингредиенты. Этот процесс называется электролитической диссоциацией.
С. Аррениус полагал, что частицы изначально находятся в растворах. Он не учитывал, что при взаимодействии электролита и воды происходит химическая реакция. Пытаясь объяснить процесс диссоциации, этот учёный опирался на физическую теорию растворов.
В отличие от него, русские физикохимики Вадимир Александрович Кистяковский и Иван Алексеевич Каблуков применили подход Д. И. Менделеева. Опираясь на химическую теорию, они сумели разработать доказательство того, что реакция является ступенчатой. Когда компонент растворяется в воде, сначала образуются гидраты. Следующая ступень — высвобождение ионов. Атомы водорода в молекуле воды расположены под углом 104,5°. При этом они как бы окутывают элемент, который впоследствии переходит в свободное состояние.
Обратимость реакции
Вещества, имеющие ионную кристаллическую решётку, диссоциируют активнее. Они уже состоят из мельчайших элементов, среди которых есть положительно и отрицательно заряженные. Молекула воды представляет собой диполь — 2 противоположно заряженных полюса. К ним притягиваются частицы вещества при растворении. Одновременно ослабевают связи в кристаллической решётке. Кристалл распадается и раствор насыщается элементами. Схематично процесс электролитической диссоциации можно представить так:

- Молекулы воды ориентируются вокруг частиц противоположно заряженными концами.
- Диполи взаимодействуют с ионами, расположенными в поверхностных слоях кристаллической решётки.
- Кристалл электролита диссоциирует с образованием гидратированных элементов.
Диссоциация электролитов, состоящих из молекул с ковалентной связью, происходит аналогично. Диполи воды оказывают влияние на молекулы вещества. При этом ковалентная связь преобразуется в ионную. Механизм диссоциации выглядит так:
- Диполи воды притягиваются к полюсам электролита.
- Молекулы жидкого и твёрдого компонентов раствора вступают во взаимодействие.
- Ковалентная полярная связь преобразуется в ионную — происходит ионизация.
- Молекулы электролита распадаются на гидратированные ионы.
В естественных условиях частицы в растворе перемещаются хаотично. При этом некоторые из них сталкиваются и объединяются. Такой процесс называется ассоциацией. Отображая эти реакции в виде формулы или уравнения электролитической диссоциации, ставят знак обратимости. Он показывает, что противоположно направленные реакции происходят одновременно. Гидроокиси, обладающие подобным свойством, называют амфотерными.
Некоторые слабые электролиты диссоциируют обратимо и ступенчато. К таким относятся угольная и сероводородная кислоты, гидроксид магния. Гидратированные и негидратированные частицы имеют разные свойства. Например, подвергаясь гидратации, катион или анион меди приобретает голубой цвет. Будучи негидратированным — белый.
В гидратированном элементе количество молекул воды может быть как постоянным, так и изменчивым.
Определение степени
Когда a=100% или 1, это означает, что электролит целиком распался на ионы. Если a=0, реакция отсутствует. Степень диссоциации неодинакова у разных жидкостей. Она обусловлена тем, каким свойствами обладает электролит изначально. Также интенсивность распада обусловлена тем, сколько в растворе электролита и воды. Чем концентрированнее соединение, тем ниже показатель степени, и наоборот.
Типы электролитов
По способности диссоциировать на ионы жидкости с электролитическим компонентом делят на сильные и слабые. К первым относят те, что полностью вступают в реакцию. Их степень диссоциации равна единице или 100%. Список электролитов, относящихся к сильным:

- щёлочи;
- сильные кислоты (серная, соляная);
- растворимые соли (хлориды, ацетат калия).
У слабых электролитов показатель степени диссоциации почти всегда минимален или стремится к нулю. Такие вещества практически не распадаются на элементарные частицы. Категории соединений, отнесённых к слабым электролитам:
- вода;
- некоторые соли;
- водный раствор аммиака;
- слабые кислоты.
Динамическое равновесие
Слабые электролиты диссоциируют не полностью. Когда они находятся в растворе, процесс диссоциации происходит до определённого момента, потом прекращается. Устанавливается динамическое равновесие. Это явление можно выразить в виде уравнения. Способность вещества диссоциировать на мельчайшие частицы называют константой диссоциации или равновесия.
Чем активнее электролит образует ионы, тем он сильнее, а значит, константа выше. У слабых этот показатель будет ниже. Значения констант диссоциации для разных элементов, из которых состоит таблица Менделеева, приводятся в справочной литературе. Эти показатели применимы только к водным растворам. В неводных химические элементы ведут себя иначе.

Кроме воды, вещества могут растворяться в ацетоне, эфире, бензоле, спирте и многих других жидкостях.
Основные положения теории
Электролитической диссоциации посвящена научная теория, состоящая из 5 постулатов. Первый гласит, что электролиты, растворяясь в воде, распадаются на 2 категории ионов — положительно и отрицательно заряженные. Этот вид частиц представляет собой одну из форм, в которой может существовать химический элемент.
Свойства атомов и ионов различаются. Например, ионы натрия не образуют соединений с водой, а атомы этого же элемента вступают с ней в реакцию. Результатом взаимодействия становятся водород и щёлочь. Атомы и ионы хлора различаются по свойствам: первые токсичны, окрашены в жёлто-зелёный цвет и издают резкий запах, а вторые не пахнут, бесцветны и неядовиты.
Когда один или группа атомов присоединяют или отдают электроны, образуются ионы, несущие отрицательный или положительный заряд. По составу они подразделяются на простые и сложные. Находясь в растворе, эти частицы хаотично и непрерывно движутся.
Суть следующего положения теории заключается в том, что причиной диссоциации является взаимодействие молекул воды и электролита, сопровождающееся разрывом химической связи в последнем. В результате гидратации образуются ионы, связанные с молекулами H2O. По-другому эти частицы называют гидратированными. От негидратированных их отличает наличие водной оболочки.

Третье положение объясняет, как образуются катионы и анионы. Под воздействием электротока отрицательные ионы перемещаются к аноду. Он представляет собой положительный полюс. Эти ионы называют анионами.
Положительно заряженные частицы движутся к катоду — отрицательному полюсу источника электротока. Эти частицы называются катионами. Таким образом, ионы могут классифицироваться по знаку заряда. Растворы электролитов всегда электронейтральны, потому что суммы зарядов катионов и анионов равны.
Согласно четвёртому положению теории, электролитическая диссоциация, происходящая с участием слабых электролитов, является обратимым процессом. Одновременно с распадом вещества на ионы происходит соединение последних.
Согласно пятому положению, степень электролитической диссоциации отличается у разных элементов. Она зависит от природы вещества и его концентрации в растворе.
Ионный обмен
В процессе распада кристаллической решётки образуются ионы и молекулы. Состояние, в котором они пребывают, называют динамическим равновесием. Жидкость, содержащая растворившийся сильный электролит, имеет свойства, обусловленные ионами, а та, в которой присутствует слабый, — ещё и молекулами. Например, уксусная кислота обладает характерными вкусом и запахом. Первое свойство объясняется присутствием ионов, второе — содержанием молекул.
Есть ряд характеристик, общих для всех растворов, содержащих сильный электролитический компонент. Так, щёлочи мыльные на ощупь, при этом они способны изменять цвет индикаторов. Эти характеристики объясняются наличием гидроксид-ионов. Растворимые соли приобретают свои характеристики в связи с тем, что в растворенном виде они распадаются на анионы и катионы. Идентичные характеристики кислот обусловлены тем, что в их составе присутствуют ионы оксония H3O.
Некоторые реакции в электролитных растворах протекают с высокой скоростью. Это обусловлено тем, что в них участвуют ионы. Формулы, описывающие эти процессы, называют ионными. Так же именуют и реакции, при этом их классифицируют на обратимые, протекающие до конца, и необратимые. Во втором случае процесс одновременно протекает в прямом и обратном направлениях. Когда ионы вступают в необратимую реакцию, они соединяются и образуют следующие типы элементов и соединений:
- газообразные;
- малодиссоциирующие;
- нерастворимые.
Будет ли реакция обратимой, зависит от того, какие химические элементы есть среди исходных. Если это малорастворимые компоненты или слабые электролиты, диссоциация протекает одновременно с ассоциацией. Следовательно, наблюдается обратимое явление. Для него характерно смещение равновесия. Образуется слабый электролит, при этом остаются гидроксид-ионы и недиссоциированные молекулы.
Если исходные компоненты представляют собой сильные электролиты, диссоциация не происходит. При взаимодействии образуется смесь ионов, при этом реакция не протекает. Сильные электролиты не образуют газов, малодиссоциирующих или нерастворимых веществ. Сколько и какого вещества образуется в результате реакции, определяют с помощью уравнений. Например, при распаде 1 моль нитрата аммония возникает 2 моль анионов и катионов.
Читайте также:

