Нахождение серебра в природе кратко
Обновлено: 25.06.2024
Расположено в IB группе 5 периоде периодической системы элементов. Электронная конфигурация двух внешних электронных слоев 4s 2 p 6 d 10 5s 1 . Радиус атома 0, 144 нм. Радиус иона Ag + 0, 100 нм (координационное число 4) и 0, 115 нм (6), иона Ag 2+ 0, 079 (4) и 0, 094 (6). Энергии последовательной ионизации 7, 576, 21, 487, 34, 83 эВ. Степени окисления +1 (наиболее характерна), +2 и +3 (валентность I, II, III). Электроотрицательность по Полингу 1, 93.
Историческая справка
Серебро известно с древнейших времен, уже в 4 тысячелетии до нашей эры из него изготавливали украшения и монеты. Серебро считалось металлом, связанным с Луной.
Нахождение в природе
Содержание в земной коре 7·10 –6 % по массе. Встречается в самородном виде. Известно более 60 серебросодержащих минералов, среди них: аргентит Ag2S, кераргирит AgCl, пираргирит Ag3[SbS3] и прустит Ag3[AsS3], галогениды серебра, антимониды и арсениды. Месторождения серебра делятся на собственно серебряные руды (содержание серебра выше 50%) и комплексные полиметаллические руды цветных и тяжелых металлов (содержание серебра до 10-15%). Комплексные месторождения обеспечивают 80% добычи серебра. Основные месторождения таких руд сосредоточены в Мексике, Канаде, Австралии, Перу, США, Боливии и Японии.
Получение
В древности серебро извлекали из руд обработкой их ртутью. В настоящее время применяется цианидное выщелачивание.
Чтобы сместить равновесие вправо, через него пропускают воздух. Сульфид-ионы при этом окисляются до тиосульфат-ионов (ионов S2O3 2– ) и сульфат-ионов (ионов SO4 2– ).
Для получения серебра очень высокой чистоты (99, 999%) его подвергают электрохимическому рафинированию в азотной кислоте или растворению в концентрированной серной кислоте. При этом серебро переходит в раствор в виде сульфата Ag2SO4. Добавление меди или железа вызывает осаждение металлического серебра:
Физические и химические свойства
Серебро — белый блестящий металл, с кубической гранецентрированной решеткой, a = 0, 4086 нм. Плотность 10, 491 г/см 3 , температура плавления 961, 93°C, кипения 2167°C. Серебро мягкий и пластичный металл, с теплопроводностью 419 Вт/м –1 ·К –1 при 20°C и самой высокой электропроводимостью (удельное сопротивление r 1, 59 мкОм·см при 0°C). Примеси, присутствующие в серебре даже в незначительных количествах, ухудшают его механические свойства.
Серебро легко вытесняется более активными металлами из своих соединений. Углем, водородом и другими восстановителями серебро восстанавливается до металла. Например, образование тонкого слоя серебра на чистой стеклянной поверхности при взаимодействии альдегида с aммиачным раствором соли серебра:
Стандартный электродный потенциал пары Ag + /Ag 0 0, 799В, в неокисляющих кислотах серебро не растворяется. С кислотами-окислителями, особенно с HNO3 активно взаимодействует:
При комнатной температуре не окисляется кислородом воздуха, при 170°C его поверхность покрывается пленкой Ag2O. Озон в присутствии влаги окисляет серебро до высших оксидов [AgO] или Ag2O3.
Оксид серебра(I) Ag2O выпадает в осадок при добавлении щелочи к растворам солей серебра(I), так как гидроксид серебра [AgOH] неустойчив и разлагается на оксид и воду:
Соли серебра, взаимодействуя с ороксодисульфатом в щелочной среде, образуют осадок AgO, который является соединением Ag I Ag III O2.
Взаимодействуя с HF, Ag2O образует раствор oторид серебра AgF. Остальные галогениды серебра нерастворимы в воде и в кислых водных растворах. Но AgCl при нагревании растворяется в насыщенном растворе поваренной соли, так как образуется растворимый комплекс серебра:
При нагревании смеси фторида серебра AgF и фторидов щелочных металлов в атмосфере газообразного фтора получены соединения Ag(III):
Все эти соединения серебра(III) неустойчивы и разлагаются при наличии следов влаги. Высокой стабильностью обладает только комплекс Ag 3+ с этилендибигуанидином, который образуется в виде красной соли при действии водного пероксодисульфата калия в присутствии сульфата этилендибигуанидина на Ag2SO4.
Применение
Около 30-40% всего производимого серебра расходуется на производство кино и фотоматериалов. 20% серебра в виде сплавов с золотом, палладием, медью или цинком используется для изготовления контактов, припоев, проводящих слоев в электротехнике и электронике.
20-25% произведенного серебра служит для производства серебряно-цинковых аккумуляторов. Из сплава на основе серебра изготовляют монеты, ювелирные изделия, украшения и столовую посуду.
Сплавы серебра с Cu, Au, Pb, Hg находят применение в стоматологии в качестве пломбирующего и протезирующего материала. Нитрат серебра AgNO3 в медицине используют вместе с нитратом калия и называют ляписом. Использование колларгола (коллоидного раствора серебра) основано на вяжущих, прижигающих и антисептических свойствах.
Физиологическое действие
Серебро — примесный микроэлемент растительных и животных организмов. В организме человека общее содержание серебра составляет несколько десятых грамма. Физиологическая роль серебра неясна. Соединения серебра токсичны. При попадании в организм больших доз растворимых солей серебра наступает острое отравление, сопровождающееся некрозом слизистой желудочно-кишечного тракта. Первая помощь при отравлении — промывание желудка раствором хлорида натрия NaCl, при этом образуется нерастворимый хлорид серебра AgCl, который и выводится из организма.
Серебро бактерицидно, при 40-200 мкг/л погибают неспоровые бактерии, а при более высоких концентрациях — споровые.
В наше время серебро (читайте подробнее о драгоценном металле серебре) является самым доступным из всех драгоценных металлов. Стоимость одного грамма золота почти в 60 раз выше, чем стоимость серебра. Платина дороже примерно в 70 раз. Однако с древних времен и практически до начала 20 века именно серебро было самым распространенным эквивалентом денег и материалом для чеканки монет. И еще — этот металл единственный, в честь которого названа была целая страна, являвшаяся в то время основным источником запасов серебра.

Нахождение серебра в природе
Серебро занимает 65-е место по распространенности в земной коре, между ртутью (64-е место) и селеном (66-е место). Среди драгоценных металлов серебро самое распространенное в природе. Среднее содержание этого белого металла в земной коре составляет 0,075 грамм на тонну, что примерно в 20 раз больше, чем золота или платины. Среднее содержание серебра в различных породах не одинаково, и колеблется в пределах 0,05 – 1,0 г/т.
Средняя концентрация серебра в морской воде примерно 0,00004 грамм на тонну (или 0,04 мкг/л), что на порядок выше концентрации золота и платины. Это объясняется большей химической активностью серебра.

Самый большой самородок серебра. Фото Denver Library.
В природе известно около 60 минералов, содержащих серебро. Как правило, оно входит в состав сульфидных руд меди, свинца и цинка, реже – висмута и сурьмы. Серебро всегда присутствует в залежах золотых руд.
Запасы серебра в мире
До 19 века основным поставщиком серебра на мировой рынок была Южная Америка. Всего три страны — Перу, Боливия и Мексика — обеспечивали 85% мировой добычи. В 19 и 20 веках, с развитием технологий промышленного извлечения серебра из полиметаллических руд, крупные источники были открыты по всему миру и его добыча превратилась в глобальную индустрию. Тем не менее, месторождения в Южной Америке продолжают оставаться одним из главных ресурсов природного серебра.
Россия входит в пятерку стран, располагающих наибольшими прогнозными ресурсами серебра. Основные месторождения в нашей стране находятся в Сибири и на Дальнем Востоке.
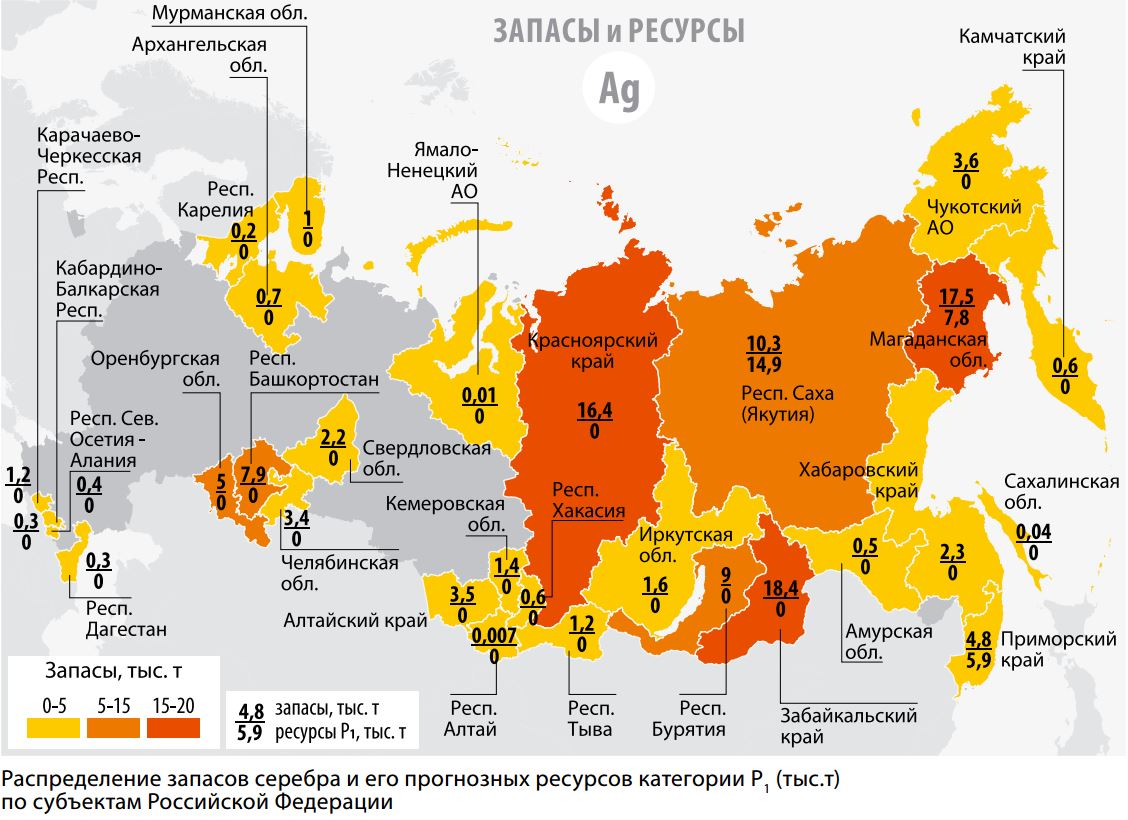
Мировые залежи серебра
Все значимые месторождения серебра можно условно разделить на два типа:
— собственно серебряные месторождения. В них после переработки руды более 50% от стоимости полученных полезных компонентов приходится на серебро.
— месторождения с полиметаллическими рудами. Руда в них содержит несколько металлов, но серебро составляет не более 15% от их общей стоимости.
Из серебряных руд в мире добывается около 25 % серебра. Остальные 75 % приходятся на различные полиметаллические руды, в основном свинцово-цинковые, медные, никелевые, кобальтовые и золотые, где производство серебра является попутным продуктом.

Процесс добычи, переработки и последующего выделения серебра из руды схож с таковым у золота. Он включает в себя извлечение руды из земли, подготовку руды, получение концентрата (обычно методом цианирования), получение чистого металла на аффинажных фабриках.
Мировым лидером по добыче серебра исторически является Мексика. Китай с 2011 года занимает второе место, продолжая мощно наращивать добычу.
Добыча и запасы серебра в мире. 2011-2012 г.
| Страна | Добыча в 2011 г, тонн | Добыча в 2012 г, тонн | Запасы, тонн |
|---|---|---|---|
| Мексика | 4 150 | 4 250 | 37 000 |
| Китай | 3 700 | 3 800 | 43 000 |
| Перу | 3 410 | 3 450 | 120 000 |
| Австралия | 1 730 | 1 900 | 69 000 |
| Россия | 1 350 | 1 500 | * |
| Боливия | 1 210 | 1 300 | 22 000 |
| Польша | 1 170 | 1 170 | 85 000 |
| Чили | 1 290 | 1 130 | 77 000 |
| США | 1 120 | 1 050 | 25 000 |
| Канада | 572 | 530 | 7 000 |
| Другие страны | 3 600 | 3 900 | 50 000 |
| Всего (округленно) | 23 300 | 24 000 | 540 000 |
Добыча серебра в России
СЕРЕБРО. Этот красивый металл известен людям с древнейших времен. Изделиям из серебра, найденным в Передней Азии, более 6 тысяч лет. Из сплава золота и серебра (электрума) были изготовлены первые в мире монеты. И в течение нескольких тысячелетий серебро, наряду с золотом и медью, было одним из основных монетных металлов. С цветом серебра связано и его латинское название Argentum, оно происходит от греческого argos – белый, блестящий.
Серебро в природе.
Самородное серебро находят редко; основная часть серебра в природе сосредоточена в минералах, которых известно более 50; в них серебро связано с серой, селеном, теллуром или галогенами. Основной серебряный минерал – аргентит Ag2S. Еще больше серебра рассеяно среди различных горных пород, так что основная часть добываемого в мире серебра получается в результате комплексной переработки полиметаллических руд, содержащих свинец, медь и цинк.
Свойства серебра.
Чистое серебро – сравнительно мягкий и пластичный металл: из 1 г серебра можно вытянуть тончайшую проволочку длиной почти 2 км! Серебро – довольно тяжелый металл: по плотности (10,5 г/см 3 ) оно лишь немного уступает свинцу. По электропроводности же и теплопроводности серебру нет равных (поэтому серебряная ложка в стакане горячего чая быстро нагревается). Плавится серебро при относительно низкой температуре (962° С), что значительно облегчает его обработку. Серебро легко сплавляется со многими металлами; небольшие добавки меди делают его более твердым, годным для изготовления различных изделий.
Это свойство серебра приводит к красивому (и опасному) явлению – разбрызгиванию серебра, которое известно с древних времен. Если расплавленное серебро поглотило значительные количества кислорода, то затвердевание металла сопровождается высвобождением большого количества газа. Давлением выделяющегося кислорода корка на поверхности застывающего серебра разрывается, часто с большой силой. В результате происходит внезапное взрывное разбрызгивание металла.
Чтобы защитить поверхность серебра от потемнения ее пассивируют – покрывают защитной пленкой. Для этого хорошо очищенное изделие погружают на 20 минут в слегка подкисленный 1%-ный раствор дихромата калия K2Cr2O7 при комнатной температуре. Образовавшаяся тонкая пленка Ag2Cr2O7 защищает поверхность серебра.
Серебро легко растворяется в азотной и горячей концентрированной серной кислоте: 3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O; 2Ag + 2H2SO4 = Ag2SO4 + SO2 + 2H2O. Серебро растворяется также в концентрированных иодо- и бромоводородной кислотах, а в присутствии кислорода – и в хлороводородной (соляной) кислоте; реакции способствует образование комплексных галогенидов серебра: 2Ag + 4HI = 2H[AgI2] + H2
Применение серебра.
Огромные количества серебра раньше шли на изготовление монет. Сейчас из серебра делают в основном юбилейные и памятные монеты. Самая тяжелая современная серебряная монета, выпущенная в России в 1999, весит 3000 граммов, имеет тираж 150 штук. Посвящена она 275-летию Санкт-петербургского монетного двора. При высоком содержании серебра монеты и другие изделия весьма устойчивы на воздухе. Низкопробное серебро часто зеленеет. Зеленый налет содержит основной карбонат меди (CuOH)2CO3. Он образуется под действием углекислого газа, паров воды и кислорода.
Чтобы узнать содержание серебра в сплаве (его пробу), а также отличить серебряные изделия от сплавов, похожих на серебро, используют разные способы. Самый простой – реакция с так называемой пробирной кислотой для серебра, которая представляет собой раствор 3 мл концентрированной серной кислоты и 3 г дихромата калия в 32 мл воды. Каплю раствора наносят на поверхность изделия в незаметном месте. Под действием серной кислоты в присутствии сильного окислителя медь и серебро переходят в сульфаты CuSO4 и Ag2SO4, далее сульфат серебра быстро превращается в нерастворимый рыхлый осадок дихромата серебра Ag2Cr2O7 красного цвета. Он особенно хорошо заметен на поверхности, если каплю осторожно смыть водой. Красный осадок легко удалить механически; при этом на поверхности останется чуть заметное светлое пятнышко.
Этот метод не дает положительного результата, если в сплаве меньше 25% серебра (т.е. проба меньше 250). Такие бедные серебром сплавы встречаются довольно редко. В этом случае серебро можно обнаружить, если капнуть на поверхность азотной кислотой, а затем на то же место – раствором поваренной соли. В присутствии серебра в сплаве появится молочное помутнение: кислота растворяет небольшое количество металла, а хлорид-ионы дают с ионами серебра белый осадок нерастворимого хлорида AgCl.
Для более точного определения пробы ювелиры используют пробирный камень – черный камень с отшлифованной матовой поверхностью. Изделием проводят по камню, а оставшийся штрих сравнивают с цветом штрихов от эталонных сплавов известной пробы.
Многие декоративные серебряные изделия покрыты красивой чернью. Для чернения используют так называемую серную печень, содержащую полисульфид калия (в основном K2S4). Под действие этого реагента на поверхности серебра образуется черная пленка сульфида Ag2S.
Соединения серебра часто неустойчивы к нагреванию и действию света. Открытие светочувствительности солей серебра привело к появлению фотографии и быстрому увеличению спроса на серебро. Еще в середине 20 во всем мире ежегодно добывалось около 10 000 тонн серебра, а расходовалось значительно больше (дефицит покрывался за счет старых запасов). Причем почти половина всего серебра шла на изготовление кино- и фотоматериалов. Так, обычная черно-белая фотопленка содержит (до проявления) до 5 г/м 2 серебра. Вытеснение черно-белых фотографий и кинофильмов цветными позволило значительно снизить потребление серебра.
Биохимия серебра.
Бактерицидное действие ничтожных концентраций ионов серебра объясняется тем, что они вмешиваются в жизнедеятельность микробов, мешая работе биологических катализаторов – ферментов. Соединяясь с аминокислотой цистеином, входящей в состав фермента, ионы серебра препятствуют его нормальной работе. Аналогично действуют и ионы некоторых других тяжелых металлов, например, меди или ртути, но они намного токсичнее серебра. А главное – хлориды меди и ртути прекрасно растворяются в воде и потому представляют большую опасность для человека; любая же хорошо растворимая соль серебра в желудке человека под действием соляной кислоты быстро превращается в хлорид серебра, растворимость которого в воде при комнатной температуре составляет менее 2 мг/л.
Однако, как это часто бывает, то, что полезно в малых дозах, губительно в больших. Не составляет исключения и серебро. Так, введение значительных концентраций ионов серебра вызывает у животных снижение иммунитета, изменения в сосудистой и нервной тканях головного и спинного мозга, а при увеличении дозы – повреждения печени, почек, щитовидной железы. Описаны случаи отравления человека препаратами серебра с тяжелыми нарушениями психики. К счастью, в теле человека через 1–2 недели остается всего 0,02–0,1% введенного серебра, остальное выводится из организма.
При многолетней работе с серебром и его солями, когда они поступают в организм длительно, но малыми дозами, может развиться необычное заболевание – аргирия. Поступающее в организм серебро способно медленно отлагаться в виде металла в соединительной ткани и стенках капилляров разных органов, в том числе в почках, костном мозге, селезенке. Накапливаясь в коже и слизистых оболочках, серебро придает им серо-зеленую или голубоватую окраску, особенно сильную на открытых участках тела, подвергающихся действию света. Изредка окраска может быть настолько интенсивной, что кожа напоминает кожу негров.
Илья Леенсон
Серебро в медицине.
Об этом свойстве серебра знали очень давно. Персидский царь Кир II Великий (558–529 до н.э.) пользовался серебряными сосудами для хранения питьевой воды во время своих военных походов. Знатные римские легионеры носили нагрудники и налокотники из серебряных пластинок: при ранении прикосновение такой пластинки предохраняло от инфекции.
Колларгол (коллоидное серебро) – зеленовато- или синевато-черные чешуйки с металлическим блеском; в воде они образуют коллоидный раствор.
Это лекарство появилось в 1902, когда немецкий химик Карл Пааль придумал способ, как защитить мельчайшие частички серебра: надо, чтобы вокруг каждой из них образовалась тончайшая оболочка из белка альбумина, который содержится в курином яйце, тогда эти частички не будут слипаться. Колларгол содержит до 70% серебра. Применяют его в виде 0,2–1,0%-го водного (коллоидного) раствора для промывания гнойных ран и глаз при конъюнктивите, 1–2%-м раствором лечат воспаление мочевого пузыря, а 2–5%-м – гнойный насморк.
Протаргол – это серебросодержащее белковое соединение, коричнево-желтый или коричневый порошок без запаха, хорошо растворимый в воде. Содержание серебра в нем – 7,8–8,3%. Протаргол применяют для тех же целей, что и колларгол. Жидкую смесь, состоящую из 0,2 г протаргола, 5 мл глицерина и 15 мл воды, используют для орошения голосовых связок, а 1–3%-й раствор протаргола успешно лечит насморк и конъюнктивит.
Ляпис – нитрат серебра AgNO3 впервые применили врачи-алхимики голландец Ян-Баптист ван Гельмонт (1579–1644) и немец Франциск де ла Бое Сильвий (1614–1672), которые научились получать нитрат серебра взаимодействием металла с азотной кислотой.
При этом протекает реакция:
Тогда-то и было обнаружено, что прикосновение к кристаллам полученной серебряной соли не проходит бесследно: на коже остаются черные пятна, а при длительном контакте – глубокие ожоги. Нитрат серебра – бесцветный (белый) порошок, хорошо растворимый в воде, на свету он чернеет с выделением металлического серебра.
Медицинский ляпис, строго говоря, не чистый нитрат серебра, а его сплав с нитратом калия, иногда отлитый в виде палочек – ляписного карандаша. Ляпис оказывает прижигающее действие и применяется с давних пор. Однако пользоваться им надо чрезвычайно аккуратно: нитрат серебра может вызвать отравления и сильные ожоги. Хранить ляпис следует в местах, недоступных детям!
Лечебное действие нитрата серебра заключается в подавлении жизнедеятельности микроорганизмов; в небольших концентрациях он действует как противовоспалительное и вяжущее средство, более концентрированные растворы, как и кристаллы AgNO3, прижигают живые ткани. Это связано с образованием альбуминатов (белковых соединений) серебра при соприкосновении с кожей. Раньше ляпис применяли для удаления мозолей и бородавок, прижигания угрей. Да и теперь, если нет возможности прибегнуть к криотерапии (прижиганию сухим льдом или жидким азотом), чтобы безболезненно избавиться от ненужных наростов, пользуются ляписом.
Людмила Аликберова
Максимов М.М. Очерк о серебре. М., Недра, 1981
Кульский Л.А. Серебряная вода. Киев, Наукова думка, 1982
Малышев В.М., Румянцев Д.В.. Серебро. М., Металлургия, 1987
Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. М., Химия, 1992
Степин Б.Д., Аликберова Л.Ю. Книга по химии для домашнего чтения. – 2-е изд. М., Химия, 1995
Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов / Р.А. Лидин, В.А. Молочко, Л.Л.Андреева; под ред. Р.А. Лидина. М., Химия, 1996
Здорик Т., Фельдман Л. Энциклопедия природы России. Минералы и горные породы. М., 1998
Аликберова Л.Ю. Занимательная химия: Книга для учащихся, учителей и родителей. М., АСТ-ПРЕСС, 1999
Степин Б.Д., Аликберова Л.Ю., Рукк Н.С. Домашняя химия. Химия в быту и на каждый день. М., РЭТ, 2001
Многих людей интересует серебро - химический элемент, который ассоциируется с роскошью, дорогими изделиями, уникальными технологиями в науке и технике. Этот элемент занимает особое место во всей таблице Менделеева, так как всегда, буквально во всей известной человечеству истории, он был материалом для изготовления монет, уникальных предметов быта и прочих ценных вещей. Серебряные монеты известны еще в самых древних цивилизациях, и они продолжают выпускаться в наше время.
Также материал играет важную роль в науке, медицине, промышленности, уникальных технологиях, где выставляются серьезные требования к чистоте используемых веществ. Многих людей интересует не столько химия серебра, как различные связанные с ним поверья, легенды и сказки. Это также занимает большой пласт общечеловеческой культуры и показывает важность рассматриваемого элемента для людей.
История металла
Такое вещество, как серебро, известно человечеству уже очень много тысячелетий, если не сотен тысяч лет. В самых древних мифах, сказаниях и повестях можно встретить упоминания о сделанных из него деньгах и предметах. Свое название материал получил от праславянского наречия, которое было распространено на территории нынешней России, Германии и балтийских стран.

Причина такой ранней известности вещества во многих культурах состоит в том, что в отличие от других металлов, которые добывают путем переплавки, руда рассматриваемого материала не требует этой процедуры. Очень часто серебро встречалось древним людям в виде уже готовых к обработке самородков. То есть, не нужны были никакие сложные технологии, чтобы просто брать его и активно использовать в своих целях.
Происхождение названия
Степень принадлежности слова к той или иной культуре установить очень сложно, если вообще возможно. Существует также и греческое слово, обозначающее серебро árgyros, откуда пошло латинское argentum, принятое международным сообществом в качестве основного названия в международной системе и таблице Менделеева.
Нахождение в природе
Если рассматривать состав земной коры, то в ней на серебра примерно 70 миллиграмм на 1 тонну. Это не так много. С древних времен серебреные монеты и предметы имели высокую ценность, что уже указывает на то, что материал является редким и ценным.

Сплавы материала встречаются реже, нежели чистая руда, но при нынешнем развитии технологий легко обрабатываются с целью выделения необходимой фракции.
Интересно отметить, что нередко копателям удавалось обнаружить не руду, а самородки, при этом огромного размера. Истории известен случай, когда был найдет самородок серебра на целых 20 тонн веса! Также находили и другие самородные объекты весом в 500-600 килограммов.
Крупнейшие месторождения серебра в мире
Распределение драгоценного ресурса по поверхности планеты крайне неравномерно. Наиболее интенсивно добыча материала происходит в Перу – это государство является безусловным лидером по количеству получаемого здесь серебра. В среднем, за один год в этой стране добывается около 110 миллионов унций вещества.

Польша является также одним из лидеров по добыче серебра, хотя мало кто догадывается об этом. Здесь добывается около 40,5 миллионов унций серебра.
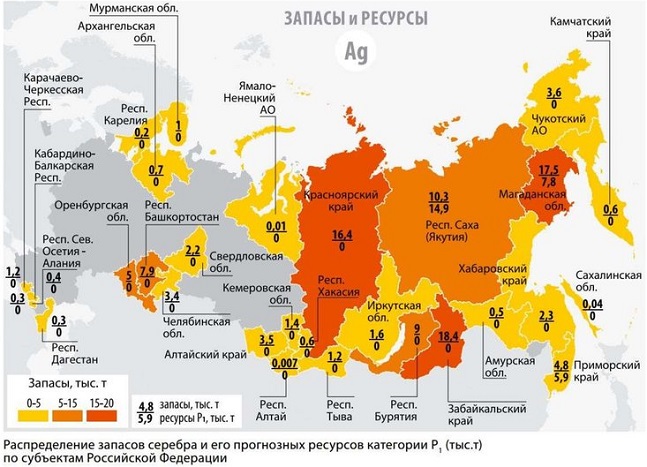
Россия и постсоветские страны имеют около 12-15% от мировых запасов серебра. Горнодобывающая промышленность здесь достаточно развита и дает тонны материала ежегодно. Австралия также входит в перечень счастливчиков, которым повезло с рассматриваемым ресурсом. В остальных частях мира серебра не так много, но всегда есть вероятность обнаружить его пока неизвестные месторождения.
Физические свойства
Масса вещества достаточно высока, что обуславливается тем, что его плотность равна целых 10,5 г/см³. Это больше, чем у другого популярного металла – меди, но меньше, нежели у известного каждому свинца.

Плавление серебра начинается при температуре 962°C, что является достаточно высоким значением. Именно поэтому металл считается тугоплавким и используется, к примеру, для пайки сложных соединений в качестве припоя.
В комнатных условиях вещество имеет высокий уровень электропроводности, также отличается высокой теплопроводностью. Оксид, хлорид, сульфид, гидроксид серебра активно используются в научной деятельности и промышленности для решения целого спектра задач.
Химические свойства
Максимальная валентность рассматриваемого металла составляет 1, так как она соответствует номеру группы, где он находится в таблице Менделеева. Ионы серебра слабо реагируют на другие элементы, включая даже серную и соляную кислоту.

Молярная масса равна 107,8 а.е.м. (вес атома такой же), цвет тонкой фольги с чистого материала напоминает фиолетовый, если же берется самородок, то он ярко-светлый, серебристый.
Окисление вещества происходит крайне слабо и только в специальных условиях. Для этого приходится использовать плазменные технологии, озон или обработку ультрафиолетовым излучением. Электронная конфигурация серебра выглядит так: 4d^10 5s^1. Кристаллическая решетка – кубическая, а если быть более точным - кубическая гранецентрированная.
Сфера применения серебра
Существует масса применений рассматриваемого материала, благодаря чему он и имеет столь высокую стоимость и авторитет среди самых широких масс людей.

Вот основные случаи его использования:
Техническое применение в науке и промышленности. Надежные контакты для электрического соединения обрабатываются серебром. Так как материал плавится при очень высокой температуре, почти 1000 градусов, то его применяют везде, где важно выдерживать высокотемпературную среду.
Удельный вес вещества позволяет использовать его в составе различных припоев, к примеру, большой популярностью пользуется медно-серебряный припой.
Используется среди драгоценных металлов в области создания ювелирных изделий.
Также металл применяется для создания высококачественных зеркал с повышенной отражающей способностью, в СВЧ-электротехнике.
Серебро известно своими дезинфицирующими свойствами, поэтому используется для очищения воды от микробов.
В химии существует не одна формула применения серебра для науки, химической промышленности и массы других задач. С его помощью проводятся всевозможные пробы, делаются качественные сварные швы, создается сложная электроника.
Заключение
Argentum – известнейший во всем мире химический элемент, который активно используется в огромном количестве случаев. Значение серебра для современной цивилизации сложно переоценить – во многих сферах деятельности оно буквально незаменимо.
Получение металла из земной породы в наше время поставлено на крупный поток, поэтому человечество получает тонны драгоценного материала для своих нужд ежегодно.
Читайте также:

