Нахождение озона в природе кратко
Обновлено: 03.07.2024
Кислород – элемент VIA группы. Для него свойственны две аллотропные модификации с разными химическими формулами – кислород О2 и озон О3. Они отличаются не только составом молекул, но и различными характеристиками.
В конце XVIII века ученый Мартин Ван Марум провел эксперимент, в результате которого получил озон. Он через воздушное пространство пропускал электричество. Таким образом, образовался озон – это голубоватый газ с необычным запахом. Ученый предполагал, что полученный газ представляет собой электрическую материю.
Получение озона
Существует несколько способов получения молекул озона.
- Из кислорода воздуха при электрическом разряде
- 3О2 = 2О3 – 284 кДж
В промышленных условиях газ получают в озонаторах и отделяют фракционной перегонкой.
- 3О2 = 2О3 – 284 кДж
- Взаимодействие охлажденной концентрированной серной кислоты и пероксида бария
- 3H2SO4 + 3BaO2 = 3BaSO4 + O3 + 3H2O
Данной реакцией синтезируют озон в лабораториях.
- 3H2SO4 + 3BaO2 = 3BaSO4 + O3 + 3H2O
Физические свойства озона
Озон – бесцветный (в толстых слоях голубоватый) газ. Он почти в два раза тяжелее воздуха. Озон обладает специфическим запахом свежести.
- Температура сжижения -112˚С (газ приобретает оттенок индиго).
- Температура плавления -197˚С.
- Молярная масса озона – 48 г/моль.
Озон растворим в воде. Примеси позволяют растворяться еще быстрее. Если озон находится в состоянии газа, то он выступает в роли диамагнетика. Если озон – это жидкость, то проявляет свойства слабого парамагнетика.
Озон ядовит и губителен для бактерий. Его используют при обеззараживании воздуха и воды.
Химические свойства озона
Озон обладает сильными окислительными свойствами по сравнению с кислородом. Он реагирует с рядом веществ.
Если озон находится в состоянии газа, то реакция с сероводородом выглядит следующим образом:
H2S + O3 = SO2 + H2O
Озон способен взаимодействовать со ртутью при обычных условиях. В результате металл теряет блеск и способность липнуть к стеклу.
Токсичность озона
При умеренных концентрациях озон безвреден. Реакции с озоном характеризуются формированием свободных радикалов кислорода, которые губительны для организма при высоком содержании. Чрезмерное воздействие озона часто приводит к гибели. Озон особенно губителен для органов дыхания.
Озоновый слой в верхних слоях атмосферы
Озоновый слой – слой в верхней части атмосфера Земли, который состоит из бесцветного нестабильного газа. Он располагается на высоте 15-20 км над поверхностью планеты. Стратосфера – слой атмосферы, в котором содержится много озона.
Озон образуется в результате воздействия ультрафиолета на кислород. Слой газа задерживает все формы поступающей ультрафиолетовой коротковолновой радиации.
Озоновый экран защищает от вредного излучения, длина волн которого 290-320 нм. Это излучение может спровоцировать рак кожи. Озоновый слой появился на Земле около 600 млн лет назад в результате процесс фотосинтеза. Благодаря озоновому слою первые живые организмы смогли выйти из океана на сушу.
Дыры в озоновом слое
Озоновые дыры – локальное истощение озонового слоя. Самая большая озоновая дыра находится над Антарктидой. Если озоновый слой полностью исчезнет, то все живое на планете погибнет.
Озоновые дыры возникают по многим причинам, главная из которых – загрязнение окружающей среды. Озоновый слой разрушается под воздействием хлора, водорода, кислорода, брома и других продуктов сгорания. Выбросы фабрик, заводов и различных производств негативно влияют на выработку озона в верхних слоях атмосферы.
Озоновый слой может разрушить война. При испытании ядерного оружия выделяется огромное количество энергии и образуются окислы азота, которые разрушают озон. В период с 1952 по 1971 года при ядерных взрывах в атмосферу попало около 3 млн т окислов азота.
Реактивные самолеты выбрасывают окислы азота. Чем выше мощность турбореактивного двигателя, тем больше разрушающего вещества попадает в атмосферу. Ежегодно в воздух выбрасывается более 1 млн т соединений азота, из которых треть выбрасывают самолеты.
Защита озонового слоя
До 1989 года на производствах часто применялись галогенированные углеводороды, которые разрушают озоновый слой. Монреальская конвенция разработала программу по сокращению использования хлорфторуглеродов, которые быстро испарялись и достигали стратосферы. Они разлагаются на компоненты и разрушают озоновый слой. Из этих соединений раньше изготавливали аэрозоли, растворители и др.
Озоновые дыры произвольно создаются и исчезают. Это связано с некоторыми природными явлениями и даже климатическими особенностями. Газ озон образуется в результате воздействия ультрафиолета на кислород. Во время полярной ночи дыры образуются из-за того, что солнце не заходит несколько недель и ультрафиолет постоянно влияет на кислород. Во время полярного дня озоновый слой восстанавливается и воздействие ультрафиолета на живые организмы снижается.
Дыры могут формироваться в период активности Солнца. В результате этого они появляются и пропадают. Иногда это занимает несколько дней, реже растягивается на несколько месяцев.

Химия
При знакомстве с элементами таблицы Менделеева ученики изучают различные химические вещества, а также их производные и формулы. Озон имеет большое значение для природы и человека. Он образуется при разложении соединений, которые выделяют атомарный кислород. Определённая концентрация этого газа делает воздух пригодным для существования большинства живых организмов на суше.
История открытия
Об озоне учёные узнали в 1785 году. Физик Мартин Ван Марум обнаружил этот газ, когда проводил опыты. Специалист пропустил через воздух электрический ток и почувствовал неизвестный запах. Затем он увидел, что возникший газ имел голубой цвет. Позже физик начал изучать незнакомое соединение и узнал, что он сильнее кислорода. Это вещество также воздействовало на ртуть, которая теряла свойственный ей блеск и прилипала к стеклянной поверхности. Учёный думал, что газ служил своеобразной электрической материей.
Физик не знал, что сделал большое открытие. Через время он прекратил дальнейшие исследования нового газа. Об этом веществе вспомнили лишь через 50 лет.

В 1840 году немецкий химик Кристиан Фридрих Шенбейн провёл несколько опытов с озоном и дал ему современное наименование. Через 20 лет учёные Тэт и Эндрюс доказали, что объём газа, в котором кислород превращается в новое соединение, немного уменьшается. Для опыта они взяли стеклянную трубку с манометром и впаянными платиновыми проводниками, которые позволили получить электрический заряд.
В 1880 году с веществом работали французы. Учёные вывели его из кислорода путём понижения температуры до -24 o C. При сжатии газ приобрёл тёмно-синий цвет. Потом химики ещё снизили температуру и сбросили давление. На стекле появились фиолетовые капли жидкого вещества.
Пути получения
Вещество формируется при любых процессах, при которых выделяется атомарный кислород. К примеру, он может образоваться при разложении пероксидов, окислении фосфора и т. д.
В области промышленности голубой газ получают в озонаторе. Через воздух пропускают электрическую искру, в результате чего происходит реакция 3O2→cur2O3. Затем озон выделяют путём дистилляции.
В лаборатории газ получают из пероксида бария. Соединение смешивают с концентрированной серной кислотой. В результате реакции получают озон и сульфат бария.
В медицинских организациях газ часто используют для улучшения состояния больных. Его получают с помощью облучения кислорода ультрафиолетом. Тем же путём вещество образуется и в атмосфере Земли под влиянием солнечных лучей.
Нахождение в атмосфере

Объём газа в атмосфере составляет около 4 млрд тонн. Его уровень повышается с удалением от поверхности Земли. Большая часть озона обнаружена в стратосфере. Озоновый слой можно наблюдать на высоте 22−26 км от поверхности планеты. Он препятствует проникновению ультрафиолета, который опасен для жизни различных земных организмов.
На озоновый слой также воздействуют хладоны, содержащие атомы хлора. Люди создают эти вещества для холодильной техники и заполняют ими аэрозольные баллончики. Когда хладоны попадают в воздух, они медленно поднимаются к озоновому слою. Под воздействием ультрафиолета соединения распадаются и разрушают массу из озона.
Кроме того, надо учитывать то, что люди сегодня вдыхают больше голубого газа, чем в древности. Это объясняется загрязнением воздуха метаном и оксидом азота.
Физические свойства
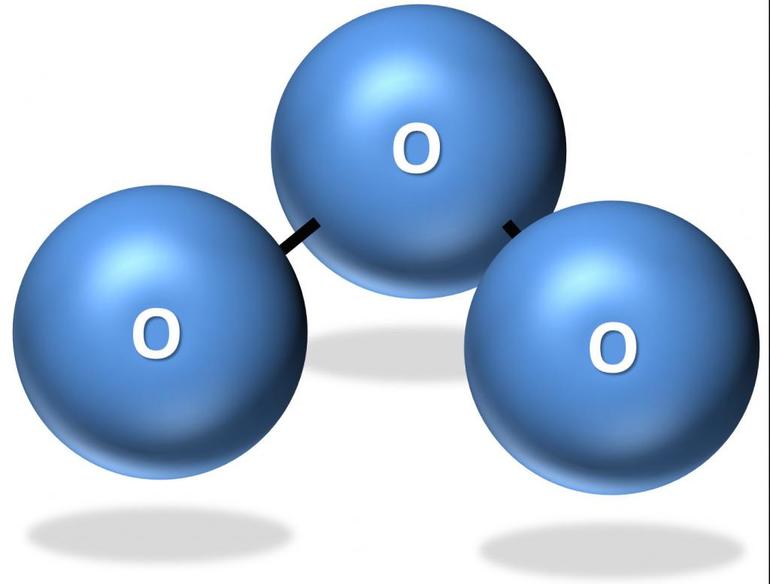
Молекула газа состоит из трёх атомов кислорода и характеризуется уголковым строением. Химическая формула озона — O3. При нормальных условиях голубой газ имеет резкий запах металла. В жидкой форме озон отличается тёмно-фиолетовым оттенком. В твёрдом виде он представляет кристаллы тёмно-синего или чёрного цвета.
Главные физические характеристики вещества:
- молярная масса — 48 а. е. м.;
- температура кипения — 111,8 o C;
- температура плавления — 197,2 o C;
- растворимость в воде при 0 о — 0,394 кг/м 3 .

Плотность газа составляет 2,1445 г/дм 3 . В жидкой форме она равняется 1,59 г/дм 3 , а в твёрдой — 1,73 г/дм 3 . Озон растворяется в H2O быстрее, чем кислород. В газообразном состоянии вещество выступает диамагнетиком, а в жидкой форме — слабым парамагнетиком. Озон хорошо растворяется в хладонах, образуя стабильные растворы. В жидком виде вещество смешивают с азотом, аргоном, метаном и фтором.
Химические особенности
Молекулам голубого газа характерна неустойчивость. После появления они существуют примерно 20−30 минут, а потом разлагаются с образованием кислорода и тепла. Скорость реакции повышается при условиях с высокой температурой или низким атмосферным давлением.

Молекулы вещества приобретают стабильность, когда они преобразуются в отрицательные ионы О3-, которые включены в озониды. Эти соединения могут разлагаться при хранении и при большом объёме воды, а также растворяться в жидком аммиаке.
Когда озон разрушает органические вещества, он выделяет много энергии. При контакте с эфиром, метаном или спиртом происходит самовоспламенение этих веществ. Если смешать озон с этиленом, то произойдёт сильный взрыв.
Газ может уменьшить степень токсичности некоторых соединений. К примеру, озон способен окислять цианиды до цианатов. Эти вещества считаются безопаснее для живых организмов.
Сферы применения
Озон относится к группе веществ 1-го класса опасности. Поскольку он выступает сильным окислителем, он может причинить большой вред здоровью человека и животных.
Несмотря на опасность газа, его применяют в различных сферах жизни:
- стерилизация медицинских инструментов;
- очистка нефтепродуктов и масел;
- фильтрация воды;
- отбеливание бумаги;
- лабораторный и промышленный синтез.

С помощью озона дезинфицируют помещения. Это происходит при помощи бытовых озонаторов. Производители и продавцы советуют сначала прочитать инструкцию по использованию этих предметов, поскольку неправильная эксплуатация изделий может навредить здоровью людей.
В области медицины вещество используют для очистки разных растворов. Следует отметить, что фильтрация воды с помощью этого вещества имеет больше преимуществ, чем хлорирование. В фильтрованной жидкости после обработки озоном нет его остатков и болезнетворных микробов.
Озонотерапевты утверждают, что здоровье больных людей улучшается, если в лечебную программу добавить вещество для перорального или внутривенного приёма. Но не во всех странах озон считают эффективным средством. Учёные провели многочисленные опыты и обнаружили, что это вещество способно уничтожать не только больные, но и здоровые клетки кожи и лёгких. Поэтому озон применяется лишь в качестве альтернативной медицины. Лечение этим веществом возможно только с согласия самих пациентов или в тяжёлых случаях заболеваний, когда другие препараты не помогают.
Воздействие на людей
Многие люди любят гулять после дождя, когда повышен уровень озона. Поскольку этот газ избавляет кислород от вредных веществ, воздух становится свежим и приятным. В это время людям легче дышать, однако озон нельзя долго вдыхать, иначе его высокая концентрация в человеческом организме может привести к смерти.
При частом вдыхании газа могут появиться боли в голове, головокружение и понижение давления. Кроме того, снижается иммунитет, который перестаёт бороться с болезнетворными бактериями.
Специалисты утверждают, что допустимая концентрация вещества в воздухе должна быть не более 0,1 мкг/л. Если поместить человека в помещение, в котором уровень озона превышает 0,4 мкг/л, то у него будут наблюдаться сильные боли в груди, кашель, бессонница и ухудшение зрения. Концентрация газа больше 2 мкг/л приведёт к более тяжёлым последствиям.
Интересная информация
Современные учёные продолжают изучать свойства озона. Но об этом веществе уже известно немало интересных фактов:

- В малых концентрациях запах озона напоминает хлор или сернистый газ.
- Голубой газ формируется во время грозы, при ударе молнии и в рентгеновском оборудовании.
- В стоматологии вещество используют вместо антибиотиков.
- Озон стали применять для фильтрации воды ещё в 1898 году.
- Газ соединяется с другими соединениями быстрее, чем кислород.
- Наибольшую озоновую дыру диаметром свыше 1000 км учёные обнаружили над Антарктидой в 1985 году.
- В период Первой мировой войны люди использовали вещество в качестве антисептика.
- Международный день охраны озонового слоя отмечают с 16 сентября 1987 года.
- При смешении с кислородом озон образует пероксиацетилнитрат. Это вещество затрудняет дыхание, вызывает слезотечение и может привести к параличу сердца.
Дальнейшее изучение озона необходимо по многим причинам. Озоновые дыры, которые то появляются, то исчезают, влияют на живые организмы и планету в целом. Однако с открытием полезных свойств вещества люди всё ещё пытаются найти ему применение и в других сферах жизни.
1) В природе озон образуется во время грозы под действием молний, а также при окислении смолы хвойных деревьев. На высоте 20-25 км озон образуется постоянно, образуя тонкий озоновый слой или экран.
2) В лаборатории озон получают при помощи озонатора (рисунок ниже).

3) Бесцветный газ с резким характерным запахом. Ядовит. Намного лучше растворим в воде, чем кислород. Химически значительно более активен, чем кислород. В атмосфере озона некоторые вещества склонны к самовоспламенению (спирт, фосфор). Каучук становится хрупким, а красители обесцвечиваются.
4) Для дезинфекции: сточных вод, воды в бассейнах, питьевой воды. Для стерилизации хирургических инструментов. В химической промышленности.
На уроках химии ученики знакомятся с таблицей Менделеева, а также изучают структурные формулы и производные разных веществ. Поскольку эта наука тесно связана со всеми сферами жизни человека, необходимо уделить ей внимание. Много интересной информации имеется об озоне. Химическим элементом, который его образует, выступает кислород. Газ делает состав воздуха пригодным для существования на суше.
- История открытия
- Способы получения
- Вещество в атмосфере
- Физические особенности
- Химическая природа
- Области использования
- Влияние на здоровье человека
- Занимательные факты
История открытия

Озон был открыт в 1785 году. Нидерландский физик Мартин Ван Марум обнаружил вещество во время проводимых им опытов. Учёный пропустил через воздух электрический ток, после чего возник незнакомый запах. В результате реакции получился неизвестный газ синеватого цвета. По окислительным свойствам вещество оказалось сильнее кислорода. Кроме того, неизвестный газ воздействовал на ртуть при нормальных условиях и заставлял её терять характерный блеск и прилипать к стеклу.
Ван Марум полагал, что это была некая электрическая материя. Но он не считал его открытие важным. Только через половину столетия этим газом снова заинтересовались учёные.
В 1860 году было доказано, что при превращении кислорода в озон объём газа уменьшался. Для опытов химики Тэт и Эндрюс использовали стеклянную трубку с манометром, наполненную O2, с впаянными в неё проводниками из платины, которые способствовали получению электрического заряда.
В 1880 году французские учёные Готфейль и Шаппюи смогли получить вещество из кислорода при температуре -23 o C. Когда газ медленно сжимался, он постепенно приобретал тёмно-синий оттенок. Затем давление резко сбросили, а температура ещё понизилась, что привело к образованию фиолетовых капель жидкого озона. Если вещество не охлаждали или быстро сжимали, тогда оно переходило в кислород с мгновенной жёлтой вспышкой.
Способы получения
Газ образуется во многих процессах, которые сопровождаются выделением атомарного кислорода. Озон формируется при разложении пероксидов, окислении фосфора и т. д.
В промышленной сфере вещество получают в специальном оборудовании, которое называют озонатор. Через воздух проводят электрическую искру, которая даёт реакцию 3O2→cur2O3. Получившийся газ отделяют фракционной перегонкой.
В лабораторных условиях используют пероксид бария, который обрабатывают концентрированной серной кислотой. В результате реакции получаются сульфат бария и озон.
В медицинских учреждениях, где вещество применяют для оздоровления пациентов, средство получают путём облучения кислорода ультрафиолетом. Именно этим способом газ образуется и в атмосфере нашей планеты под воздействием солнца.
Вещество в атмосфере
В атмосфере Земли озон находится в объёме 4 млрд тонн. Его концентрация растёт с удалением от поверхности планеты. Максимальное количество газа находится в стратосфере. Озоновый слой наблюдается на высоте 20−25 км от Земли. Хотя озона в атмосфере не так много, его хватает для обеспечения жизни на планете. Газ создаёт особый защитный слой, который не даёт опасным ультрафиолетовым лучам достичь поверхности Земли.
Кроме того, существуют искусственные причины, воздействующие на озоновый слой. Например, фирмы создают фреоны с атомами хлора, которые используются в холодильной технике и для заполнения аэрозольных баллончиков. Эти соединения попадают в воздух, а затем постепенно поднимаются и достигают озонового слоя. Под воздействием солнечной радиации фреоны разлагаются и разрушают его.
Также следует учитывать тот факт, что сегодня люди вдыхают больше озона, чем в далёком прошлом. Это связано с загрязнением воздуха большими объёмами метана и оксидов азота.
Физические особенности

Вещество представляет аллотропную модификацию кислорода, состоящую из трёхатомных молекул. Химическая формула озона и обозначение — O 3 . При нормальных условиях вещество выглядит как голубой ядовитый газ с резким запахом, напоминающим металлический аромат. При сжижении преобразуется в жидкость оттенка индиго. В твёрдом состоянии выглядит как тёмно-синие или чёрные кристаллы. Полярная молекула отличается уголковым строением. Между атомами имеется две связи О-О.
Основные физические свойства озона:
- молярная масса — 48 а. е. м.;
- температура кипения — 111,8 o C;
- температура плавления — 197,2 o C;
- растворимость в воде при 0 о — 0,394 кг/м 3 .
Плотность озона в газообразном состоянии равна 2,1445 г/дм 3 , в жидком — 1,59 г/см 3 , в твёрдом — 1,73 г/см 3 . Ещё одна важная характеристика вещества — его молекулярная кристаллическая решётка.
O 3 растворяется в воде в 10 раз быстрее, чем кислород. А с наличием примесей реакция ускоряется в несколько раз. В виде газа озон выступает диамагнетиком, а в жидком состоянии — слабым парамагнетиком. Производная кислорода отлично растворяется во фреонах с образованием стабильных растворов, которые возможно перевозить. Жидкий озон можно смешивать с азотом, аргоном, метаном, фтором, углекислотой и тетрахлоруглеродом в том же агрегатном состоянии.
Химическая природа

Молекулы озона отличаются неустойчивостью. После образования они существуют около 10−30 минут, а затем начинают разлагаться, образуя кислород и большой объём тепла. Если температура окружающей среды будет высокой, тогда процесс реакции ускорится. Тот же эффект наблюдается и при понижении атмосферного давления.
Среди химических свойств озона следует выделить его высокую реакционную способность. Он окисляет металлы (за исключением платины, золота и иридия), органические вещества, а также повышает степень окисления у оксидов. Действующим началом газа в качестве окислителя выступает атомарный кислород, который образуется при распаде молекулы озона. Однако в некоторых случаях в окислении участвуют все три атома элемента. Озон считается сильным окислителем, хотя уступает в этом плане фтору и фториду кислорода.
Молекула газа становится стабильнее, если она превращается в отрицательный ион О3-. Такие анионы содержатся в озонидах (озонокислых солях). Соединения разлагаются во время хранения или при избытке H2O. Озонокислые соли хорошо растворяются в жидком аммиаке.
Озон разрушает все органические вещества, с которыми он контактирует. При реакции выделяется большое количество энергии. К примеру, такие вещества, как эфир, спирт или метан, самовоспламеняются, когда они соприкасаются с озонированным воздухом. При смешении этилена и озона произойдёт сильный взрыв.
Газ способен уменьшать токсичность некоторых веществ. Например, он может окислить цианиды до цианатов, которые безопаснее для живых организмов.
Области использования
В Российской Федерации озон относится к группе вредных веществ первого класса опасности. Сильные окислительные свойства делают его опасным для здоровья человека. Однако вещество широко используется в разных сферах.
Основные области применения озона:
- стерилизация медицинских инструментов;
- отбеливание бумаги;
- очистка нефтепродуктов и масел;
- лабораторный и промышленный синтез.
Озон применяется для дезинфекции одежды и помещений, озонирования растворов медицинского назначения. Также вещество используется в качестве дезинфицирующего средства при очистке воздуха и воды от вредных микроорганизмов.
Озонирование воды имеет много преимуществ перед хлорированием, поскольку в обработанной жидкости отсутствуют токсины. Кроме того, озон лучше растворяется в воде.

Если верить заявлениям озонотерапевтов, здоровье пациентов значительно улучшается, когда лечение включает пероральное или внутривенное применение вещества. Однако пока нет объективных клинических подтверждений терапевтического эффекта. Сегодня озонотерапию используют только в некоторых частных клиниках развитых стран, где она не считается лечебным методом. Поскольку доказано мутагенное и токсическое действие этого вещества, пациентов лечат озоном только с их согласия и лишь в тяжёлых случаях.
С начала XXI века многие компании начали выпускать бытовые озонаторы. Такие устройства предназначены для дезинфекции помещений. Перед их использованием необходимо прочитать инструкцию по применению техники. Поскольку некоторые фирмы не пишут в аннотациях о мерах безопасности при работе с озонаторами, не рекомендуется приобретать их продукцию.
Влияние на здоровье человека

Некоторые считают, что озон, как и кислород, полезен для организма. Многие люди любят гулять после дождя, когда в воздухе остаётся этот газ из-за грозы. Озон действительно разрушает токсические соединения и очищает кислород от вредных примесей. Из-за этого воздух после дождя свежий и приятный, а небо приобретает привлекательный лазурный оттенок.
Наличие в воздухе озона позволяет легче дышать, но сильный окислитель способен вызвать отравление и привести к летальному исходу. Негативные последствия происходят при превышении определённого порога концентрации и времени вдыхания этого вещества. Газ может вызывать мигрень, головокружения, раздражение слизистых органов зрения и обоняния, снижение артериального давления. Чрезмерное вдыхание вещества нередко способствует тому, что организм перестаёт сопротивляться бактериальным инфекциям дыхательной системы.
Учёные считают, что предельно допустимая концентрация (пдк) озона в воздухе составляет 0,1 мкг/л. Если человек проведёт несколько часов в помещении, где в воздухе будет содержаться больше 0,4 мкг/л вещества, у него появятся болезненные ощущения в груди, кашель и бессонница. Кроме того, возможно снижение остроты зрения. Более тяжёлые последствия наблюдаются при концентрации озона в воздухе свыше 2 мкг/л.
Опасный газ может образовывать с кислородом другое опасное вещество — пероксиацетилнитрат. Органическое соединение затрудняет дыхание и вызывает слезоточивость. Высокие концентрации этого вещества могут привести к параличу сердца.
Занимательные факты
Озон вызывает большой интерес не только у учёных, но и у обычных людей. Хотя это вещество ещё не полностью изучено, о нём уже имеется немало занимательной информации:

- Озон эффективно уничтожает бактерии и плесень.
- В малых концентрациях запах вещества может напоминать хлор, сернистый газ или даже чеснок.
- Озон образуется во время грозы, при ударе молнии и в рентгеновском оборудовании.
- Он применяется в стоматологии вместо антибиотиков.
- Для очистки воды вещество начали использовать в 1898 году во Франции.
- Во время Первой мировой войны его применяли в качестве антисептического средства.
- Самая большая озоновая дыра была обнаружена над Антарктидой в 1985 году. Это явление отличается диаметром свыше 1000 км.
- Молнии Кататумбо считаются крупнейшим одиночным генератором озона в тропосфере нашей планеты.
Вещество продолжают изучать не только из-за озоновых дыр, которые могут повлиять на будущее людей и всех других живых организмов. Хотя озон опасен, учёные считают, что он способен заменить многие лечебные средства при борьбе с тяжёлыми заболеваниями.

Озон возникает естественным образом в верхних слоях атмосферы, где он образуется в результате фотохимической реакции. Он также образуется в результате электрических разрядов и химических реакций, в результате которых кислород выделяется при охлаждении. В нижних слоях атмосферы он является токсичным загрязнителем для животных и растений. Однако в стратосфере он образует защитный слой для жизни на Земле, поглощая ультрафиолетовое излучение Солнца.
1. Физические и химические свойства
Озон - это голубой газ с сильным, проникающим запахом, опасный для дыхания и более окисляющий, чем кислород. Он имеет плотность 1,66 и сжижается при температуре -112°C, образуя крайне нестабильную жидкость цвета индиго. Он в холодном состоянии окисляет йод и почти все металлы, особенно ртуть и серебро; он вытесняет хлор, бром и йод из их соединений с водородом или металлами; он максимально окисляет серную, фосфорную и мышьяковую кислоты; он также разрушает органические материалы (пробку, резину) путем окисления. С другой стороны, с различными ненасыщенными органическими соединениями он дает нестабильные аддитивные соединения, озониды.
2. Используется
Озон используется благодаря своим окислительным и бактерицидным свойствам для дезинфекции воздуха в замкнутых пространствах, стерилизации воды, отбеливания текстиля и выдержки вина и древесины. При лечении ран (озонотерапия) он применяется в виде струи или в водном растворе, в одной или нескольких дозах в зависимости от полученного результата. Он используется в приготовлении высыхающих масел и в синтезе некоторых растительных эссенций.
3. Атмосферный озон
3.1. Стратосферный озон и преимущества озонового слоя
Озон играет фундаментальную роль в балансе окружающей среды Земли. 90% атмосферного озона находится на высоте от 20 до 50 км. Этот "озоновый слой" объясняет существование на этих же высотах области большой стабильности в отношении вертикальных обменов - стратосферы. Хотя он является незначительным компонентом атмосферы (его максимальная относительная концентрация, наблюдаемая на высоте 25 км, не превышает 5-6 миллионных долей по объему), озон является единственным поглотителем ультрафиолетового солнечного излучения с длиной волны от 240 до 300 нанометров. Это поглощение позволяет поддерживать жизнь животных и растений на Земле, устраняя коротковолновое излучение, которое может разрушать клетки живой материи и подавлять фотосинтез. По этой причине с 1980-х годов существует большая озабоченность по поводу ущерба, нанесенного стратосферному озоновому слою в результате деятельности человека.
3.2. Тропосферный озон и его влияние на живые организмы
На высоте ниже 10 км уровни озона очень низкие, порядка 0,03 миллионных долей. Однако, в отличие от своей полезной роли в стратосфере, озон действует у земли как окислитель, который нарушает фотосинтез и может вызвать повреждение растений (коричневые пятна на листьях, соответствующие некрозу). В районах с высоким уровнем загрязнения, где его уровень может быть намного выше, озон непосредственно влияет на здоровье человека, особенно на дыхательную систему и слизистые оболочки. Озон раздражает легкие, вызывая кашель, респираторный дискомфорт, а иногда даже отек легких. Лечение после тяжелых ингаляций заключается в строгом покое под наблюдением врача.
Количество озона в атмосфере выражается как "уменьшенная толщина", т.е. вертикальная толщина столба, в котором был бы собран весь газ, при нормальной температуре и давлении. В среднем эта толщина составляет 2,5 мм.
4. Озоновая дыра
4.1. Открытие озоновой дыры
В 1985 году британские исследователи впервые сообщили о существовании озоновой дыры, а точнее, о значительном уменьшении толщины озонового слоя над Южным полюсом. Верхние слои атмосферы этого региона являются ареной бешеного цикла разрушения озона. Во время полярной зимы образование стратосферного воздушного вихря изолирует атмосферу Антарктики от остальной части Южного полушария. Затем температура стратосферы может опуститься до -85°C, что приведет к образованию ледяных облаков. Эти полярные облака фиксируют хлор в стратосфере в виде соляной кислоты (HCl) и нитрата хлора (ClONO2). В южную весну, когда Солнце вновь появляется в сентябре и октябре, его излучение вызывает диссоциацию хлора в результате фотохимической реакции. После этого запускается настоящая цепная реакция: каждый атом высвобожденного хлора может разрушить до 100 000 молекул озона. Этот процесс продолжается до ноября и уменьшает толщину слоя почти наполовину. К этому времени Солнце достаточно прогрело атмосферу, чтобы рассеять стратосферные облака. Полярный вихрь, ограничивавший озоновую дыру, исчезает, и богатый озоном воздух из средних широт просачивается обратно в стратосферу Антарктики. На Северном полюсе такая "дыра" в слое не образуется, а локальные дефициты озона наблюдаются с 1991 года. Это связано с циркуляцией воздуха, который сильно отличается от антарктического, и более мягкими зимними температурами.
4.2 Происхождение и последствия
Если некоторые природные факторы, такие как выброс сернистых газов при извержениях вулканов, всегда способствовали частичному и временному разрушению озонового слоя, то опасность, которую представляют промышленные выбросы хлора, ученые осуждают с 1980 года. Хлорфторуглероды (ХФУ), используемые в качестве аэрозольных пропеллентов, хладагентов или пенообразователей в некоторых жестких пенопластах, являются основной причиной разрушения озонового слоя. Многие другие химические вещества, такие как галоны (галогенизированные производные углеводородов), используемые в огнетушителях, а также некоторые растворители, такие как четыреххлористый углерод или бромистый метил, также способствуют образованию озоновой дыры. Все эти соединения чрезвычайно стабильны и могут оставаться в атмосфере в течение 50-100 лет. Они попадают на полюса и высвобождают свои атомы хлора (или брома), которые разрушают озон.
Истощая озоновый слой, человеческая деятельность поставила под угрозу нашу естественную защиту от солнца. Истощение стратосферного озона приводит к увеличению количества ультрафиолетового излучения, достигающего земли. Эти лучи могут повреждать ДНК человека, вызывать рак кожи и катаракту, а также другие заболевания. Они также оказывают вредное воздействие на растения и фитопланктон.
4.3. Международная осведомленность
С 1985 года (Венская конвенция) несколько международных конференций ознаменовали собой глобальное осознание необходимости защиты стратосферного озонового слоя и обеспечения ограничения воздействия человеческой деятельности на климат. Основные страны-производители ХФУ отказались от производства и использования этих озоноразрушающих газов. Сегодня гидрофторуглероды (ГФУ) и перфторуглероды (ПФУ), второе поколение заменителей ХФУ, безопасны для озонового слоя (хотя для его восстановления потребуются годы), но они являются мощными парниковыми газами, способствующими глобальному потеплению.
Читайте также:

